Прикладная биохимия и микробиология, 2022, T. 58, № 4, стр. 388-399
Бактериальная целлюлоза как матрица для микроорганизмов в биоэлектрокаталитических системах
С. Е. Тарасов 1, Ю. В. Плеханова 1, А. Е. Китова 1, А. Г. Быков 1, А. В. Мачулин 1, В. В. Колесов 2, Н. А. Кленова 3, В. В. Ревин 4, О. Н. Понаморева 5, А. Н. Решетилов 1, 5, *
1 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, ФГБУН “ФИЦ ПНЦБИ РАН”
142290 Пущино, Московская обл., Россия
2 Институт радиотехники и электроники им. В.А. Котельникова РАН
125009 Москва, Россия
3 Самарский национальный исследовательский университет им. С.П. Королева
443086 Самара, Россия
4 Национальный исследовательский Мордовский государственный университет им. Н. П. Огарева
430005 Саранск, Россия
5 Тульский государственный университет
300012 Тула, Россия
* E-mail: anatol@ibpm.pushchino.ru
Поступила в редакцию 09.02.2022
После доработки 18.02.2022
Принята к публикации 28.02.2022
- EDN: GQREUZ
- DOI: 10.31857/S0555109922040158
Аннотация
Для создания амперометрического биосенсора была использована бактериальная целлюлоза (БЦ), продуцируемая бактериями Komagateibacter sucrofermentas ВКПМ B-11267, в качестве носителя для иммобилизации уксуснокислых бактерий Gluconobacter oxydans. Биосенсор формировали на поверхности печатного графитового электрода, модифицированного наноматериалом – терморасширенным графитом (ТРГ), или на поверхности пористого трехмерного материала – никелевой пены (НП). Структурные особенности этих материалов способствовали созданию плотного контакта между материалом электрода и поверхностью БЦ, на которой были иммобилизованы бактериальные клетки. Методом сканирующей электронной микроскопии (СЭМ) показано, что бактерии не только сорбировались на поверхности БЦ, но и проникали во внутренний объем пленки. С помощью импедансометрии изучена проводимость двух типов биосенсоров и показано уменьшение сопротивления графитового электрода на 3 порядка при модификации его поверхности ТРГ. Биоэлектроды, содержащие БЦ, применили в конструкции амперометрического биосенсора для определения содержания глюкозы. Значение коэффициента чувствительности биосенсора составило 3 мкА/мМ · cм2. Таким образом, БЦ в комбинации с ТРГ и НП может быть использована для создания трехмерных электродов биоэлектрокаталитических устройств.
Одним из важнейших этапов создания биосенсоров и биотопливных элементов является иммобилизация на носителе или получение биокатализатора [1]. Иммобилизация должна обеспечивать надежную фиксацию биологического компонента на поверхности электрода или в его объеме (в случае использования электродов, имеющих трехмерную структуру активной части) и сохранение каталитической активности объекта в течение длительного времени [2]. Кроме того, иммобилизующие агенты не должны препятствовать переносу субстратов к активным центрам ферментов, а также переносу электронов в системе [3]. Одним из распространенных методов иммобилизации бактерий и ферментов является их включение в полимерные гели. Полимеры, используемые для иммобилизации биокатализаторов, можно разделить на две группы – природные и синтетические. Синтетические матрицы для иммобилизации включают поливиниловый спирт [4], полиакриламид [5], полиэтиленгликоль [6], полианилин [7] и другие. Природные полимеры, такие как, белковые гидрогели [8], альгинаты [9], каррагинаны [10], хитин и хитозан [11], желатин [12], агар [13], а также бактериальная целлюлоза (БЦ) [14] обладают биосовместимостью [15], их применение не оказывает отрицательного воздействия на человека и на окружающую среду, уменьшая ее загрязнение веществами синтетического происхождения.
Одним из продуктов современной биотехнологии является бактериальная целлюлоза, которую способны продуцировать как грамположительные [16], так и грамотрицательные [17] бактерии. Биологическая роль БЦ связана с защитой клеток микроорганизмов от высыхания и других неблагоприятных факторов внешней среды. БЦ обладает повышенной влагоудерживающей способностью, гидрофильностью, ультрадисперсной сетчатой архитектурой и прочностью [18]. Для эффективной иммобилизации микроорганизмов на БЦ зачастую проводится их культивирование в присутствии полисахарида. Такой подход позволяет получить биокомпозиты, в которых клетки равномерно распределены в гидрогеле целлюлозы и прочно связаны с полимером, однако он является длительным и достаточно сложным методически [14]. При этом следует отметить, что БЦ обладает достаточно низкой электрической проводимостью [19], в связи с чем ее используют в сочетании с наночастицами металлов [20, 21] или углеродными наноматериалами, призванными снизить сопротивление БЦ [22, 23].
Бактериальная целлюлоза является перспективным материалом для получения широкого спектра продуктов и наноматериалов, в том числе для медицины [24], диетологии [25], промышленной электронике [26]. Тем не менее, многие аспекты ее полезного применения в различных областях промышленности находятся в стадии изучения, например, взаимодействие БЦ со многими металлическими и углеродными матрицами. Интерес представляет изучение свойств комплексов БЦ с таким материалом, как никелевая пена (НП). Этот материал обладает высокой электрической проводимостью и позволяет легко формировать электроды различной формы и площади [27], чтопредставляется особенно важным качеством при создании биотопливных элементов (БТЭ).
Не изучено взаимодействие БЦ с таким углеродным материалом, как терморасширенный графит (ТРГ). ТРГ характеризуется значительной электропроводностью, что обусловлено большой удельной площадью его поверхности и высокой биосовместимостью, а также позволяет формировать дополнительные связи между биологическим компонентом и поверхностью электрода для эффективной передачи заряда [28].
В качестве объекта в работе выбраны уксуснокислые бактерии Komagateibacter sucrofermentas как продуцент БЦ, и Gluconobacter oxydans как биокатализатор в составе биосенсоров. K. sucrofermentas является одним из наиболее часто используемых для получения БЦ микроорганизмов [17], а G. oxydans содержат во внешней мембране пирролохинолин-хинон-зависимые дегидрогеназы [11], обеспечивающие эффективный перенос электронов при участии редокс-соединений (медиаторов электронного транспорта) на проводящую поверхность электрода. В качестве модельного субстрата для проверки работоспособности разработанных композиций в составе биосенсоров использовали глюкозу, т. к. определение глюкозы – один из наиболее востребованных анализов как в промышленности, так и в медицине.
Цель работы – оценка возможности использования бактериальной целлюлозы как полимерной матрицы для иммобилизации уксуснокислых бактерий G. oxydans в биосенсорах амперометрического типа, основанных на трехмерных проводящих материалах: графитовых печатных электродах, модифицированных терморасширенным графитом, либо на никелевой пене.
МЕТОДИКА
Реагенты. В работе использовали калий фосфорнокислый двузамещенный 3-водный, натрия гидроксид, натрий хлористый, уксусную кислоту, соляную кислоту, гидрофосфат натрия, этиловый спирт, лимонную кислоту (“Мосреактив”, Россия); натриевую соль 2,6-дихлорфенолиндофенола (ДХФИФ), хитозан низкомолекулярный, оксид осмия (VIII), трет-бутиловый спирт, трис(гидроксиметил)аминометан (“Merck”, Германия); сорбит, глюкозу, дрожжевой экстракт, глутаровый альдегид, трис(гидроксиметил)аминометан (“Merck”, Германия); сорбит, глюкозу, дрожжевой экстракт, агар-агар бактериологический, пептон (“Диа-М”, Россия). В качестве рабочих использовали фрагменты никелевой пены (“Xiamen Tob New Energy Technology Co.”, Китай), и 3-контактные электроды, полученные методом матричной печати (ЭМП) (“КолорЭлектроникс”, Россия). В качестве модифицирующего материала использовали терморасширенный графит, полученный по методике, описанной в работе [28].
Культивирование клеток микроорганизмов. В работе использовали штамм Gluconobacter oxydans sbsp. industrius ВКМ B-1280 (Всероссийская коллекция микроорганизмов, Россия). Культивирование проводили по методике, описанной в работе [29] в течение 18–20 ч до достижения стационарной фазы роста, при которой количество жизнеспособных клеток близко к максимальному. Выращивание проводили в колбах Эрленмейера объемом 750 мл при перемешивании (200 об/мин, 28°С) в 50 мл среды, содержащей (%): сорбит – 10, дрожжевой экстракт – 0.2 (вода дистиллированная). Клетки отделяли центрифугированием при 10000 g в течение 5 мин. Осадок отмывали дважды 25 мМ К-фосфатным буферным раствором, рН 6.5. Культуру поддерживали на скошенной агаризованной среде, содержащей (г/л): сорбит – 100.0, дрожжевой экстракт – 5.0 и агар-агар 15.0.
Получение бактериальной целлюлозы. Культивирование Komagateibacter sucrofermentas осуществляли при температуре 28°С в течение 3 сут на скошенной агаризованной среде следующего состава, г/л: глюкоза – 10.0; дрожжевой экстракт – 10.0; пептон – 7.0; агар-агар – 15.0; лимонная кислота – 0.2; уксусная кислота – 0.1; этанол – 10.0, рН 5.0–6.0. Режим стерилизации: 121°С в течение 15 мин без этанола в автоклаве MLS-3781L (“Sanyo”, Япония). Для получения инокулята использовали среду Хестрин-Шрамма, содержащую (г/л): глюкоза – 20.0; пептон – 5.0; дрожжевой экстракт – 5.0; гидрофосфат натрия – 2.7; лимонная кислота – 1.15, Выращивали в колбах объемом 250 мл, содержащих 100 мл среды на шейкере-инкубаторе ES – 20/60 (“Biosan”, Латвия) при 250 об./мин в течение 24 ч при температуре 28 ± 1°С. Полученным инокулятом (10% от объема среды) засевали опытные колбы, содержащие по 100 мл среды. Культивирование проводили в шейкере-инкубаторе при 250 об./мин и температуре 28 ± 1°С в течение 3–6 сут [30], а затем стационарно 5 сут с добавлением свежей среды в соотношении 1 : 1.
Полученные пленки промывали проточной водой, затем освобождали от остатков клеток обработкой 0.1 н NaOH при 80°С в течение 30 мин. Затем отмывали дистиллированной водой до рН 7.0 и выдерживали 30 мин в 1.5%-ной соляной кислоте, затем снова отмывали дистиллированной водой до нейтральной реакции. Полученные пленки подсушивали на фильтровальной бумаге и хранили в 70%-ном этиловом спирте.
Для удаления остатков этилового спирта из образцов БЦ их переносили из среды хранения в раствор фосфатного буфера на 24 ч и высушивали до постоянного веса в течение 3 ч. Для оценки содержания влаги в БЦ полученные образцы взвешивались в нативном (Вг) и высушенном до постоянного веса (Вс) состояниях.
Оценка дыхательной активности бактерий. Измерение дыхательной активности бактериальных клеток проводили с помощью кислородного электрода Кларка. На носитель наносили 15 мкл бактериальной суспензии G. oxydans (0.5 мг/мл). В качестве носителей использовали хроматографическую бумагу Whatman GF/A (“Sigma”, США) размером 3 × 3 мм2, фрагменты никелевой пены размером 3 × 3 мм2 и толщиной 1 мм, фрагмент пленки БЦ толщиной 30 мкм размером 3 × 3 мм2. Измерения проводили в кювете объемом 2 мл, содержащей 25 мМ калий-фосфатный буфер, рН 6.5, при постоянном перемешивании и температуре 27°С. Регистрируемым параметром была максимальная скорость изменения выходного сигнала электрода dI/dT (нА/с), связанная пропорциональной зависимостью со скоростью изменения концентрации кислорода, потребленного иммобилизованными клетками биорецептора, в ответ на внесение субстрата в измерительную ячейку.
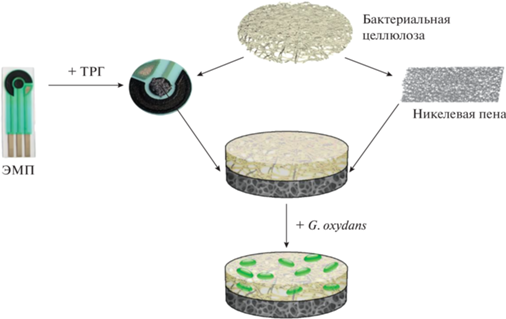
Формирование биосенсоров на основе электродов матричной печати. ЭМП представлял собой композицию вспомогательного и рабочего электродов, выполненных из графитовой пасты Electrodag 6017SS (“Henkel”, Германия), и электрода сравнения (Ag/AgCl). Диаметр рабочего электрода составлял 3 мм. При формировании печатных электродов, модифицированных терморасширенным графитом (ТРГ), на рабочем электроде закрепляли слой ТРГ толщиной 0.1 мм прессованием под давлением в 150 бар. Схема формирования рабочего электрода представлена на рис. 1.
На рабочий электрод биосенсора наносили 10 мг БЦ, предварительно промытой в дистиллированной воде. Затем электрод с нанесенной БЦ высушивали при комнатной температуре в течение 3 ч и наносили 5 мкл суспензии бактерий с концентрацией 0.5 мг/мкл (рассчет на сырые клетки) и оставляли на 12 ч при температуре 4°С. В качестве контрольного электрода использовали биосенсор с клетками G. oxydans, иммобилизованными в геле хитозана [31]. Содержание клеток бактерий на электроде составляло 0.12 мг/мм2.
Формирование биосенсоров на основе электродов из никелевой пены. В качестве основы для трехмерных электродов использовали никелевую пену, применяемую для создания батарей и суперконденсаторов. Чистота образца составляла 99.8%, толщина НП составляла 0.5 мм, пористость 97%, плотность 350 г/м2, размер пор варьировал в пределах 0.1–0.3 мм. Для формирования электродов использовали фрагменты НП размером 3 × 3 мм2. На фрагмент НП наносили 10 мг БЦ, предварительно промытой в дистиллированной воде. Электрод с нанесенной БЦ высушивали при температуре 25°C в течение 24 ч. Затем на поверхность электрода наносили 10 мкл суспензии бактерий и оставляли на 1 ч при комнатной температуре. Содержание клеток бактерий на электроде составляло 0.12 мг/мм2. Схема формирования рабочего никелевого электрода представлена на рис. 1. Полученный электрод использовали в качестве рабочего, вспомогательным электродом служила платиновая пластина площадью 10 × 5 мм2, а электродом сравнения служил Ag/AgCl электрод.
Схема измерений. Электрохимические измерения проводили в кювете объемом 5 мл при температуре 25°С и постоянном перемешивании (500 об./мин). В качестве фонового раствора использовали 25 мМ К-фосфатный буфер, рН 6.5, содержащий 10 мМ хлорид натрия. Для регистрации сигналов электрода использовали гальванопотенциостат IPCmicro (“Кронас”, Россия) или гальванопотенциостат-импедансметр VersaSTAT 4 (“Ametek Inc.”, США). Хроноамперометрические зависимости регистрировали при приложенном потенциале +200 мВ (vs Ag/AgCl) (для измерений ЭМП), либо +400 мВ (vs Ag/AgCl) (для измерений НП) в присутствии медиатора электронного транспорта ДХФИФ (0.14 мМ). Циклические вольтамперограммы (ЦВА) регистрировали при скорости сканирования 40 мВ/с в диапазоне от –500 до +500 мВ. Значения параметров биосенсоров приведены как средние из 5 измерений.
Импедансные характеристики измеряли при приложенном потенциале +200 мВ (vs Ag/AgCl) либо +400 мВ (vs Ag/AgCl) в диапазоне частот от 40 кГц до 0.2 Гц при амплитуде модуляции напряжения 10 мВ в присутствии 0.14 мМ ДХФИФ. Подходящую эквивалентную электрическую схему для каждой системы подбирали с помощью программы ZSimpWin (“EChem Electrochemystry Software”, USA). Схема считалась подходящей, если погрешность определения параметров была ниже 10%.
Сканирующая электронная микроскопия. Образцы для сканирующей электронной микроскопии (СЭМ) перед измерениями предварительно высушивали в течение 4 ч при температуре 25°C в соответствии с рекомендациями фирмы-производителя. СЭМ-анализ образцов БЦ, содержащих клетки микроорганизмов, выполняли с помощью сканирующего электронного микроскопа JSM6510 LV (“JEOL”, Япония) в режиме высокого вакуума при регистрации вторичных электронов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические параметры БЦ. Известно, что пористая нитевидная структура БЦ образована микрофибриллами диаметром около 100 нм, что обеспечивает высокую влагоудерживающую способность (ВУС) за счет капиллярных взаимодействий и формировании гидрофильной оболочки на поверхности фибрилл [32]. ВУС бактериальной целлюлозы составляла 98 ± 1%, при этом кинетика процессов набухания была типичной для гидрогелей. Полученные данные согласовывались с результатами исследований бактериальной целлюлозы, синтезируемой другими уксуснокислыми бактериями [33, 34].
При адсорбции бактериальных клеток для формирования биоэлектрохимических устройств основная масса биологического материала располагается на поверхности рабочего электрода. Использование бактериальной целлюлозы предполагает возможность распределения клеток не только на ее поверхности, но и в объеме иммобилизующей матрицы. На рис. 2 представлены полученные с помощью сканирующей электронной микроскопии изображения поверхности электрода с иммобилизованными в гидрогели целлюлозы микроорганизмами G. oxydans. На микрофотографиях видно, что основная масса бактерий адсорбируется на поверхности БЦ (рис. 2а), однако часть клеток встраивается между волокнами БЦ (рис. 2б), что обеспечивает формирование трехмерного биорецептора.
Рис. 2.
Пленки на поверхности БЦ в СЭМ с иммобилизованными на поверхности клетками G. oxydans (а) и клетки, проникшие диффузионно в объем БЦ (б).
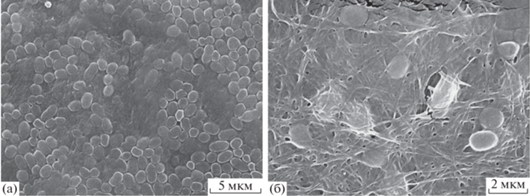
Рис. 3.
Эквивалентная электрическая схема, использованная для обработки импедансных спектров. RS – омическое сопротивление электролита, C – емкость и RСT – сопротивление переноса заряда.
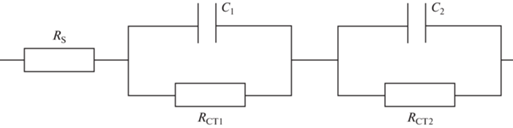
БЦ на графитовых печатных электродах, модифицированных ТРГ. При функционировании биосенсора важную роль играет проводимость измерительного электрода, которая позволяет заряду в процессе биотрансформации субстрата переходить от активных центров фермента микроорганизмов на электрод. Каждый компонент биосенсора вносит свой вклад в этот процесс. В описываемом варианте биосенсора такими компонентами являются терморасширенный графит, модифицирующий поверхность электрода, бактериальные клетки и БЦ, удерживающая их на поверхности электрода. Для оценки влияния каждого из компонентов на общую проводимость системы использовали метод электрохимической импедансной спектроскопии (ЭИС). Каждый из компонентов иммобилизовали на поверхности графитового электрода отдельно и в различных сочетаниях с другими компонентами, и изучали импедансные спектры полученных композиций. Для интерпретации полученных импедансных спектров была применена эквивалентная электрическая схема, представленная на риc. 3, где RS обозначает омическое сопротивление электролита, а пары C (емкость) и RСT (сопротивление переноса заряда) соответствуют стадиям электронного переноса между отдельными компонентами системы. Значения электрохимических параметров для каждого варианта композиции представлены в табл. 1.
Таблица 1.
Значения параметров, полученных в результате обработки импедансных спектров биосенсоров
| Композиция | Параметр | ||||
|---|---|---|---|---|---|
| RS, Ом | C1, мкФ | RCT1, Ом | C2, мкФ | RCT2, Ом | |
| ЭМП | 920 ± 20 | 0.029 ± 0.001 | 823 333 ±155 026 | 0.223 ± 0.001 | 6 100 000 ± 953 939 |
| ЭМП + G.oxydans | 863 ± 9 | 0.046 ± 0.001 | 463 333 ± 28 867 | 0.160 ± 0.002 | 2 633 333 ± 321 455 |
| ЭМП + БЦ | 1062 ± 6 | 0.058 ± 0.008 | 930 000 ± 62 449 | 0.054 ± 0.003 | 52 000 000 ± 7 211 102 |
| ЭМП + БЦ + G. oxydans | 1033 ± 13 | 0.053 ± 0.004 | 693 333 ± 87 369 | 0.079 ± 0.002 | 7 333 333 ± 1 625 833 |
| ЭМП + ТРГ | 300 ± 6 | 9.5 ± 0.8 | 1630 ± 330 | 22.3 ± 1.2 | 55 333 ± 14 012 |
| ЭМП + ТРГ + БЦ | 339 ± 8 | 3.7 ± 0.2 | 1939 ± 440 | 6.2 ± 0.5 | 523 333 ± 15 725 |
| ЭМП + ТРГ + G. oxydans | 402 ± 6 | 7.7 ± 0.8 | 1335 ± 48 | 46 ± 2 | 46 000 ± 10 00 |
| ЭМП + ТРГ + БЦ + + G.oxydans | 383 ± 6 | 4.3 ± 0.2 | 2163 ± 174 | 11.3 ± 0.6 | 183 333 ± 20 817 |
БЦ увеличивает значение сопротивления переноса заряда электрода (52 МОм для ЭМП + БЦ против 6 МОм для ЭМП). При этом применение терморасширенного графита в качестве модификатора электрода приводит к значительному (~ на 3 порядка) снижению сопротивлений переноса заряда как при использовании БЦ, так и в ее отсутствии. Таким образом, добавление проводящего углеродного наноматериала позволяет улучшить общую проводимость системы, несмотря на высокое сопротивление отдельных ее компонентов (БЦ и бактериальные клетки). Использование ТРГ приводит к увеличению емкости электрода биосенсора, что не оказывает негативного влияния на его работу.
Для изучения медиаторного электронного переноса в системе “ЭМП/ТРГ/БЦ/G. oxydans” использовали метод циклической вольтамперометрии. На рис. 4a приведены ЦВА биоэлектрода на основе клеток G. oxydans, иммобилизованных на БЦ. Измерения проводили в диапазоне от –0.5 до 0.5 В. Максимальное значение анодного тока в присутствии глюкозы составляло 1.9 мкА.
Рис. 4.
ЦВА биосенсора на основе клеток, иммобилизованных на БЦ (а) и включенных в хитозан (б), в буферном растворе (1) и при введении ДХФИФ (0.05 мМ) и глюкозы (5 мМ) (2).
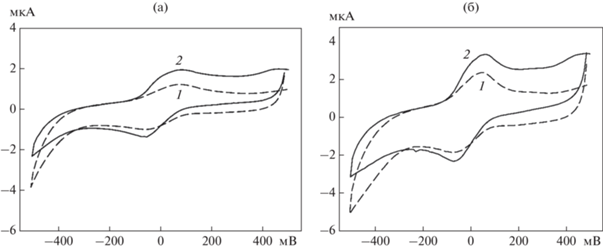
Полученные циклические вольтамперограммы сравнивали с ЦВА биоэлектрода с клетками G. oxydans, включенными в гель хитозана (рис. 4б). Иммобилизация в гель хитозана является одним из наиболее часто используемых методов иммобилизации бактериальных клеток в биоэлектрохимических устройствах [31, 35]. На ЦВА (рис. 4б) можно видеть, что максимальное значение анодного тока при добавлении глюкозы составляло 3.5 мкА, что примерно в 2 раза превышало значение анодного тока биоэлектрода на основе БЦ. Тем не менее, для обоих типов биоэлектродов наблюдалось значительное расхождение токов окисления в области приложенных потенциалов от –50 до 500 мВ в присутствии и отсутствии максимальной концентрации (5 мМ) глюкозы. Это свидетельствовало о наличии эффективного медиаторного электронного переноса в данных системах и позволило использовать его как основу для амперометрического глюкозного биосенсора.
На рис. 5а представлен типичный вид сигналов биосенсоров при введении в измерительную кювету глюкозы и медиатора, а также полученные калибровочные зависимости для глюкозного биосенсора (рис. 5б). Для сравнения приведены параметры биосенсора, в котором бактериальные клетки иммобилизованы в гель хитозана. Амплитуда сигнала биосенсора на основе клеток, включенных в хитозан, в 1.6 раза превышала амплитуду сигнала биосенсора на основе клеток, иммобилизованных на БЦ.
Рис. 5.
Вид сигнала биосенсоров на основе клеток G. oxydans, иммобилизованных на БЦ (1) и включенных в гель хитозана (2) на введение глюкозы (1.5 мМ, а) и их калибровочные зависимости (б): б – на оси Х концентрация глюкозы в измерительной ячейке.
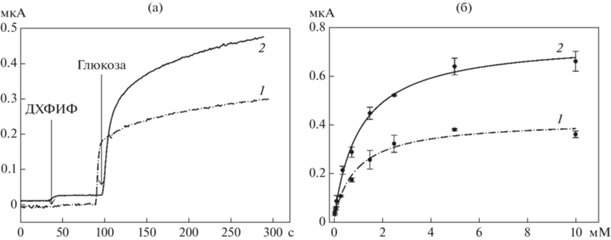
Способ иммобилизации бактериальных клеток на поверхности электрода (иммобилизация на БЦ, либо включение в гель хитозана) не влиял на диапазон детекции, линейный диапазон и нижний предел обнаружения глюкозы. Нижний предел детекции глюкозы составил 62.5 мкМ, диапазон детекции – 62.5 мкМ – 5 мМ. Линейный диапазон определения составлял 62.5–1500 мкМ. Калибровочные зависимости для обоих биосенсоров аппроксимировали трехпараметрическим уравнением Хилла (r2 = 0.988). Кинетические константы уравнения для биосенсора на основе БЦ составили: Km = 0.89 ± 0.16 мМ и Vmax = 0.42 ± 0.02; для биосенсора на основе хитозана – Km = 1.05 ± 0.12 мМ и Vmax = 0.75 ± 0.03 мкА. Коэффициент чувствительности биосенсора определяли как значение производной от калибровочной характеристики биосенсора в области линейного диапазона. Для биосенсора на основе клеток G. oxydans, иммобилизованных на БЦ, его значение составило 3 мкА/мМ × cм2. Для биосенсора на основе клеток G. oxydans, включенных в гель хитозана, данный параметр был равен 5 мкА/мМ × cм2. Таким образом, можно отметить, что несмотря на незначительную потерю в чувствительности электрода на основе БЦ, ее можно использовать как носитель для бактериальных клеток в составе микробного биосенсора или анода микробного топливного элемента.
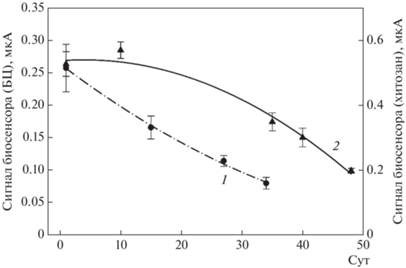
Изучение стабильности сигналов биосенсоров на основе клеток, иммобилизованных на БЦ и в геле хитозана (рис. 6) показало, что в течение первых 10 cут хранения амплитуда отклика биосенсора на основе БЦ снижалась на 40%, в то время как сигнал биосенсора на основе геля хитозана оставался на прежнем уровне. На 34 сут хранения отклик биосенсора на основе БЦ уменьшался в 5 раз по сравнению с начальным уровнем сигнала. На 48 сут хранения отклик биосенсора на основе хитозана снижался в 3 раза по сравнению с начальным уровнем сигнала. Возможно, это связано с различием в строении полимеров: в составе хитозана присутствуют реакционноспособные аминогруппы, которые способствуют более эффективному закреплению микроорганизмов внутри полимерной матрицы за счет образования связей с отрицательно заряженными карбоксильными и фосфатными группами на поверхности мембран бактериальных клеток [36], и которые отсутствуют в БЦ.
Рис. 6.
Долговременная стабильность биосенсора на основе клеток, иммобилизованных на БЦ (1, мкА) и в хитозане (2, мкА). Между измерениями электроды хранили при температуре 4°С. Концентрация глюкозы в кювете – 1.5 мМ
Таким образом, показана возможность использования БЦ для иммобилизации уксуснокислых бактерий G. oxydans на поверхности графитовых ЭМП в составе биосенсоров. Следует отметить, что использование БЦ возможно лишь в случае предварительной модификации поверхности графитового электрода наноматериалами, например, ТРГ. Последний выполняет двойную функцию, позволяя снизить общее сопротивление полученного электрода и обеспечивая надежное закрепление матрицы БЦ с иммобилизованными клетками на поверхности электрода.
БЦ на поверхности объемных электродов из никелевой пены. Для оценки возможности использования БЦ в качестве иммобилизующего агента в составе трехмерного электрода необходимо оценить степень удерживания БЦ на поверхности электрода (в данном случае НП). Была проверена способность БЦ удерживаться на поверхности НП при двух различных состояниях: а) предварительно высушенная пленка БЦ, повторно гидратированная и иммобилизованная на поверхности НП; б) агрегат БЦ, хранившийся в 70% растворе этилового спирта.
Поведение гидратированных фрагментов БЦ на НП были различны для образцов пленок и агрегатов. Гидратированная пленка отслаивалась после высыхания и погружения в измерительный раствор, а агрегаты БЦ прочно закреплялись на носителе в процессе высушивания. Таким образом, стандартная процедура предварительного засева БЦ бактериями в данном случае не подходит. В дальнейшей работе микроорганизмы иммобилизовали на агрегаты БЦ после высыхания непосредственно на электроде.
Влияние НП на дыхательную активность бактерий, иммобилизованных в пленках БЦ. Известно, что НП может использоваться для очистки бытовых сточных вод от некоторых видов бактерий [37], поэтому необходимо оценить ее влияние на каталитическую активность микроорганизмов, используемых в работе. Для этого регистрировали дыхательную активность бактерий G. oxydans, иммобилизованных на разных типах подложек (хроматографическая бумага, НП, БЦ) с помощью кислородного электрода типа Кларка. На рис. 7 показаны уровни дыхательной активности бактерий, измеренные в 9 последовательных измерениях. Из полученных данных видно, что скорость ферментативной реакции окисления глюкозы незначительно понижалась в случае использования НП как подложки. Тем не менее, это могло быть связано не с токсическим действием никеля на бактериальные клетки, а с диффузионными ограничениями при использовании 3D-материала в качестве подложки.
Рис. 7.
Сигнал кислородного электрода (скорость изменения сигнала, нА/с) с бактериями G. oxydans, иммобилизованными на разных носителях: 1 – НП, 2 – хроматографическая бумага GF/A, 3 – БЦ, в присутствии 1.25 мМ глюкозы. Ось х – номер измерения.
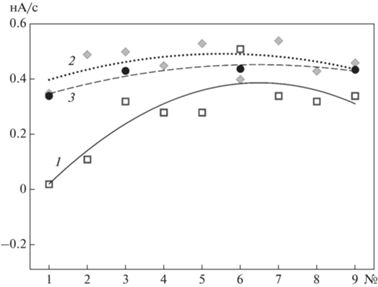
На всех носителях активность бактерий сохранялась до 7 сут. При этом уровень сигнала для бактериальных клеток на поверхности НП через 7 сут составлял ~30% от начальной величины.
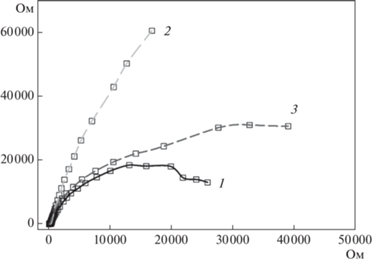
Электрохимические измерения. Для изучения импедансных характеристик биоэлектродов из НП были построены диаграммы Найквиста (рис. 8). Как видно из представленных диаграмм, наиболее низкое общее сопротивление электрода характерно для образца из немодифицированной НП (26.4 кОм). Иммобилизация БЦ на поверхности НП приводила к заметному увеличению емкостной составляющей импеданса и общего сопротивления электрода. Добавление бактерий G. oxydans незначительно уменьшало общее сопротивление электрода (55.3 кОм) по сравнению с композитом НП + БЦ (179.5 кОм) за счет снижения сопротивления переноса заряда, что свидетельствовало о потенциальной возможности применения данного композита в составе биоэлектродов, входящих в биосенсор, и БТЭ, так как в системе наблюдался перенос заряда от биокатализатора на поверхность рабочего электрода.
Рис. 8.
Диаграммы Найквиста для трехмерных электродов из НП (1) в присутствии БЦ (2) и иммобилизованных бактериальных клеток G. oxydans (3). На оси X (Zre) − величину активного сопротивления, оси Y (Zim) – мнимого.
Для оценки возможности использования композиции “НП + БЦ + бактериальные клетки” в составе биоэлектрохимических устройств оценивали ЦВА и хроноамперометрические зависимости биоэлектрода до и после введения в измерительную ячейку максимальной (для данного типа композиции) концентрации субстрата (глюкоза, 3 мМ) в присутствии ДХФИФ в качестве медиатора электронного транспорта. Результаты представлены на рис. 9. При добавлении в систему глюкозы наблюдался рост анодных пиков в диапазоне от 200 до 500 мВ (рис. 9а), что свидетельствовало о наличии медиаторного электронного переноса в системе в присутствии субстрата и подтверждало данные, полученные методом ЭИС. Для получения амперометрических сигналов биоэлектрода выбран рабочий потенциал, равный +400 мВ (относительно стандартного хлорсеребряного электрода), так как при этом потенциале на ЦВА-зависимостях наблюдали максимальное расхождение анодных пиков при добавлении в систему субстрата. На рис. 9б представлен вид типичной хроноамперометрической зависимости, показывающей изменение тока при введении субстрата в систему “НП + БЦ + иммобилизованные бактерии”.
Рис. 9.
Циклические вольт-амперные характеристики (а) и хроноамперометрическая зависимость (б) для биоэлектрода НП + БЦ + иммобилизованные клетки G. oxydans, в отсутствии (1) и после добавления 3 мМ глюкозы в ячейку (2). а – по оси Х (мВ) −приложенный потенциал, на оси Y (мкА) – уровень тока; б – на оси Х (с) – время, на оси Y (мкА) – уровень тока.
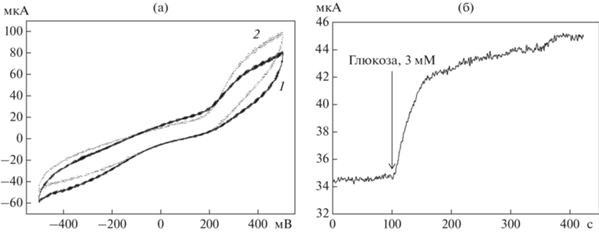
Таким образом, иммобилизованная на НП БЦ способна эффективно удерживать бактериальные клетки. С помощью электрохимических методов исследования показано, что, используя простую иммобилизацию БЦ на поверхности НП возможно создание комплексов “НП + БЦ + бактерии”, которые представляют основу для трехмерных электродов биоэлектрохимических устройств.
В работе показана возможность использования бактериальной целлюлозы в сочетании с высокопроводящими объемными материалами, такими как ТРГ и НП, для иммобилизации уксуснокислых бактерий в составе биосенсоров амперометрического типа. Несмотря на то, что биосовместимость БЦ была детально изучена ранее [38] и показана возможность использования ее в качестве основы электродов биоэлектрохимических устройств [39], вопрос об эффективности применения БЦ как компонента иммобилизующей матрицы оставался не до конца изученным. Основная масса работ посвящена применению БЦ как самостоятельного рабочего электрода, модифицируемого наноматериалами [40], либо как основы для нанесения проводящих чернил, которые формируют электроды на поверхности БЦ [41]. В данной работе БЦ использована как полимерная матрица для иммобилизации бактериальных клеток на поверхности графитового или никелевого электрода. При этом показано, что модификация поверхности графитовых электродов БЦ для иммобилизации бактерий не приводила к получению стабильно функционирующего биосенсора. Только добавление дополнительного наноматериала – ТРГ – позволяло эффективно иммобилизовать БЦ на регистрирующем электроде. Кроме того, использование ТРГ позволяло на ~3 порядка снизить сопротивление переноса заряда графитового электрода, что положительно сказывалось на эффективности его работы. Показана возможность применения двух высокопроводящих материалов ТРГ и НП для обеспечения высокоэффективного медиаторного переноса электронов от клеток микроорганизмов, иммобилизованных в БЦ. В случае использования данных композиций не требуется дополнительной химической привязки клеток к поверхности электрода. С помощью метода СЭМ показано, что основная масса бактерий оседает на поверхности БЦ, а часть клеток встраивается между ее волокнами, позволяя получить объемный биоэлектрод, сохраняющий свою активность в течение 34 сут. Полученные результаты представляют собой основу для дальнейшей разработки биоэлектрохимических устройств на основе БЦ, в том числе амперометрических биосенсоров для определения глюкозы. Таким образом, БЦ в сочетании с НП и ТРГ может быть материалом, который можно использовать для формирования объемных электродов биосенсоров и биотопливных элементов, основанных на бактериальных клетках Gluconobacter.
Исследование выполнено в рамках Государственного задания Министерства образования и науки РФ № FEWG-2020-0008 и Государственного задания ИРЭ им. В.А. Котельникова РАН FFWZ-2022-0002.
Список литературы
Lobsiger N., Stark W.J. // Anal Sci. 2019. V. 35. № 8. P. 839–847. https://doi.org/10.2116/analsci.19R004
Andriukonis E., Celiesiute–Germaniene R., Ramanavicius S., Viter R., Ramanavicius A. // Sensors. 2021. V. 21. № 7. 2442. https://doi.org/10.3390/s21072442
Lakard B. // Appl. Sci. 2020. V. 10. 6614. https://doi.org/10.3390/app10186614
Liu C., Xu Y., Han X., Chang X. // Environ. Toxicol. Chem. 2017. V. 37. № 2. P. 329–335. https://doi.org/10.1002/etc.3959
Chen J.Y., Xie P., Zhang Z.P. // Chem. Eng. J. 2019. V. 361. P. 615–624. https://doi.org/10.1016/j.cej.2018.12.116
Piao M., Zou D., Yang Y., Ren X., Qin C., Piao Y. // Materials. 2019. V. 12. 704. https://doi.org/10.3390/ma12050704
Truong D.H., Dam M.S., Bujna E., Rezessy-Szabo J., Farkas C., Vi V. N. H., Csernus O., Nguyen V.D., Gathergood N., Friedrich L., Hafidi M., Gupta V.K., Nguyen Q.D. // Fuel. 2021. V. 285. 119259. https://doi.org/10.1016/j.fuel.2020.119259
Meyer J., Meyer L.-E., Kara S. // Eng. Life. Sci. 2021. P. 1–13. https://doi.org/10.1002/elsc.202100087
Gao H., Khera E., Lee J.K., Wen F. // J. Vis. Exp. 2016. V. 110. 53944. https://doi.org/10.3791/53944
Chakraborty S. // J. Carbohydr. Chem. 2017. V. 36. № 1. P. 1–19. https://doi.org/10.1080/07328303.2017.1347668
Plekhanova Y., Tarasov S., Bykov A., Prisyazhnaya N., Kolesov V., Sigaev V., Signore M.A., Reshetilov A. // Biosensors. 2019. V. 9. 137. https://doi.org/10.3390/bios9040137
Kalita T., Sangma S., Bez G., Ambasht P. // J. Sci. Res. 2020. V. 64. P. 192–200. https://doi.org/10.37398/JSR.2020.640227
Sattar H., Aman A., Qader S.A.U. // Int. J. Biol. Macromol. 2018. V. 111. P. 917–922. https://doi.org/10.1016/j.ijbiomac.2018.01.105
Żywicka A., Wenelska K., Junka A., Chodaczek G., Szymczyk P., Fijałkowski K. // World. J. Microbiol. Biotechnol. 2019. V. 35. № 1. P. 11. https://doi.org/10.1007/s11274-018-2584-7
Bezerra C.S., de Farias Lemos C.M.G., de Sousa M., Gonçalves L.R.B. J. Appl. Polym. Sci. 2015. V. 132. № 26. https://doi.org/10.1002/app.42125
Moniri M., Boroumand Moghaddam A., Azizi S., Abdul Rahim R., Bin Ariff A., Zuhainis Saad W., Navaderi M., Mohamad R. // Nanomaterials. 2017. V. 7. № 9. 257. https://doi.org/10.3390/nano7090257
Revin V., Liyaskina E., Nazarkina M., Bogatyreva A., Shchankin M. // Braz. J. Microbiol. 2018. V. 49. P. 151–159. https://doi.org/10.1016/j.bjm.2017.12.012
Mohite B.V., Patil S.V. // Biotechnol. Appl. Biochem. 2014. V. 61. № 2. P. 101–110. https://doi.org/10.1002/bab.1148
Kiesewetter D.V., Zhuravleva N.M., Reznik A.S., Khripunov A.K., Migunova A.V. // 2020 IEEE 3rd International Conference on Dielectrics (ICD). 2020. P. 245–248. https://doi.org/10.1109/ICD46958.2020.9341885
Wang W., Zhang T.-J., Zhang D.-W., Li H.-Y., Ma Y.-R. Qi, L.-M., Zhou Y.-L., Zhang X.-X. // Talanta. 2011. V. 84. № 1. P. 71–77. https://doi.org/10.1016/j.talanta.2010.12.015
Li G., Sun K., Li D., Lv P., Wang Q., Huang F., Wei Q. // Colloids Surf. A Physicochem. 2016. V. 509. P. 408–414. https://doi.org/10.1016/j.colsurfa.2016.09.028
Jasim A., Ullah M.W., Shi Z., Lin X., Yang G. // Carbohydr. Polym. 2017. V. 163. P. 62–69. https://doi.org/10.1016/j.carbpol.2017.01.056
Divya Mahapatra S., Srivastava V.R., Chandra P. // Biosensors. 2021. V. 11. № 6. 168. https://doi.org/10.3390/bios11060168
Swingler S., Gupta A., Gibson H., Kowalczuk M., Heaselgrave W., Radeck, I. // Polymers. 2021. V. 13. № 3. P. 412. https://doi.org/10.3390/polym13030412
Dourado F., Gama M., Rodrigues A.C. // Toxicol. Rep. 2017. V. 4. P. 543–553. https://doi.org/10.1016/j.toxrep.2017.09.005
Poddar M.K., Dikshit P.K. // Nano Select. 2021. V. 2. № 9. P. 1605–1628. https://doi.org/10.1002/nano.202100044
Hui Y., Ma X., Qu F., Chen F., Chen Y. // J. Electrochem. Soc. 2017. V. 164. № 13. P. 112–120. https://doi.org/10.1149/2.0761713jes
Plekhanova Y., Tarasov S., Kitova A., Kolesov V., Kashin V., Sundramoorthy A.K., Reshetilov A. // 3 Biotech. 2022. V. 12. P. 42. https://doi.org/10.1007/s13205-021-03107-w
Reshetilov A.N., Plekhanova Y.V., Tarasov S.E., Arlyapov V.A., Kolesov V.V., Gutorov M.A., Gotovtsev P.M., Vasilov R.G. // Appl. Biochem. Microbiol. 2017. V. 53. № 1. P. 123–129. https://doi.org/10.1134/s0003683817010161
Ревин В.В., Кленова Н.А., Редькин Н.А., Белоусова З.П., Тукмаков К.Н., Маркова Ю.А., Сосова Э.Ю. // Известия вузов. Прикладная химия и биотехнология. 2017. Т. 7. № 1. С. 102–110. https://doi.org/10.21285/2227-2925-2017-7-1-102-110
Плеханова Ю.В, Тарасов С.Е., Быков А.Г., Присяжная Н.В., Тенчурин Т.Х., Чвалун С.Н., Орехов А.C., Шепелев А.Д., Готовцев П.М., Решетилов А.Н. // Российские нанотехнологии. 2018. Т. 13. № 9–10. С. 77–84. https://doi.org/10.1134/S1992722318050114
Погорелова Н.А., Чернигова С.В., Рогачев Е.А. // Вестник Омского государственного аграрного университета. 2019. Т. 4. № 36. С. 131–141.
Zhang H.Y., Yan X.J., Jiang Y., Cong J. // AMR 2010. V. 152–153. P. 978–987. https://doi.org/10.4028/www.scientific.net/amr.152-153.978
Rebelo A.R., Archer A.J., Chen X., Liu C., Yang G., Liu Y. // Sci. Technol. Adv. Mater. 2018. V. 19. № 1. P. 203–211. https://doi.org/10.1080/14686996.2018.1430981
Nangia S., Warkar S., Katyal D. // J. Macromol. Sci. A. 2019. P. 1–17. https://doi.org/10.1080/10601325.2018.1526041
Kubota M., Matsui M., Chiku H., Kasashima N., Shimijoh M., Sakaguchi K. // Appl Environ. Microbiol. 2005. V. 71. № 12. P. 8805–8902
Zhao J., Yan P., Snow B., Santos R.M., Chiang Y.W. // Process. Saf. Environ. Prot. 2020. V. 142. P. 191–202. https://doi.org/10.1016/j.psep.2020.06.013
Torres F., Commeaux S., Troncoso Heros O. // J. Funct. Biomater. 2012. V. 3. P. 864–878. https://doi.org/10.3390/jfb3040864
Li X., Lv P., Yao Y., Feng Q., Mensah A., Li D., Wei Q. // Chem. Eng. J. 2019. 122316. https://doi.org/10.1016/j.cej.2019.122316
Mashkour M., Rahimnejad M., Mashkour M., Soavi F. // J. Power Sources. 2020. V. 478 P. 228822. https://doi.org/10.1016/j.jpowsour.2020.228822
Eynaki H., Ali Kiani M., Golmohammadi H. // Nanoscale. 2020. V. 12. P. 18409–18417. https://doi.org/10.1039/D0NR03505J
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология