Прикладная биохимия и микробиология, 2022, T. 58, № 4, стр. 400-413
Изменения в протеоме мышечной ткани птицы при включении в рацион различных белковых добавок
Д. Ю. Исмаилова 1, О. С. Савинова 2, Т. В. Фёдорова 2, *, Д. В. Васина 2, В. Г. Волик 1, В. С. Лукашенко 3, И. П. Салеева 3
1 Всероссийский научно-исследовательский институт птицеперерабатывающей промышленности – филиал ФНЦ “ВНИТИП” РАН (ВНИИПП)
141552 Московская обл., п. Ржавки, Солнечногорский район, Россия
2 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
3 Федеральный научный центр “Всероссийский научно-исследовательский и технологический институт птицеводства” Российской академии наук (ФНЦ “ВНИТИП” РАН)
141311 Московская обл., Сергиев Посад, Россия
* E-mail: fedorova_tv@mail.ru
Поступила в редакцию 03.09.2021
После доработки 01.11.2021
Принята к публикации 15.11.2021
- EDN: NMXGER
- DOI: 10.31857/S0555109922040067
Аннотация
Показано, что при введении в рацион кормления цыплят бройлеров ферментированной белковой кормовой добавки (ФКД), в протеомах грудных (pectoralis) и ножных (femoralis) мышц птицы отмечалось появление дополнительных фрагментов белков, являющихся биомаркерами нежности (актин, тропонин, тяжелые и легкие цепи миозина) и влагоудерживающей способности мяса (креатинкиназа М типа). Также присутствовали дополнительные изоформы белков, относящихся к различным комплексам электрон-транспортной цепи (комплекс цитохромов bc1, или комплекс III дыхательной цепи переноса электронов), характеризующих эффективность данного рациона кормления. Введение в рацион кормления птицы ФКД приводило также к повышению антиоксидантной емкости тканей грудных и ножных мышц бройлеров и снижению содержания жира в тканях ножных мышц.
Качество и безопасность продукции птицеводства во многом зависят как от технологии выращивания и содержания птицы, так и от рационов кормления. Сбалансированное кормление цыплят-бройлеров (цыплята определенных кроссов с высокой продуктивностью набора мышечной массы за короткий промежуток времени) предполагает использование рационов, содержащих безвредные и полноценные корма и добавки, которые позволяют наиболее полно реализовать генетический потенциал птицы и получить высокопитательную и безопасную пищевую продукцию.
В последнее время все более популярным становится замещение традиционных источников белка в рационе птицы гидролизатами вторичных продуктов животноводства [1, 2], в том числе птицеводства [3–5]. Внимание к таким подходам обусловлено тем, что содержащиеся в гидролизатах пептиды могут проявлять функциональную (регуляторную) и биологическую (противомикробную, антиоксидантную, антигипертензивную и иммуномодулирующую) активности.
Поскольку сочность, нежность, запах и вкус мяса цыплят зависят от разных факторов (генетических особенностей, условий кормления и содержания птицы, обработки и хранения тушек) [6], знание динамики роста, морфологии и биохимического состава мышечной ткани с учетом вида, породы, пола, условий содержания и кормления птицы представляет большой научный и практический интерес. Однако традиционные методы оценки качества мяса, такие как анализ текстуры, цветовых различий, влагоудерживающей способности (ВУС) и вкуса, не могут полностью достичь цели контроля и прогнозирования качества мяса [7–9]. Поэтому, в последние годы все большее внимание уделяется поиску и изучению биомаркеров, обуславливающих качественные характеристики мяса, с помощью протеомных технологий [10–18]. Протеомика становится важным и перспективным инструментом в области науки о мясе и позволяет исследователям получить более глубокие знания об основных молекулярных механизмах, влияющих на качество мяса.
Хотя протеомные исследования были успешно применены для поиска биомаркеров и изучения молекулярных механизмов, связанных с качеством мяса домашних животных, таких как свиньи [19], коровы [20] и овцы [21], тем не менее, сообщения о подобных исследованиях на птице весьма ограничены. Так, были проведены протеомные исследования для выяснения влияния рациона питания на рост и качество мяса птицы [10, 11]. Исследователи обнаружили влияние дефицита аминокислот в рационе питания на протеом мышц и объяснили изменения в протеомах во время роста кур-несушек [11]. В результате изучения протеома индеек были обнаружены различия в быстром и нормально протекающем гликолизе в тканях грудных мышц и установлена их связь с качеством мяса [12]. Был проведен протеомный анализ мышц нативных и коммерческих цыплят-бройлеров [13] с целью определения взаимосвязи между белковым составом и нежностью мяса. Результаты показали, что гликолитические ферменты, такие как пируваткиназа, фосфоглицерат мутаза и триозофосфатизомераза, связаны с качеством мяса. Протеомная характеристика саркоплазматических белков в грудных мышцах была проведена для двух различных генотипов цыплят, включая коммерческих бройлеров Ross 708 и цыплят-леггорнов Hyline W-36 [15]. Результаты показали, что гликогенфосфорилаза, енолаза, креатинкиназа, фруктозо-бисфосфатальдолаза и глицеральдегид-3-фосфатдегидрогеназа различались у этих двух штаммов в период роста грудных мышц. В работе [16] авторы изучили протеомный состав и дифференциальную экспрессию белков, экстрагированных из мышц молодняка кур с различной скоростью роста и отличающихся ВУС. Белки отличия, идентифицированные у разных групп цыплят с помощью двумерного электрофореза и масс-спектрометрии, включали такие метаболические ферменты как креатинкиназа и пируваткиназа. Эти исследования обозначили потенциал протеомных методов для выяснения биохимических основ изменения окраски, ВУС и текстуры мяса цыплят-бройлеров.
Цель работы – сравнительное исследование протеомов белого и красного мяса цыплят-бройлеров при выращивании на разных рационах кормления и анализ белковых биомаркеров качества мяса птицы.
МАТЕРИАЛЫ И МЕТОДЫ
Кормовые добавки. В качестве кормовых добавок животного происхождения при кормлении бройлеров использовали побочные продукты птицепереработки, такие как кровь, кишечник, перо, которые подвергали кратковременному гидротермическому гидролизу (гидролизованная кормовая добавка – ГКД) [22] с последующим ферментативным гидролизом протеазами (ферментированная кормовая добавка – ФКД) [23], и рыбную муку – РМ (Марка МК – 0378, производитель “Капитан Назин”, Россия).
ГКД получали гидролизом побочных продуктов переработки птицы (перо, кишечник) в аппарате высокотемпературной обработки при 140–190°С в течение 60–90 с [22]. ФКД получали ферментацией побочных продуктов переработки птицы после гидротермической обработки [23]. Для гидролиза перьевого сырья использовали ферментные препараты Протозим С (“Биопрепарат”, Россия) и Novo-Pro D (“Novozymes”, Дания) из расчета 5–15 ед. протеолитической активности (ME) на г белка при гидромодуле 1 : 4, температуре 55–58°С, в течение 4 ч. Для ферментации кишечного сырья использовали ферментные препараты нейтраза и алкалаза (“Novozymes”, Дания) в дозе 5–10 MЕ/г белка при гидромодуле 1 : 1, температуре 50–52°С, продолжительности гидролиза 2–4 ч.
Исследования in vivo. Опыт по включению различных кормовых добавок в рацион цыплят бройлеров кросса “Смена” проводили в условиях вивария селекционно-генетического центра “Загорское Экспериментальное Племенное Хозяйство” ФНЦ ВНИТИП РАН (Россия). Для опыта были отобраны цыплята-бройлеры кросса “Смена 9” средней живой массой 43 ± 0.8 г. Из них было сформировано случайным образом 4 группы по 35 голов в каждой.
Контрольная группа № 1 получала основной рацион без добавления кормовых добавок животного происхождения (табл. 1), а контрольная группа № 4 – основной рацион с добавлением рыбной муки. Опытные группы №№ 2 и 3 дополнительно к основному рациону до конца периода выращивания получали экспериментальные кормовые добавки (табл. 2). В опытной группе № 2 в качестве кормовой добавки использовали гидролизат побочных продуктов переработки птицы, полученный методом кратковременной высокотемпературной обработки (ГКД, гидролизованная кормовая добавка). В опытной группе № 3 – ферментированный гидролизат побочных продуктов переработки птицы (ФКД). Масса потребленного протеина в составе белковых добавок – 1.6 кг на 1 кг живой массы птицы.
Таблица 1.
Рацион без добавления кормовых добавок животного происхождения
| Компонент | Период выращивания, сут. | |||
|---|---|---|---|---|
| 0–5 (престарт) |
6–14 (старт) |
15–22 (рост) |
23–38 (финиш) |
|
| Пшеница 11.5% | 32.70 | 33.90 | 34.80 | 37.00 |
| Кукуруза 8.5% | 20.00 | 19.34 | 20.55 | 20.00 |
| Соевый шрот 44% | 25.14 | 22.80 | 2.70 | 0 |
| Соя полуобеж 40% | 15.00 | 16.00 | 25.60 | 24.14 |
| Жмых подсолн. 34% | 0 | 0 | 9.80 | 11.60 |
| Масло соевое | 2.80 | 3.50 | 2.50 | 3.50 |
| Известняк Са 36% | 1.10 | 1.12 | 1.05 | 0.96 |
| Монокальцийфосфат | 1.60 | 1.60 | 1.35 | 1.26 |
| Лизин монохлоргидрат | 0.23 | 0.27 | 0.31 | 0.29 |
| Метионин | 0.34 | 0.35 | 0.26 | 0.17 |
| Соль | 0.26 | 0.27 | 0.27 | 0.28 |
| Треонин | 0.12 | 0.14 | 0.10 | 0.10 |
| Сульфат натрия | 0.11 | 0.11 | 0.11 | 0.10 |
| Холин хлорид | 0.10 | 0.10 | 0.10 | 0.10 |
| Премикс “Агрофид” 0.5% | 0.50 | 0.50 | 0.50 | 0.50 |
| Итого: | 100 | 100 | 100 | 100 |
| В 100 г комбикорма содержится, % | ||||
| Обменной энергии, ккал | 305.0 | 310.0 | 310.0 | 320.0 |
| Сырого протеина | 23.03 | 22.54 | 21.0.3 | 20.01 |
| Сырой клетчатки | 3.79 | 3.69 | 4.46 | 4.57 |
| Кальция | 0.96 | 0.96 | 0.87 | 0.82 |
| Фосфора общего | 0.79 | 0.78 | 0.77 | 0.75 |
| Фосфора усвояемого | 0.48 | 0.48 | 0.43 | 0.41 |
| Натрия | 0.16 | 0.16 | 0.16 | 0.16 |
| Хлориды | 0.23 | 0.24 | 0.26 | 0.26 |
| Лизина | 1.37 | 1.23 | 1.22 | 1.12 |
| Лизина усвояемого | 1.23 | 0.66 | 1.09 | 1.00 |
| Метионина + Цистина | 1.03 | 1.03 | 0.95 | 0.84 |
| Мет + Цистина усвояемого | 0.93 | 0.96 | 0.84 | 0.73 |
| Треонина | 0.94 | 0.94 | 0.86 | 0.78 |
| Треонина усвояемого | 0.81 | 0.81 | 0.71 | 0.68 |
Таблица 2.
Физико-химический, фракционный состав и антиоксидантная емкость кормовых добавок
| Показатель, % | ГКД | ФКД | РМ |
|---|---|---|---|
| Массовая доля жира | 6.6 | 11.7 | 13.0 |
| Массовая доля протеина | 26.0 | 76.1 | 74.3 |
| Массовая доля золы | 3.3 | 4.9 | 9.1 |
| Массовая доля влаги | 4.9 | 7.3 | 3.6 |
| Пищевые волокна | 59.2 | – | – |
| Переваримость протеина | 66.9 | 95.4 | 90.2 |
| Антиоксидантная емкость (ORAC), мкмоль ТЭ/г | 401.5 ± 50 | 1980 ± 100 | 152.8 ± 10 |
| Массовая доля белковой фракции с Mr >10 кДа | 32.8 | 4.9 | 7.9 |
| Массовая доля белковой фракции с Mr 3–10 кДа | 13.6 | 16.6 | 8.5 |
| Массовая доля белковой фракции с <3 кДа | 53.6 | 78.5 | 83.6 |
В возрасте 38 дней были отобраны по 3 средних по живой массе бройлера из каждой группы. С целью оценки мясных качеств тушки цыплят после обескровливания подвергали анатомической разделке согласно методике [24]. После анатомической разделки были отобраны образцы мышечной ткани бедра и грудки цыплят бройлеров, проанализированы их физико-химические свойства (рН, содержание белка, жира, влаги и золы, ВУС), белковый состав и антиоксидантная емкость.
Содержание белка определяли согласно ISO 5983-1:2005; жира по ISO 6492:1999; влаги – по ISO 6496:1999; золы по ISO 5985:2002 и рН по ISO 2917:1974. ВУС определяли методом Грау-Хамма в модификации Журавской [25].
Протеомный анализ экстрактов мышечной ткани бройлеров. Анализ проводили методом двумерного электрофореза с масс-спектрометрической идентификацией отдельных белковых пятен. Использовали образцы мышечных тканей грудки и бедра бройлеров 4-х экспериментальных групп (табл. 3).
Для получения белковых экстрактов мышечные ткани бедра и грудки бройлеров измельчали в блендере (“Selecline”, Китай) в течение 5 минут до гомогенного состояния. Затем навеску измельченной мышечной ткани (100 мг) гомогенизировали с использованием гомогенизатора Поттера в 400 мкл лизис-буфера следующего состава (%): дитиотреитол (DTT, “Merck”, Германия) – 1; 3‑(3-холамидопропил) диметиламмоний-3-пропансульфонат (CHAPS, “VWR Chemicals”, США) – 4; амфолины 3/10 (“Serva Electrophoresis”, Германия) – 5; 7 M мочевина и 2 M тиомочевина (“GE Healthcare”, США). Полученный экстракт центрифугировали в течение 10 мин при 800 g, отбирали надосадочную жидкость и хранили при температуре –73°С до проведения анализа.
Двумерный электрофорез (2-DE). 2-DЕ электрофорез проводили по О’Фарреллу с изоэлектрофокусированием в амфолиновом градиенте рН 3–10 (“Serva Electrophoresis”, Германия), как было описано ранее в [26], на системе PROTEAN II xi 2-D Cell (“Bio-Rad”, США). Количество образца составляло 70 мкг белка на трубку. Электрофорез полученных после изоэлектрофокусирования образцов проводили в градиентном акриламидном геле в присутствии додецилсульфата натрия (ДДС-Na, 7.5–25%) при напряжении 300 В. Перед нанесением на второе направление образцы инкубировали 20 мин в растворе, содержащем дитиотреитол (мочевина – 6 М, ДДС-Na – 2%, DTT – 10 мМ, трис-HCl – 0.5 M, pH 6.8) для предотвращения окисления сульфгидрильных групп в белках. Для визуального анализа распределения белковых компонентов и масс-спектрометрического анализа гели окрашивали раствором AgNO3 или Brilliant Blue R Staining Solution (“Sigma”, США).
Для получения белковых карт, использовали систему гельдокументирования Infinity1000/26MX (“Vilber Lourmat”, Франция). Анализ белковых карт проводили при помощи программного обеспечения ImageMaster 2D Platinum, v.7 (“GE Healthcare”, США).
Масс-спектрометрический анализ белков. Для масс-спектрометрического анализа вырезали кусочки геля размером 3–4 мм3, соответствующие белковым пятнам, и дважды промывали для удаления красителя в 100 мкл 40%-ного раствора ацетонитрила в 0.1 М NH4HCO3 в течение 20 мин при 37°С. После удаления раствора, добавляли 100 мкл ацетонитрила для дегидратации геля. После удаления ацетонитрила и высушивания геля, добавляли раствор модифицированного трипсина (“Promega”, США) в 0.05 М NH4HCO3 с концентрацией 15 мкг/мл. Гидролиз проводили в течение 8 ч при 37°С, затем к раствору добавляли 0.5%-ную трифторуксусную кислоту (ТФУ) в 10%-ном водном растворе ацетонитрила. Раствор, содержащий гидролизат белка, использовали для масс-спектрометрического анализа. В качестве матрицы использовали раствор 2,5-дигидроксибензойной кислоты (“Aldrich”, США) 10 мг/мл в 20%-ном водном ацетонитриле и 0.5%-ной ТФУ.
Масс-спектры были получены на MALDI-времяпролетно-времяпролетном масс-спектрометре Ultraflex II (“Bruker”, Германия), оснащенном УФ-лазером в режиме положительных ионов с использованием рефлектрона. Точность измеренных масс моноизотопов после докалибровки по пикам автолиза трипсина составляла 0.005% (50 ррm). Спектры получали в диапазоне масс 700–4500 m/z, выбирая мощность лазера оптимальную для достижения наилучшего разрешения. Для получения спектров фрагментации использовали тандемную масс-спектрометрию MALDI TOF/TOF-MS, точность измерения фрагментных ионов была не ниже 1 Да.
Обработку масс-спектров осуществляли с помощью программного пакета FlexAnalysis 3.3 (“Bruker Daltonics”, Германия). Идентификацию белков проводили при помощи программы Mascot (www.matrixscience.com). Для этого, используя опцию “пептидный фингерпринт”, проводили поиск в базе данных NCBI (www.ncbi.nlm.nih.gov) среди белков всех организмов с указанной выше точностью, с учетом возможного окисления метионинов кислородом воздуха и возможной модификации цистеинов акриламидом геля. Кандидатные белки, имеющие параметр достоверности score >76 в базе данных NCBI считали определенными надежно (p < 0.05), белки, имеющие параметр достоверности score >50, считали вероятными. С использованием программного обеспечения Biotools 3.2 (“Bruker Daltonics”, Германия) проведен поиск по объединенным результатам.
Определение in vitro антиоксидантной емкости (АОЕ) в гомогенатах мышечной ткани бедра и грудки цыплят бройлеров. Для определения АОЕ гидрофильных компонентов тканевых экстрактов, 200 мг ткани грудной мышцы или бедра птицы помещали в пластиковую пробирку, добавляли 8 мл 11.5%-ного раствора хлорида калия. Гомогенизацию проводили в течение 5 мин при температуре 4°С в гомогенизаторе Silent Crusher S, снабженным насадкой 7F (“Heildolph”, Германия) при скорости 75 000 об./мин. Гомогенат центрифугировали в течение 20 мин при 30 000 g и температуре 4°С. Надосадочную жидкость отделяли и разводили в 50 мМ фосфатно-солевом буфере, рН 7.4, в 15–25 раз.
Анализ антиоксидантной емкости гомогенизированных образцов мяса грудной мышцы и бедра птицы измеряли по отношению к пероксильному радикалу. Пероксильный радикал генерировался непосредственно в реакционной среде при термическом распаде азосоединения 2,2'-азобис(2-метилпропионамидина) дигидрохлорида (ААРН, “Sigma”, США), которое инициировалось инкубацией при 37°С в течение 10 мин [27]. АОЕ гидрофильных компонентов экстрактов мышечной ткани птицы по отношению к пероксильному радикалу выражали в мкмоль эквивалентов тролокса (ТЭ) в расчете на г ткани. Кинетику уменьшения флуоресценции регистрировали в течение 1 ч с интервалом измерений 60 сек на фотометре-флуориметре BioTek Synergy 2 (“BioTek”, США), в режиме регистрации интенсивности флуоресценции (длина волны возбуждения – 485 нм, длина волны испускания – 528 нм).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства грудных и ножных мышц птицы. Результаты оценки влияния скармливания белковых кормовых добавок на физико-химический состав грудных и ножных мышц цыплят-бройлеров представлен в табл. 3. По показателям рН грудных и ножных мышечных тканей после забоя и анатомической разделки тушек не обнаружено принципиальных различий в группах. Между тем в группах 2–4 цыплят-бройлеров наблюдалась общая закономерность снижения количества общей влаги по сравнению с контрольной группой 1, при этом в грудных мышцах содержание влаги было меньше контроля в группах 2 и 3, а в ножных мышцах – в группах 2 и 4. Содержание жира в грудных мышцах опытных птиц в группах 2–4 было достоверно ниже (примерно на 28%) относительно контрольной группы 1. Также содержание жира в ножных мышцах опытной группы 3 было ниже контрольной на 16%. В то же время в группах 2 и 4 содержание жира в ножных мышцах было выше на 26 и 46% соответственно по сравнению с контрольной группой 1.
Таблица 3.
Физико-химический состав грудных мышц (pectoralis muscle) и ножных мышц (femoralis muscle)
| Пока-затель | Группа № | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 контроль | 2 ГКД | 3 ФКД | 4 РМ | |||||
| грудные мышцы | ножные мышцы | грудные мышцы | ножные мышцы | грудные мышцы | ножные мышцы | грудные мышцы | ножные мышцы | |
| рН | 5.79 ± 0.00 | 6.07 ± 0.00 | 5.80 ± 0.00 | 6.01 ± 0.00 | 5.99 ± 0.00 | 6.00 ± 0.00 | 5.82 ± 0.00 | 5.90 ± 0.00 |
| Влага, % | 73.2 ± 7.3 | 73.2 ± 7.3 | 72.8 ± 7.2 | 71.1 ± 7.1 | 72.8 ± 7.2 | 73.5 ± 7.3 | 73.1 ± 7.3 | 69.7 ± 6.9 |
| Жир, % | 1.8 ± 0.3 | 7.0 ± 1.0 | 1.3 ± 0.2 | 8.8 ± 1.3 | 1.3 ± 0.2 | 5.9 ± 0.9 | 1.3 ± 0.2 | 10.2 ± 1.5 |
| Белок, % | 23.7 ± 1.9 | 18.6 ± 2.8 | 24.5 ± 2.00 | 18.9 ± 2.8 | 24.5 ± 2.00 | 19.4 ± 2.9 | 24.1 ± 1.9 | 18.9 ± 2.8 |
| Зола, % | 1.22 ± 0.17 | 1.02 ± 0.15 | 1.30 ± 0.18 | 1.03 ± 0.15 | 1.30 ± 0.18 | 1.09 ± 0.16 | 1.35 ± 0.19 | 1.05 ± 0.15 |
| ВУС, % | 58.5 | 61.5 | 60.4 | 61.5 | 63.4 | 64.4 | 58.9 | 62.7 |
Показано повышение содержания сырого протеина в грудных мышцах цыплят-бройлеров трех групп (группы 2, 3 и 4) примерно на 3.4%, в сравнении с контролем (группа 1). В то же время суммарное содержание белка в ножных мышцах цыплят из опытной группы 3 было выше на 4.3% по сравнению с остальными группами, что, по-видимому, является следствием увеличения усвоения белка у цыплят этой группы, получавших белковую кормовую добавку ФКД (табл. 3).
ВУС грудных и ножных мышечных тканей в опытной группе 3 была самой высокой среди всех групп и превосходила аналогичный показатель групп 1 и 4 на 8.4% для грудных мышц и на 4.7% для ножных мышц. Значение ВУС грудных мышц птицы, получавшей рацион с ГКД (группа 2), также было выше показателей групп 1 и 4 на 3.2%. Однако значение ВУС ножных мышц птицы из группы 2 имело близкие с контрольной группой 1 значения и несколько уступало значениям в группе 4.
Мясо птицы является наиболее полноценным и диетическим продуктом по сравнению с мясом других сельскохозяйственных животных, так как в нем содержится больше полноценных и меньше трудно усваиваемых белков (коллагена и эластина), что обусловливает его высокую питательную ценность. Увеличение содержания белка в мышечных тканях цыплят-бройлеров группы 3 повышало питательную ценность мяса птиц этой опытной группы. При этом показатели ВУС грудных и ножных мышечных тканей у данной опытной группы самые высокие, что свидетельствовало также о повышении качества мяса птиц, получавших рацион с кормовой добавкой ФКД.
Таким образом, показано, что включение в рацион цыплят-бройлеров кросса “Смена 9" экспериментальной кормовой белковой добавки ФКД наиболее существенно влияло на физико-химический состав мышечной ткани, по сравнению с ГКД и РМ, что в свою очередь положительно сказывается на питательной ценности и качестве мяса.
В настоящее время для исследования качества мяса и поиска биомаркеров, характеризующих его вкусовые качества, такие как нежность и влагоудерживающую способность, активно применяют протеомные методы [28, 29]. Кроме того, протеомика позволяет определять модификацию белков мышечных тканей, а именно фосфорилирование, окисление, деградацию и денатурацию [30]. В связи с этим в работе был изучен белковый состав образцов мышечных тканей птицы из разных групп и проведен их сравнительный анализ.
Фракционный состав белковых экстрактов грудных и ножных мышц птицы. В ходе исследования были получены протеомные карты образцов тканей грудных (pectoralis muscle) и ножных (femoralis muscle) мышц бройлеров (белое и красное мясо птицы соответственно) при различных рационах кормления (рис. 1 и 2).
Рис. 1.
Протеомный профиль образцов грудных мышц бройлеров групп 1(а), 3 (б), 2 (в) 4 (г). Черным обозначены белки, характерные для всех образцов, зеленым – присутствующие не во всех образцах, красным – уникальные; М – маркер молекулярной массы.
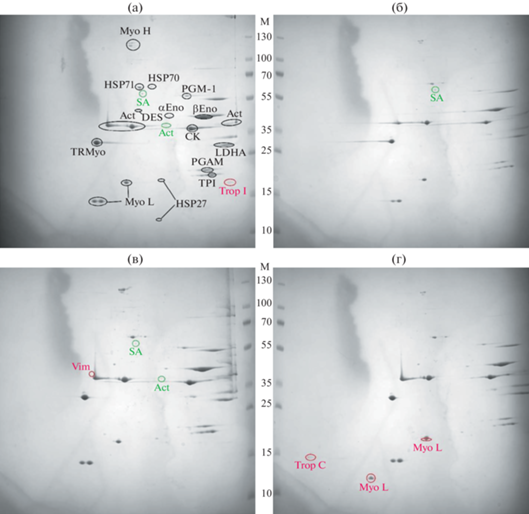
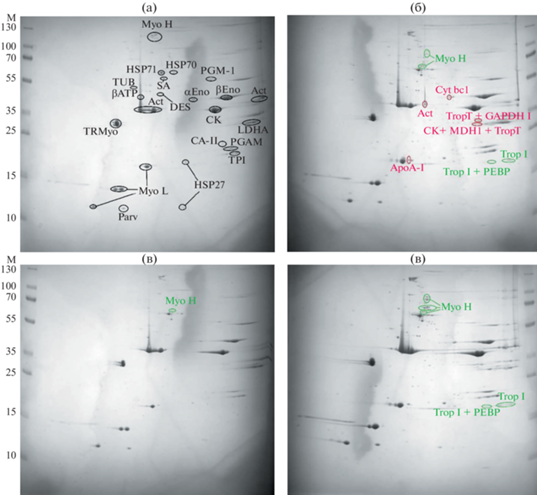
Рис. 2.
Протеомный профиль образцов ножных мышц бройлеров групп 1(а), 3 (б), 2 (в) 4 (г). Черным обозначены белки, характерные для всех образцов, зеленым – присутствующие не во всех образцах, красным – уникальные; М – маркер молекулярной массы.
Белковые фракции характеризовались различными изоточками рI и различными молекулярными массами. Фракционирование образцов методом двумерного электрофореза позволило идентифицировать до 150 белковых фракций (основные представлены в табл. 4). Большинство триптических спектров белков соответствовали последовательностям, существующим в базах данных для цыпленка (Gallus gallus), однако для некоторых гомологи были найдены у других видов. Среди идентифицированных белков более половины (61%) составляли белки структурной функции, в том числе фибриллярные белки: актин, миозин, тропомиозин и тропонин, также были идентифицированы виментин и парвальбумин. Изменения спектра структурных белков в образцах в основном обусловлены аминокислотными заменами или модификациями этих форм относительно белковых последовательностей, существующих в базах данных. Это вероятно связано с генетическими особенностями птиц, использованных в исследовании.
Таблица 4.
Список белков в тканях грудных (pectoralis) и ножных (femoralis) мышц бройлеров кросса “Смена 9”, идентифицированных с помощью MALDI TOF/TOF-масс-спектрометрии
| Идентифицированный белок | Обозна-чение на (рис. 1 и 2) | NCBI ID | Mм, кДа | pI | Индекс совпаде-ния (Score) |
E-value | Организм |
|---|---|---|---|---|---|---|---|
| Структурные белки | |||||||
| Актины | |||||||
| Кардиальный альфа-актин 1 | Act | KFW81934.1 | 30 | 4.99 | 54 | 12 | Manacus vitellinus |
| Актин альфа скелетно-мышечный* | NP_001026234.1 | 42 | 5.23 | 329 | 1.3e-030 | Gallus gallus | |
| Кардиальный альфа-актин 2 | AAX85445.1 | 42.5 | 5.23 | 75 | 0.11 | Rana catesbeiana | |
| Миозины | |||||||
| Легкая цепь миозина, изоформа скелетно-мышечная Х1* | Myo L | XP_015144626.1 | 19 | 4.96 | 244 | 1.3e-18 | G. gallus |
| Легкая цепь миозина 1, кардиальная изоформа Х1 | XP_015136535.1 | 22 | 5.13 | 96 | 2.3e-007 | G. gallus | |
| Тяжелая цепь миозина 1E, скелетно-мышечная | Myo H | NP_001013415.1 | 224 | 5.63 | 234 | 1.3e-17 | G.gallus |
| Тяжелая цепь миозина* | AAB20215.1 | 222 | 5.61 | 412 | 2.1e-35 | G. gallus | |
| Тропонины | |||||||
| Тропонин C скелетно-мышечный | Trop C | NP_990781.1 | 18 | 4.05 | 163 | 1.7e-10 | G. gallus |
| Тропонина С сердечная/медленная скелетная изоформа | NP_990464.1 | 19 | 4.05 | 139 | 4.2e-08 | G. gallus | |
| Тропонин I скелетно-мышечный, быстрый тип* | Trop I | NP_990748.1 | 21 | 9.19 | 201 | 2.6e-14 | G. gallus |
| Тропонин Т скелетно-мышечный, быстрый тип, изоформа Х42 | Trop T | XP_015142062.1 | 30 | 9.19 | 112 | 2.1e-05 | G. gallus |
| Тропонин Т скелетно-мышечный, быстрый тип | NP_990253.1 | 34 | 6.60 | 88 | 0.0058 | G. gallus | |
| Тропомиозины | |||||||
| Тропомиозин альфа 1-цепь, изоформа X1* | TRMyo | AAA49113.1 | 31 | 4.64 | 423 | 1.2e-36 | G. gallus |
| Тропомиозин альфа 1-цепь, изоформа X1* | XP_015134260.1 | 32 | 4.7 | 472 | 1.5e-41 | G. gallus | |
| Тропомиозин β-цепь, изоформа В | OPJ75462.1 | 30 | 4.63 | 329 | 3.1e-27 | Patagioenas fasciata monilis | |
| Другие | |||||||
| Парвальбумин мышечный | Parv | KFV44965.1 | 10 | 5.07 | 118 | 3.9e-06 | Tyto alba |
| Виментин | Vim | NP_001041541.2 | 53 | 5.13 | 139 | 4.2e-08 | G. gallus |
| Ферменты | |||||||
| Креатинкиназа М-тип* | CK | NP_990838.1 | 44 | 6.50 | 365 | 1.00e-30 | G. gallus |
| Цитоплазматическая малатдегидрогеназа | MDH1 | NP_001006395.1 | 37 | 6.92 | 160 | 3.3e-10 | G. gallus |
| Субьединица β митохондриального комплекса АТФ синтазы | βATP | NP_001026562.2 | 57 | 5.44 | 419 | 4.2e-36 | G. gallus |
| Фосфоглюкомутаза-1* | PGM-I | NP_001033782.2 | 53 | 6.52 | 324 | 9.7e-27 | G. gallus |
| Гликолиз | |||||||
| α-Енолаза, изоформа Х3 | α-Eno | XP_015152319.2 | 48 | 6.09 | 118 | 5.2e-06 | G. gallus |
| β-Енолаза | β-Eno | NP_990450.1 | 48 | 7.28 | 223 | 1.7e-16 | G. gallus |
| Глицеральдегид-3-фосфатдегидрогеназа 1 | GAPDH-I | AZN23181.1 | 39 | 6.27 | 126 | 8.3e-07 | G. gallus |
| Триозофосфатизомераза* | TPI | NP_990782.1 | 27 | 6.71 | 393 | 1.7e-33 | G. gallus |
| Лактатдегидрогеназа А* | LDHA | NP_990615.1 | 29 | 7.75 | 301 | 1.9e-24 | G. gallus |
| Фосфоглицератмутаза-1* | PGAM | NP_001026727.1 | 22 | 7.03 | 217 | 4.9e-16 | G. gallus |
| Другие белки | |||||||
| Аполипопротеин A1 | Apo A-I | AAA48597.1 | 31 | 5.58 | 615 | 1.00e-55 | G. gallus |
| Цитохром-bc1-комплекс митохондриальный, субъединица 1 | Cyt bc1 | XP_414356.3 | 54 | 6.58 | 114 | 1.3e-05 | G. gallus |
| Фосфатидилэтаноламин-связывающий белок 1 | PEBP-I | NP_001185571.1 | 21 | 6.96 | 159 | 4.2e-10 | G. gallus |
| Карбоангидраза II | CA II | CAA29417.1 | 30 | 6.56 | 127 | 6.6e-07 | G. gallus |
| Сывороточный альбумин, прекурсор | SA | NP_990592.2 | 72 | 5.51 | 376 | 8.3e-32 | G. gallus |
| Белок теплового шока 71 | HSP71 | XP_010147574.1 | 60 | 5.23 | 318 | 3.9e-26 | Eurypyga helias |
| Белок теплового шока 70 | HSP70 | AAP37959.1 | 60 | 5.66 | 291 | 1.9e-23 | G. gallus |
Кроме того, были идентифицированы ферменты, участвующие в гликолизе: енолаза, глицеральдегид-3-фосфатдегидрогеназа (GAPDH), фосфоглицератмутаза (PGM), лактатдегидрогеназа (LDH), триозофосфатизомераза и другие ферменты: АТФ-синтаза, малатдегидрогеназа, креатинкиназа (CK), а также различные белки семейства молекулярных шаперонов (HSP70 и HSP71).
Проведенный протеомный анализ позволил выявить зоны локализации важных структурных мышечных белков: актинов, миозинов, тропомиозинов и тропонинов (рис. 1а и 2а). Как видно на рисунках, протеомные профили в группах 1–4 близки для образцов грудных мышц (рис. 1) и ножных мышц (рис. 2) птицы. Так, в каждой группе белков присутствуют “стабильные” формы, продукция которых неизменна от образца к образцу. Тем не менее, были идентифицированы также индивидуальные белковые компоненты, изменяющиеся как количественно, так и качественно в зависимости от образца (рис. 1 и 2).
Показаны значительные изменения в профилях продукции трех групп белков мышечного сокращения (актины, миозины и тропонины) в зависимости от рациона питания. Обнаружены дополнительные фракции актина в протеоме грудных мышц птицы из группы 2: кардиальный альфа-актин 1 (ACTA1, KFW81934.1) и скелетномышечный альфа-актин (NP_001026234.1) (рис. 1б). На протеомных картах ножных мышц птицы из группы 3 присутствовали дополнительные изоформы актина: скелетномышечный альфа-актин (NP_001026234.1) и кардиальный альфа-актин 2 (AAX85445.1) (рис. 2в). В протеоме ножных мышц птицы из группы 4 также идентифицированы дополнительные изоформы скелетномышечного альфа-актина (NP_001026234.1, рис. 2г).
На протеомных картах различался также состав фракций миозинов: в грудных мышцах птицы из группы 2 обнаружено увеличенное содержание фракции тяжелых цепей миозинов (AAB20215.1), по сравнению с образцами из других групп. В тоже время в грудных мышцах птицы из группы 4 идентифицированы дополнительные изоформы легких цепей миозина (XP_015144626.1). Что касается изоферментного состава тропонинов в различных образцах, то в грудной мышце опытной группы 4 были обнаружены дополнительные изоформы тропонина С (NP_990781.1 и NP_990464.1, рис. 1г). В протеомах ножных мышц птицы из групп 3 и 4 идентифицированы фракции тропонинов I (NP_990748.1) и T (XP_015142062.1, NP_990253.1) (рис. 2 в, г).
В процессе созревания мяса происходят существенные биохимические изменения в мышцах, влияющие на конечные характеристики качества мяса. Хорошо известно, что под действием протеолитических ферментов в мышцах postmorthem происходят автолитические изменения, в результате чего образуются фрагменты миофибриллярных белков актина, миозина и тропонина, которые можно рассматривать как молекулярные маркеры нежной структуры мяса [31]. Во многих исследованиях показано, что увеличение в протеомах мышц интенсивности белковых пятен легких и тяжелых цепей миозина, актина ACTA1, тропонина T связано с нежностью мяса [32, 33].
Таким образом, в протеомах грудных и ножных мышц птицы, содержащейся на рационах с добавлением белковых кормовых добавок, отмечено наличие дополнительных фрагментов структурных белков, таких как актин, тропонин и миозин (тяжелые и легкие цепи), по сравнению с первой контрольной группой бройлеров.
Стоит также отметить, что в образце грудных мышц бройлеров из группы 2 помимо увеличения содержания тяжелых цепей миозина, идентифицирован дополнительный белок виментин (VIM, vimentin, NP_001041541.2), отсутствующий в других образцах. Белки виментин и десмин играют важную роль в поддержании цитоархитектуры мышц и считаются надежными маркерами регенеративных процессов, протекающих в мышцах. Недавно проведенные исследования показали увеличение экспрессии гена VIM, а также увеличение содержания кодируемого им белка виментина в грудной мышце (Pectoralis major) быстрорастущих бройлеров с различными миопатиями, приводящими к развитию таких пороков мяса как появление идущих параллельно мышечным волокнам белых полос (white stripes – WS) и синдром “деревянной груди” (wooden breast – WB) [34]. Таким образом, виментин может являться маркером аномального развития мышечных волокон Pectoralis major на ранних стадиях. Интересно, что в группах 2 и 4, получавших ферментированные белковые корма с более высоким содержанием аминокислот, низкомолекулярных пептидов и высокой переваримостью (табл. 2), виментин в грудных мышцах обнаружен не был. Известно, что мышечная дистрофия наблюдается при скармливании цыплятам рационов с недостаточным содержанием витамина Е, селена и серосодержащих аминокислот [34]. Включение же в рацион метионина, цистеина или увеличение содержания витамина Е способствует профилактике мышечной дистрофии у цыплят, причем комбинация антиоксидантов и омега-3 жирных кислот более действенна в борьбе с этим пороком мяса. Анализ антиоксидантной емкости кормовых добавок (табл. 2), используемых в данной работе, показал, что содержание антиоксидантов значительно выше в белковой добавке ФКД (1980 мкМоль ТЭ/г), по сравнению с ГКД (около 400 мкМоль ТЭ/г) и РМ (около 150 мкМоль ТЭ/г).
Вторую широко представленную группу в образцах протеомов мышц составляли ферменты (табл. 4). Основными растворимыми белковыми компонентами протеома являлись α- и β-енолазы, лактатдегидрогеназа А, фосфоглицератмутаза, фосфоглюкомутаза, креатинкиназа, а кроме того триозофосфатизомераза. В грудной мышце птиц гликолиз является одним из основных путей получения энергии для сокращения мышц и для удовлетворения энергетических потребностей при росте. Чтобы поддерживать мышечную массу, а также удовлетворять потребности сократительной мускулатуры птицы нуждаются в значительном количестве энергии. Поэтому не удивительно, что во фракции растворимых белков преобладали преимущественно ферменты гликолиза. Для всех образцов в этой категории так же существует “минимальный” консервативный набор белков, не изменяющих свою продукцию. Основные отличия между образцами были зафиксированы в протеоме ножных мышц птицы из группы 3, где обнаружены дополнительные изоформы α-енолазы (XP_015152319.2), глицеральдегид-3-фосфатдегидрогеназы (AZN23181.1), малатдегидрогеназы (NP_001006395.1) и креатинкиназы (NP_990838.1) (рис. 2в). Интересно отметить, что именно в этой опытной группе бройлеров отмечался наиболее интенсивный прирост мышечной массы, по сравнению с другими группами.
В ножных мышцах птицы из группы 3 обнаружен повышенный уровень белка креатинкиназы M-типа (NP_990838.1), одного из четырех форм CK (рис. 2в). Известно, что CK является потенциальным биомаркером ВУС мяса [8], действительно значение ВУС ножных мышц птицы из группы 3 самое высокое (табл. 3). Ранее было показано [35], что продукция креатинкиназы М-типа и сывороточного альбумина была ниже в образцах с низкой ВУС [8].
Кроме того, в образцах мышечных тканей всех групп птиц были идентифицированы такие белки как фосфатидилэтаноламин-связывающий белок 1, карбоангидраза II и сывороточный альбумин (кроме группы 4) (табл. 4).
Известно, что обнаруженный фермент карбоангидраза II катализирует обратимую реакцию гидратации диоксида углерода и дегидратации угольной кислоты, участвует в поддержании рН-баланса в мышечных тканях. Фосфатидилэтаноламин-связывающий белок 1, который вместе с виментином является протеомным маркером ревматических заболеваний хрящевой ткани [36] и гомолог которого у людей способен взаимодействовать с Map-киназами [37].
Для образца № 3 (рацион ФКД) показано присутствие аполипопротеина А1 (ApoA-I) в тканях ножных мышц бройлеров (табл. 4, рис. 2). ApoA-I участвует в метаболизме липидов, и, являясь основным компонентом липопротеинов высокой плотности (ЛПВП), играет важную роль в регуляции содержания холестерина в периферических тканях посредством его обратного транспорта в печень. Дефицит ApoA-I связан с избыточным накоплением внутриклеточного холестерина у людей и птицы. Показано, что уровень экспрессии ApoA-I снижается при геморрагическом синдроме жирной печени у кур [38], также показано снижение уровня экспрессии ApoA-I в тканях бройлеров с высоким содержанием абдоминального жира [39]. Действительно, наличие фракции ApoA-I в тканях ножных мышц бройлеров из группы 3 коррелировало с самым низким содержанием жира в мышечных тканях femoralis muscle среди всех групп – 5.9 ± 0.9% (табл. 3).
В литературе предпринимались попытки ассоциировать экспрессию (и активность) митохондриальных белков с эффективностью рационов кормления (ЭРК) птиц [40]. Было показано, что активность комплексов I и II электрон-транспортной цепи выше в митохондриях образцов белого и красного мяса, полученных при высокой ЭРК. Экспрессию митохондриальных белков при низкой ЭРК связывают с низкой способностью передачи электронов в электрон-транспортной цепи при окислительном фосфорилировании.
Появление в образцах группы 3 дополнительных изоформ различных комплексов электрон-транспортной цепи свидетельствует об изменениях, происходящих в метаболизме.
Стоит отметить отсутствие различий в продукции шаперонового комплекса в протеоме птиц различных групп: для фракции белков HSP70 и HSP71 не было выявлено изменений в составе изоформ. Предполагается, что данные белки участвуют в регуляции процессов сборки и поддержания структуры мышечной ткани, в защите структурных белков, в том числе десмина, актина и титина при стрессе [41], а также в регуляции гликолиза [42]. При этом снижение их продукции ассоциируют с развитием PSE-синдрома, характерными признаками которого являются экссудативное бледное, мягкое, водянистое мясо с мягкой рыхлой консистенцией и выделением мясного сока вследствие пониженной ВУС [42, 43].
Антиоксидантная емкость грудной и мышечной ткани птицы. Из литературы известно, что АОЕ мышечной ткани влияет на качество мяса. Исследования показали, что окисление мышечных белков, вызванное окислительным стрессом, приводит к потере незаменимых аминокислот (например, триптофана) и влияет на ВУС белков мяса, цвет и текстуру получаемых мясных продуктов, а также на усвояемость мяса и приводит к снижению его пищевой ценности [44, 45]. Окисление миофибриллярных белков свиней также снижает их способность к гелеобразованию, что важно для текстурных и структурных характеристик мясных продуктов [46]. Как видно из представленных в табл. 5 результатов, самые высокие значения АОЕ мышечной ткани грудных и ножных мышц были получены для бройлеров из группы 3, получавших дополнительно к основному рациону ФКД.
Таблица 5.
Антиоксидантная емкость (АОЕ) тканей грудных (pectoralis) и ножных (femoralis) мышц бройлеров кросса “Смена 9”, выращенных на различных рационах кормления
| Группа, № | АОЕ, мкМоль ТЕ/г ткани | |
|---|---|---|
| грудная мышца | ножная мышца | |
| 1 | 27.39 ± 1.9 | 24.85 ± 1.7 |
| 2 | 31.11 ± 1.6 | 23.18 ± 1.5 |
| 3 | 36.97 ± 2.0 | 31.29 ± 1.3 |
| 4 | 31.41 ± 1.8 | 25.53 ± 1.6 |
Таким образом, при введение в рацион кормления цыплят бройлеров кросса “Смена 9” ферментированной белковой кормовой добавки, в протеомах грудных и ножных мышц птицы отмечены фрагменты белков, являющихся биомаркерами нежности (актин, тропонин, тяжелые и легкие цепи миозина) и ВУС мяса (креатин киназа М типа), а также появление дополнительных изоформ различных комплексов электрон-транспортной цепи (комплекс цитохромов bc1, или комплекс III дыхательной цепи переноса электронов), характеризующих эффективность данного рациона кормления. Введение в рацион кормления птицы ФКД приводило также к увеличению антиоксидантной емкости тканей грудных и ножных мышц бройлеров, и снижению содержания жира в тканях ножных мышц, что коррелировало с наличием в протеомах данных тканей аполипопротеина А1 (ApoA-I).
Исследование выполнено при финансовой поддержке РНФ (проект № 17-16-01028).
Список литературы
Еремеев Н.Л., Николаев И.В., Керученько И.Д., Степанова Е.В., Сатрутдинов А.Д., Зиновьев С.В. и др. // Прикл. биохимия и микробиология. 2009. Т. 45. № 6. С. 717–724. https://doi.org/10.1134/S0555109909060130
Mamelona J., Saint-Louis R., Pelletier E., Mamelona J. // Int. J. Food Sci. Technol. 2010. V. 45. P. 147–154. https://doi.org/10.1111/j.1365-2621.2009.02114.x
Khiari Z., Ndagijimana M., Betti M. // Poult. Sci. 2014. V. 93. P. 2347–2362. https://doi.org/10.3382/ps.2014-03953
Фисинин В.И., Исмаилова Д.Ю., Волик В.Г., Лукашенко В.С., Салеева И.П. // Сельскохозяйственная биология. 2017. Т. 52. № 6. С. 1105–1115. https://doi.org/10.15389/agrobiology.2017.6.1105rus
Фисинин В.И., Лукашенко В.С., Салеева И.П., Овсейчик Е.А., Журавчук Е.В., Волик В.Г., Исмаилова Д.Ю. // Птицеводство. 2018. Т. 11. № 12. С. 20–22.
Силкина В.А. // Генетика и разведение животных. 2015. № 1. С. 26–29.
Piras C., Roncada P., Rodrigues P.M., Bonizzi L., Soggiu A. // Proteomics. 2016. V. 16. P. 799–815. https://doi.org/10.1002/pmic.v16.5
Vlachos A., Arvanitoyannis I.S., Tserkezou P. // Crit. Rev. Food Sci. Nutr. 2013. V. 56. P. 1061–1096. https://doi.org/10.1080/ 10408398.2012.691573
Wu W., Fu Y., Therkildsen M., Li X.M., Dai R.T. // Food Rev. Int. 2015. V. 31. P. 13–28. https://doi.org/10.1080/ 87559129.2014.961073
Paredi G., Raboni S., Bendixen E., de Almeida A.M., Mozzarelli A. // J. Proteomics. 2012. V. 75. № 14. P. 4275–4289. https://doi.org/10.1016/j.jprot.2012.04.011
Corzo A., Kidd M.T., Dozier W.A., Shack L.A., Burgess S.C. // The British Journal of Nutrition. 2006. V. 95. № 4. P. 703–708. https://doi.org/10.1079/bjn20051716
Molette C., Remignon H., Babile R. // Poultry Science. 2005. V. 84. № 1. P. 119–127. https://doi.org/10.1093/ps/84.1.119
Mekchay S., Teltathum T., Nakasathien S., Pongpaichan P. // The J. Poultry Science. 2010. V. 47. № 1. P. 8–12.
Surowiec I., Koistinen K.M., Fraser P.D., Bramley P.M. // Meat Science. 2011. V. 89. № 2. P. 233–237.
Zapata I., Reddish J.M., Miller M.A., Lilburn M.S., Wick M. // Poultry Science. 2012. V. 91. № 7. P. 1654–1659. https://doi.org/10.3382/ps.2011-02029
Phongpa-Ngan P., Grider A., Mulligan J.H., Aggrey S.E., Wicker, L. // Journal of Agricultural and Food Chemistry. 2011. V. 59. № 24. P. 13181–13187.
Laville E., Sayd T., Terlouw C., Blinet S., Pinguet J., Fillaut M., Glannison J., Chérel P. // J. Agric. Food Chem. 2009. V. 57. № 11. P. 4913–4923. https://doi.org/10.1021/jf900286x
Marcos B., Mullen A.M. // Meat Science. 2014. V. 97. № 1. P. 11–20. https://doi.org/10.1016/j.meatsci.2013.12.008
Sayd T., Morzel M., Chambon C., Franck M., Figwer P., Larzul C. et al. //J. Agric Food Chem. 2006. V. 54. P. 2732–2737. https://doi.org/10.1021/jf052569v
Bouley J., Meunier B., Chambon C., De S.S., Hocquette J.F., Picard B. // Proteomics. 2005. V. 5. P. 490–500. https://doi.org/10.1002/()1615-9861
Hamelin M., Sayd T., Chambon C., Bouix J., Laville E., Milenkovic D. et al. // J. Anim. Sci. 2007. V. 84. P. 3266–3276. https://doi.org/10.2527/jas.2006-162
Волик В.Г., Исмаилова Д.Ю., Зиновьев С.В., Ерохина О.Н. // Птица и птицепродукты. 2017. № 2. С. 40–42.
Волик В.Г., Исмаилова Д.Ю., Лукашенко В.С., Салеева И.П., Фёдорова Т.В., Овсейчик Е.А., Журавчук Е.В., Зиновьев С.В. // Ученые записки Казанского университета, серия естественные науки. 2019. Т. 161. № 3. С. 422–439. https://doi.org/10.26907/2542-064X.2019.3.422-439
Лукашенко В.С., Лысенко М.А., Столяр Т.А. Методика проведения анатомической разделки тушек, органолептической оценки качества мяса и яиц сельскохозяйственной птицы и морфологии яиц. / Ред. В.С. Лукашенко. Сергиев Посад: ВНИТИП, 2013. 36 с.
Журавская Н.К., Алехина Л.Т. Отряшенкова Л.М. Исследование и контроль качества мяса и мясопродуктов. / Агропромиздат. Москва. 1985. 295 с.
Vasina D.V., Pavlov A.R., Koroleva O.V. // BMC Microbiology. 2016. V. 16. Article 106 (2016). https://doi.org/10.1186/s12866-016-0729-0
Nikolaev I.V., Sforza S., Lambertini F., Ismailova D.Yu., Khotchenkov V.P., Volik V.G. et al. // Food Chemistry. 2016. V. 197. Part A. P. 611–621.
Picard B., Lebret B., Cassar-Malek I., Liaubet L., Berri C., Le Bihan-Duval E., Renand G. // Meat Science. 2015. V. 109. P. 18–26. https://doi.org/10.1016/j.meatsci.2015.05.003
Huang H., Lametsch R. in Proteomics in Foods: Principles and Applications. / Ed. F. Toldrá, L.M.L. Nollet New York, Heidelberg, Dordrecht, London: Springer, 2013. P. 103–109.
D’Alessandro A., Marrocco C., Rinalducci S., Mirasole C., Failla S., Zolla L. // J. Proteom. 2012. V. 75. № 14. P. 4381–4398.
Luccia A. D., Picariello G., Cacace G., Scaloni A., Faccia M., Liuzzi V., Alviti G., Musso S. S. // Meat Science. 2005. V. 69. P. 479–491. https://doi.org/10.1016/j.meatsci.2004.10.004
Beldarrain L.R., Aldai N., Picard B., Sentandreu E., Navarro J.L., Sentandreu M.A. // J. Proteomics. 2018. V. 183. P. 25–33. https://doi.org/10.1016/j.jprot.2018.05.005
Gagaoua M., Monteils V., Picard B. // J. Agric. Food Chem. 2018. V. 66. № 51. P. 13552–13563. https://doi.org/10.1021/acs.jafc.8b05744
Soglia F., Mazzoni M., Zappaterra M., Di Nunzio M., Babini E., Bordini M. et al. // Front. Physiol. 2020. https://doi.org/10.3389/fphys.2019.01581
Bottje W., Iqbal M., Tang Z.X., Cawthon D., Okimoto R., Wing T., Cooper M. // Poult. Sci. 2002. V. 81. № 4. P. 546–555.
Yeung K., Janosch P., McFerran B., Rose D.W., Mischak H., Sedivy J.M., Kolch W. // Mol. Cell. Biol. 2000. V. 20. № 9. P. 3079–3085. https://doi.org/10.1128/mcb.20.9.3079-3085.2000
Ghosh J.G., Houck S.A., Clark J.I. // Int. J. Biochem. Cell. Biol. 2007. V. 39. № 10. P. 1804–1815.
Song Y., Ruan J., Luo J., Wang T., Yang F., Cao H., Huang J., Hu G. // Poult. Sci. 2017. V. 96. № 10. P. 3559–3563. https://doi.org/10.3382/ps/pex163
Wang D., Wang N., Li N., Li H. // Poult. Sci. 2009. V. 88. № 11. P. 2285–2292. https://doi.org/10.3382/ps.2009-00190
Iqbal M., Pumford N.R., Tang Z.X., Lassiter K., Wing T., Cooper M. // Poult. Sci. 2004. V. 83. № 3. P. 474–484. https://doi.org/10.1093/ps/83.3.474
Laville E., Sayd T., Santé-Lhoutellier V., Morzel M., Labas R., Franck M., Chambon C., Monin G. // Meat Sci. 2005. V. 70. P. 167–172.
Xing T., Wang P., Zhao L., Liu R., Zhao X., Xu X., Zhou G. // Poultry Science. 2016. V. 95. № 10. P. 2391–2396. https://doi.org/10.3382/ps/pew181
Xing T., Zhao X., Zhou G., Xu X. // J. Agric. Food Chem. 2017. V. 65. № 13. P. 2913–2922. https://doi.org/10.1021/acs.jafc.6b05835
Lund M.N., Heinonen M., Baron C.P., Estévez M. // Mol. Nutr. Food Res. 2011. V. 55. P. 83–95.
Zhou F., Zhao M., Zhao H., Sun W., Cui C. // Meat Sci. 2014. V. 96. № 4. P. 1432–1439.
Carvalho M.E., Gasparin G., Poleti M.D., Rosa A.F., Balieiro J.C., Labate C.A., Coutinho L.L. // Meat Science. 2014. V. 96. № 3. P. 1318–1324.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


