Прикладная биохимия и микробиология, 2022, T. 58, № 4, стр. 360-365
Малые РНК Mcr11 и DrrS Mycobacterium tuberculosis как возможные регуляторы метаболизма глицерина
А. А. Острик 1, *, А. С. Григоров 2, И. В. Бочарова 3, А. С. Капрельянц 1, Т. Л. Ажикина 2, Е. Г. Салина 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
117997 Москва, Россия
3 Центральный научно-исследовательский институт туберкулеза
107564 Москва, Россия
* E-mail: albina.ostrik@gmail.com
Поступила в редакцию 31.01.2022
После доработки 10.02.2022
Принята к публикации 28.02.2022
- EDN: IPEUKK
- DOI: 10.31857/S0555109922040134
Аннотация
Изучали роль малых некодирующих РНК Mcr11 и DrrS и их возможную синергию в метаболизме Mycobacterium tuberculosis. При выращивании на стандартных средах заметных различий в динамике роста как штаммов с однократной делецией малых РНК ΔMcr11 и ΔDrrS, так и штамма с двойной делецией ΔΔMcr11_DrrS по сравнению со штаммом M. tuberculosis дикого типа выявлено не было. Однако, после пассирования in vivo этих штаммов в мышах линии B6, мутантные штаммы характеризовались угнетением роста in vitro на среде Сотона с высоким содержанием глицерина (6% об.), более выраженным у штамма с двойной делецией. Как известно, торможение роста в присутствии высоких концентраций глицерина у клеток M. tuberculosis вызывала делеция генов Rv3679-3680, которое было обусловлено накоплением токсичного метаболита метилглиоксаля. Согласно биоинформатическим расчетам, мРНК гена Rv3679 содержит два потенциальных участка связывания с малой РНК DrrS в 5'-нетранслируемой области, и, следовательно, является ее потенциальной мишенью. При этом Rv3679 не содержит потенциальных участков связывания с малой РНК Mcr11, однако ее делеция также ухудшает рост клеток M. tuberculosis на средах с высоким содержанием глицерина, что указывает на общность регуляторного действия малых РНК DrrS и Mcr11 с возникновением синергического эффекта в развитии “глицериновой токсичности” у штамма ΔΔMcr11_DrrS. Таким образом, малые РНК Mcr11 и DrrS принимают участие в регуляции метаболизма глицерина M. tuberculosis.
Малые некодирующие РНК, осуществляющие посттранскрипционную регуляцию экспрессии генов в клетках бактерий, действуют как преобразователи сигналов окружающей среды и контролируют транскрипцию, трансляцию и стабильность целевых мРНК в ответ на изменение внешних условий [1–4]. Особенно интересна роль малых некодирующих РНК у патогенных бактерий, поскольку существует ряд указаний на их участие во взаимодействии с иммунной системой организма-хозяина и сохранении жизнеспособности бактерий в условиях стрессового воздействия [1, 5].
Одной из наиболее распространенных в мире инфекций человека является туберкулез, уносящий ежегодно свыше 8 миллионов человеческих жизней [6]. В настоящее время у M. tuberculosis с помощью биоинформатических подходов выявлено несколько сотен потенциальных малых регуляторных РНК, при этом присутствие некоторых из них подтверждено экспериментально [4, 5, 7–9]. Механизм регуляторного действия, однако, установлен лишь для крайне небольшого числа [4, 10].
Особое внимание исследователей привлекают малые некодирующие РНК M. tuberculosis, индуцируемые во время инфекции, поскольку изучение их функции может существенно углубить понимание механизмов патогенеза туберкулезной инфекции. Ранее было обнаружено, что малые некодирующие РНК Mcr11 и DrrS интенсивно экспрессируются в моделях хронической инфекции мышей, и сравнимы с уровнем транскрипции 16S рРНК [11, 12], что позволяет предположить, что они участвуют в ответе на стрессовое воздействие, которое микобактерии испытывают после фагоцитоза в организме хозяина. Малые РНК Mcr11 и DrrS присутствуют только у патогенных видов микобактерий туберкулезного комплекса, пособных вызывать туберкулез у человека и животных. Они имеют стабильную вторичную структуру и высоко консервативны [7]. Впервые они были обнаружены в результате полнотраскриптомного анализа M. tuberculosis методом RNA-seq и подтверждены Нозерн-блоттингом [11]. Позднее нами было показано, что гиперэкспрессия этих малых РНК в клетках M. tuberculosis приводит к замедлению роста патогена в стандартных условиях in vitro [13].
Экспрессия малой РНК Mcr11 зависит от фазы роста микобактерий, а также от условий выращивания. Показано, что уровень экспрессии повышается при недостатке питательных веществ и снижается при выращивании в среде с кислым рН [14], что указывает на ее возможную роль в процессах адаптации к стрессовым условиям. Mcr11 функционально связана со смежными генами – Rv1264 и Rv1265. Rv1265 кодирует ДНК-, АТФ-связывающий белок, увеличивающий экспрессию Mcr11 в стационарной фазе роста [15]. Предполагаемыми мишенями Mcr11 являются мРНК генов Rv3282, fadA3, и lipB, вовлеченных в метаболизм липидов [16]. При выращивании M. tuberculosis и M. bovis в среде без источников жирных кислот штаммы с делецией малой РНК Mcr11 показывали отставание в росте.
Малая РНК DrrS является очень стабильным транскриптом, время полужизни которого составляет 6 ч, ее экспрессия функционально связана с регулоном DosR, активирующемся при стрессовом воздействии оксида азота, кислородных радикалов и при гипоксии [17]. Недавно удалось показать, что гиперэкспрессия DrrS в клетках M. tuberculosis приводила к повышению устойчивости бактерий к стрессовым воздействиям [18]. В логарифмической фазе роста такие бактерии сохраняли более высокую метаболическую активность в условиях повышенного окислительного стресса, голодания, продукции оксида азота или при понижении pH среды. Гиперэкспрессия DrrS повышала выживаемость микобактерий при фагоцитировании их макрофагами в экспериментах по инфицированию клеточной линии THP-1, тогда как гиперэкспрессия Mcr11 несущественно сказывалась на выживаемости M. tuberculosis в этих условиях [18]. Кроме того, показано, что в макрофагах, активированных γ-интерфероном, экспрессия DrrS повышается [19], что указывает на ее роль в патогенезе M. tuberculosis.
Полученные данные указывают на вероятную роль малых РНК Mcr11 и DrrS в адаптации M. tuberculosis к персистенции внутри макроорганизма и их участии во взаимодействии “патоген-хозяин”.
Цель работы – изучение роли малых некодирующих РНК Mcr11 и DrrS и их возможной синергии в метаболизме M. tuberculosis.
МЕТОДИКА
Культивирование бактерий. Бактерии M. tuberculosis штамм H37Rv (“ЦНИИ Туберкулеза”, Россия) выращивали в жидкой среде Сотона (г/л дистиллированной воды): L-аспарагин – 4.0, KH2PO4 – 0.5, MgSO4 – 1.4, железо лимоннокислое аммиачное – 0.05, натрий лимоннокислый трехзамещенный – 2.0, ZnSO4 – 0.1, глицерин – 60 мл, pH 7.2; а также в жидкой среде Сотон_R со сниженной концентрацией глицерина (г/л дистиллированной воды): L-аспарагин – 2.0, KH2PO4 – 0.25, MgSO4 – 0.7, железо лимоннокислое аммиачное – 0.025, натрий лимоннокислый трехзамещенный – 1.0, ZnSO4 – 0.05, глицерин – 6 мл, pH 7.2. Для выращивания также использовали жидкую среду Миддлбрука (7Н9, “HiMedia”, Индия) в присутствии ростовой добавки альбумин-декстроза-каталаза (АДК, “HiMedia”, Индия), 0.05% твин-80 при 37°С и перемешивании (200 об./мин). Культивирование на плотных средах проводили в статическом режиме без добавления твин-80.
Пассирование мутантных штаммов in vivo. Мутантные штаммы М.tuberculosis с делецией генов малой РНК MTS0997 и MTS1338 были получены по методике, описанной в статье [20].
Делеция генов была подтверждена полногеномным секвенированием. Данные о мутантных штаммах содержатся в базе данных NCBI (идентификатор проекта: PRJNA701202). Для восстановления вирулентности мутантных штаммов с делецией малой РНК DrrS (ΔDrrS), малой РНК Mcr11 (ΔMcr11) штамма с двойной делецией малых РНК Mcr11 и DrrS (ΔΔMcr11_DrrS), полученных in vitro, и штамма дикого типа (wt) клетки выращивали в стандартных условиях культивирования на среде Сотона с добавлением АДК и 0.05% твина-80 до ОП = 1, отмывали от среды и ресуспендировали в физиологическом растворе. Полученную суспензию использовали для заражения мышей линии C57BL/6Ycit (B6), резистентных к туберкулезу, с целью восстановления вирулентных свойств бактерий M. tuberculosis (доза 105 бактерий/мышь, внутривенный способ инфицирования).
Мыши содержались в обычных условиях в виварии Центрального научно-исследовательского института туберкулеза (Россия) в соответствии с рекомендациями Минздрава России № 755. Для эксперимента использовали самок мышей в возрасте 2.5–3.0 мес. Экспериментальные процедуры были одобрены Комитетом по биоэтике Центрального научно-исследовательского института туберкулеза. Через 21 сут после инфицирования мышей выводили из эксперимента, готовили гомогенаты селезенок и высевали их на плотные питательные среды Сотона и Миддлбрука в присутствии АДК.
Статистическая обработка данных. Статистическую обработку данных проводили с помощью t-теста Стьюдента. За статистически достоверные принимались значения с p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
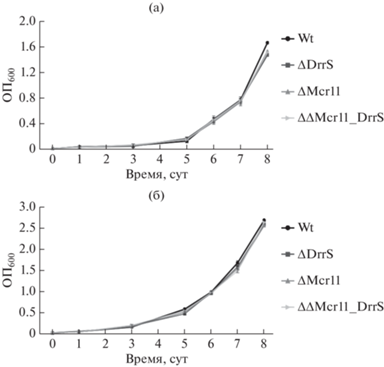
При культивировании бактерий в жидкой среде Сотона с добавлением ростовой добавки АДК и твин-80 in vitro было обнаружено, что кривая роста штамма ΔΔMcr11_DrrS была аналогична кривым роста штаммов с однократной делецией малых РНК ΔMcr11 и ΔDrrS, и кривой роста штамма дикого типа H37Rv, взятого в качестве контроля (рис. 1). Также не наблюдалось различий в динамике роста указанных штаммов в жидкой среде Миддлбрука с добавлением ростовой добавки АДК и твин-80. Таким образом, при росте на стандартных средах заметных различий в динамике роста как штаммов с однократной делецией малых РНК ΔMcr11 и ΔDrrS, так и штамма с двойной делецией ΔΔMcr11_DrrS по сравнению со штаммом M. tuberculosis дикого типа выявлено не было.
Рис. 1.
Динамика роста штаммов wt, ΔMcr11, ΔDrrS и ΔΔMcr11_DrrS M. tuberculosis на средах Сотона (а) и Миддлбрука (б).
При высеве гомогенатов селезенок зараженных мышей линии B6, резистентных к туберкулезу, на плотную питательную среду Сотона с ростовой добавкой АДК и параллельно на среду Миддлбрука с ростовой добавкой АДК, было обнаружено, что, несмотря на идентичный характер роста на среде Миддлбрук + АДК, характер роста штаммов на среде Сотон + АДК был неодинаковым. На плотной среде Сотона у штаммов ΔΔMcr11_DrrS, ΔMcr11 и ΔDrrS наблюдали торможение роста, более выраженное у штамма с двойной делецией, у которого рост почти полностью отсутствовал (рис. 2). Колонии, полученные после высева гомогенатов селезенок инфицированных мышей линии B6, были пересеяны на жидкую среду для дальнейшей дифференциации. Оказалось, что штаммы с делецией малой РНК ΔMcr11 и малой РНК ΔDrrS, а также двух малых РНК ΔΔMcr11_DrrS после пассирования in vivo были не способны расти на стандартной среде Сотон + АДК с твином (рис. 3а), и при этом хорошо росли на среде Миддлбрук + АДК с твином (рис. 3б). Для штамма дикого типа заметной разницы в росте на этих двух средах не наблюдалось.
Рис. 2.
Рост штаммов M. tuberculosis после высева из гомогенатов селезенок инфицированных мышей линии B6 на плотной среде Сотона (1) и Миддлбрука (2); а – дикий тип, б – ΔMcr11, в – ΔDrrS, г – ΔΔMcr11_DrrS.
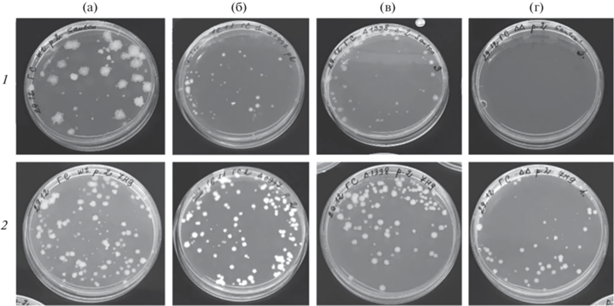
Рис. 3.
Культивирование штаммов M. tuberculosis с восстановленной вирулентностью на жидкой среде Сотона (а) и на среде Миддлбрука (б) в присутствии ростовой добавки АДК и 0.05% твина-80 в течение 7 дней культивирования: 1 – дикий тип, 2 – ΔDrrS, 3 – ΔΔMcr11_DrrS.

Основным отличием в составе сред является различная концентрация глицерина, которая в среде Сотона составляла 6 об. %, а в среде Миддлбрука – всего 0.5 об. %. В связи с этим, было выдвинуто предположение о токсичном воздействии глицерина на рост штаммов с делецией малых РНК ΔMcr11, ΔDrrS и ΔΔMcr11_DrrS. Действительно, при выращивании штаммов в среде Сотона со сниженной в 10 раз концентрацией глицерина (0.6%, среда Сотон_R) рост штамма ΔDrrS возобновлялся после незначительно увеличенного лаг-периода (рис. 4). При выращивании штаммов ΔΔMcr11_DrrS и особенно ΔMcr11 на среде Сотон_R наблюдали значительно увеличенный лаг-период (рис. 4). Однако позднее рост также возобновлялся.
Рис. 4.
Динамика роста штаммов wt, ΔMcr11, ΔDrrS и ΔΔMcr11_DrrS M. tuberculosis с восстановленной вирулентностью на различных средах с АДК и 0.05% твин-80: а – среда Сотона, б – среда Сотона со сниженной концентрацией глицерина (Сотон_R), в – среда Миддлбрука
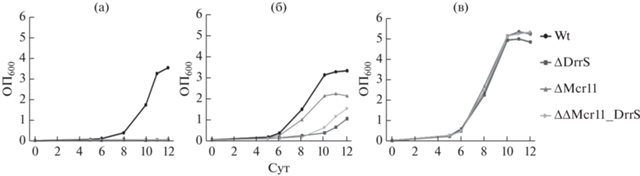
Анализ литературы показал, что подобное торможение роста M. tuberculosis на плотных питательных средах в присутствии высоких концентраций глицерина наблюдалось при делеции генов Rv3679-3680, кодирующих белковый комплекс с АТФ-азной функцией [21], и, что особенно интересно, оно тоже проявлялось только после пассирования мутантных клеток in vivo. Авторы исследования показали, что при понижении концентрации глицерина в среде рост мутантных штаммов восстанавливался, подобно тому, как это было в наших экспериментах с мутантными штаммами ΔMcr11, ΔDrrS и ΔΔMcr11_DrrS.
Малые РНК, как известно, часто осуществляют регуляторную функцию посредством связывания с мРНК гена-мишени, что ингибирует или активирует его трансляцию. Была поставлена задача поиска возможного связывания малых РНК Mcr11 и DrrS с мРНК генов Rv3679 и Rv3680. Согласно биоинформатическим расчетам, мРНК гена Rv3679 в 5'-нетранслируемой области действительно содержит 2 потенциальных участка связывания с малой РНК DrrS, но не с малой РНК Mcr11 (Григоров А.С, персональное сообщение на основании алгоритма CopraRNA https://rna.informatik.uni-freiburg.de), что позволило предположить, что Rv3679 может являться мишенью DrrS, а DrrS является регулятором глицеринового метаболизма M. tuberculosis. При этом мРНК гена Rv3679 не содержит потенциальных участков связывания с малой РНК Mcr11, однако ее делеция также ухудшает рост клеток M. tuberculosis на средах с высоким содержанием глицерина, при этом торможение роста на средах с высоким содержанием глицерина особенно ярко проявляется у штамма с двойной делецией ΔΔMcr11_DrrS (рис. 2б, 4). Полученный результат, по все вероятности, указывает на возникновение синергического эффекта в развитии “глицериновой токсичности” у штамма ΔΔMcr11_DrrS M. tuberculosis. Подобный синергитический эффект был ранее отмечен у другого внутриклеточного бактериального патогена Legionella pneumophila. Примечательно, что делеция двух малых РНК rsmY и rsmZ приводила к резкому снижению вирулентности клеток штамма ΔΔrsmYZ L. pneumophila и их способности к внутриклеточному росту в макрофагах, тогда как делеция малых РНК rsmY и rsmZ по-отдельности не оказывала заметного влияния на вирулентность патогена [22].
Полученные нами результаты открывают перспективы дальнейшего изучения двух малых некодирующих РНК Mcr11 и DrrS ex vivo и in vivo и их регуляторной роли в метаболизме глицерина M. tuberculosis и накоплении токсических метаболитов с целью поиска новых антибиотических веществ, использующих возможности клеточного суицида для уничтожения опасного патогена.
Заявление о работе в соответствии с международными Правилами работы с животными
Исследования на лабораторных мышах линии B6 проводили в строгом соответствии с этическими нормами обращения с животными, принятыми Европейской конвенцией по защите позвоночных животных, используемых для исследовательских и иных научных целей (European Treaty Series, № 123).
А.А. Острик и Е.Г. Салина благодарят РФФИ (проект № 20-34-90015) за финансовую поддержку работы.
Список литературы
Holmqvist E., Wagner E.G.H. // Biochem. Soc. Trans. 2017. V. 45. P. 1203–1212.
Papenfort K., Vogel J. // Cell Host Microbe. 2010. V. 8. P. 116–127.
Waters L.S., Storz G. // Cell 2009. V. 136. № 4. P. 615–628.
Schwenk S., Arnvig K.B. // Pathog. Dis. 2018. V. 76. № 4. P. 1–12.
Haning K., Cho S.H., Contreras L.M. // Front. Cell. Infect. Microbiol. 2014. V. 4. P. 1–11.
Global tuberculosis report 2020. Geneva: World Health Organization; 2020. Licence: CC BY-NC-SA 3.0 IGO https://www.who.int/tb/publications/global_report/en/
DiChiara J.M., Contreras-Martinez L.M., Livny J., Smith D., McDonough K.A., Belfort M. // Nucleic Acids Res. 2010. V. 38. № 12. P. 4067–4078.
Ignatov D.V., Malakho S., Majorov K.B., Skvortsov T., Apt A.S., Azhikina T.L. // PLoS ONE. 2013. V. 8. № 9. e74209.
Tsai C.-H., Baranowski C., Livny J., McDonough K.A., Wade J.T., Contreras L.M. // PLoS One. 2013. V. 8. № 11. e79411.
Острик А.А., Ажикина Т.Л., Салина Е.Г. // Успехи биологической химии 2021. Т. 61. С. 229–252.
Arnvig K.B., Comas I., Thomson N.R., Houghton J., Boshoff H.I., Croucher N.J., Rose G., Perkins T.T., Parkhill J., Dougan G., Young B.Y. // PLoS Pathog. 2011. V. 7. № 11. P. 1–16.
Игнатов Д.В., Логунова Н.Н., Ажикина Т.Л. // Биоорг. химия. 2014. Т. 40. С. 253–256.
Ignatov D.V., Salina E.G., Fursov M.V., Skvortsov T.A., Azhikina T.L., Kaprelyants A.S. // BMC Genomics. 2015. V. 16. № 1. P. 1–13.
Pelly S., Bishai W.R., Lamichhane G. // Gene. 2012. V. 500. № 1. P. 85–92.
Girardin R.C., Bai G., He J., Sui H., McDonough K.A. // Mol. Microbiol. 2018. V. 110. № 5. P. 811–830.
Girardin R.C., McDonough K.A. // Mol. Microbiol. 2020. V. 113. № 2. P. 504–520.
Moores A., Riesco A.B., Schwenk S., Arnvig K.B. // PLoS One. 2017. V. 12. № 3. P. 1–27.
Острик А.А., Салина Е.Г., Скворцова Ю.В., Григоров А.С., Быченко О.С., Капрельянц А.С., Ажикина Т.Л. // Прикл. биохимия и микробиология. 2020. Т. 56. № 4. С. 336–341.
Salina E.G., Grigorov A.S., Skvortsova Y.V., Majorov K.B., Bychenko O.S., Ostrik A.A., Logunova N.N., Ignatov D.V., Kaprelyants A.S., Apt A.S., Azhikina T.L. // Front. Cell. Infect. Microbiol. 2019. V. 9. P. 474304.
Parish T., Stoker N.G.J. // Bacteriol. 2000. V. 182. № 20. P. 5715–5720.
Whitaker M., Ruecker N., Hartman T., Klevorn T., Andres J., Kim J., Rhee K., Ehrt S. // Bacteriol. 2020. V. 16. P. e00202-20
Sahr T., Brüggemann H., Jules M., Lomma M., Albert-Weissenberger C., Cazalet C., Buchrieser C. // Mol. Microbiol. 2009. V. 72. № 3. P. 741–762.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


