Прикладная биохимия и микробиология, 2022, T. 58, № 4, стр. 374-381
Выделение, очистка и идентификация секретируемого соединения Pantoea brenneri AS3, обладающего фунгицидной активностью
Д. Л. Иткина 1, *, А. Д. Сулейманова 1, М. Р. Шарипова 1
1 Казанский (Приволжский) федеральный университет
420008 Казань, Россия
* E-mail: laia9301@mail.ru
Поступила в редакцию 12.10.2021
После доработки 15.12.2021
Принята к публикации 28.02.2022
- EDN: FTKFQL
- DOI: 10.31857/S0555109922040079
Аннотация
Штамм Pantoea brenneri AS3 стимулирует рост растений и активен против патогенов, выделяя в культуральную среду вторичные метаболиты, подавляющие рост грибов. Выделен и идентифицирован активный вторичный метаболит, продуцируемый штаммом P. brenneri AS3, биосурфактант – n(2-гидроксигексадецил) диэтаноламиновая кислота, ингибирующий рост фитопатогена Fusarium solani. В дальнейшем он может быть использован при разработке биоудобрений и биопестицидов.
Поражение сельскохозяйственных культур патогенными микромицетами может иметь катастрофические последствия для агропроизводства, несмотря на все профилактические меры, принятые для контроля их распространения. Широкое использование химических веществ для борьбы с болезнями растений нарушает баланс сообществ микроорганизмов в почве, что приводит не только к развитию устойчивых штаммов-патогенов, но и загрязнению грунтовых вод и очевидным рискам для здоровья людей [1]. Разработка альтернативы химическим пестицидам для борьбы с болезнями сельскохозяйственных культур – одна из актуальных проблем, с которыми сталкиваются микробиологи и фитопатологи [2].
Более 80% всех известных болезней растений вызваны грибами – самой распространенной группой возбудителей [3]. В настоящее время эффективным методом контроля этих болезней растений является широкое применение химических фунгицидов. Однако активное использование химикатов наносит значимый ущерб окружающей среде, что вынуждает искать новые подходы, позволяющие свести к минимуму их использование. Применение микроорганизмов, обладающих биоконтрольными свойствами считается одним из них [4].
Способность ризобактерий контролировать рост патогенной микрофлоры растений осуществляется, с одной стороны, за счет стимулирующего воздействия на рост растения и улучшения его жизненного статуса: увеличение поступления минеральных элементов, фосфора, азота, расщепление сложных белков и др., с другой – за счет выделения соединений, обладающих фунгицидными свойствами и способных подавлять развитие фитопатогенных бактерий и грибов в ризосфере [5]. Одной из стратегий преодоления ограничений в использовании бактериальных удобрений является использование автохтонных микроорганизмов, приспособленным к климатическим условиям каждого региона [6]. Таким образом, актуальным становится поиск эффективных адаптированных микроорганизмов, способных действовать как против патогенов растений, так и одновременно способствовать росту растений и повышать урожайность, при этом, не нарушая агроценоза и качества почвы.
Ранее из почв Республики Татарстан были выделены гидролизующие фитаты штаммы, идентифицированные молекулярно-генетическими методами как Pantoea brenneri [7]. В предыдущих исследованиях уже были показаны их PGP-свойства: установлена способность к секреции комплекса гидролитических ферментов (фитазы, протеазы, целлюлазы), деструкции цианидов (HCN), способность штаммов синтезировать фитогормоны и сидерофоры. Установлено, что штамм P. brenneri подавлял (>87%) рост микромицетов рода Fusarium [7, 8, 10].
Цель работы – очистка и идентификация секретируемого P. brenneri AS3 вещества, обладающего фунгицидной активностью по отношению к микромицетам рода Fusarium.
МЕТОДИКА
Объектом исследования служил выделенный из почвы Республики Татарстан (Россия) бактериальный штамм P. brenneri AS3, способный к синтезу фитазы на дифференциальной среде PSM. Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов под номером ВКМ В-12911 [11].
Выделение соединений P. brenneri AS3 с фунгицидной активностью. Штамм P. brenneri AS3 культивировали на среде NBRIP, следующего состава (г/л): глюкоза – 10.0; Са3(РО4)2 – 5.0; MgCl2 ∙ · 6H2O – 5.0; MgSO4 ∙ 7 H2O – 0.25; KCl – 2.0; (NH4)2SO4 – 0.1; aгар-агар – 20, pH 6.8–7.0. Культивирование проводили в течение 24 ч при 37°С на качалке при 200 об./мин до достижение плотности клеток 108 КОЕ/мл. Полученную культуральную жидкость фильтровали через фильтр с диаметром пор 0.22 мкм (“Millipore”, Германия). Фильтрат центрифугировали с использованием центрифужного концентратора Amicon Ultra-15ml Ultracel 3K (“Millipore”, Германия) при 3500 g (rcf). Полученную фракцию, содержащую низкомолекулярные вещества массой менее 3000 Да, концентрировали пропуская через картридж Discovery DSC С-18 SPE (“Superlco”, США) для твердофазной экстракции. Сконцентрированные органические вещества промывали от остатков солей 1.5 мл 0.1%-ного раствора трифторуксусной кислоты (ТФУ) и 1 мл воды. Затем органические вещества эллюировали 500 мкл 80%-ного раствора ацетонитрила (“Biosolve”, Франция). Растворитель упаривали в центрифужном испарителе Concentrator Plus (“Eppendorf”, Германия) при 45°С под вакуумом. Полученный сухой остаток разводили в 5%-ном растворе ацетонитрила.
Фракционирование методом ВЭЖХ (HPLC). Полученные образцы фракционировали на жидкостном хроматографе UltiMate 3000 (“Thermo Scientific”, США) на колонке Acclaim Polar Advantage II (“Dionex”, США), С18 5 мкм, 120А, 4.6 × × 250 мм.
Объем пробы, нанесенной на колонку – 50 мкл. Разделение проводили в условиях градиента: 2 мин 5%-ный ацетонитрил (АЦН), градиент 5–70% АЦН 10 мин, 70%-ный АЦН 4 мин, от 70–95% АЦН 5 мин, 95%-ный АЦН 5 мин со скоростью 1 мл/мин при температуре 25°С. Собранные фракции высушивали на центрифужном испарителе, а затем разводили в 20 мкл воды.
Повторная хроматорграфия на колонке Zorbax С-18. Для последующего выделения активной фракции с фунгицидной активностью проводили рехроматографию на колонке Zorbax С-18, 2.1 × × 150 мм, 5 мкм (“Agilent”, США). На колонку наносили 80 мкл пробы, вещества разделяли в условиях градиента: 2 мин 40%-ный АЦН, от 40–90% АЦН 10 мин, 90%-ный АЦН 5 мин, градиент от 90–40% АЦН 5 мин со скоростью 0.5 мл/мин при температуре 25°С. Собранные фракции высушивали на центрифужном испарителе, разводили в 20 мкл воды и проверяли на фунгицидную активность.
Определение фунгицидной активности штамма P. brenneri AS3 и полученных при разделении фракций метаболитов. Оценку фунгицидной активности фракций после хроматографии проводили на среде Чапека (г/л): сахароза – 30; NaNO3 – 3.0; KH2PO4 – 1.0; MgSO4 ∙ 7H2О – 0.5; KCl – 0.5; FeSO4 ∙ 7H2O – 0.01; aгар-агар – 20. Контролем служил посев гриба Fusarium solani без добавления ингибирующего метаболита. В центр чашки Петри на агаризованную среду высевали штамм микромицета, на одинаковом расстоянии от посева раскладывали диски фильтровальной бумаги, пропитанные каждой фракцией [9].
Идентификация веществ. Идентификацию активного вещества проводили на масс-спектрометре QTrap 6500 (“AB Sciex”, Канада). Фракцию разводили в 600 мкл воды и делили на 2 части. В одну часть добавляли 20 мкл 100 мМ раствора формиата аммония для получения спектра в режиме отрицательной ионизации; во вторую – добавляли муравьиную кислоту до конечной концентрации 0.1% для получения спектра в режиме положительной ионизации. Пробу вводили шприцом со скоростью 7 мкл/мин. Параметры сканирования, следующие: IS voltage – напряжение на источнике 5500 В, 250°С, режим сканирования MS Q1. Выбранные ионы далее отправлялись на фрагментацию в режиме MS Q2.
Программное обеспечение. Анализ масс-спектрометрических данных проводили с использованием программного обеспечения PeakView®2.1 (Sciex) и MasterView®1.1 (Sciex), которые осуществляют поиск по библиотечным базам данных, представленным на серверах http://www.massbank.jp; http://www.chemspider.com.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
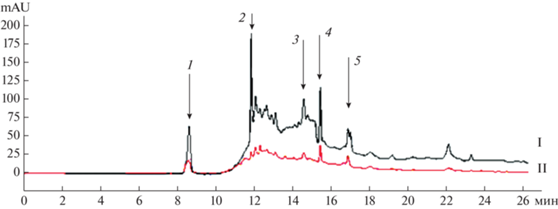
Эффективный метод разделения сложных смесей методом ВЭЖХ был использован для выделения, очистки и идентификации, секретируемых штаммом P. brenneri AS3 веществ, обладающих фунгицидными свойствами. На первом этапе проводили фракционирование высушенного фильтрата культуральной жидкости штамма. Были получены низкомолекулярные вещества с массой менее 3000 Да, которые подвергали разделению на колонке Acclaim Polar Advantage II по степени гидрофобности. Результаты хроматографического анализа представлены на рис. 1. Было отобрано 5 фракций объемом 10 мкл с наибольшей оптической плотностью при 220–260 нм, которые далее исследовали на фунгицидную активность.
Рис. 1.
Фракционирование культуральной жидкости P. brenneri AS3 методом ВЭЖХ на колонке Acclaim Polar Advantage II: I – 260 нм, II – 220 нм, 1–5 фракции с наибольшей ОП при 220–260 нм.
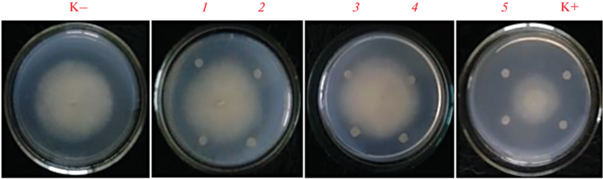
Ранее было установлено, что максимальная ингибирующая способность P. brennery AS3 проявлялась по отношению к микромицету F. solani, возбудителю корневой гнили и трахеомикозного увядания, предоставленному музеем кафедры микробиологии ИФМиБ К(П)ФУ. F. solani выделен из пораженных клубней картофеля в отделе сельскохозяйственной биотехнологии ГНУ Татарский НИИ сельского хозяйства Роcсельхозакадемии и идентифицирован нами ранее с помощью анализа последовательностей 5.8 S рРНК со стандартными праймерами ITS1 и ITS4. Рост микромицета ингибировался на 87% под действием бактериального штамма P. brennery AS3. [8]. Активность отобранных в процессе хроматографии фракций проверяли, используя тест-штамм F. solani как наиболее чувствительный к фунгицидному соединению, продуцируемому штаммом P. brenneri AS3. Определение фунгицидной активности штамма P. brenneri AS3 и фракций метаболитов после разделения проводили по методу, описанному в статье [9] (рис. 2). Максимальное фунгицидныое действие проявляла фракция № 5, активность которой соответствовала активности исходного не очищенного образца до разделения на хроматографе.
Рис. 2.
Подавление роста мицелия F. solani фракциями 1–5, полученными при после разделения методом ВЭЖХ: К1 – контроль, посев гриба без дисков с фракциями; 1–5 – фракции (см. рис. 1), нанесенные на диски, в двух повторностях; К2 – исходный образец до разделения.
Выше описаны стадии разделения исходной фракции, полученной после разделения на фильтре на 2 части культуральной жидкости P. brennery: с молекулярной массой ниже и выше 3000 Да. Анализ второй половины фильтрата с молекулярной массой выше 3000 Да показал отсутствие фунгицидной активности.
На следующем этапе проводили рехроматографию активной фракции № 5 на колонке Zorbax С-18 (рис. 3).
Рис. 3.
Разделение активной фракции № 5 на колонке Zorbax С-18: I – 260, II – 220, III – 330 нм (1–8 – активные фракции).
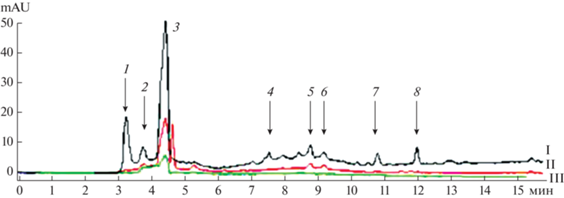
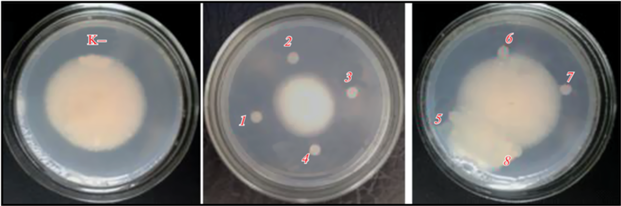
После разделения собрали 8 фракций, которые тестировали на присутствие метаболитов, ингибирующих рост фитопатогена F. solani с использованием дисков, пропитанных каждой из них (рис. 4). Фунгицидной активностью обладали фракции 1, 2, 3 и 4, которые были использованы для дальнейшего анализа и идентификации.
Рис. 4.
Определение фунгицидной активности фракций после рехроматографии методом ВЭЖХ на колонке Zorbax С-18: К – посев без нанесения фракций; 1–8 – диски с нанесенными активными фракциями.
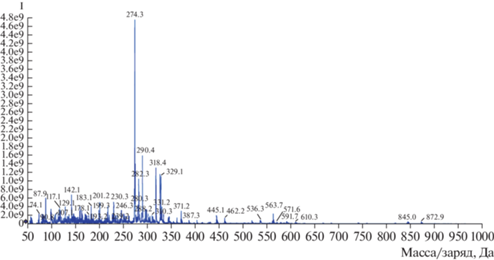
Идентификация фунгицидного соединения. Анализировали фракцию № 3, соответствующую максимальному пику на хроматограмме (рис. 3). Идентификацию активного вещества проводили с помощью масс-спектрометра QTrap 6500. Добавление муравьиной кислоты позволило положительно ионизировать пробу, что изменило характер спектра первичных ионов, появились интенсивные сигналы с m/z 274.3; 282.3; 290.4; 318.4; 563.7, которые далее фрагментировали в режиме MS Q2 с использованием ионной ловушки для идентификации химического соединения (рис. 5).
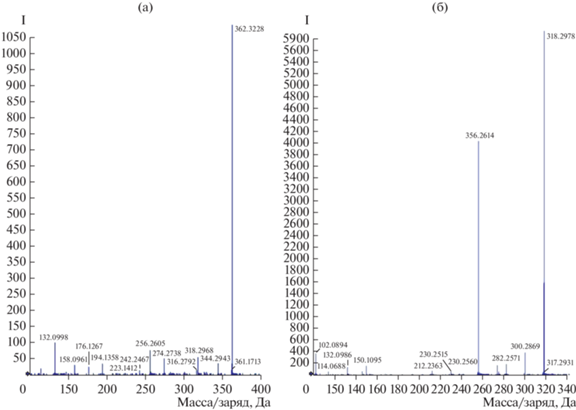
Установлено, что ион с m/z 318 принадлежал нестабильному соединению, которое распадалось при низких энергиях СЕ (Colission energy). Поскольку данное вещество было нестабильно, вещества в пробе, подкисленной муравьиной кислотой, идентифицировали на масс-спектрометре TripleTOF 5600. Был обнаружен интенсивный сигнал с m/z 362, при фрагментации которого образовывались ионы с m/z 318 и 274, а также с m/z 150. На рис. 6 представлены спектры фрагментации ионов c m/z 362, 318.
Выброс нейтральной частицы с массой 62 (разница m/z 318–256, 212–150, 256–194) характерен при фрагментации для метоксиметильных простых эфиров, этиленгликолей, этиленкеталей. Выброс нейтральной частицы с массой 26 (разница между дочерними ионами m/z 256–230) могут давать при фрагментации ароматические соединения (потеря С2Н2) или нитрилы (потеря СN). В случае родительского иона с m/z 362 наблюдали потерю нейтральной частицы с массой 44 (является разницей между родительским ионом и дочерним ионом m/z 318, а также между дочерними ионами 318–274, 176–132, 158–114), которая характерна для спектров фрагментации пропилалканов, диметиламинов, этиламинов, циклоалканов, циклических простых эфиров и этиленкеталей. Нейтральный фрагмент с массой 18 (является разницей между парами ионов с m/z 318–300, 362–344, 274–256, 230–212, 150–132, 132–114, 194–176) принадлежит воде.
По предполагаемым нейтральным осколкам соединение, продуцируемое P. brenneri AS3, содержит кислород в составе спиртовых или эфирных групп, но не в составе карбоксильных групп, поскольку нет характерных нейтральных выбросов 17 (18) и последующего выброса 28, свидетельствующих о декарбоксилировании [13].
Первичную обработку полученных в результате QTRAPMS/MS-анализа масс-спектрометрических данных проводили с использованием программного обеспечения PeakView®2.1 (Sciex). Программа позволяла вычислить точную массу и интерпретировать одновременно структуру вещества по массе, фрагментам и изотопному распределению [14]. Дальнейшую обработку результатов проводили с помощью подпрограммы MasterView®1.1 (Sciex), которая осуществляла поиск по библиотечным базам данных (Chem Spider) http://www.massbank.jp; http://www.chemspider.com.
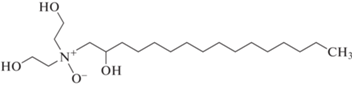
Установлено (табл. 1), что первое соединение (C19H44N3OP) не может быть искомым веществом, поскольку не встречается в природе. Наиболее вероятное соединение – C20H43NO4 (структура представлена на рис. 7). Для него выявлены нейтральные осколки, соответствующие спектру исследуемого вещества, а также потеря трех молекул воды при фрагментации, свидетельствующая о наличии трех гидроксильных групп. На MS-спектре фрагментов родительского иона c m/z 362; 318 есть характерные для аминосоединений m/z: 114.132. Данные из базы Massbank позволяют утверждать, что в образце присутствуют аминосоединения с карбоксильной группой, поскольку имеются фрагменты ионов с более тяжелыми массами.
Таблица 1.
Результаты анализа иона с m/z 362 с помощью программы Master View (C20H43NO4 предполагаемое соединение)
| Формула | Оценка сходства | m/z, Да | Ошибка, ppm | Количество совпадений |
|---|---|---|---|---|
| C19H44N3OP | 78.7 | 362.32948 | 2.1 | 0 |
| C20H43NO4 | 34.6 | 362.32649 | 6.1 | 13 |
| C16H40BN5O3 | 52.3 | 362.3297 | 3.6 | 0 |
| C21H42B2NP | 4.1 | 362.331198 | 9.5 | 0 |
| C21H39N5 | 58.6 | 362.32782 | 2.4 | 2 |
| C19H43N3O3 | 0 | 362.33772 | 24.9 | 1 |
| C15H39N9O | 0 | 362.33503 | 17.5 | 0 |
| C16H39N7O2 | 0 | 362.3238 | 13.5 | 0 |
Рис. 7.
Предполагаемое соединение, биосурфактант – n(2-гидроксигексадецил) диэтаноламиновая кислота.
Результаты поиска по базе данных позволили предположить, что исследуемое вещество по наличию функциональных групп (неполярный алкановый фрагмент и полярные гидроксильные группы, аминогруппа) является биосурфактантом, то есть может нарушать целостность клеточной мембраны [12].
Исходя из анализа фрагментов и нейтральных выбросов, исследуемое вещество содержало остаток гидроксимиристиновой кислоты, связанной с многоатомным спиртом или углеводным остатком через остаток азота, что соответсвует структуре, представленной на рис. 7.
Биосурфактанты – поверхностно-активные вещества бактериального происхождения с выраженными мультифункциональными свойствами. Они привлекают внимание как альтернатива химически синтезированным аналогам, ввиду их способности подвергаться деструкции, не вызывая загрязнение окружающей среды [15]. Биосурфактанты представляют собой химически гетерогенную группу, которая включает гликолипиды, липопептиды, фосфолипиды, жирные кислоты, нейтральные липиды, полимерные соединения [16]. Бактерии и другие микроорганизмы легко разлагают биосурфактанты, поэтому они не токсичны для окружающей среды [12]. Микробные сурфактанты могут изменять физико-химические свойства среды обитания и оказывать влияние на структуру развивающегося микробного сообщества, предотвращая бактериальные и грибковые заболевания, являясь фактором биоконтроля среды [17]. В настоящее время биосурфактанты рассматриваются в качестве средства для биологической борьбы с фитопатогенами [18]. Фунгицидная активность по отношению к фитопатогенным микромицетам была продемонстрирована у таких соединений, как гликолипиды, целлобиозные липиды [19], рамнолипиды [20] и циклических липопептидов [21] включая сурфактин, итурин и фенгицин [22].
Было показано, что бактерии рода Pantoea секретируют множество противомикробных соединений. Примером может служить вторичный метаболит, полученный из Pantoea ananatis 4G-9, обладающий противомикробной активностью в отношении Mycosphaerella musicola, представляющий собой по структуре производное индола [23]. Установлено, что бактерии рода Pantoea способны к синтезу бацилломицина и итурина, подавляющих возбудителей коричневой гнили плодов – Monilinia fructigena и M. laxa. [24]. При исследовании антимикробной активности P. aggolomerans против Penicillium citrinum выделены следующие соединения: аэругинальдегид и пуликатин С (C11H11NO2S) [25]. Новый гликолипидный биосурфактант P. ananatis BRT175 оказывал цитотоксично действие на амебы Dictyostelium discoideum, нарушая целостность клеток [26]. Штамм Pantoea sp. продемонстрировал способность к синтезу биосурфактантов, таких как гликолипид ананатозид А [27] и рамнолидов, обладающих выдающимся поверхностно-активными свойствами, а также полной биоразлагаемостью низкой токсичностью и хорошей стабильностью [28].
Полученные в работе результаты позволяют предположить, что P. brenneri AS3 может быть использован при получении препаратов биоудобрений и биопестицидов, поскольку обладал множественными биоконтрольными свойствами и синтезировал биосурфактант, ингибирующий рост фитопатогенного микромицета F. solani, вызывающего фузариозное увядание, сухую гниль клубней картофеля, плодов томатов, семян и зерновок хлебных злаков. [8].
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-38-90208.
Список литературы
Aktar W., Sengupta D., Chowdhury A. // Interdiscip. Toxicol. 2009. V. 2. P. 1–12. https://doi.org/10.2478/v10102-009-0001-7
Bozkurt T. //American Journal of Plant Biology. 2017. V. 2. № 3. P. 28–31. https://doi.org/10.11648/j.ajpb.s.2017020301.1
Титова Ю.А., Краснобаева И.Л. //АгроЭкоИнженерия. 2019. № 2. С. 164–183.
Etesami H., Beattie G.A. // Front. Microbiol. 2018. V. 9. P. 1–20. https://doi.org/10.3389/fmicb.2018.00148
Kosmidis C.D., Denning W. // Infectious Diseases (Fourth Edition). 2017. V. 2. P. 1681–1709.
Zahid M., Abbasi M.K., Hameed S.N. // Front. Microbiol. 2015. V. 6. P. 1–15.
Сулейманова А.Д., Иткина Д.Л., Пудова Д.С., Шарипова М.Р. // Микробиология. 2021. Т. 90. № 1. С. 100–109.
Иткина Д.Л., Сулейманова А.Д., Шарипова М.Р. // Микробиология. 2021. Т. 90. № 2. С. 204–214.
Grady E.N., MacDonald J., Ho M.T., Weselowski B., McDowell T., Solomon O., Renaud J., Yuan Z. // BMC Microbiology. 2019. V. 19. № 5. https://doi.org/10.1186/s12866-018-1380-8
Itkina D., Suleimanova A. // E3S Web of Conferences DAIC. 2020. V. 222. № 02055. https://doi.org/10.1051/e3sconf/202022202055
Suleimanova A.D., Beinhauer A., Valeeva L.R., Chastukhina I.B., Balaban N.P., Shakirov E.V., Greiner R., Sharipova M.R. // Appl. Environ. Microbiol. 2015. V. 81. № 19. P. 6790–6799.
Duong D.A., Stevens A.M. // Peer J. 2017. V.6. № 5. P. 41–45. https://doi.org/10.7717/peerj.4145
Преч Э., Бюльманн Ф., Аффольтер К. // Определение строения органических соединений. Таблицы спектральных данных. М.: Мир, 2006. 438 с.
Ильиных Е.С., Ким Д.Г. // Масс-спектрометрия в органической химии: учебное пособие. / Ред. Ильиных Е.С., Ким Д.Г., Челябинск: Издательский центр ЮУрГУ, 2016. 63 с.
Nawrath M.M., Ottenheim C., Chuan Wu J., Zimmermann W. // Microbiologyopen. 2020. V. 9. № 5. P. 1–14.
Tacconelli E. Magrini N., Kahlmeter G., Singh N. // J. Med. Soc. 2017. V. 32. № 1. P. 76–77.
Farrar K., Bryant D., Cope-Selby N. // Plant Biotechnol. J. 2014. V. 12. № 9. P. 1193–1206.
Chopra A., Bobate S., Rahi P., Banpurkar A., Mazumder P.B., Satpute S. // Front. Bioeng. Biotechnol. 2020. V. 8. № 861. P. 1–14.
Sato S., Fukuoka T., Saika A., Koshiyama T., Morita T. // J. Oleo Sci. 2019. V. 68. № 12. P. 1287–1294.
Yan F, Hu H, Lu L, Zheng X. // Pest Manag. Sci. 2016. V. 72. № 8. P. 1500–1507. https://doi.org/10.1002/ps.4177
Favaro G., Bogialli S., Gangi I.M. Di, Nigris S., Baldan E., Squartini A., Pastore P., Baldan B. // Rapid Commun Mass Spectrom. 2016. V. 30. № 20. P. 2237–2252.
Zhang F., Huo K., Song X., Quan Y., Wang S., Zhang Z., Gao W., Yang C. // Microb. Cell Fact. 2020. V. 19. № 1. P. 223–242. https://doi.org/10.1186/s12934-020-01485-z
Aman M., Rai R. // Biocont. Sci. Technol. 2015. V. 26. № 4. P. 1–35. https://doi.org/10.1080/09583157.2015.1126223
Lahlali R., Aksissou W., Lyousfi N., Ezrari S., Blenzar A., Tahiri A., Amiri S. // Microbial Pathogenesis. 2019. V. 139. https://doi.org/10.1016/j.micpath.2019.103914
Thissera B., Alhadrami H.A., Hassan M.H.A., Hassan H.M., Behery F.A., Bawazeer M., Yaseen I.M., Belbahri L., Rateb M.E. // Biomolecules. 2020. V. 10. № 2. P. 268. https://doi.org/10.3390/biom10020268
Smith D.D.N., Nickzad A., Deziel E., Stavrinides J. // ASM Journals, mSphere. 2016. V. 1. № 1. https://doi.org/10.1128/mSphere.00075-15
Almeida F.C.G., Lins C.I.M., Vieira A.M., Vilar C.J., Mota Lins C., Campos-Takaki G.M., Tambourgi E.B. // Microbes in App. Res. 2012. P. 348–352. https://doi.org/10.1142/9789814405041_0070
Tan Y.N., Li Q. // Microb. Cell Fact. 2018. V. 17. № 1. P. 89–92. https://doi.org/10.1186/s12934-018-0938-3
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология