Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 185-194
Стимулирование защитных механизмов Solanum tuberosum бактериями Вacillus subtilis и хитоолигосахаридами при инфицировании Phytophthora infestans
Л. Г. Яруллина 1, *, Г. Ф. Бурханова 1, В. О. Цветков 2, Е. А. Черепанова 1, Е. А. Заикина 1, А. В. Сорокань 1, В. О. Максутова 2, Ж. Н. Калацкая 3, И. В. Максимов 1
1 Институт биохимии и генетики – обособленное структурное подразделение
Уфимского федерального исследовательского центра Российской академии наук
450054 Уфа, Россия
2 Башкирский государственный университет
450076 Уфа, Россия
3 Институт экспериментальной ботаники им. В.Ф. Купревича НАН Беларуси
220072 Минск, Беларусь
* E-mail: yarullina@bk.ru
Поступила в редакцию 20.08.2021
После доработки 25.10.2021
Принята к публикации 05.11.2021
- EDN: YPSANB
- DOI: 10.31857/S0555109922020179
Аннотация
Изучено совместное влияние эндофитных бактерий Bacillus subtilis 26Д и хитоолигосахаридов (ХОС) на устойчивость растений картофеля (Solanum tuberosum L.) сорта Ранняя Роза к возбудителю фитофтороза оомицету Phytophthora infestans (Mont.) de Bary. Выявлено двукратное снижение площади поражения фитофторозом на листьях картофеля при совместной предпосевной обработке миниклубней бактериями B. subtilis (108 кл./мл) с ХОС (1 мг/л). Сходное защитное действие на растения картофеля оказывала обработка ХОС, чего не наблюдалось при использовании только бактерий. Механизмы повышения устойчивости растений картофеля к P. infestans были связаны с активацией каталазы, пероксидазы, ингибиторов гидролаз (амилазы и протеазы), накоплением пероксида водорода и транскриптов генов, кодирующих PR-белки: PR-1 (основной антимикробный белок), PR-3 (хитиназа), PR-6 (ингибитор протеазы), PR-9 (пероксидаза), ингибитор амилазы. Выявленная активация экспрессии генов основного антимикробного белка PR-1 (маркера развития системной приобретенной устойчивости) и PR-6 (маркера развития системной индуцированной устойчивости) под воздействием совместной обработки B. subtilis и ХОС свидетельствует о том, что развитие защитных реакций в растениях картофеля к возбудителю фитофтороза в данном случае проходит синергетически, при участии различных сигнальных путей, где B. subtilis праймируют защитные гены, а хитоолигосахариды выступают в качестве триггера их экспрессии.
В настоящее время первостепенной задачей растениеводства является использование эффективных и безопасных для окружающей среды и человека средств защиты растений. Во всем мире данное направление все более успешно конкурирует с химическими средствами защиты растений [1]. Считается, что биопрепараты вызывают активацию тех физиолого-биохимических процессов, которые участвуют в формировании неспецифического ответа растений на внешнее стрессовое воздействие. Так, обработка растений препаратами непатогенных ризобактерий повышает чувствительность генов, вовлеченных в системную приобретенную устойчивость (СПУ) или системную индуцированную устойчивость (СИУ), при последующем инфицировании патогенами [2].
Для защиты растений широко используются биопрепараты на основе эндофитных бактерий Bacillus subtilis, подавляющие рост и развитие патогенов, а также стимулирующие рост растений и их устойчивость к неблагоприятным факторам окружающей среды [3]. Повышение устойчивости растений к патогенам под воздействием таких препаратов связывают со способностью бактерий B. subtilis к продукции различных метаболитов, обладающих антивирусным, антибактериальным, антифунгальным действием [4]. Показано, что продуцируемые бактериями липопептиды, как сигнальные молекулы, способствуют развитию СИУ в результате трансдукции генерации Н2О2 и липоксигеназного сигнального каскада [5].
В этой связи весьма актуальным становится повышение эффективности микробиологических препаратов для защиты продовольственных культур от различного рода фитопатогенов. Показано, что производные хитина совместимы с микробиологическими препаратами, усиливают и пролонгируют их действие [6]. Хитозан и хитоолигосахариды (ХОС) являются активными элиситорами иммунитета растений, которые используются для повышения биологической активности биопрепаратов [7]. Предполагается, что ХОС связываются со специфическими рецепторами на мембранах клеток, включая триггерные механизмы активации генома [8]. Среди них быстрой и высокой экспрессией характеризуются гены, ответственные за синтез регуляторных белков, участвующих в транскрипции и передаче информации [9]. Как элиситоры защитных реакций растений, ХОС участвуют в индукции накопления АФК, в том числе перекиси водорода [10], в синтезе антибиотиков [11], гидролитических и антиоксидантных ферментов [12].
Фитофтороз, вызываемый оомицетом Phytophthora infestans (Mont) de Bary, является одним из распространенных заболеваний картофеля на территории России, борьба с которым в настоящее время остается важной задачей. Показано, что метаболиты B. subtilis [13], как и ХОС [14], снижают степень поражения Solanum tuberosum возбудителем фитофтороза P. infestans. Познание механизмов формирования защитного ответа растений биопрепаратами в сочетании с элиситорами позволит значительно повысить эффективность экологически безопасных защитных мероприятий на картофеле и расширить спектр их применения.
Цель работы – изучение индуцирующего действия бактерий B. subtilis в сочетании с ХОС на формирование защитных реакций растений картофеля при инфицировании возбудителем фитофтороза.
МЕТОДИКА
Объекты исследования. В опытах использовали растения картофеля Solanum tuberosum (Чишминская опытная станция Башкирского научно-исследовательского Института сельского хозяйства, Уфа, Россия), выращенные из микроклубней восприимчивого сорта Ранняя роза. Клубни высаживали в емкости с грунтом (“TerraVita”, Норд Палп, торф верховой разной степени разложения, очищенный речной песок, перлит, комплексные минеральные удобрения, биогумус, pH 6.0–6.5) на глубину 3–4 см. Растения выращивали на светоплощадке с фотопериодом 16 ч (освещенность 8000–10 000 люкс) при температуре 20–22°С.
Бактерии B. subtilis 26Д из коллекции Института биохимии и генетики Уфимского федерального исследовательского центра РАН (Уфа, Россия) культивировали в среде LB (Lysogeny Broth) в течение 24 ч, затем суспензию разбавляли дистиллированной водой до необходимой концентрации.
Для заражения растений использовали культуру оомицета P. infestans из коллекции Института биохимии и генетики Уфимского федерального исследовательского центра РАН (Уфа, Россия). Патоген выращивали на картофельном агаре с декстрозой в течение 7 сут после повторного выделения из инфицированных мини-клубней картофеля для восстановления агрессивности патогена. Поверхность колоний изолята P. infestans заливали дистиллированной водой и выдерживали при 4°C в течение 30 мин. Концентрацию спорангиев оценивали с помощью камеры Фукса–Розенталя, суспензию спор разводили до титра 1 × × 105 спор/мл.
Обработка клубней перед посадкой. Клубни поверхностно стерилизовали, промывали проточной водой, подсушивали, часть из них опрыскивали суспензией B. subtilis 26Д (108 кл./мл), раствором ХОС (1 мг/мл) или смесью бактерий с ХОС из расчета 2 мл на 1 микроклубень. В контроле микроклубни обрабатывали дистиллированной водой. ХОС со средней молекулярной массой 7.5 кДа и степенью ацетилирования 65% были получены в лаборатории в соответствии с [15].
Через 15 сут после прорастания часть растений опрыскивали 5 мл суспензии спор P. infestans 1 × × 105 спор/мл. В качестве контрольных растений использовали необработанные и не инфицированные фитофторой растения, а также необработанные и инфицированные растения (для сравнения зараженных образцов). Через 24 и 72 ч после инфицирования в листьях определяли содержание H2O2, активность каталазы, пероксидазы, гидролитических ферментов и их ингибиторов, а также транскрипционную активность генов PR-белков. О развитии болезни судили по проценту пораженной площади листовой пластинки (степень поражения) на 7 сут после заражения растений P. infestans. Листья фотографировали, полученные изображения анализировали в компьютерной программе ImageJ (“NIH”, США).
Определение содержания H2O2. Для определения содержания H2O2 использовали метод, описанный в работе [16], с модификациями. Листья гомогенизировали в ступке при 4°C в 25 мМ фосфатном буфере (ФБ), pH 6.2, в соотношении 1 : 3, и центрифугировали в течение 10 мин при 10 000 g и 4°C на с микроцентрифуге 5415R (“Eppendorf”, Германия). В супернатанте определяли содержание H2O2 с использованием ксиленолового оранжевого. Реагент содержал 0.074% соли Мора (Fe2(NH4)2SO4 (чистота 99.997%) в 5.81%-ной серной кислоте и 0.009% ксиленолового оранжевого в 1.82%-ном сорбите (в соотношении 1 : 100). Реакционную смесь инкубировали 40 мин при комнатной температуре, затем измеряли оптическую плотность при 560 нм с использованием люминесцентной спектрометрической ячейки фирмы “Perkin Elmer” LS 55 (США) против контроля, содержащего воду вместо образца. Концентрацию пероксида водорода определяли по предварительно построенной калибровочной кривой.
Определение активности каталазы (КАТ). Для определения активности каталазы (КФ 1.11.1.6) методом [17] с модификациями растительную ткань гомогенизировали при 4°C в 50 мМ ФБ (pH 7.8) в соотношении 1 : 10. После центрифугирования при 10 000 g и 4°C на микроцентрифуге 5415R (“Eppendorf”, Германия) супернатант использовали для анализа активности фермента. Реакцию инициировали добавлением надосадочной жидкости к 65 мМ пероксиду водорода в 50 мМ ФБ (pH 7.8), смесь выдерживали при комнатной температуре в течение 2 мин. Реакцию останавливали добавлением 32.4 мМ молибдата аммония. В контрольную пробу вместо супернатанта добавляли дистиллированную воду. Интенсивность проявленной окраски измеряли на спектрофотометре Perkin Elmer LS 55 при 410 нм. Активность каталазы рассчитывали по формуле:
где Aк и Aо – абсорбция контрольных (содержащих воду вместо образца) и опытных образцов, соответственно, V – объем пробы, 0.1 мл, T – время инкубации, 600 с, K – коэффициент молярного поглощения H2O2, равный 22.2 × 103 моль–1 см–1. Активность КАТ выражали в ед./мг белка.
Определение активности пероксидазы (ПО). Для определения активности пероксидазы (КФ 1.11.1.7) использовали метод, описанный в работе [18], с модификациями. Листья гомогенизировали при 4°C в 10 мМ ФБ, pH 6.2, соотношение массы образца листьев к объему ФБ составляло 1 : 3. Гомогенат центрифугировали 20 мин при 10 000 g и 4°C на центрифуге 5415R. Пероксидазную активность супернатанта определяли микрометодом по окислению субстрата 20 мМ ортофенилендиамина 10 мМ пероксидом водорода, развитие окраски останавливали 4 н. H2SO4. Оптическую плотность раствора измеряли при 490 нм на приборе Perkin Elmer LS 55. За единицу активности фермента принимали изменение оптической плотности раствора за 1 мин. Активность ПО выражали в ед./мг белка.
Активность амилаз, протеаз и их ингибиторов. Активность амилаз, протеаз и их ингибиторов определяли по степени гидролиза иммобилизованных крахмала и БСА соответственно [19]. Субстраты ферментов с конечной концентрацией 1% иммобилизовали в 4%-ном полиакриламидном геле (ПААГ). Растворы, обладающие ферментативной активностью, наносили на ПААГ, выдерживали 20 мин при 37°C, затем окрашивали раствором Люголя или Кумасси G-250. Активность ферментов определяли методом денситометрии по калибровочным кривым, построенным с использованием стандартных препаратов амилазы Aspergillus niger и бычьего трипсина (“Sigma”, США). Ферментативную активность выражали в мкмоль субстрата/г белка мин. При определении ингибиторной активности препараты ингибиторов добавляли к стандартным растворам ферментов, ингибиторную активность определяли как величину изменения ферментативной активности.
Определение содержания белка. Содержание белка в образцах определяли по методу Брэдфорда [20], с использованием БСА в качестве стандарта.
Определение транскрипционной активности генов PR-белков. РНК выделяли из растений с помощью тризола (“Molecular Research Center, Inc.”, США). Навеску листьев гомогенизировали в жидком азоте. Для получения кДНК на основе мРНК исследуемых образцов проводили реакцию обратной транскрипции с использованием обратной транскриптазы M-MuLV согласно протоколу поставщика. Анализ накопления транскриптов генов PR-1 (номер GenBank AY050221), PR-3 (номер GenBank U49970 ), PR-5 (номер GenBank AY737317), PR-6 (номер GenBank JX683427), PR-9 (номер GenBank M21334) и ингибитора амилазы (номер GenBank XM006351484) проводили с помощью количественной ПЦР в реальном времени с использованием красителя SYBR Green I (“Synthol”, Россия) на приборе CFX Connect Real-Time System (“Bio-Rad”, США). кДНК разводили в пять раз и использовали непосредственно в качестве матрицы.
Изменения транскрипционной активности гена (количество копий мРНК для каждого гена) оценивали относительно эталонного гена St_act (“ген домашнего хозяйства”, актин, номер GenBank X55749) с использованием программного обеспечения “CFX Connect Real-Time System” (“Bio-Rad”, США). Анализ данных проводили с помощью программного пакета Lasergene от “DNASTAR, Inc.” (США). Праймеры, использованные в работе, приведены в табл. 1 .
Статистическая обработка. Эксперименты проводили в 5 биологических повторностях для биохимических показателей и 15 – для транскрипционной активности. На гистограммах показаны выборочные средние и их 95%-ные доверительные интервалы. Различия исследуемых параметров анализировали с помощью теста Краскела–Уоллиса в программе Statistica 8 (Statsoft, США). Разными буквами обозначены достоверно различающиеся значения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние бактерий B. subtilis и ХОС на устойчивость растений картофеля к инфицированию P. infestans и содержание H2O2. Анализ развития возбудителя фитофтороза на листьях картофеля показал, что предпосевная обработка клубней картофеля B. subtilis, ХОС и их смесью благоприятно отражалась на защитном потенциале растений (рис. 1, 2а). Так, в контроле степень поражения листьев составляла 85 ± 7%. Предобработка растений бактериями снижала пораженность листьев до 70 ± 5%, в варианте сочетания B. subtilis и ХОС – до 50 ± 6%. Результаты показали, что добавление ХОС к бактериям значимо повышало устойчивость растительных тканей к инфицированию возбудителем фитофтороза. Ранее было показано, что добавление хитина к бактериям рода Bacillus способствовало повышению устойчивости растений хлопка к вилту [21] и клубники к мучнистой росе [22].
Рис. 1.
Листья картофеля через 7 сут после инокуляции P. infestans: 1 – контроль, 2 – обработка B. subtilis, 3 – ХОС, 4 – B. subtilis + ХОС.
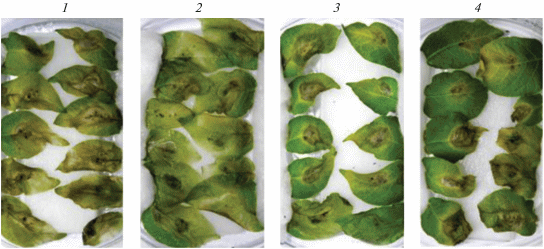
Рис. 2.
Степень пораженности листьев картофеля (а, % от площади листовой пластинки) и содержание H2O2 (б) через 24 ч после инфицирования P. infestans (1, контроль), обработки B. subtilis 26Д (2) и ХОС (3), B. subtilis + ХОС (4). I – незараженные, II – зараженные P. infestans растения. Разными буквами обозначены достоверно различающиеся значения.
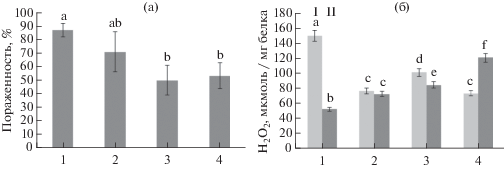
Известно, что наиболее ранней ответной реакций растительного организма на внедрение патогена является генерация АФК – окислительный взрыв, запускающий каскад последующих защитных реакций. При этом в растительных тканях повышается концентрация свободных радикалов (супероксидного ${\text{О}}_{2}^{{\centerdot - }},$ гидроксильного ОН•) и пероксида водорода. Показано, что Н2О2 участвует в запуске СВЧ-реакции, процессов лигнификации, а может также проявлять антимикробную активность [23]. Механизмы повышения устойчивости картофеля к инфицированию P. infestans под влиянием бактерий B. subtilis в сочетании с ХОС могли быть также связаны с повышением содержания Н2О2 в растительных тканях [24]. Исследования показали, что во всех вариантах обработки в неинфицированных растениях содержание Н2О2 было ниже, чем в контроле (рис. 2б). Возможно, это обусловлено способностью бактерий рода Bacillus индуцировать активность актиоксидантных ферментов [25]. В обработанных B. subtilis 26Д, ХОС, B. subtilis + ХОС растениях при инфицировании концентрация Н2О2 в листьях заметно повышалась по сравнению с зараженными контрольными растениями. Так, в варианте обработки бактериями в сочетании с ХОС уровень пероксида водорода в листьях инфицированных растений картофеля повышался в два раза по сравнению с контролем уже через 24 ч после заражения (рис. 1б, 4).
Известно, что устойчивость картофеля к возбудителю фитофтороза P. infestans во многом определяется развитием реакции сверхчувствительности (СВЧ). Это предполагает изменения концентрации Н2О2 в растительных тканях в ответ на внедрение патогена, поэтому Н2О2 можно рассматривать в качестве важнейшей молекулы, вовлеченной в передачу внутриклеточных сигналов, регулирующих экспрессию генов и активацию защитных систем растения. Повышение уровня Н2О2 вызывает увеличение концентрации в цитозоле ионов кальция, выполняющих важную роль в процессах передачи сигнальной информации в геном растения [26]. ХОС, как элиситоры, способствуют генерации Н2О2 при формировании защитных реакций к патогенам с различным типом трофности [14]. Известно, что хитин, хитозан и их олигомеры являются активными иммуностимуляторами. Вероятно, совместная обработка бактерий B. subtilis с ХОС способствует формированию более ранних и интенсивных защитных реакций при контакте с патогеном в результате быстрого накопления пероксида водорода на начальных этапах инфекционного процесса.
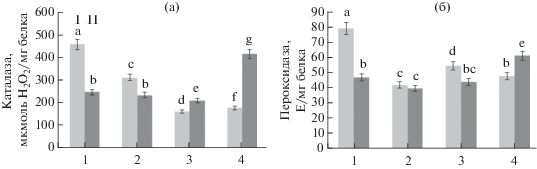
Влияние бактерий B. subtilis и ХОС на активность антиоксидантных ферментов в листьях картофеля при инфицировании P. infestans. Изменение концентрации H2O2 в растительных тканях при инфицировании происходит, в основном, в результате изменения активности антиоксидантных ферментов. Важнейшим антиоксидантным ферментом является каталаза (КАТ). Во всех вариантах обработки у незараженных растений наблюдалось снижение активности КАТ по сравнению с контрольными растениями (рис. 3а). Существенное повышение активности КАТ проявлялось на протяжении 24 ч в инфицированных растениях, предобработанных B. subtilis в сочетании с ХОС (рис. 3а, 4).
Рис. 3.
Активность каталазы (а) и пероксидазы (б) в листьях картофеля при заражении P. infestans (1, контроль), обработке B. subtilis 26Д (2) и хитоолигосахаридами (3), B. subtilis + ХОС (4). I – незараженные, II – зараженные P. infestans растения. Разными буквами обозначены достоверно различающиеся значения.
Известно, что активность КАТ может существенно модифицироваться пероксидом водорода, который является не только сигнальной молекулой, но и субстратом КАТ. В то же время, это воздействие на активность КАТ у растений неоднозначно. Например, в проростках пшеницы Н2О2 в зависимости от концентрации либо ингибировала [27], либо стимулировала активность КАТ [28].
Ферментом, вовлеченным как в генерацию, так и в утилизацию Н2О2, является пероксидаза (ПО). Основной функцией ПО является защита растительного организма от окислительного стресса, а также непосредственное участие в процессах лигнификации.
В настоящей работе во всех вариантах предобработки через 24 ч после инокуляции в незараженных растениях активность ПО была ниже, чем в контрольном варианте (рис. 3б). Следует отметить, что в инфицированных растениях только обработка B. subtilis в сочетании с ХОС вызывала повышение активности ПО по сравнению с зараженным контролем.
Важной особенностью ПО является ее способность переключаться на каталазную активность, предотвращая образование избытка Н2О2. Такое явление, в частности, зарегистрировано для нескольких форм апопластных пероксидаз [29]. Возможно, добавление ХОС к культуре B. subtilis способствует более раннему и интенсивному накоплению Н2О2 в инфицированных тканях растений. В регуляцию содержания Н2О2 в растениях картофеля на ранних этапах инфекционного процесса в этом случае вовлечены и КАТ и ПО.
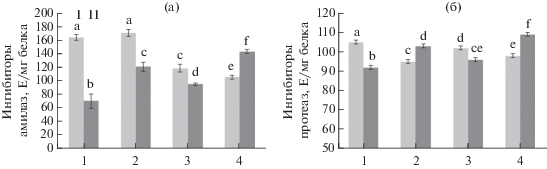
Влияние бактерий B. subtilis и ХОС на активность гидролаз и их ингибиторов в растениях картофеля при инфицировании P. infestans. Основным орудием воздействия патогена на растения являются продуцируемые ими гидролитические ферменты, разрушающие клеточные стенки растений и обеспечивающие его проникновение в ткани [30]. Ответная защитная реакция растений сопровождается синтезом ингибиторов этих ферментов [31].
Как видно из рис. 4, в инфицированных растениях картофеля уже через 24 ч происходит повышение активности амилаз и протеаз (рис. 4, 1). Во всех вариантах обработки неинфицированных растений активность амилаз и протеаз в листьях также достоверно возрастала либо не отличалась от контрольного варианта. Следует отметить, что в предобработанных бактериями и ХОС и инфицированных растениях активность как амилаз, так и протеаз снижалась, особенно в варианте сочетания B. subtilis с ХОС, по сравнению с инфицированным контролем (рис. 4, 4).
Рис. 4.
Активность амилаз (а) и протеаз (б) в листьях картофеля при заражении P. infestans (1, контроль), обработке B. subtilis 26Д (2) и хитоолигосахаридами (3) и B. subtilis + ХОС (4). I – незараженные, II – зараженные P. infestans растения. Разными буквами обозначены достоверно различающиеся значения.
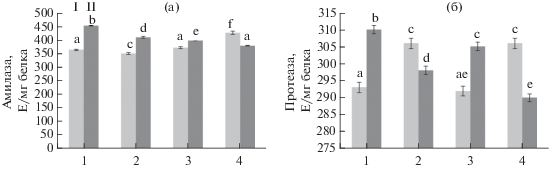
Известно, что амилолитическая активность характерна для представителей большинства таксономических групп возбудителей болезней растений, и почти всегда эти ферменты представлены конститутивными белками. Однако амилаза отсутствует у оомицетов, в частности у представителей рода Phytophthora, которые используют для расщепления крахмала ферменты картофеля, активируя их биосинтез в пораженных тканях [32]. Можно предположить, что снижение уровня амилаз под действием бактериальных метаболитов и ХОС препятствует росту и развитию P. infestans в растительных тканях.
Высокая же протеолитическая активность в зараженных тканях не только обеспечивает аминокислотами рост и развитие патогенного микроорганизма, но и может нейтрализовать защитные белки картофеля, такие как лектины – ингибиторы гидролаз. Так, показано, что экстрацеллюлярная металлопротеиназа фитопатогенной бактерии Erwinia carotovora (Jones) Waldee расщепляет лектин картофеля, принимающий участие в защите растений [33].
Исследования показали, что в инфицированных необработанных растениях активность ингибиторов амилаз снижалась (рис. 5а, 1), что могло быть вероятной причиной высокого уровня амилаз в инфицированных тканях картофеля (рис. 4а, 1). Сходная тенденция характерна и для ингибиторов протеаз при заражении необработанных растений (рис. 5б, 1). Однако, в предобработанных и инфицированных P. infestans растениях активность ингибиторов амилаз и протеаз была выше, чем в необработанном и инфицированном контроле. Наиболее значимые различия были характерны для варианта сочетания B. subtilis с ХОС (рис. 5, 4). Это предполагает, что в ответ на инфицирование P. infestans в растениях картофеля могут синтезироваться de novo ингибиторы ферментов, которые способны подавлять активность амилаз и протеаз [31].
Рис. 5.
Активность ингибиторов амилаз (а) и протеаз (б) в листьях картофеля при заражении P. infestans (1, контроль), обработке Bacillus subtilis 26Д (2), ХОС (3) и B. subtilis + ХОС (4). I – незараженные, II – зараженные P. infestans растения. Разными буквами обозначены достоверно различающиеся значения.
Влияние бактерий B. subtilis и ХОС на транскрипционную активность генов PR-белков в растениях картофеля при инфицировании P. infestans.
Активация защитных реакций растения при контакте с патогенами может происходить посредством различных сигнальных путей, что выражается в изменении уровней экспрессии генов, кодирующих PR-белки. Известно, что защитное действие препаратов на основе бактерий рода Bacillus обусловлено запуском системной индуцированной устойчивости (СИУ) [34], маркером развития которой является экспрессия гена PR-6 (ингибитор протеазы).
Однако формирование устойчивости к патогенам под влиянием бактерий Bacillus также может развиваться по типу СПУ, маркером развития которой является экспрессия гена PR-1 [35]. Как видно из рис. 6а, инфицирование и обработка B. subtilis, ХОС и их смесью стимулировали накопление транскриптов гена PR-1, причем ген PR-1 наиболее интенсивно экспрессировался в инфицированных растениях.
Рис. 6.
Влияние B. subtilis 26Д (2) и ХОС (3) и B. subtilis + ХОС (4) на относительное количество транскриптов генов PR- белков: PR-1 (основной защитный белок), PR-3 (хитиназа), PR-5 (тауматин-подобный белок), PR-6 (ингибитор протеазы), PR-9 (пероксидаза), Ai (ингибитор амилазы) в здоровых (I) и инфицированных P. infestans (II) растениях через 24 ч после заражения (1, контроль). Измерения транскрипционной активности проводили относительно эталонного гена St_act (“ген домашнего хозяйства”, актин). Разными буквами обозначены достоверно различающиеся значения.
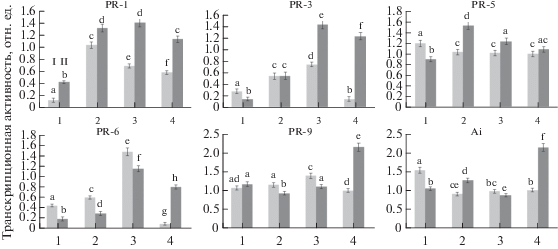
Следует обратить внимание, что обработка бактериями в сочетании с ХОС, как и обработка только ХОС, оказывали значительное влияние на повышение уровня экспрессии гена хитиназы (PR-3) у зараженных растений (рис. 6б). Среди внеклеточных гидролаз, способных лизировать клеточную стенку и гифы грибов, наибольший интерес представляют именно хитиназы [12]. В большинстве случаев хитиназы являются индуцибельными ферментами, образующимися в присутствии специфического субстрата. В наших исследованиях сочетание бактерий с ХОС способствовало усилению транскрипционной активности гена хитиназы. Показано, что в устойчивых к Pectobacterium carotovorum сортах картофеля экспрессия гена PR-3 значительно выше, чем в восприимчивых растениях [36].
У инфицированных растений, обработанных только бактериями B. subtilis, значительно повышалась экспрессия гена тауматин-подобного белка (PR-5) (рис. 6). Считается, что активность белков семейства PR-5 связана с увеличением проницаемости мембран [37]. Показано, что под влиянием штамма B. cereus BS107 в формирование устойчивости растений перца к бактериальной гнили Xantomonas axonopodis pv. vesicatoria вовлекались гены РR-1, РR-4, РR-10 [38].
Необходимо отметить, что в инфицированных растениях, предобработанных ХОС и сочетанием бактерий с ХОС, наблюдался высокий уровень транскрипционной активности гена ингибитора протеаз PR-6 (рис. 6б, 3, 4). Показано, что обработка растений томата штаммом B. subtilis BEB-DN приводила к усилению экспрессии генов PR-6 и ферментов синтеза лигнина [39]. Считается, что индукция устойчивости растений, опосредованная стимулирующими рост бактериями, отличается не прямой активацией экспрессии генов PR-белков, а развивается путем праймирования, через генерацию АФК и редокс-чувствительные транскрипционные факторы и гены PR-белков [40]. Это нашло подтверждение и в настоящей работе.
Обработка бактериями, ХОС, их смесью, как и инфицирование P. infestans, снижали накопление транскриптов гена ингибитора амилазы в растениях картофеля по сравнению с контрольными инфицированными растениями (рис. 6). Интересно, что при совместной обработке B. subtilis с ХОС в инфицированных растениях уровень транскрипционной активности гена ингибитора амилазы возрастал более чем в 2 раза по сравнению с контролем (рис. 6а, 4). Вероятно, это обеспечивало повышение активности ингибиторов амилаз в растительных тканях (рис. 5а, 4).
Повышение содержания ингибиторов гидролаз в растении происходит, как правило, не за счет увеличения концентрации конститутивных соединений, а за счет синтеза новых форм ингибиторов [28]. В нашем случае, накопление транскриптов генов ингибиторов протеазы и амилазы и повышение активности их белкового продукта в листьях картофеля при совместной обработке клубней B. subtilis и ХОС было направлено на подавление активности экзогенных гидролаз, что способствовало повышению устойчивости картофеля к P. infestans.
У инфицированных растений, обработанных бактериями B. subtilis в сочетании с ХОС значительно повышалась экспрессия гена пероксидазы (PR-9) (рис. 6). Растительные пероксидазы играют ключевую роль в защите растений от патогенов, принимая участие в синтезе антимикробных соединений и укреплении клеточной стенки растения путем формирования лигнина, что коррелирует с их устойчивостью [39].
Таким образом, совместная обработка штаммами B. subtilis 26Д с ХОС приводила к снижению степени пораженности листьев картофеля возбудителем фитофтороза. Механизмы повышения устойчивости растений картофеля к P. infestans связаны с активацией каталазы, пероксидазы, ингибиторов гидролаз (амилазы и протеазы), накоплением пероксида водорода и транскриптов генов, кодирующих PR-белки: ингибитор амилазы, основной защитный белок (PR-1), хитиназа (PR-3), ингибитор протеазы (PR-6), пероксидаза (PR-9). Выявленная активация экспрессии генов основного антимикробного белка PR-1 (маркера развития системной приобретенной устойчивости) и PR-6 (маркера развития системной индуцированной устойчивости) под воздействием совместной обработки B. subtilis и ХОС свидетельствует о том, что развитие защитных реакций в растениях картофеля к возбудителю фитофтороза в данном случае проходит синергетически, при участии различных сигнальных путей, где B. subtilis праймируют защитные гены, а ХОС выступают в качестве триггера их экспрессии.
Работа выполнялась частично по теме госзадания (№ гос. регистрации AAAA-A21-121011990120-7), при финансовой поддержке Российского фонда фундаментальных исследований и Белорусского республиканского фонда фундаментальных исследований в рамках научного проекта № 20-516-00005, на оборудовании Центра коллективного пользования “Биомика” (Отделение биохимических исследований и нанобиотехнологии Регионального центра коллективного пользования “Агидель”) и Уникальной научной установки “Кодинк”.
Список литературы
Zalila-Kolsi I., Ben Mahmoud A., Hacina A., Sellami S. et al. // Microbiol Res. 2016. V. 192. P. 148–158. https://doi.org/10.1016/j.micres.2016.06.012
Burkhanova G.F., Veselova S.V., Sorokan’ A.V., Blagova D.K., Nuzhnaya T.V., Maksimov I.V. // Appl. Biochem. Microbiol. 2017. V. 53. № 3. P. 346–352. https://doi.org/10.18699/VJ19.561
Verma P., Yadav A.N., Kumar V., Singh D.P., Saxena A.K. In: Plant-Microbe Interactions in Agro-Ecological Perspectives. / Eds. D.P. Singh, H.B.Singh, R. Prabha. Singapore: Springer, 2017. V. 2. P. 543–580.
Berg G. // Appl. Microboil.Biotehnol. 2009. V. 84. P. 11–18. https://doi.org/10.1007/s00253-009-2092-7
Yarullina L.G., Kasimova R.I., Kuluev B.R., Surina O.B., Yarullina L.M., Ibragimov R.I. // Agricultural Sciences. 2014. V. 5. P. 906–912. https://doi.org/10.4236/as.2014.510098
Павлюшин В.А., Тютерев С.Л., Попова Э.В., Новикова И.И., Быкова Г.А., Домнина Н.С. // Биотехнология. 2010. № 4. С. 69–80.
Краснобаева И.Л., Коваленко Н.М., Попова Э.В. // Вестник защиты растений. 2020. Т. 103. № 4. С. 233–240.
Yin H., Li Y., Zhang H.Y., Wang W.X., Lu H. et al. // Int. J. Plant Sci. 2013. V. 174. № 4. P. 722–732. https://doi.org/10.1086/669721
Rush T.A., Puech-Pagès V., Bascaules A. et al. // Nat. Commun. 2020. V. 11. P. 3897. https://doi.org/10.1038/s41467-020-17615-5
Kawano T., Sahashi N., Takahashi K., Uozumi N., Muto S. // Plant Cell Physiοl. 1998. V. 39. № 7. P. 721–730. https://doi.org/10.1093/oxfordjournals.pcp.a029426
Wang X.Q., Zhao D.L., Shen L.L., Jing C.L., Zhang C.S. In: Role of Rhizospheric Microbes in Soil. / Ed. V.S. Meena. Singapore: Springer, 2018. V. 1. P. 225–250. https://doi.org/10.1007/978-981-10-8402-7-9
Журавлева Н.В., Лукьянов П.А. // Вестник ДВО РАН. 2004. Т. 3. С. 76–86.
Янчевская Т.Г., Гриц А.Н., Коломиец Э.И., Романовская Т.В., Яруллина Л.Г., Ибрагимов Р.И., Цветков В.О. // Прикл. биохимия и микробиология. 2018. Т. 54. № 3. С. 304–312. https://doi.org/10.7868/S0555109918030108
Яруллина Л.Г., Сорокань А.В., Бурханова Г.Ф., Черепанова Е.А., Максимов И.В. // Прикл. биохимия и микробиология. 2018. Т. 54. № 5. С. 532–539. https://doi.org/10.1134/S0555109918050185
Максимов В.И., Смирнова Ю.В. // Биотехнология. 1993. № 10. С. 26–30.
Jiang Z.Y., Woollard A.C.S., Wolff S.P. // FEBS Lett. 1990. V. 268. P. 69–71.
Hadwan M.H., Abed H.N. // Data in Brief. 2016. V. 6. P. 194–199. https://doi.org/10.1016/j.dib.2015.12.012
Fornera S., Walde P. // Anal. Biochem. 2010. V. 407. № 2. P. 293–295. https://doi.org/10.1016/j.ab.2010.07.034
Цветков В.О., Шпирная И.А., Максутова В.О., Ибрагимов Р.И. // Известия Уфимского научного центра Российской академии наук. 2018. № 3–5. С. 81–85.
Bradford M.M. // Anal. Biochem. 1976. V. 72. № 1–2. P. 248–254. https://doi.org/10.1016/0003-2697(76)90527-3
Rajendran L., Samiyappan R. // Plant Pathol. J. 2008. V. 7. № 1. P. 1–12. https://doi.org/10.3923/ppj.2008.1.12
Abdel-Kader M.M., El-Mougy N.S., Aly M.D., Lashin S.M. // Int. J. Agric. Forestry. 2012. V. 2. № 2. P. 8–48. https://doi.org/10.5923/j.ijaf.20120202.07
Bolwell G.P., Bindschedler L.V., Blee K.A., Butt V.S., Davies D.R., Gardner S.L., Gerrish C., Minibayeva F. // J. Exp. Bot. 2002. V. 53. № 372. P. 1367–1376. PMID: 11997382
Pfannschmidt T., Bräutigam K., Wagner R., Dietzel L., Schröter Y. // Ann. Bot. 2009. V. 103. P. 599–607. https://doi.org/10.1093/aob/mcn081
White J.F., Torres M.S. // Physiol. Plantarum. 2010. V. 138. P. 440–446. https://doi.org/10.1111/j.1399-3054.2009.01332.x
Galvez–Valdivieso G., Fryer M.J., Lawson T., Slattery K., Truman W., Smirnoff N. et al. // Plant Cell. 2009. V. 21. P. 2143–2162. https://doi.org/10.1105/tpc.108.061507
Bakalova S., Nikolova A., Wedera D. // J. Plant Physiol. 2004. V. 30. P. 64–77. https://doi.org/10.1556/AAgr.56.2008.2.1
Luna C.M., Pastori G.M., Driscoll S., Groten K., Bernard S., Foyer C.H. // J. Experimental Botany. 2005. V. 56. № 417–423. P. 417–423. https://doi.org/10.1093/jxb/eri039
Minibayeva F., Kolesnikov O., Chasov A., Beckett R.P., Luthje S., Vylegzhanina N., Buck F., Bottger M. // Plant, Cell & Environment. 2009. V. 32. P. 497. https://doi.org/10.1111/j.1365-3040.2009.01944.x
Максимов И.В., Сорокань А.В., Черепанова Е.А., Сурина О.Б., Трошина Н.Б., Яруллина Л.Г. // Физиология растений. 2011. Т. 58. № 2. С. 243.
Яруллина Л.Г., Касимова Р.И., Ибрагимов Р.И., Ахатова А.Р., Умаров И.А., Максимов И.В. // Прикл. биохимия и микробиология. 2016. Т. 52. № 1. С. 85. https://doi.org/10.7868/S0555109916010153
Gappa-Adachi R., Yano1 K., Takeuchi S., Morita Y., Uematsu S. // J. Gen. Plant Pathol. 2012. V. 78. P. 39. https://doi.org/10.1007/s10327-011-0351-9
Feng T., Nyffenegger C., Hojrup P., Vidal-Melgosa S., Yan K., Ulrik Fangel J., Meyer A.S., Kirpekar F. // Prt. Appl. Microbiol. Biotechnol. 2014. V. 98 № 24. P. 10077. https://doi.org/10.1007/s00253-014-5877-2
Wang T., Liang Y., Wu M., Chen Z. et al. // Chinese J. Chem. Eng. 2015. V. 23. № 4. P. 744–754. https://doi.org/10.1016/j. cjche.2014.05.020
Gimenez–Ibanez S., Solano R. // Front. Plant Sci. 2013. V. 4. № 72. https://doi.org/10.3389/fpls.2013.00072.eCollection
Третьякова О.М., Евтушенков А.И. // Труды БГУ. 2011. Т. 6. № 1. С. 163–167.
Васюкова Н.И., Озерецковская О.Л. // Физиология растений. 2009. Т. 56. № 5. С. 643–653.
Yang J.W., Yu S.H., Ryu C.M. // Plant Pathol. J. 2009. V. 25. № 4. P. 389–399. https://doi.org/10.5423/PPJ.2009.25.4.389
Valenzuela-Soto J.H., Estrada-Hernández M.G., Laclette E.I., Délano-Frier J.P. // Planta. 2010. V. 231. P. 397–410. https://doi.org/10.1007/s00425-009-1061-9
Martinez–Medina A., Flors V., Heil M., Mauch-Mani B., Corné M.J., Pieterse C.M.J. et al. // Trends Plant Sci. 2016. V. 21. P. 818–822. https://doi.org/10.1016/j.tplants.2016.07.009
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


