Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 179-184
Ранозаживляющая активность in vivo глицерогидрогелевых пластин на основе аскорбата хитозана, алоэ вера и полиолата кремния
О. Н. Малинкина 1, *, Ю. Ю. Журавлёва 1, А. Б. Шиповская 1
1 Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского
410012 Саратов, Россия
* E-mail: Olga-Malinkina@yandex.ru
Поступила в редакцию 19.08.2021
После доработки 29.10.2021
Принята к публикации 05.11.2021
- EDN: MUHJLY
- DOI: 10.31857/S0555109922020143
Аннотация
Проведено исследование in vivo ранозаживляющих свойств глицерогидрогелевых пластин на основе L- и D-аскорбата хитозана, сока Алоэ вера (Aloe vera) и тетраглицеролата кремния при лечении резаной раны у альбиносов крыс-самцов. Установлено, что применение пластин статистически значимо повышало темп убыли площади раневой поверхности, скорость ранозаживления и снижало сроки восстановления кожного покрова по сравнению с контролем. Наиболее высокая интенсивность регенерации наблюдалась под пластинами с D-аскорбатом хитозана, что подтвердило обнаруженный ранее эффект влияния гомохиральности солей хитозана на биологическую функциональность его материалов. Глицерогидрогелевые пластины на основе D-аскорбата хитозана являются высокоэффективными раневыми покрытиями и экономически целесообразны вследствие более низкой стоимости D-изомера аскорбиновой кислоты.
Аминополисахарид хитозан, получаемый деацетилированием хитина, относится к классу линейных сополимеров D-глюкозамина и N-ацетил-D-глюкозамина. Его биологическая активность зависит от степени дезацетилирования и плотности распределения аминогрупп, приобретающих положительный заряд в водно-кислотной среде при рН < 6 [1–3]. Применение для растворения хитозана биологически активных карбоновых кислот и аминокислот позволяет, с одной стороны, варьировать свойства получаемых материалов для наилучшего соответствия области применения, а с другой – объединить биохимические активности макромолекулы аминополисахарида и аниона кислоты для получения возможного синергетического эффекта [4–7]. Так, использование аскорбиновой кислоты в качестве источника протонов для формирования солевой формы хитозана способствует повышению адгезии эндотелиальных клеток [8], проявлению высокой мукоадгезии [9], а также усилению антиоксидантных свойств [10], антибактериальной [11, 12] и ранозаживляющей активности [7, 13].
Для повышения полезных свойств в хитозансодержащие материалы биомедицинского назначения вводят биологически активные вещества [14], например, сок Алоэ вера (Aloe vera) [15–21]. Сухой остаток сока этого растения содержит 55% полисахаридов, в основном глюкоманнана, 17% сахаров, 16% минеральных веществ, 7% аминокислот, 4% липидов и 1% фенольных соединений [22]. Алоэ вера повышает клеточный транспорт кислорода, ферментов и других участвующих в регенерации тканей биологических факторов, улучшает выработку и секрецию коллагена [17, 23]. Считается, что активные компоненты Алоэ вера, в частности глюкоманнан, взаимодействуют с маннозными рецепторами и стимулируют факторы роста, клеточную активность и пролиферацию фибробластов [24]. Гидрогелевые раневые покрытия на основе хитозана и Алоэ вера повышают активность макрофагов [19], проявляют эффективное ранозаживление [20] и ингибируют формирование рубцовой ткани [21].
Ранее было показано, что золь-гель-синтез в системе на основе аскорбата хитозана и тетраглицеролата кремния Si(С3Н7О3)4, обладающего ранозаживляющей и транскутанной активностью [25], сопровождается формированием устойчивых к синерезису глицерогидрогелей-монолитов [26]. При введении в данную систему поливинилового спирта в качестве структурообразующей добавки возможно получение глицерогидрогелей в форме тонкопленочных пластин [11, 27]. Обнаружено влияние изомера (L- или D-) аскорбиновой кислоты на конформационные параметры макромолекул аскорбата хитозана [28], кинетику золь-гель процесса и физико-механические свойства пластин [11, 27], а также биологическую активность глицерогидрогелей [11, 12]. Замена поливинилового спирта на сок Алоэ вера приводит к формированию полностью биорезорбируемых глицерогидрогелевых пластин [29] с развитым поверхностным рельефом [30]. Поскольку морфоструктура ранозаживляющих покрытий влияет на адгезию и пролиферацию эпителиальных клеток [31], представляется целесообразным оценить ранозаживляющие свойства пластин, полученных с использованием L- и D-аскорбата хитозана, Алоэ вера и Si(С3Н7О3)4.
Цель работы – исследование ранозаживляющей активности in vivo глицерогидрогелевых пластин на основе L- и D-аскорбата хитозана, Алоэ вера и полиолата кремния.
МЕТОДИКА
Для получения глицерогидрогелевых пластин использовали: L- и D-аскорбиновую кислоту (L- и D-АК) производства ООО “Люми” (Россия) и ЗАО “Вектон” (Россия) соответственно; два коммерческих образца хитозана со средневязкостной молекулярной массой 40 и 60 кДа (ХТЗ-40 и ХТЗ-60), близкой степенью деацетилирования 80 ± 2 мол. % – ООО “Биопрогресс” (Россия) и “GoldenShell” (Китай) соответственно. Дистиллированную воду дегазировали от CO2 и О2 кипячением в течение 1 ч. Сок Алоэ вера (Aloe vera) получали из предварительно вымытых листьев 3‑летнего растения механическим отжимом и последующим фильтрованием через бумажный фильтр. Выход сока Алоэ вера составил ~58 мл/100 г листьев, содержание сухих веществ в соке – ~1 мас. %. В качестве гелеобразователя применяли раствор тетраглицеролата кремния в глицерине (Si(С3Н7О3)4∙3C3H8O3) концентрации 58.7 мас. %, полученный в лаборатории органических материалов Институте органического синтеза им. И.Я. Постовского УрО РАН (Россия).
Водный раствор L- и D-аскорбата хитозана готовили внесением навески порошка L- или D-АК в водную суспензию полимера при перемешивании на магнитной мешалке при 20 ± 2°С. Навеску хитозана предварительно стерилизовали в ламинарном боксе NuAire Biological Safeti Cabinets (“NuAire”, Франция) в течение 15 мин. Концентрация хитозана и L-(D-)АК в растворе составила 8.0 мас. %.
Гелеобразующую композицию получали как описано в работе [29], смешивая исходные субстанции в соотношении раствор аскорбата хитозана : сок Алоэ вера : Si(С3Н7О3)4∙3C3H8O3 = 4 : 1 : 1, по массе. Полученную смесь заливали в стерильную силиконовую форму из расчета 0.5 ± ± 0.1 мл/см2 и оставляли при 20 ± 2°С для гелеобразования в течение 18 ± 2 ч до получения глицерогидрогелевой пластины толщиной 2.5 ± 0.5 мм. Состав гелеобразующих композиций и обозначение глицерогидрогелевых пластин приведены в табл. 1. Полученные пластины на основе L- и D‑аскорбата хитозана обладали высокой конгруэнтностью к поверхности со сложным рельефом, что позволяло закреплять их на ране без фиксирующих средств.
Таблица 1.
Состав гелеобразующей композиции для получения глицерогидрогелевых пластин на основе L- и D-аскорбата хитозана
| Образец пластины |
Состав гелеобразующей композиции | ||||||
|---|---|---|---|---|---|---|---|
| Изомер АК, мас. % | Хитозан, мас. % | Сок Алоэ вера, % | Гелеобразователь, % | ||||
| L- | D- | ХТЗ-40 | ХТЗ-60 | Si(С3Н7О3)4 | С3Н8О3 | ||
| 40 L | 5.33 | – | 5.33 | – | 16.7 | 9.81 | 6.89 |
| 40 D | – | 5.33 | 5.33 | – | |||
| 60 L | 5.33 | – | – | 5.33 | |||
| 60 D | – | 5.33 | – | 5.33 | |||
В качестве модели использовали белых нелинейных альбиносов крыс-самцов с массой тела 170 ± 10 г и площадью поверхности кожного покрова 350 ± 50 см2. Животные были выращены в питомнике вивария Саратовского государственного медицинского университета им. В.И. Разумовского (Россия) и содержались по одной особи в клетке в стандартных условиях на обычном рационе. Резаные раны со средней площадью 260 ± 10 мм2 (0.75 ± 0.05% от площади поверхности тела) моделировали иссечением кожного покрова хирургическим лезвием по трафарету в дорсальной области без повреждения подкожно-мышечного слоя. Животных случайным образом распределяли на 5 экспериментальных групп по 5 особей в каждой. В контрольной группе № 1 животные лечения не получали (отрицательный контроль). В экспериментальных группах № 2 и № 3 на дно раны однократно накладывали глицерогидрогелевые покрытия 40 L и 40 D, в экспериментальных группах № 4 и № 5 – 60 L и 60 D соответственно. Наблюдение за состоянием раны проводили до выздоровления животных.
Показатели роста и развития определяли по изменению живой массы лабораторных животных. Взвешивание проводили до и после завершения эксперимента (на 18 сут) на лабораторных весах “Масса-К” ВК-600 (цена деления 0.01 г). Рассчитывали прирост массы (%) и среднесуточный привес (%/сут).
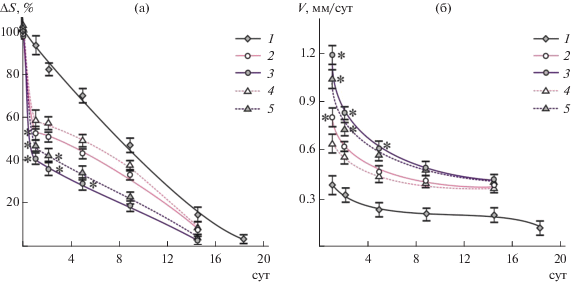
Рис. 1.
Динамика уменьшения площади поверхности (а) и скорости заживления (б) резаной раны у альбиносов крыс-самцов без и с применением глицерогидрогелевых пластин на основе L- и D-аскорбата хитозана (номера маркеров кривых соответствуют номеру группы животных в табл. 2).
При работе с экспериментальными животными руководствовались “Общими этическими принципами экспериментов на животных” (2001) и требованиями Европейской конвенции по защите лабораторных животных. Все болезненные для крыс манипуляции выполняли под наркозом после внутримышечной инъекции раствора “Zoletil” (“Virbac”, Франция) в дозе 0.07 мг/100 г веса в условиях асептики. Эвтаназия животных не осуществлялась.
Динамику ранозаживления оценивали планиметрическим методом, замеряя контуры раны с помощью стерильной прозрачной палетки из плотного полиэтилена с разметкой из сетки квадратов с длиной сторон 2.5 мм. Площадь поверхности раны (S, мм2) и ее изменение во времени (ΔS, %) определяли по формулам (1) и (2), соответственно:
где n и k – количество квадратов, полностью и частично находящихся в пределах контура раны соответственно; С – площадь одного квадрата (6.25 мм2), S0 и St – площадь раневой поверхности при предшествующем измерении и через промежуток времени t соответственно.Скорость заживления раны (V, мм/сут) вычисляли по формуле (3) [32]:
где P0 и Pt – периметр раневой поверхности при предшествующем измерении и через промежуток времени t соответственно. Определение проводили курвиметром по обведенному контуру на полиэтиленовой палетке.Статистическую значимость различий измеряемых показателей оценивали с помощью непараметрического критерия для малых групп Манна–Уитни с использованием программы “Statistica 8.0” (StatSoft Russia). Количественные показатели представлены в виде $\bar {x}~$ ± х, где $\bar {x}$ – среднеарифметическое значение, а х – отклонение от среднеарифметического значения. Критический уровень значимости – p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В ходе эксперимента установлено, что присутствие на ране глицерогидрогелевых пластин на основе L- и D-аскорбата хитозана не доставляло дискомфорта и не вызывало побочных эффектов у экспериментальных животных, а также не влияло на их двигательную активность и аппетит. За весь период наблюдения не было отмечено ни одного случая нагноения раны или осложненного течения раневого процесса.
У крыс из контрольной группы к концу 2 сут по периметру раны образовывалась корочка с умеренно эксудирующим центром, а на 4 сут формировался струп. У крыс из опытных групп под глицерогидрогелевыми покрытиями за 1 сут лечения происходило значительное стягивание (контракция) раны, а на 3 сут пластины переставали визуализироваться и струп формировался на всей поверхности раны.
Согласно клинической практике, динамика заживления открытой раны определяется скоростью репаративно-регенераторных процессов, направленных на постепенное сокращение раны до ее полного закрытия. В связи с этим эффективность ранозаживляющего препарата принято оценивать по темпу убыли площади поверхности раны. Известно также, что в процессе восстановления целостности кожного покрова после повреждения периметр раны уменьшается линейно, а площадь – квадратично, вследствие чего отношение периметра раны к ее площади различно для ран разного размера [32]. В этой связи в настоящем исследовании оценивали не только изменение площади поверхности раны, но и скорость ранозаживления. Зависимости, отражающие результаты планиметрии резаных ран у крыс в динамике, представлены на рис. 1.
Результаты исследования показали, что применение глицерогидрогелевых пластин на основе L- и D-аскорбата хитозана ускоряло процесс заживления и во всех экспериментальных группах животных интенсивность регенерации была существенно выше по сравнению с контролем. Наиболее высокие темпы репаративно-регенеративных процессов в экспериментальных группах № 2–5 отмечались в ранние сроки (t = 1–2 сут) лечения, в группе сравнения изменение ΔS практически линейно (рис. 1а). На 5 сут эксперимента площадь раневой поверхности составляла менее 40% в группах № 3 и № 5 (ранозаживление под пластинами 40 D и 60 D), ~50% в группах № 2 и № 4 (40 L и 60 L), в то время как в контрольной группе еще достигало 70%. В группах № 2–5 закрытие раны (~90% от исходной площади резаной раны) наблюдалось на 14–15 сут, что на 4 сут превосходило аналогичный показатель для контрольной группы животных. В сопоставлении с группой № 1 скорость заживления раны в группах № 2–5 оказалась в ~2–3 раза выше на начальном этапе лечения при t = 1–2 сут и в ~1.5–2 раза выше на завершающем, t > 9–10 сут (рис. 1б). Ранозаживляющая активность глицерогидрогелевых пластин увеличивалась в ряду 60L → 40L → 60D → 40D. Следовательно, наилучшее ранозаживляющее действие проявляли пластины, полученные с использованием D-АК для растворения хитозана, а при сравнении между ними – образца полимера меньшей молекулярной массы.
По завершении эксперимента проведена оценка изменения живой массы лабораторных животных. Оказалось, что крысы экспериментальных групп статистически значимо и более активно набирали вес, чем животные контрольной группы (табл. 2). Наибольший прирост массы, как и наиболее высокая ранозаживляющая активность, наблюдались для крыс экспериментальных групп № 3 и № 5 (40 D и 60 D).
Таблица 2.
Изменение веса животных в контрольной и экспериментальных группах альбиносов крыс-самцов в процессе заживления резаной раны
| № группы | Обработка раны | Средний вес животных, г | Прирост массы при t = 18 сут, % | Среднесуточный привес, %/сут | |
|---|---|---|---|---|---|
| t = 0 сут | t = 18 сут | ||||
| 1 | – (контроль) | 175 ± 5 | 246 ± 17 | 40.6 ± 6.9 | 2.3 ± 0.3 |
| 2 | 40 L | 171 ± 6 | 282 ± 18 | 64.9 ± 7.0* | 3.6 ± 0.9* |
| 3 | 40 D | 165 ± 5 | 288 ± 20 | 74.5 ± 9.1* | 4.1 ± 0.4* |
| 4 | 60 L | 174 ± 6 | 275 ± 15 | 58.1 ± 5.2 | 3.2 ± 0.8 |
| 5 | 60 D | 173 ± 7 | 283 ± 18 | 63.6 ± 6.4* | 3.5 ± 0.9* |
Таким образом, заживление резаной раны у крыс протекало более высокими темпами на фоне применения глицерогидрогелевых пластин по сравнению с группой контроля. При этом, интенсивность регенерации резаных ран у лабораторных животных под влиянием глицерогидрогелевых пластин на основе обоих образцов D-аскорбата хитозана выше, чем на основе L-аскорбата хитозана. По-видимому, это связано со способностью макромолекул D-аскорбата хитозана вызывать более быстрое купирование воспалительных процессов в поврежденных тканях за счет альтернативной активации тканевых макрофагов и подавления продукции медиаторов воспаления (ФНОα, ИЛ-8 и др.), нежели макромолекул L-аскорбата хитозана [7, 11, 12, 33]. Кроме того, наличие в составе пластин дополнительных биологически активных компонентов сока Алоэ вера и полиолатов Si, обладающих коллагенстимулирующими, антимикробными, антиоксидантными и ангиогенными свойствами, в сочетании с хитозаном способствует увеличению пролиферативной активности фибробластов и повышению скорости эпителизации ран [19, 20].
Проведенные в настоящей работе эксперименты, а также предыдущие исследования [7, 11, 12], указывают на высокую регуляторную роль гомохиральности солевой формы хитозана в биологической функциональности получаемых материалов. Глицерогидрогелевые пластины на основе D-аскорбата хитозана были не только высокоэффективными раневыми покрытиями, но и экономически целесообразными вследствие более низкой стоимости D-изомера аскорбиновой кислоты.
Работа выполнена при финансовой поддержке Фонда содействия инновациям РФ, договор № 3161ГС1/48642 от 26.08.2019.
Благодарности: Авторы выражают благодарность Т.Г. Хониной (ГБУН ИОС им. И.Я. Постовского УрО РАН, г. Екатеринбург) за предоставленный глицеролат кремния, Г.Н. Масляковой, А.Б. Бучарской и Д.А. Мурдак (СГМУ им. В.И. Разумовского Минздрава России, г. Саратов) за предоставление экспериментальных животных и содействие в реализации исследования.
Список литературы
Moeini A., Pedram P., Makvandi P., Malinconico M., d’Ayala G.G. // Carbohydr. Polym. 2020. V. 233. P. 115839. https://doi.org/10.1016/j.carbpol.2020.115839
Шагдарова Б.Ц., Ильина А.В., Варламов В.П. // Прикл. биохимия и микробиология. 2016. Т. 52. № 2. С. 237–241.
Ильина А.В., Варламов В.П. // Прикл. биохимия и микробиология. 2015. Т. 51. № 1. С. 5–14.
de Souza Soares L., Perim R.B., de Alvarenga E.S., de Moura Guimarães L., de Carvalho Teixeira A.V.N., dos Reis Coimbra J.S., de Oliveira E.B. // Int. J. Biol. Macromol. 2019. V. 128. P. 140–148.
Park C.H., Oh J.H., Jung H.M., Choi Y., Rahman S.U., Kim S., Woo K.M. // Acta Biomater. 2017. V. 61. P. 134–143.
Cervera M.F., Heinämäki J., de la Paz N., López O., Maunu S.L., Virtanen T., Hatanpää T., Antikainen O., Nogueira A., Fundora J., Yliruusi J. // AAPS PharmSciTech. 2011. V. 12. № 2. P. 637–649.
Шиповская А.Б., Малинкина О.Н., Гегель Н.О., Зудина И.В., Луговицкая Т.Н. // Известия академии наук. Серия химическая. 2021. № 9. С. 1765–1774.
Augustine R., Dan P., Schlachet I., Rouxel D., Menu P., Sosnik A. // Int. J. Pharm. 2019. V. 559. P. 420–426.
Marciello M., Rossi S., Caramella C., Remunan-Lope C. // Carbohydr. Polym. 2017. V. 170. P. 43–51.
Tan W., Zhang J., Zhao X., Li Q., Dong F., Guo Z. // Int. J. Biol. Macromol. 2020. V. 146. P. 53–61.
Gegel N.O., Zhuravleva Yu.Yu., Shipovskaya A.B, Malinkina O.N., Zudina I.V. // Polymers. 2018. V. 10. № 3. P. 259–272.
Гегель Н.О., Зудина И.В., Малинкина О.Н., Шиповская А.Б. // Микробиология. 2018. Т. 87. № 5. С. 618–623.
Rossi S., Vigani B., Puccio A., Bonferoni M.C., Sandri G., Ferrari F. // Mar. Drugs. 2017. V. 15. № 10. P. 319. https://doi.org/10.3390/md15100319
Луньков А.П., Ильина А.В., Варламов В.П. // Прикл. биохимия и микробиология. 2018. Т. 54. № 5. С. 444–454.
Abdel-Mohsen A.M., Frankova J., Abdel-Rahman R.M., Salem A.A., Sahffie N.M., Kubena I., Jancar J. // Int. J. Pharm. 2020. V. 582. P. 119349. https://doi.org/10.1016/j.ijpharm.2020.119349
Silva S.S., Popa E.G., Gomes M.E., Cerqueira M., Marques A.P., Caridade S.G., Reis R.L. // Acta biomater. 2013. V. 9. № 6. P. 6790–6797.
Miguel S.P., Ribeiro M.P., Coutinho P., Correia I.J. // Polymers. 2017. V. 9. № 5. P. 183–207.
Retnowati D., Sari R., Hendradi E., Septiani S. // JBCPP. 2021. V. 32. № 4. P. 651–656.
Ashouri F., Beyranvand F., Boroujeni N.B., Tavafi M., Sheikhian A., Varzi A.M., Shahrokhi S. // Drug Deliv. Transl. Res. 2019. V. 9. № 6. P. 1027–1042.
Janahmadi Z., Motlagh M.R., Zaeri S. // Formos. J. Surg. 2019. V. 52. № 3. P. 84–91.
Zhang N., Gao T., Wang Y., Liu J., Zhang J., Yao R., Wu F. // Int. J. Biol. Macromol. 2020. V. 154. P. 835–843.
Rahman S., Carter P., Bhattarai N. // J. Funct. Biomater. 2017. V. 8. № 1. P. 6–9.
Radha M.H., Laxmipriya N.P. // J. Tradit. Complement. Med. 2015. V. 5. № 1. P. 21–26.
Suganya S., Venugopal J., Mary S.A., Ramakrishna S., Lakshmi B., Dev V.G. // Iran. Polym. J. 2014. V. 23. № 3. P. 237–248.
Хонина Т.Г., Чупахин О.Н., Ларионов Л.П., Бояковская Т.Г., Суворов А.Л., Шадрина Е.В. // Хим.-фарм. жур. 2008. Т. 42. № 11. С. 5–9.
Шадрина Е.В., Малинкина О.Н., Хонина Т.Г., Шиповская А.Б., Фомина В.И., Ларченко Е.Ю., Попова Н.А., Зырянова И.Г., Ларионов Л.П. // Изв. АН. Cер. химич. 2015. № 7. С. 1633–1639.
Shipovskaya A.B., Zhuravleva Yu.Yu., Khonina T.G., Malinkina O.N., Gegel N.O. // J. Sol-Gel Sci. Technol. 2019. V. 92. № 2. P. 349–358.
Malinkina O.N., Gegel N.O., Shipovskaya A.B. // J. Mol. Liq. 2019. V. 284. P. 75–81.
Пaтeнт PФ. 2020. № 2732241.
Zhuravleva Yu.Yu., Malinkina O.N., Zudina I.V., Shipovskaya A.B. // J. Phys. Conf. Ser. 2020. V. 1695. № 1. P. 012099.
Базунова М.В., Шарафутдинова Л.А., Лаздин Р.Ю., Чернова В.В., Миксонов Д.Н., Захаров В.П. // Прикл. биохимия и микробиология. 2018. Т. 54. № 5. С. 472–476.
Пaтeнт PФ. 1998. № 2102755.
Иванов П.В., Булкина Н.В., Зудина И.В., Ведяева А.П., Зюлькина Л.А. // Изв. ВУЗов. Поволжский регион. Медицинские науки. 2015. Т. 2. № 34. С. 68–74.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


