Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 195-205
Конъюгаты хитозана с оксикоричными кислотами: получение, физико-химические характеристики и оценка их влияния на продуктивность и качество редиса
А. Е. Гилевская 1, В. В. Николайчук 1, А. Н. Красковский 1, К. С. Гилевская 1, *, В. И. Куликовская 1, Ж. Н. Калацкая 2, Е. Л. Недведь 2, Н. И. Величко 2, Н. А. Ламан 2
1 Институт химии новых материалов НАН Беларуси
220141 Минск, Республика Беларусь
2 Институт экспериментальной ботаники им. В.Ф. Купревича НАН Беларуси
220072 Минск, Республика Беларусь
* E-mail: k_hilevskay@mail.ru
Поступила в редакцию 21.07.2021
После доработки 26.10.2021
Принята к публикации 02.11.2021
- EDN: LLVFWN
- DOI: 10.31857/S0555109922020064
Аннотация
Карбодиимидным методом синтезированы конъюгаты хитозана с феруловой (Хит-ФК) и кофейной (Хит-КК) кислотами. Образование конъюгатов подтверждено методами УФ- и ИК-спектроскопии. Показано, что антиоксидантная активность увеличивается в ряду Хит-КК > Хит-ФК > хитозан. Получены ультратонкие (менее 100 нм) пленки на основе синтезированных конъюгатов и методами кварцевого микровзвешивания и атомно-силовой микроскопии изучены их физико-химические характеристики. Установлено, что обработка семян редиса конъюгатами хитозана с оксикоричными кислотами способствует повышению содержания витамина С в корнеплодах и снижению количества нитратов.
Одной из эффективных технологий регуляции роста и развития, а также продуктивности растений является обработка семян. До настоящего времени самой распространенной формой обработки остается применение фунгицидов и инсектицидов для подавления семенных инфекций и уничтожения комплекса вредителей, обеспечения получения дружных и здоровых всходов в полевых условиях. Однако используемые в практике сельского хозяйства защитные препараты могут быть токсичными не только для фитопатогенных организмов, но и оказывать негативное влияние непосредственно на развивающийся проросток, являться небезопасными для животных и человека. В многочисленных исследованиях показана высокая эффективность применения природных и синтетических регуляторов роста растений для предпосевной обработки семян: инкрустирования и дражирования. Поиск и выбор экобезопасных составов для инкрустирования семян до сих пор остается важной задачей, так как компоненты должны сочетать поверхностно-активные, адгезионные, пленкообразующие и водоудерживающие свойства и способствовать однородному распределению веществ различной химической природы, не вступая в химическое взаимодействие в процессе обработки или после высева в почву.
Природный биополимер хитозан обладает широким спектром физиологической активности, проявляет антибактериальные и сорбирующие свойства, используется в составе лекарственных и профилактических средств в медицине и ветеринарии [1, 2]. В литературе также есть данные о том, что хитозан оказывает стимулирующее и защитное действие на ряд сельскохозяйственных культур (пшеницу [3], томаты [4], клубнику [5] и т.д.) [6].
Использование хитозана в составах для инкрустации семян в качестве плёнкообразователя и биологически активного вещества позволит создать экобезопасные инкрустирующие составы с улучшенными свойствами. Это, с одной стороны, приведет к значительному снижению экологической нагрузки на окружающую среду, за счет использования нетоксичных биоразлагаемых полимеров. С другой стороны, позволит получить новые препараты сельскохозяйственного назначения, которые помогут минимизировать применение синтетических регуляторов.
Повышение эффективности препаратов на основе хитозана может достигаться за счет включения в их состав физиологически активных соединений. К таким соединениям относятся оксикоричные кислоты (ОК), которые являются предшественниками большинства фенольных соединений, формирующих защитные ответные реакции у растений [7–9].
Высокой активностью в процессе прорастания семян характеризуются производные коричной кислоты – феруловая (ФК) и кофейная (КК) кислоты. Появление двух оксигрупп в молекуле коричной кислоты приводит к изменению ее активности. Так, кофейная кислота по сравнению с феруловой в большей степени ингибирует, чем стимулирует прорастание семян. Исключением было ее сильное стимулирующее действие на посевные качества семян пшеницы [7]. У производных коричной кислоты замена оксигруппы на метоксигруппу приводила к потере ингибирующей и появлению стимулирующей активности. Это хорошо видно при сравнении действия КК и ФК на прорастание семян. Оптимальное стимулирующее действие ароматические соединения проявляли при концентрации 10–6 М, а максимальное ингибирующее – 10–4 М [7]. Ранее были не только выявлены оптимальные составы пленкообразующих формуляций на основе механических смесей хитозана и оксикоричных кислот, но и показано [10], что инкрустирование семян такими составами ускоряет прорастание семян овощных культур и способствует повышению неспецифической устойчивости проростков, и в результате к развитию адаптивных реакций у растений на возможное действие стрессовых факторов различной природы.
В настоящий момент представляет интерес изучение химически конъюгированных хитозана и ОК. Модификация хитозана молекулами биологически активных веществ позволяет изменять его свойства: улучшать растворимость, повышать антибактериальную и антиоксидантную активность [11–14]. В последние годы конъюгаты хитозана все больше и больше привлекают внимание ученых, прежде всего благодаря возможности получать новые производные с улучшенными свойствами, которые могут быть использованыв самых различных областях от медицины до сельского хозяйства [14–16]. Это приводит к активному изучению и совершенствованию методик синтеза таких соединений. Одним из наиболее популярных методов синтеза конъюгатов является использование 1-этил-3-(3-диметиламинопропил) карбодиимида, который активирует карбоксильные группы, делая возможным связывание их с аминогруппами хитозана [16–18]. Простота, высокая скорость и возможность проведения реакции в водной среде способствовали быстрому и широкому распространению этого метода.
Цель работы – синтез конъюгатов хитозана с ФК и КК, получение ультратонких пленок на их основе, изучение их физико-химических характеристик, а также оценка влияния инкрустирования семян синтезированными конъюгатами на продуктивность и качество редиса.
МЕТОДИКА
Материалы. В работе использовали хитозан (Хит, M ~ 30 кДа, степень деацетилирования >90%, “Glentham Life Sciences”, Великобритания), феруловую (M = 194.18 г/моль) и кофейную (M = 180.16 г/моль) кислоты, 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (EDC), диаммонийную соль 2,2'-азинобис-3-этилбензтиазолин-6-сульфоновой кислоты (АBTS, “Sigma”, США).
Получение конъюгатов хитозана с оксикоричными кислотами. Конъюгаты хитозана с феруловой (Хит-ФК) и кофейной (Хит-КК) кислотами получали карбодиимидным методом [15].
Феруловую (или кофейную) кислоту (5 мг/мл) и EDC растворяли в диметилсульфоксиде (ДМСО). При этом EDC брали в трехкратном мольном избытке по отношению к ФК (КК). В процессе синтеза соотношение масс Хит : ФК (КК) а составляло 5 : 1. Раствор кислоты по каплям добавляли к раствору EDC и оставляли при перемешивании на магнитной мешалке в темноте на 1 ч. Далее раствор, содержащий активированную кислоту, прибавляли по каплям к раствору Хит в 0.5%-ной уксусной кислоте при постоянном перемешивании на магнитной мешалке и оставляли на 20 ч при комнатной температуре в темноте.
Синтезированные конъюгаты Хит-ФК и Хит-КК очищали диализом (целлюлозные диализные трубки, размер пор 14 кДа, Sigma D9277-100FT и D9652-100FT, “Sigma”, США) против воды в течение 1 сут. Полученные конъюгаты хранили в виде лиофилизатов, полученных на лиофильной сушке Freezone 1.0 (“Labconco”, США) при ‒47.0°С в течение 8 ч и давлении 0.04 мбар.
УФ-спектроскопия. Содержание ФК (КК) в синтезированном конъюгате определяли спектрофотометрически. Для этого снимали спектр поглощения конъюгата в области 200–400 нм и рассчитывали количество ФК и КК по предварительно построенному калибровочному графику. Калибровочный график строили в координатах: оптическая плотность (при λ = 316 нм = f(c), где с – концентрация КК. Спектры поглощения записывали на спектрофлуориметре СМ 2203 (“Solar”, Беларусь) в кварцевой кювете 1 см. Степень модификации Хит ФККК (CR, %) рассчитывали по формуле:
ИК-спектроскопия. ИК-спектры синтезированных образцов записывали в диапазоне 400–4000 см–1 на ИК-Фурье спектрометре Tensor-27 (“Bruker”, Германия).
Метод динамического светорассеивания. Измерения гидродинамического диаметра и величины ζ-потенциала конъюгатов проводили методом динамического светорассеивания и по их электрофоретической подвижности с помощью анализатора Zetasizer Nano-ZS (“Malvern”, Великобритания). Измерения проводили при комнатной температуре. Образцы предварительно разбавляли в 10 раз дистиллированной водой.
Метод кварцевого микровзвешивания. Закономерности чередующейся адсорбции конъюгатов хитозана с оксикоричными кислотами (Хит-OК) изучали с помощью метода кварцевого микровзвешивания. В работе использовали прибор QCM-D компании “Biolin Scientific” (Швеция).
Тонкие пленки получали методом послойного осаждения полиэлектролитов, в качестве поликатиона использовали конъюгат Хит-ОК, в качестве полианиона – высокометоксилированный пектин.
Измерения проводили одновременно в четырех проточных ячейках. Использовали кварцевые резонаторы с золотым напылением и рабочей частотой 5 МГц. Для снижения влияния шероховатости подложки на поверхность резонатора предварительно наносили подслой синтетических полиэлектролитов: полистиролсульфоната натрия (ПСС) и полиэтиленимина (ПЕИ). Растворы полиэлектролитов с рабочей концентрацией 1 мг/мл пропускали через ячейку со скоростью 150 мкл/мин, время адсорбции каждого слоя 10 мин, промежуточную промывку проводили соответствующим растворителем (дистиллированная вода или 0.15 М NaCl). Для расчета массы (m) адсорбированного слоя использовали уравнение Сауэрбрея: Δm = –CΔF/n,
где C – константа, зависящая от свойств кварцевого кристалла, равная 17.7 нг/см2 · Гц для 5 МГц резонатора; ΔF – изменение частоты колебаний до и после адсорбции материала, Гц; n – номер гармоники (1, 3, 5 и т.д.). При расчете толщины слоя (h) плотность покрытий принимали равной 1.1 г/см3.
Атомно-силовая микроскопия. Особенности морфологии мультислойных покрытий исследовали методом атомно-силовой микроскопии (АСМ) с помощью Nanoscope IIID (“Veeco”, США). Шероховатость поверхности (Rms) рассчитывали по формуле:
где σ – среднеквадратичное отклонение значений высоты на участке поверхности 1 × 1 мкм. Значение Rms усредняли по 10 участкам поверхности.Определение антиоксидантной активности. Антиоксидантную активность (АА) полученных материалов определяли спектрофотометрическим методом, регистрируя восстановление катион-радикала АBTS+ под действием хитозана и конъюгатов на его основе. Реакционная смесь состояла из 1 мл ABTS•+ и 100 мкл исследуемого вещества, разведенного ацетатным буфером рН 4.0.
Антирадикальную активность (АА, %) рассчитывали по формуле:
где Аk – оптическая плотность раствора ABTS•+, не содержащего исследуемое вещество; Ах – оптическая плотность реакционной смеси.Также в работе для количественной оценки ингибиторной эффективности веществ путем линейного регрессионного анализа рассчитывали значение величины ЕC50, т.е. концентрации вещества, при которой количество катион-радикала ABTS•+ снижалось в 2 раза.
Влияние конъюгатов на продуктивность и качество продукции растений редиса. Влияние обработки семян редиса конъюгатами Хит-ОК оценивали в условиях полевого опыта в оптимальных и неблагоприятных условиях выращивания. В качестве объектов исследования использовали семена редиса сорт “Жара”, которые обрабатывали конъюгатами в концентрации 10 мкМ. Семена обрабатывали путем их механического перемешивания в 1%-ном водном растворе конъюгатов хитозана с оксикоричными кислотами в объеме 140 мкл на 3 г семян до равномерного распределения раствора по поверхности семян. После обработки семена выдерживали при комнатной температуре в течение 24 ч. Контролем служили необработанные семена. Обработанные и контрольные семена перед закладкой опыта имели одинаковую исходную влажность. Растения редиса выращивали в полевых условиях на экспериментальных делянках в трех биологических повторностях. Солевой стресс создавали внесением в почву хлорида натрия из расчета 500 г соли на 2 м2. Качество получаемой продукции оценивали по содержанию нитратов [19] и витамина С [20].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Конъюгаты Хит с КК и ФК были синтезированы карбодиимидным методом. При таком способе синтеза карбоксильные группы ОК активируются при помощи 1-этил-3-(3-диметиламинопропил) карбодиимида, что делает возможным их связывание с аминогруппами хитозана.
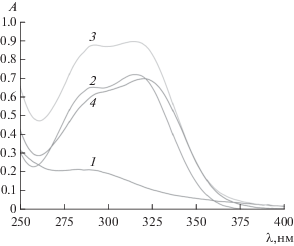
Структура конъюгатов была подтверждена методом УФ-спектроскопии. Так, в спектрах поглощения гидроксикоричных кислот присутствовали пики с максимумом при 285 и 316 нм (рис. 1, 2), спектры поглощения КК и ФК практически совпадали. Для раствора хитозана характерно незначительное поглощение в области 290 нм (рис. 1, 1). В спектрах поглощения синтезированных конъюгатов наблюдались две полосы с максимумом при 295 и 320 нм (рис. 1, 4). Для механических смесей полимера и ОК ожидаемо регистрировались полосы с максимумами, характерными для индивидуальных соединений (рис. 1, 3). Батохромный сдвиг полос поглощения конъюгатов обусловлен, вероятно, уменьшением энергии n → π* и π → π* переходов, поскольку благодаря ковалентной связи между молекулами ОК и Хит происходило формирование более длинной сопряженной системы. Эффект длинноволнового сдвига полос поглощения в УФ-спектрах в случае ковалентного связывания хитозанов с полифенольными соединениями отмечен в ряде работ [21–23]. Рассчитанная степень модификации для Хит-ФК составляла 3.6 ± 0.4%, для Хит-КК – 4.4 ± 1.3%. Массовая доля пришитых ОК равна 42.7 ± 4.8 и 48.4 ± 14.3 мкг/мг хитозана для ФК и КК соответственно. Выход конъюгатов составлял 70.0 ± 10.0 и 81.0 ± 1.0% от теоретического для Хит-ФК и Хит-КК соответственно.
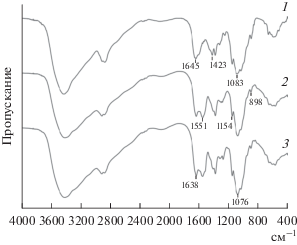
В ИК-спектрах конъюгатов Хит-КК и Хит-ФК по сравнению с исходным Хит появлялась интенсивная полоса поглощения при 1551 см–1, обусловленная деформационными колебаниями аминогруппы (амид II) вторичных амидов (рис. 2). Также в спектрах конъюгатов наблюдался сдвиг максимума полосы колебаний карбонила с 1645 до 1638 см–1 и уменьшение интенсивности частоты колебаний протонированных NH2-групп Хит при 1423 см–1. Эти изменения в ИК-спектрах свидетельствовали о формировании ковалентной связи между карбоксильной группой кислоты и аминогруппой хитозана.
Кроме того, в спектрах конъюгатов наблюдался сдвиг (∆ ~ 7 см–1) в коротковолновую область максимума полосы скелетных колебаний С–О–С-связей глюкопиранозного кольца при 1083 см–1. При этом гликозидная связь не затрагивалась: полоса ассиметричных колебаний С–О–С при 1154 см–1 не изменялась. Это подтвердило, что ковалентное связывание происходило с участием боковых аминогрупп кольца полимера, что, вероятно, приводило и к изменению его конформации. Так, в ИК-спектре конъюгатов по сравнению с исходным Хит наблюдался сдвиг (∆ ~ 3 см–1) в длинноволновую область максимума полосы при 895 см–1, которая обусловлена колебаниями глюкопиранозного кольца. Это согласуется с данными, полученными методом динамического светорассеяния: введение ОК в структуру Хит приводило к конформационным изменениям полимера за счет формирования новых межмолекулярных взаимодействий с гидрофобным фрагментами ОК.
Макромолекулы исходного хитозана заряжены положительно, значение ξ-потенциала составляет 28.2 ± 0.1 мВ. Заряд поверхности обусловлен протонированными аминогруппами полимера. Гидродинамический диаметр молекулы Хит при оценке методом динамического рассеяния света, равен 66.4 ± 14.2 нм. Гидродинамический диаметр конъюгатов Хит-ОК по сравнению с исходным полимером увеличивался в 6–8 раз, а значение дзета-потенциала – в 1.3 раза и составляло ~40 мВ (табл. 1). Столь существенное различие значения DH обусловлено гидрофобностью фенольных соединений и их низкой растворимостью в водных растворах, поэтому введение ОК в структуру полимера может приводить к изменению конформации его макромолекул и разрыхлению полимерного клубка. При сравнении значений DH конъюгатов Хит-ОК существенного различия не наблюдалось. Энергия сольватации ФК в воде на порядок выше по сравнению с КК [24], однако молекулы имеют сопоставимую гидрофобность. Так, согласно данным авторов [24] площадь гидрофобного фрагмента по отношению ко всей молекуле составляет 55 и 62% для КК и ФК соответственно. Также при проведении компьютерного моделирования взаимодействия ОК с Хит показано [24], что в случае молекул КК и ФК связывание с полимером протекает по одинаковым участкам и молекулы претерпевают сходные конформационные изменения. Эти изменения приводят к росту электрокинетического потенциала конъюгатов по сравнению с исходным полимером, что указывает на увеличение агрегативной стабильности хитозана, модифицированного ОК. Таким образом, в результате конъюгирования Хит с КК и ФК происходило изменение конформации полимерной цепи полисахарида и формирование новой системы водородных связей, что приводило к увеличению гидродинамического диаметра и электрокинетического потенциала Хит.
Таблица 1.
Характеристики синтезированных конъюгатов и исходного Хит
| Образец | ξ-потенциал, мВ | PdI | DH, нм |
|---|---|---|---|
| Хит-ФК | 40.0 ± 1.8 | 0.7 ± 0.3 | 394.4 ± 100.9 |
| Хит-КК | 39.0 ± 0.4 | 0.7 ± 0.2 | 515.2 ± 105.3 |
| Хит | 28.2 ± 0.1 | 0.5 ± 0.0 | 66.4 ± 14.2 |
Для оценки антиоксидантной активности в качестве характерного показателя использовали степень восстановления катион-радикала ABTS•+ за определенный временной интервал. Значение показателя отражает долю, на которую снижается концентрация свободных радикалов в системе под действием антиоксиданта. Для КК и ФК значения величины EC50 составляли 19.4 и 11.9 мкг/мл соответственно. Эти значения согласуются с теоретическими расчетами по АА, приведенными в литературе. Tак, рассчитанный авторами [25, 26] потенциал ионизации (отражающий восстановительную активность соединения – его способность легко отдавать электрон) для ФК несколько выше, чем для КК. Кроме того, экспериментальные данные тех же авторов позволили установить, что наличие двух гидроксильных групп в м- и п-положениях КК значительно понижает ЕC50 по сравнению с кумаровыми кислотами, имеющими всего одну гидроксогруппу. В то время как для ФК, которая имеет одну гидроксильную и одну метоксильную группу, авторы регистрировали большую АА (степень ингибирования ABTS+ радикала) по сравнению с КК [25, 27]. В то же время при оценке АА методом циклической вольтамперометрии авторы установили, что меньший потенциал анодного пика, а значит и способность быстрее отдавать электрон, характерна для КК 265 мВ, по сравнению с феруловой (470 мВ) [13]. Однако стоит учитывать, что в настоящей работе измерения АА проводились при рН 4.0, и в таких условиях происходит протонирование гидроксилов и карбонилов ОК, уменьшение отрицательного заряда молекулы, что усложняет отрыв электрона от молекулы и, в конечном счете, приводит к уменьшению антирадикальной активности антиоксиданта. С учетом строения используемых в работе ОК снижение рН оказывало большее влияние на АА КК (две –OH группы и одна COOH) по сравнению с ФК (один карбоксил и одна гидроксигруппа).
Для Хит характерны незначительные значения АА по сравнению с оксикоричными кислотами, которые можно отнести к классическим антиоксидантам. Степень ингибирования ABTS+-радикала Хит не превышала 5% и практически не изменялась в диапазоне концентраций от 0.1 до 0.6 мг/мл.
Конъюгаты Хит-ОК проявляли гораздо более сильную антиоксидантную активность, чем исходный Хит (рис. 3). При восстановлении катион-радикалов конъюгатами наблюдалась концентрационная зависимость: с увеличением концентрации действующего вещества от 0.1 до 0.6 мг/мл степень ингибирования радикала линейно возрастала в среднем от 20 до 90% и существенно не зависела от типа конъюгата. Значение величины EC50 для конъюгата с КК составляло 276 мкг/мл, а с ФК – 288 мкг/мл. Эти значения на порядок выше по сравнению с исходными оксикоричными кислотами. С учетом степени модификации и в пересчете на массу КК или ФК в конъюгате, становится очевидным, что основной вклад в АА конъюгатов вносят химически пришитые к полимеру фрагменты ОК. Причем антирадикальная активность ФК в составе конъюгата близка к 100% по сравнению с исходной. В то время как для КК наблюдалось повышение активности в среднем на 30%. В основе механизма реакции ингибирования ABTS•+ лежит перенос электронов (ЕТ процесс) от гидроксилов и карбоксилов ОК. После конъюгирования COOH-группы кислоты ковалентно связаны с NH2-группами хитозана и вклад в АА конъюгатов вносят лишь гидроксилы кольца ОК. При этом согласно авторам [24] гидроксилы пирокатехинового кольца КК связаны водородными взаимодействиями с гидроксилами и кислородом хитозана. В то время как фенольный гидроксил ФК не вовлечен в образование водородных или полярных связей с хитозаном. Возможно, именно этим можно объяснить повышение антирадикальной активности КК в составе конъюгата. Таким образом, ингибирующий эффект уменьшался в ряду Хит-КК > Хит-ФК > Хит. Подобный эффект увеличения АА конъюгатов по сравнению с немодифицированным хитозаном наблюдался в работах [21, 28, 29].
Для оценки потенциала практического применения синтезированных конъюгатов, в том числе и для различных типов обработки семян растений, были изучены их пленкообразующие свойства. Для этого использовали метод кварцевого микровзвешивания, который позволял in situ изучать закономерности адсорбции веществ на планарной поверхности. Адсорбцию конъюгатов Хит-ФК и Хит-КК проводили из воды и солевого раствора (физиологический раствор хлорида натрия). В качестве отрицательно заряженного полианиона использовали полисахарид пектин. При чередующейся адсорбции конъюгата Хит-ОК и пектина из их водных растворов наблюдался линейный рост (y = 10.607x и y = 14.905x для Хит-КК и Хит-ФК соответственно) массы пленки вплоть до 10 бислоев (рис. 4, 1, 2): величина достоверности апроксимации (R2) экспериментальных данных линейной функцией составляет 0.99 и 0.98 для Хит-КК и Хит-ФК соответственно). При адсорбции компонентов из 0.15 М растворов NaCl масса покрытия возрастала экспоненциально (рис. 4, 3, 4). В этом случае зависимость частоты колебаний резонатора от числа адсорбированных бислоев описывалась уравнением:
Рис. 4.
Изменение частоты колебаний кварцевого резонатора при чередующейся адсорбции конъюгатов Хит-ОК и пектина на его поверхности из водных (1, 2) и 0.15 М NaCl (3, 4) растворов: 1 – Хит КК (Н2O); 2 – Хит ФК (Н2O); 3 – Хит-ФК (NaCl); 4 – Хит КК (NaCl). Сплошные линии – экспериментальные данные, пунктирные – апроксимированные.
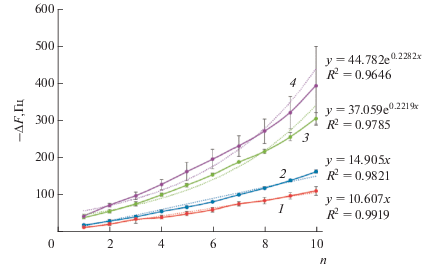
Таблица 2.
Характеристики биополимерных покрытий на основе конъюгатов Хит-ОК/пектин
| Параметр | Тип покрытия | |
|---|---|---|
| (Хит-ФК/пектин)10 | (Хит-КК/пектин)10 | |
| Вода | ||
| µ, МПа | 1.0 ± 0.3 | 0.9 ± 0.2 |
| h*, нм | 25.9 ± 0.7 | 23.8 ± 1.9 |
| m, мкг/см2 | 2.9 ± 0.1 | 2.6 ± 0.2 |
| 0.15 М NaCl | ||
| µ, МПа | 1.3 ± 0.3 | 1.3 ± 0.1 |
| h*, нм | 48.1 ± 1.4 | 60.7 ± 0.1 |
| m, мкг/см2 | 5.3 ± 0.2 | 6.7 ± 1.3 |
где ƒ1 и ƒ2 – кинетические масштабные коэффициенты роста пленки и они обычно равны, а β – характеристический параметр силы экспоненциального роста. Значение β близкие к 0 указывают на линейный рост массы пленки, чем выше значение β, тем интенсивнее экспоненциальный рост массы пленки [30]. Пленки адсорбированные из солевых растворов характеризовались слабым экспоненциальным ростом: параметр β составлял 0.22 и 0.23 для (Хит-ФК/пектин)n и (Хит-КК/пектин)n соответственно. Таким образом, характер зависимости ΔF от n не зависел от типа конъюгата Хит-ОК, а определялся главным образом ионной силой раствора. Характеристики мультислойных пленок (Хит-ОК/пектин)n приведены в табл. 2. Толщина мультислойных покрытий (Хит-ОК/ пектин)10, сформированных в водных растворах, не превышала 26 нм, в солевых растворах – 61 нм (табл. 2). Толщина бислоя формируемых из водных растворов покрытий составляла 2.6 ± 0.1 и 2.4 ± 0.2 нм для Хит-ФК/пектин и Хит-КК/пектин, в солевых растворах– 4.8 ± 0.1 нм и 6.1 ± 0.1 нм соответственно. Рассчитанное значение величины модуля сдвига (µ) для биополимерных покрытий на основе конъюгатов хитозана находилось в диапазоне 0.9–1.3 МПа (табл. 2).
Для мультислойных покрытий $({\text{Хит - ФК/}}$ ${\text{пектин}}{{)}_{{n{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ характерна однородная мелкозернистая поверхность (рис. 5а). С увеличением числа слоев от 1 до 10 существенного изменения структуры поверхности пленки не наблюдалось. На поверхности присутствовали аморфные округлые образования (“зерна”). Латеральный размер “зерна” для бислойной системы равен ~20–50 нм. С увеличением числа бислоев до 4 диаметр “зерна” незначительно увеличивался и составлял ~30–60 и 40–60 нм для поверхности покрытий (Хит-ФК/пектин)4 и (Хит-ФК/пектин)10 соответственно (рис. 5а).
Рис. 5.
АСМ-изображения морфологии поверхности пленок (Хит-ФК/пектин)n, полученных чередующейся адсорбцией компонентов из водных растворов (а) и 0.15 М растворов NaCl (б).

Пленки (Хит-ФК/пектин)n, сформированные из 0.15 M NaCl были неоднородными, на их поверхности наблюдали агрегаты неправильной формы (рис. 5б). Следует отметить, что с увеличением числа слоев количество агрегатов уменьшалось, а размер “зерна” увеличивался от 40–60 до 90–100 нм (рис. 5б).
Морфология поверхности покрытий на основе пленок (Хит-КК/пектин)n, сформированных из воды, сходна с пленками (Хит-ФК/пектин)n. Поверхность пленок бездефектная однородная, хорошо структурированная (рис. 6а). Размер “зерна” составлял 40–50 нм и не зависел от числа слоев покрытия. В случае адсорбции компонентов из солевых растворов с увеличением числа слоёв (Хит-КК/пектин) на поверхности пленок наблюдалось формирование доменов неправильной формы с размером до ~500 нм (рис. 6б), что могло быть связано с конформационными изменениями молекулы Хит-КК в 0.15 M NaCl и/или формированием объемных аморфных комплексов Хит-КК/пектин. Сходную морфологию имели мультислойные пленки на основе немодифицированного хитозана (рис. 7).
Рис. 6.
АСМ-изображения морфологии поверхности пленок (Хит-КК/пектин)n, полученных чередующейся адсорбцией компонентов из водных растворов (а) и 0.15 М растворов NaCl (б).

Рис. 7.
АСМ-изображения морфологии поверхности пленок (Хит/пектин)10, полученных чередующейся адсорбцией компонентов из водных растворов (а) и 0.15 М растворов NaCl (б).

Полученные данные согласуются с данными литературы. Так, ранее было показано [30], что при чередующейся адсорбции высокомолекулярного хитозана и пектина в водных растворах наблюдался линейный рост толщины пленки, а сформированные многослойные покрытия (хитозан/пектин)10 имели гладкую однородную бездефектную поверхность.
Образование аморфных агрегатов на поверхности пленок при адсорбции компонентов из солевых растворов связано с экранированием заряда протонированных аминогрупп хитозана и карбоксильных групп пектина низкомолекулярным электролитом, что приводило к снижению электростатического отталкивания полимерных цепей в растворе и переходом макромолекул полииона в “свернутое” конформационное состояние. Это обуславливает уменьшение количества контактов макромолекул и поверхности, в результате чего при адсорбции происходило формирование рыхлого слоя за счет образования полимерными цепями так называемых “петель” и “хвостов”. При адсорбции последующих слоев полиионов формируются покрытия с развитой удельной поверхностью, в том числе за счет образования объемных полиэлектролитных комплексов (жидких коацерватов) [31]. Менее выражен этот эффект на поверхности пленок (Хит-ФК/пектин)10 по сравнению с морфологией покрытий (Хит/пектин)10 и (Хит-КК/пектин)10. Это можно объяснить большей гидрофильностью конъюгата Хит-ФК и, как следствие, лучшей его растворимостью в водных растворах по сравнению с исходным Хит и Хит-КК. Так, согласно работе [28] конъюгаты Хит с ФК имели лучшую растворимость по сравнению с исходным Хит, а в работе [32] показали, что под влиянием соли в растворе макромолекулы синтетических полиэлектролитов претерпевают конформационные изменения, что приводило к формированию покрытий с высоким значением Rms и экспоненциальным ростом толщины.
Значения шероховатости поверхности для всех покрытий (Хит-ОК/пектин)n не превышали 6 нм (табл. 3). Наблюдалось относительное сглаживание поверхности 4-бислойных пленок. Так, для всех типов пленок (Хит-ОК/пектин)n за исключением (Хит-КК/пектин)NaCl в ряду n = 1, n = 4, n = 10 минимальное значение Rms характерно для 4-бислойных пленок (табл. 3). Увеличение ионной силы раствора приводило к формированию пленок с большей шероховатостью по сравнению покрытиями, сформированными из водных растворов. Причем наибольший эффект характерен для покрытий на основе немодифицированного хитозана. Вероятно, это связано с увеличением локального электростатического заряда макромолекулы хитозана после его химической модификации, усилению отталкивания одноименно заряженных групп и адсорбции макромолекул на поверхности в вытянутой конформации, что уменьшает степень шероховатости поверхности. Это согласуется с данными, полученными методом динамического светорассеивания и кварцевого микровзвешивания.
Таблица 3.
Шероховатость поверхности биополимерных покрытий на основе Хит, конъюгатов Хит-ОК и пектина
| Тип покрытия | Растворитель | n = 1 | n = 4 | n = 10 |
|---|---|---|---|---|
| (Хит/пектин)n | H2O | – | – | 3.2 ± 0.8 |
| 0.15 М NaCl | – | – | 11.8 ± 4.3 | |
| (Хит-ФК/пектин)n | H2O | 4.8 ± 0.5 | 4.3 ± 0.2 | 4.5 ± 0.8 |
| 0.15 М NaCl | 3.0 ± 0.9 | 2.1 ± 0.5 | 5.5 ± 0.2 | |
| (Хит-КК/пектин)n | H2O | 2.7 ± 0.3 | 1.7 ± 0.2 | 4.2 ± 1.3 |
| 0.15 М NaCl | 2.9 ± 0.9 | 3.5 ± 0.6 | 5.3 ± 0.4 |
Таким образом, полученные тонкие пленки на основе конъюгатов Хит-ОК имели свойства (шероховатость, модуль сдвига, толщина), сопоставимые с мультислойными пленками на основе синтетических полиэлектролитов [33 ] . Пленкообразующие свойства конъюгатов Хит-ОК зависят в большей степени от ионной силы раствора (присутствия низкомолекулярного электролита), чем от типа химически пришитой кислоты (ФК или КК). С учетом высокой антиоксидантной активности синтезированных конъюгатов полученные ультратонкие покрытия на их основе имеют потенциал использования в качестве защитных пленок для продуктов питания, а также для модификации изделий биомедицинского применения.
В дальнейшем изучали влияние обработки семян конъюгатами на продуктивность и качество продукции растений редиса, выращенных в условиях полевого мелкоделяночного опыта в оптимальных и неблагоприятных условиях роста. Визуальная оценка полученного урожая в оптимальных условиях роста растений показала, что при обработке семян редиса конъюгатами большая часть корнеплодов имела ровную и округлую форму с меньшим количеством повреждений, наблюдалось увеличение количества нестандартных крупных плодов (рис. 8). В стрессовых условиях выращивания растений отмечали изменение корнеплодов с округлой формы на более удлиненно-эллиптическую, в урожае редиса повышалось количество мелких корнеплодов. При обработке конъюгатами в стрессовых условиях в урожае сохранялось повышенное количество нестандартных крупных плодов, также заметно увеличивалась длина хвостовой части относительно стрессового контроля (рис. 8). Таким образом, в стрессовых условиях выращивания корневая система у растений редиса удлинялась в контрольном и опытных вариантах, что свидетельствует об адаптивной реакции растений. В вариантах обработки конъюгатами увеличение длины хвостовой части корнеплода относительно стрессового контроля может указывать на более эффективную адаптацию к засолению.
Рис. 8.
Внешний вид корнеплодов редиса из семян, обработанных конъюгатами Хит-ОК (б) и без обработки (а) выращенных в полевых условиях.

При обработке семян конъюгатами Хит-ФК и Хит-КК отмечали повышение содержания витамина С в корнеплодах редиса в среднем в 1.5 раза относительно контроля в оптимальных условиях выращивания (рис. 9а). При действии стрессового фактора в контроле возрастал уровень витамина С (на 50% относительно оптимальных условий) и достигал уровня в корнеплодах из обработанных конъюгатами семян. Воздействие солевого стресса не приводило к изменению содержания витамина С в корнеплодах редиса в вариантах обработки конъюгатами (рис. 9а).
Рис. 9.
Содержание витамина С (а, мг/100 г сырой массы) и нитрат-ионов (б, мг/100 г сырой массы) в корнеплодах редиса, выращенных из семян, обработанных конъюгатами Хит-ОК, в оптимальных (1) и стрессовых (2) условиях (a – различия достоверны относительно оптимального контроля, б – различия достоверны относительно стрессового контроля).
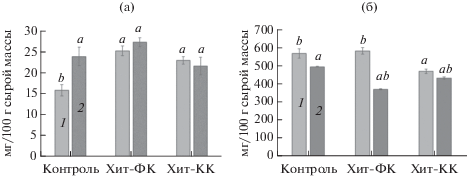
Содержание нитрат-ионов в корнеплодах редиса, полученных в оптимальных условиях роста, снижалось на 17% в варианте Хит-КК относительно контроля (рис. 9б). В неблагоприятных условиях выращивания отмечалась тенденция к снижению нитрат-ионов относительно оптимальных условий во всех вариантах. При обработке Хит-ФК снижение нитратов было наиболее существенным – на 37% относительно оптимальных условий и на 25% относительно стрессового контроля (рис. 9б).
Химическая модификация Хит-ОК позволила значительно увеличить его антиоксидантную активность. Ковалентное связывание ФК и КК с хитозаном не снижало их антирадикальную активность. Синтезированные конъюгаты пригодны для формирования ультратонких (менее 100 нм) моно- и мультислойных покрытий. Характеристики (морфология, шероховатость, масса, толщина, модуль сдвига) LbL-пленок на основе конъюгатов Хит-КК и Хит-ФК зависели, главным образом, от природы исходного полимера. При этом химическая модификация Хит приводила к увеличению ξ-потенциала молекулы полимера, что позволило стабилизировать его в растворах низкомолекулярного электролита. Формируемые ультратонкие пленки конъюгатов Хит-ОК и пектина были эластичными и имели модуль сдвига равный 0.9–1.3 МПа. Обработка семян редиса конъюгатами не оказала значительного влияния на продуктивность корнеплодов в полевых условиях. Однако применение конъюгатов Хит-ОК имело положительный воздействие на качество получаемой продукции, что выражалось в повышении содержания витамина С в корнеплодах и снижении количества нитратов.
Работа выполнена при финансовой поддержке Белорусского республиканского фонда фундаментальных исследований (договор №Б21УЗБГ-019/01).
Список литературы
Маркушин С.Г., Акопова И.И., Благодатских И.В., Куликов С.Н., Безродных Е.А., Муранов А.В., Ямсков И.А., Тихонов В.Е. // Прикл. биохимия и микробиология. 2018. Т. 54. № 5. С. 513–519.
Албулов А.И., Фролова М.А., Гринь А.В., Ковалёва Э.И., Мельник Н.В., Красочко П.А. // Прикл. биохимия и микробиология. 2018. Т. 54. № 5. С. 520–524.
Popova E.V., Kovalenko N.M., Sokornova S.V., Tyuterev S.L., Domnina N.S. // Appl. Biochem. Microbiol. 2018. V. 54. № 5. P. 535–539.
El Amerany F., Meddich A., Wahbi S., Porzel A., Taourirte M., Rhazi M., Hause B. // Int. J. Mol. Sci. 2020. V. 21. № 2. P. 535. https://doi.org/10.3390/ijms21020535
Rahman M., Mukta J.A., Sabir A.A., Gupta D.R., Mohi-Ud-Din M., Hasanuzzaman M., Miah Md.G., Rahman M., Islam Md.T. // PLoS ONE. 2018. V. 13. № 9. P. e0203769. https://doi.org/10.1371/journal.pone.0203769
Sharif R., Mujtaba M., Ur Rahman M., Shalmani A., Ahmad H., Anwar T., Tianchan D., Wang X. // Molecules. 2018. V. 23. № 4. P. 872.https://doi.org/10.3390/molecules23040872
Волынец А.П. Фенольные соединения в жизнедеяельности растений. / Ред. А.П. Волынец. Минск: Беларуская навука, 2013. 283 с.
Тютерев С.Л. Природные и синтетические индукторы устойчивости растений к болезням. / Ред. С.Л. Тютерев. Санкт-Петербург: ВИЗР, 2014. 212 с. ISBN 978-5-91844-042-1
Соколов Ю.А. Элиситоры и их применение в растениеводстве. / Ред. Ю.А. Соколов. Минск: Беларуская навука, 2016. 201 с.
Недведь Е.Л., Калацкая Ж.Н., Минкова В.В., Овчинников И.А., Гилевская К.С., Куликовская В.И., Красковский А.Н., Ламан Н.А. // Ботаника (исследования): Сборник научных трудов. 2020. № 49. С. 300–307.
Il’ina A.V., Varlamov V.P. // Appl. Biochem. Microbiol. 2016. V. 52. № 1. P. 1–14.
Alexandrova V.A., Domnina N.S., Snigireva G.P. // Appl. Biochem. Microbiol. 2016. V. 52. № 5. P. 491–495.
Yakovleva K.E., Kurzeev S.A., Stepanova E.V., Fedorova T.V., Kuznetsov B.A., Koroleva O.V. // Appl. Biochem. Microbiol. 2007. V. 43. № 6. P. 661–668.
Cho Y.-S., Kim S.-K., Ahn C.-B., Je J.-Y. // Carbohydr. Polym. 2011. V. 83. № 4. P. 1617–1622.
Kraskouski A., Nikalaichuk V., Kulikouskaya V., Hileuskaya K., Kalatskaja J., Nedved H., Laman N., Agabekov V. // Soft Materials. 2021. https://doi.org/10.1080/1539445X.2021.1877726
Schreiber S.B., Bozell J.J., Hayes D.G., Zivanovic S. // Food Hydrocolloids. 2013. V. 33. № 2. P. 207–214.
Hu Q., Luo Y. // Carbohydr. Polym. 2016. V. 151. P. 624–639.
Pasanphan W., Chirachanchai S. // Carbohydr. Polym. 2008. V. 72. № 1. P. 169–177.
Методические указания по определению нитратов и нитритов в продукции растениеводства. МУ 5048-89. М., 1989. 24 с.
Liu J., Wen X., Lu J., Kan J., Jin C. // Int. J. Biol. Macromol. 2014. V. 65. P. 97–106.
Liu J., Lu J., Kan J., Tang Y., Jin C. // Int. J. Biol. Macromol. 2013. V. 62. P. 85–93.
Zheng M., Zhang C., Zhou Y., Lu Z., Zhao H., Bie X., Lu F. // Frontiers in Microbiology. 2018. V. 9. Article 1729. https://doi.org/10.3389/fmicb.2018.01729
Delmondes P., Stefani R. // International Conference on Multidisciplinary Sciences (MOL2NET). 2016. 2. https://doi.org/10.3390/mol2net-02-03862
Машенцева А.А., Сейтембетов Т.С. // J. Siberian Federal University. Chemistry 2. 2010. № 3. P. 183–192.
Каримов О.Х., Колчина Г.Ю., Тептерева Г.А., Четвертнева И.А., Каримов Э.Х. // НефтеГазоХимия. 2020. № 2. С. 22–26.
Maurya D.K., Devasagayam T.P.A. // Food and Chemical Toxicology. 2010. V. 48. № 12. P. 3369–3373.
Woranuch S., Yoksan R. // Carbohydr. Polym. 2013. V. 96. № 2. P. 495–502.
Liu J., Pu H., Chen C., Liu Y., Bai R., Kan J., Jin C. // J. Agric. Food Chem. 2017. V. 66. № 1. P. 279–289.
Kulikouskaya V.I., Pinchuk S.V., Hileuskaya K.S., Kraskouski A.N., Vasilevich I.B., Matievski K.A., Agabekov V.E., Volotovski I.D. // J Biomed. Mater. Res. A. 2018. V. 106. № 8. P. 2093–2104.
Tang K., Besseling N.A.M. // Soft Matter. 2016. V. 12. № 4. P. 1032–1040.
Voigt U., Jaeger W., Findenegg G.H., Klitzing R. // J. Phys. Chem. B. 2003. V. 107. № 22. P. 5273–5280.
Gribova V., Auzely-Velty R., Picart C. // Chem. Mater. 2012. V. 24. № 5. P. 854–869.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология