Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 172-178
Противоспаечный эффект материалов на основе карбоксиметилхитозана и карбоксиметилцеллюлозы
М. В. Коновалова 1, *, Д. С. Царегородцева 1, А. Н. Венжик 2, Р. А. Полтавцева 3, Е. В. Свирщевская 1, 3
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
2 АО “Медтехнопроект”
121205 Москва, Россия
3 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова Министерства здравоохранения РФ
117997 Москва, Россия
* E-mail: mariya.v.konovalova@gmail.com
Поступила в редакцию 29.07.2021
После доработки 25.10.2021
Принята к публикации 05.11.2021
- EDN: NGJEEG
- DOI: 10.31857/S0555109922020118
Аннотация
В данной работе была оптимизирована модель спайкообразования на мышах. Показано, что значимые различия по уровню спайкообразования между линиями мышей (CD1, CBA, BALB/c, C57BL/6) отсутствовали, а спайка формировалась уже через 24 ч после операции и сохранялась в течение длительного времени. Проведен сравнительный анализ эффективности материалов на основе карбоксиметилхитозана (КМХ) и карбоксиметлицеллюлозы (КМЦ) в оптимизированной модели спайкообразования на мышах. Выявлено, что максимальной противоспаечной эффективностью обладали препараты медицинского КМХ (мКМХ) – 85% и модифицированной полиэтиленгликольдиглицидиловым эфиром КМЦ (мКМЦ) – 87%.
Формирование спаек является одним из самых частых осложнений после абдоминальных операций и операций на органах малого таза. Спайки могут вызвать непроходимость тонкого кишечника, хронические боли в животе, женское бесплодие и осложнения при повторных операциях [1]. Спайка состоит из соединительной ткани, фибрина и коллагена и формируется между двумя травмированными поверхностями. В формировании внутрибрюшинной спайки принимают участие клетки перитонеального экссудата, мезотелиального слоя брюшины, эпителия поврежденного органа и эндотелиальные клетки сосудов. Нарушение целостности органа приводит к каскаду событий, которые при сбалансированных процессах заживления приводят к восстановлению органов и тканей, а при нарушении баланса – к формированию спаек [2]. Из-за отсутствия надeжных прогностических моделей на животных и сложности патогенеза формирования спаек, до сих пор не существует противоспаечного материала, терапевтический эффект которого достигал бы 100% [3]. Для анализа эффекта противоспаечных материалов в модельных системах важно, чтобы в контрольной группе был высокий процент образования спаек. При выборе модели спайкообразования следует учитывать воспроизводимость результатов операции [4–6], стоимость животных, простоту в обращении и возможность проведения операций в нестерильных условиях [7]. В мировой практике используются несколько различных стандартизированных методов формирования спаечного процесса: травмирование брюшной стенки и маточных труб, повреждение исключительно брюшной стенки [8], удаление части брюшной стенки с последующим закрытием образовавшегося дефекта брюшины викриловым швом [9], применение ишемических кнопок при захвате брюшной стенки и фиксирование основания кнопки с помощью викрилового шва [10, 11], биполярная электрокоагуляция брюшины путём подачи электрического тока через брюшину, травматизация электрокоагуляцией с последующим закрытием образовавшегося дефекта брюшины с использованием викрилового шва [7]. Наиболее часто используется модель механического истирания слепой кишки и брюшной стенки на различных линиях мышей. При этом оценку спайкообразования проводят через разные промежутки времени. Однако обоснование выбора конкретной линии животных и времени, по истечении которого оценивается наличие спаек, отсутствует.
В настоящее время активно разрабатываются и внедряются в клиническую практику биоматериалы для предотвращения формирования спаек [12]. Природные полисахариды, в том числе хитозан и его производные, гиалуроновая кислота (ГК), коллаген, карбоксиметлицеллюлоза (КМЦ), пектин хорошо изучены и используются в медицине, благодаря их биосовместимости, биоразлагаемости, низкой токсичности, а также некоторым другим специфическим биологическим свойствам [13].
Среди многообразия предлагаемых методов профилактики перитонеальных спаек наиболее высокий профилактический эффект дают средства для разобщения раневых поверхностей – физические барьеры.
Одним из решающих факторов при выборе противоспаечных материалов является скорость его биодеградации. Для достижения наилучшего эффекта предотвращения спайкообразования скорость разложения биополимерных материалов должна быть достаточна для достижения клинического эффекта, после чего экзогенный материал должен быть элиминирован. Однозначного понимания, насколько быстро достигается терапевтический эффект противоспаечных материалов, на настоящий момент нет. Так, немодифицированная ГК разлагается в течение недели под действием фермента гиалуронидазы, в норме присутствующего в организме млекопитающих. Считается, что низкий противоспаечный эффект ГК – результат ее быстрой деградации [14].
Биоадгезивная способность биоматериалов к тканям является ещe одним важным фактором для предотвращения спаечного процесса. Материалы на основе биополимеров, обладающие способностью к сцеплению с тканями, могут покрывать поврежденную область и отделять агрегированный фибрин, тем самым снижая уровень спайкообразования. ГК и коммерческий препарат на основе окисленной регенерированной целлюлозы (Interceed, “Ethicon Sarl”, Швейцария) обладают этой способностью в наименьшей степени, в отличие от материалов на основе хитозана и декстрана [15].
Кровотечение, которое появляется в процессе операции, также способствует формированию спаек [16]. Соответственно, хорошо, если противоспаечные материала обладают ещe и гемостатической функцией для более эффективной профилактики спайкообразования.
Одним из полимеров, который соответствует предъявляемым требованиям наиболее полно, является катионный полисахарид хитозан и его производные. Хитозан как в виде раствора, так и в твердой форме обладает гемостатическим эффектом [17], способствует ранозаживлению и восстановлению мезотелиальных клеток [18], ингибирует рост фибробластов и снижает синтез волокон коллагена [19]. Среди производных хитозана широко используется N,O-карбоксиметилхитозан (КМХ). Он ингибирует перитонеальные спайки в маточных трубах крыс и на модели небольших рваных ран кишечника [20]. КМХ заметно уменьшает фиброз и образование спаек в кардиохирургии у животных без побочных эффектов [21].
Наиболее часто в качестве противоспаечного материала используется растворимое в воде производное целлюлозы – КМЦ. Большинство противоспаечных материалов на основе КМЦ используются в виде гидрогеля или пленки. Считается, что КМЦ эффективно предотвращает спайки за счет увеличения времени биодеградации полимера в организме человека по сравнению с коллагеном и ГК, так как отсутствуют ферменты, которые могут расщеплять целлюлозу [22, 23].
Противоспаечные свойства различных биоматериалов ранее оценивались в моделях спайкообразования на мышах и крысах, однако сравнительного исследования их эффективности на одной оптимизированной модели не проводилось.
Цель работы – сравнительный анализ эффективности материалов на основе КМХ и КМЦ в оптимизированной модели спайкообразования на мышах.
МЕТОДИКА
В работе использовали немодифицированный хитозан с молекулярной массой (ММ) 200 кДа и степенью деацетилирования 95% и материалы на основе КМХ и КМЦ (представлены в табл. 1).
Таблица 1.
Использованные в исследовании противоспаечные биоматериалы Фирмы дать в кавычках
| № | n* | Биополимеры | Обозначение | Характеристика, производитель |
|---|---|---|---|---|
| Поликатион | ||||
| 1 | 5 | Хитозан | Хитозан | ММ 200 кДа, СД 95%, (ООО “Биопрогресс”, Россия) |
| Полианионы | ||||
| Карбоксиметилхитозан | ||||
| 2 | 7 | Карбоксиметил-хитозан | NaChitin | Гель NaChitin, (“Yantai Wanli Medical Equipment Co., Ltd.”,, Китай) |
| 3 | 29 | Карбоксиметил-хитозан | КМХ1179 | 76 mPa s, (“Heppe GmbH”, Германия) |
| 4 | 7 | Карбоксиметил-хитозан | КМХ1249 | 11 mPa s, (“Heppe GmbH”, Германия) |
| 5 | 10 | Модифицированный хитозан | мКМХ | Гель медицинский, (“Shuyining”, Китай) |
| Карбоксиметилцеллюлоза | ||||
| 6 | 15 | Карбоксиметил-целлюлоза | КМЦ3275 | 10000 mPa s, (“ProFood”, Россия) |
| 7 | 6 | Карбоксиметил-целлюлоза | КМЦ2895 | 6000 mPa s, (“ProFood”, Россия) |
| 8 | 20 | Карбоксиметил-целлюлоза | Мезогель | Мезогель, (ООО “Линтекс”, Россия) |
| 9 | 8 | Карбоксиметил-целлюлоза | Марля | Гемостатическая марля, (“Yantai Wanli Medical Equipment Co., Ltd.”, Китай) |
| 10 | 33 | Карбоксиметил-целлюлоза | мКМЦ | КМЦ, модифицированная ПЭГДЭ, (АО “Медтехнопроект”, Россия) |
Для получения модифицированной КМЦ использовали раствор КМЦ марки Cekol 2000 (“CP Kelco”, США), в качестве сшивающего агента – полиэтиленгликоль диглицидиловый эфир (ПЭГДЭ) (“Sigma-Aldrich”, США).
Получение модифицированной КМЦ. Для изготовления сшитого геля 2 г КМЦ растворяли в 25 мл 1%-ного раствора NaOH, добавляли 0.28 г ПЭГДЭ и перемешивали в течение 12 ч при 25°C. Полученный гель нейтрализовали раствором HCl до нейтрального значения pH и диализовали в физрастворе в течение 24 ч с 4-кратной заменой раствора. После диализа массу геля доводили до расчетного значения концентрации КМЦ в 4%.
Подготовка гелей. Для получения противоспаечных гелей КМХ (3 и 4), КМЦ (6 и 7) растворяли в физрастворе для получения 4%-ного геля (табл. 1). Полученные гели стерилизовали автоклавированием.
Моделирование спайкообразования. Самцы и самки мышей линий CBA, C57BL/6, BALB/c, CD1 (25 ± 5 г) были получены из питомника лабораторных животных “Пущино” (Московская обл., Россия). Все животные содержались в конвенциональных условиях и имели беспрепятственный доступ к пище и воде. Протокол исследования одобрен этическим комитетом ИБХ РАН, протокол № 232. Основные эксперименты проведены на мышах CD1.
Мышей оперировали под наркозом золетил/ксилазин. Шерсть на брюхе удаляли депилятором. Поверхность кожи стерилизовали раствором йода. Вдоль срединной линии передней стенки брюшной полости делали глазными ножницами разрез длиной ~1 см. Слепую кишку извлекали пинцетом, оборачивали стерильной марлевой салфеткой, фиксировали участок поверхности площадью 1 × 1 см и растирали до получения точечных кровотечений, используя стерильный абразивный материал. Участок мышечного слоя размером 1 × 1 см на прилежащей к слепой кишке боковой стенке брюшной полости также растирали до получения точечных кровотечений. На каждую из поврежденных поверхностей пипеткой наносили по 200 мкл стерильного противоспаечного препарата. Поврежденную слепую кишку помещали обратно в брюшную полость вблизи поврежденной стенки брюшной полости. После завершения процедуры, брюшную полость и кожу закрывали швами и обрабатывали раствором йода. В указанное время после операции животных подвергали эвтаназии с использованием метода цервикальной дислокации. Брюшную полость вскрывали U-образным разрезом и проводили оценку степени тяжести спаек по шкале спайкообразования [24]. Эффективность предотвращения спайкообразования рассчитывали по формуле:
Статистический анализ. Оценку полученных результатов проводили с помощью методов вариационной статистики с использованием стандартных статистических программ Microsoft Excel и Statistica for Windows Version 6,0 (Stat Soft Inc., США). Определяли среднее значение, стандартное (среднеквадратичное) отклонение (SD), стандартную ошибку среднего (SEM) и значение вероятности (р). Для оценки достоверности различий выборок применяли тест Манна–Уитни. Различия двух сравниваемых величин считали статистически значимым, если вероятность их тождества составляла менее 5% (p < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ генетической предрасположенности к образованию спаек. К безусловным преимуществам моделирования спайкообразования на мышах можно отнести меньшую стоимость животных, что позволяет увеличить количество животных в группе; наличие инбредных животных, что позволяет оценить роль генетических факторов в процессе образования спаек; доступность генетически измененных животных, например, нокаутных мышей с недостаточной или избыточной экспрессией специфических генов; наличие специфических моноклональных антител [6]. Методы моделирования спайкообразования у мышей в большинстве статей включают в себя повреждение слепой кишки и прилежащей к ней брюшной стенки абразивным материалом или ланцетом [25, 26], а также введение внутрибрюшинной инъекции талька и физиологического раствора [27].
В данной работе спаечный процесс моделировали у мышей разных линий CD1 (аутбредные), CBA (H-2k), C57BL/6 (H-2b) и BALB/c (H-2d) с помощью механического истирания участка слепой кишки и брюшной стенки. Анализ спаечного процесса проводили у самок и самцов линии C57BL/6. Формирование спаек оценивали по шкале от 0 до 5, где 0 баллов – отсутствие спаек, 1 балл – тонкая пленочная спайка; 2 балла – несколько тонких спаек; 3 балла – утолщенная спайка с точечным прикреплением; 4 балла – утолщенная спайка с плоским прикреплением и 5 баллов – толстые кровоснабжаемые спайки (рис. 1в–1е).
Рис. 1.
Общая характеристика спаечного процесса в мышиной модели: а – зависимость предрасположенности к спайкообразованию от пола и линии мышей; б – уровень тяжести спаечного процесса в зависимости от линии мышей и длительности формирования спаек; в–г – виды спаек: 0 баллов – отсутствие спаек (в), 1 балл – тонкая пленочная спайка (г), 4 балла – плотная спайка с плоским прикреплением (д), 5 баллов – очень плотная кровоснабжаемая спайка или более одной спайки с плоским прикреплением (е).
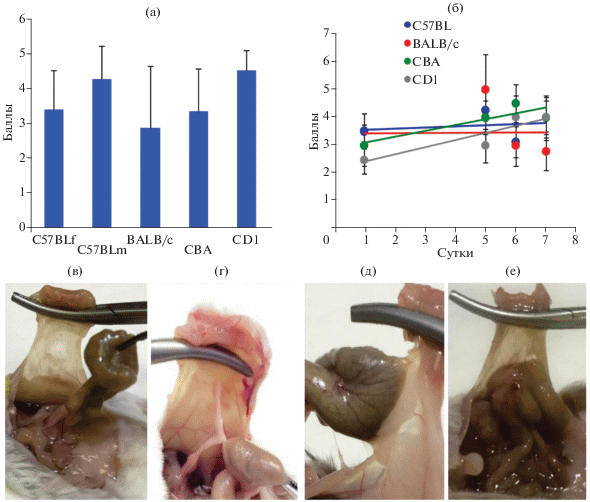
Пулированные данные по всем экспериментам контрольной группы показали, незначительные различия в спаечном процессе у мышей разных линий и полов (рис. 1а). Статистической разницы между линиями мышей не было выявлено.
Таким образом, генетическая предрасположенность к образованию спаек отсутствовала. У самцов спаечный процесс был выражен несколько больше, чем у самок линии мышей C57BL/6, однако достоверной разницы не выявили (рис. 1а). Отметим, что у человека спаечный процесс чаще встречается у женщин в соотношении 2 : 1 к мужчинам. Полученные результаты показали, что оценивать противоспаечную активность биопрепаратов можно с использованием любой линии мышей. Действительно, в литературе используются различные линии, что оправдано.
Для определения динамики послеоперационного спайкообразования у мышей различных линий проводили анализ через 1, 5, 6 и 7 сут. Показано, что если происходила инициация спаечного процесса, то спайки формировались уже через сутки и сохранялись, по крайней мере, в течение недели (рис. 2б). Следовательно, оценивать спаечный процесс можно уже через 24 ч после операции. Все дальнейшие эксперименты проводили на мышах CD1 через 24–48 ч после операции.
Рис. 2.
Оценка эффективности противоспаечных материалов: а – уровень образования спаек (в баллах) в группах с хитозаном и карбоксиметилхитозаном: 1 – хитозан, 2 – NaChitin, 3 – КМХ1179, 4 – КМХ1249, 5 – мКМХ; б – в группах с карбоксицеллюлозой: 6 – КМЦ3275, 7 – КМЦ2895, 8 – Мезогель, 9 – марля, 10 – мКМЦ. Скобками отмечены достоверные отличия от контроля (р ≤ 0.05). Два максимально активных материала выделены синим цветом.
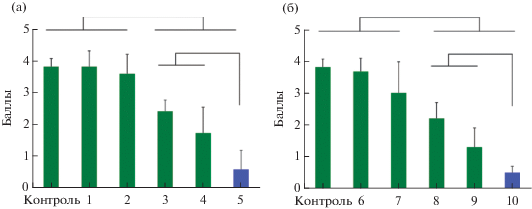
Оценка эффективности противоспаечных материалов. В работе использовали ряд коммерческих и лабораторных противоспаечных материалов. Для исследования противоспаечной активности на оптимизированной модели спайкообразования на мышах были выбраны два типа полимеров: КМЦ, которая чаще всего используется в коммерческих препаратах, и КМХ, который используется значительно реже. В работе [28] показано, что раствор КМЦ ингибирует формирование спаек кишечника, вызванное тальком у мышей [28]. КМЦ в сочетании с дексаметазоном предотвращает образование спаек на модели индуцированного истиранием слепой кишки спайкообразования у крыс за счет снижения воспаления [29]. Также показано, что местное применение 4%-ного геля КМЦ в сочетании с небольшими дозами гепарина значительно снижает образование спаек на экспериментальных моделях благодаря антикоагулянтному эффекту [30].
Хитозан легко модифицируется благодаря наличию активных аминогрупп, что позволяет создавать биоматериалы с различными свойствами. Водорастворимые производные хитозана, такие как N-карбоксиметилхитозан, O-карбоксиметилхитозан и N,O-карбоксиметилхитозан предотвращают адгезию; не требуется их удаления после операции, так как они разлагаются in vivo макрофагами [31]. Среди производных хитозана наиболее широко используется N,O-карбоксиметилхитозан. Эффективность геля N,O-карбоксиметилхитозана была показана в хирургических моделях на крысах: анастомоза брюшной аорты, кишечного анастомоза и разреза брюшной стенки [32].
Биоматериалы разделили на две группы в зависимости от полимера в их основе: 1 – хитозан и КМХ; 2 – КМЦ (табл. 1).
Противоспаечные свойства хитозана и карбоксиметилхитозана. Результаты исследования противоспаечной эффективности хитозана и препаратов КМХ приведены на рис. 2а. В эксперименте хитозан – немодифицированный поликатион с ММ5 200 кДа, СД 95% не уменьшал образование спаек. В экспериментах использовали различные производные хитозана с положительным зарядом (кватернизированный хитозан и гексаноилхитозан с разными степенями замещения), во всех случаях противоспаечный эффект отсутствовал (данные не приводятся). Таким образом, можно сделать вывод, что положительно заряженный хитозан не оказывал противоспаечного действия, несмотря на его гемостатическую активность. Производные хитозана с отрицательным зарядом КМХ 1179 и 1249 примерно в два раза снижали тяжесть спайкообразования. Противоспаечный гель NaСhitin в использованной модели практически не снижал спайкообразование у мышей. NaСhitin отличается от КМХ 1179, 1249 более низкой ММ. По-видимому, для противоспаечной активности важно использовать высокомолекулярные биополимеры. Препараты КМХ 1179, 1249 отличаются по динамической вязкости, а значит и по ММ. Вязкость КМХ 1179 была 76 mPa s, КМХ 1249 – 11 mPa s, однако в эксперименте достоверного различия по противоспаечной активности не выявили. Максимальный противоспаечной эффективностью – 85% обладал медицинский гель на основе модифицированного хитозана мКМХ. Высокая противоспаечная активность геля мКМХ может быть связана с большей ММ, степенью очистки, отсутствием эндотоксинов [33]. Препарат мКМХ является коммерческим продуктом, что не позволяет точно определить ММ.
Противоспаечные свойства карбоксиметилцеллюлозы. Результаты оценки противоспаечной эффективности препаратов КМЦ приведены на рис. 2б. При использовании 4%-ных растворов немодифицированных полимеров КМЦ 3275 и 2895 не установлено достоверного отличия от контроля. Коммерческий материал Мезогель на основе сшитой КМЦ подавлял образование спаек на 42%, марля на основе КМЦ – на 66%, а лучшие результаты были получены для геля мКМЦ, который подавлял спайкообразование на 87%. Различие между мКМЦ и растворами КМЦ 3275 и 2895 заключалось в увеличении вязкости мКМЦ за счет дополнительной сшивки полиэтиенгликольдиглицидиловым эфиром. На примере мКМЦ показано значительное увеличение противоспаечного эффекта за счет модификации полимерных цепей. Модификация может быть осуществлена путем поперечного сшивания молекул полимеров, либо одностороннего присоединения сшивающего агента к молекуле полимера. Влияние каждого из типа модификации на противоспаечный эффект также требует дальнейшего изучения.
В данном исследовании была оптимизирована широко используемая модель механического истирания поверхности слепой кишки и прилежащего участка брюшной стенки на мышах. Показано, что оценивать образование спаек можно на любой линии мышей (CD1, CBA, C57BL/6, BALB/c) мышей из-за отсутствия генетической предрасположенности к образованию спаек и уже через 24 ч, что позволяет сократить время эксперимента.
Исследование противоспаечной эффективности материалов на основе хитозана, КМХ и КМЦ показало, что наиболее эффективно подавляют спайкообразование медицинский гель мКМХ (противоспаечная эффективность составила 85%) и модифицированная ПЭГДЭ мКМЦ (противоспаечная эффективность – 87%), что позволило рекомендовать их для применения в качестве противоспаечных средств в хирургии. Поскольку полимеры имеют разную структуру, механизмы действия, по-видимому, также частично различаются. Для дальнейшего повышения противоспаечного эффекта требуется понимание механизмов протективного действия каждого из полимеров, что требует дополнительных исследований.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Животных содержали при 12-часовом световом режиме в условиях свободного доступа к воде и пище. Работу с животными осуществляли согласно Женевской конвенции 1985 г. о “Международных принципах биомедицинских исследований с использованием животных”. Все эксперименты на животных проводились согласно протоколу № 232, утвержденному локальным этическим комитетом Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН.
Список литературы
van Steensel S., Liu H., Vercoulen T.F.G., Hadfoune M., Breukink S.O., Stassen L.P.S., Lenaerts K., Bouvy N.D. // J. Biomater. Appl. 2021. V. 35. № 7. P. 887–897.
Fometescu S.G., Costache M., Coveney A., Oprescu S. M., Serban D., Savlovschi C. //Chir. 2013. V. 108. № 3. P. 331–340.
Yu-Qing F., Lan-Lan W. U., Yong-Biao L. I., Zhi-Yong Y., Cong G., Xin-Yi W., Chang C., An L. // China J. Chinese Mater. Medica. 2020. V. 45. № 18. P. 4358–4363.
Burns J.W., Skinner K., Colt J., Sheidlin A., Bronson R., Yaacobi Y., Goldberg E.P. //J. Surg. Res. 1995. V. 59. № 6. P. 644–652.
Burgess L.S., Rose R.L., Colt J.C., Skinner K.C., Burns J.W. Pelvic Surgery. N.Y.: Springer New York, 1997. P. 242–243.
Wiseman D.M. Peritoneal Surgery. N.Y.: Springer New York, 2000. P. 459–476.
Kraemer B., Wallwiener C., Rajab T.K., Brochhausen C., Wallwiener M., Rothmund R. // Biomed. Res. Int. 2014. V. 2014. P. 1–8.
Molinas P.R., Koninckx C.R. // Hum. Reprod. 2000. V. 15. № 8. P. 1758–1763.
Holmdahl L., Al-Jabreen M., Risberg B. //Eur. Surg. Res. 1994. V. 26. № 4. P. 248–256.
Reed K.L., Fruin A.B., Bishop–Bartolomei K.K., Gower A.C., Nicolaou M., Stucchi A.F., Leeman S.E., Becker J.M. // J. Surg. Res. 2002. V. 108. № 1. P. 165–172.
Reed K.L., Fruin A.B., Gower A.C., Stucchi A.F., Leeman S.E., Becker J.M. // Proc. Natl. Acad. Sci. USA. 2004. V. 101. № 24. P. 9115–9120.
Yeo Y., Kohane D.S. // Eur. J. Pharm. Biopharm. 2008. V. 68. № 1. P. 57–66.
Liu J., Willför S., Xu C. // Bioact. Carbohydrates Diet. Fibre. 2015. V. 5. № 1. P. 31–61.
Сигаева Н.Н., Колесов С.В., Назаров П.В., Вильданова Р.Р. // Вестник Башкирского Университета. 2012. Т. 17. № 3. С. 1220–1241.
Li J., Feng X., Liu B., Yu Y., Sun L., Liu T., Wang Y., Ding J., Chen X. // Acta Biomater. 2017. V. 61. P. 21–40.
Nahirniak P., Tuma F. Adhesiolysis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. 2021. PMID: 33085366.
Chou T.C., Fu E., Wu C.J., Yeh J.H. // Biochem. Biophys. Res. Commun. 2003. V. 302. № 3. P. 480–483.
Patrulea V., Ostafe V., Borchard G., Jordan O. // Eur. J. Pharm. Biopharm. 2015. V. 97. P. 417–426.
Chatelet C., Damour O., Domard A. // Biomaterials. 2001. V. 22. № 3. P. 261–268.
Kennedy R., Costain D.J., McAlister V.C., Lee T.D.G. // Surgery. 1996. V. 120. № 5. P. 866–870.
Krause T.J., Zazanis G., Malatesta P., Solina A. // J. Investig. Surg. 2001. V. 14. № 2. P. 93–97.
Lalountas M., Ballas K.D., Michalakis A., Psarras K., Asteriou C., Giakoustidis D.E., Nikolaidou C., Venizelos I., Pavlidis T.E., Sakantamis A.K. // Br. J. Surg. 2012. V. 99. № 3. P. 423–429.
Zhang Y., Gao C., Li X., Xu C., Zhang Y., Sun Z., Liu Y., Gao J. // Carbohydr. Polym. 2014. V. 101. № 1. P. 171–178.
Konovalova M.V., Markov P.A., Popova G.Y., Nikitina I.R., Shumikhin K.V., Kurek D.V., Varlamov V.P., Popov S.V. // J. Bioact. Compat. Polym. 2017. V. 32. № 5. P. 487–502.
Sıkar H.E. // Turkish J. Trauma Emerg. Surg. 2017. V. 23. № 5. P. 377–382.
Marshall C.D., Hu M.S., Leavitt T., Barnes L.A., Cheung A.T.M., Malhotra S., Lorenz H.P., Longa-ker M.T. // J. Vis. Exp. 2016. № 114.
Frazier–Jessen M.R., Kovacs E.J. // J. Immunol. Methods 1993. V. 162. № 1. P. 115–121.
Tanaka K., Hashimoto H., Misawa T., Akiba T. // J. Surg. Res. 2019. V. 234. P. 311–316.
Du X.H., Liu J.Q., Xin K., Liu G.H. // Brazilian J. Med. Biol. Res. 2015. V. 48. № 4. P. 344–348.
Docherty J.R., McCormick P.A. // J. Surg. Res. 2017. V. 213. P. 228–233.
Патент США. 1992. № 5093319.
Costain D.J., Kennedy R., Ciona C., McAlister V.C., Lee T.D.G. // Surgery. 1997. V. 121. № 3. P. 314–319.
Chattopadhyay S., Raines R.T. // Biopolymers. 2014. V. 101. № 8. P. 821–833.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


