Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 151-158
Получение и свойства комплексов на основе нанокомпозита хитозан-Ag и антибиотиков цефалоспоринового ряда
А. Н. Красковский 1, *, В. В. Николайчук 1, К. С. Гилевская 1, В. И. Куликовская 1, Е. А. Степанова 2, И. И. Кузьминский 2, Н. Опавски 3, В. Е. Агабеков 1
1 Институт химии новых материалов НАН Беларуси
220141 Минск, Республика Беларусь
2 Институт экспериментальной ветеринарии им. С.Н. Вышелесского
220063 Минск, Республика Беларусь
3 Белградский университет
11000 Белград, Сербия
* E-mail: aleks.kraskovsky@gmail.com
Поступила в редакцию 28.08.2021
После доработки 25.10.2021
Принята к публикации 05.11.2021
- EDN: YXRXHW
- DOI: 10.31857/S055510992202012X
Аннотация
Методом “зеленой химии” путем химического восстановления нитрата серебра хитозаном синтезированы агрегативно устойчивые положительно заряженные (~45 мВ) нанокомпозиты хитозан-Ag сферической формы c размером до 60.0 нм. Получены комплексы хитозан-Ag/цефтриаксон и хитозан-Ag/цефотаксим, содержащие до 1.06 ± 0.01 и 1.29 ± 0.03 мг антибиотика/мг хитозан-Ag соответственно. Установлено, что при увеличении соотношения цефтриаксон : хитозан-Ag в реакционной смеси с 0.5 до 1.25 эффективность связывания антибиотика с наночастицами возрастает с 7.2 ± 0.2 до 71.7 ± 0.2%, а при увеличении соотношения цефотаксим : хитозан-Ag в реакционной смеси от 0.5 до 10 эффективность связывания антибиотика снижается с 66.2 ± 1.5 до 13.0 ± 0.7%. Образование комплексов хитозан-Ag/антибиотик подтверждено методом ИК-спектроскопии. Установлена эффективность применения комплекса хитозан-Ag/цефотаксим против резистентных штаммов Escherichia coli и Staphylococcus aureus.
Неконтролируемое и нерациональное применение антибактериальных препаратов при лечении различного рода инфекционных заболеваний является причиной появления и развития устойчивой антибиотикорезистентности бактерий [1]. В клинической практике устойчивость бактерий к антибиотикам представляет собой серьезную проблему, для решения которой необходима разработка новых классов антибактериальных препаратов [2–4].
Одним из перспективных способов преодоления бактериальной резистентности является использование наночастиц металлов, например, серебра [5], которые обладают широким спектром антимикробной активности [6–8]. При этом использование металлических наночастиц в комбинации с традиционными антибиотиками позволяет не только снизить используемые дозы и токсичность обоих компонентов, но и достичь синергизма антибактериального действия [4, 9–11]. Так, авторы [9, 10] показали, что антимикробная активность биогенных комплексов наночастиц серебра с цефтриаксоном увеличивается по сравнению с чистыми наночастицами серебра. Повышенную антимикробную активность проявляли комплексы наночастиц серебра с цефотаксимом [12], бензилпенициллином [13, 14], тетрациклином [15], амоксициллином [16].
Для повышения агрегативной устойчивости наночастиц и улучшения их биосовместимости можно использовать полисахарид хитозан, который выступает в качестве восстановителя и стабилизатора [17, 18]. Хитозан обладает антимикробными свойствами в отношении грамположительных и грамотрицательных штаммов бактерий, некоторых видов грибов [19], а также способен оказывать синергетическое действие и повышать антимикробную активность антибиотиков [20, 21]. Нанокомпозиты хитозан-Ag имеют широкий спектр антимикробной активности [17, 18, 22] и являются перспективным материалом для разработки новых классов антибактериальных препаратов.
Цель работы – получение комплексов наночастиц серебра, покрытых оболочкой хитозана, с антибиотиками цефалоспоринового ряда и оценка их антимикробных свойств.
МЕТОДИКА
Материалы. В работе использовали хитозан (MМ ~ 30 кДа, степень деацетилирования >90%, “Glentham Life Sciences”, Великобритания), нитрат серебра (≥99%, М = 169.88 г/моль, “Carl Roth”, Германия), цефотаксима натриевую соль (М = 477.5 г/моль) и цефтриаксона динатриевую соль (М = 661.6 г/моль, ОАО “Борисовский завод медицинских препаратов”, Беларусь).
Получение нанокомпозита хитозан-Аg. Нанокомпозит хитозан-Ag получали методом гидротермального синтеза путем химического восстановления нитрата серебра хитозаном [22]. Продолжительность реакции 60 мин.
Получение комплексов хитозан-Аg/цефтриаксон. Комплексы хитозан-Ag с цефтриаксоном получали путем смешения их растворов при соотношении (по массе) антибиотик : хитозан-Ag от 0.5 до 8.0. Для этого 1 мл нанокомпозита хитозан-Аg (2 мг/мл) добавляли к 1 мл антибиотика соответствующей концентрации. Далее реакционную смесь интенсивно перемешивали в течение 1 ч. Синтезированный комплекс хитозан-Ag/цефтриаксон отделяли центрифугированием при 24 000 × g (20 мин, 10°С). Количество несвязанного антибиотика определяли спектрофотометрически (при λ = 270 нм) по предварительно построенному калибровочному графику А = 0.0506 · С.
Получение комплексов хитозан-Аg/цефотаксим. Комплексы хитозан-Ag с цефотаксимом получали путем смешения их растворов при соотношении антибиотик : хитозан-Ag (по массе) от 0.5 до 10. Для этого 1 мл нанокомпозита хитозан-Аg (2 мг/мл) добавляли к 1 мл антибиотика соответствующей концентрации. Далее реакционную смесь интенсивно перемешивали в течение 1 ч. Полученные комплексы очищали диализом против дистиллированной воды в течение 5 сут. В процессе диализа трехкратно (через 1, 2 и 5 сут) отбирали по 20 мл диализной воды, замещая ее чистым растворителем. Количество несвязанного антибиотика определяли спектрофотометрически (при λ = 260 нм) по предварительно построенному калибровочному графику A = 0.033 · C.
Определение гидродинамического диаметра и величины ζ-потенциала комплексов. Гидродинамический диаметр и величину ζ-потенциала комплексов хитозан-Ag/антибиотик определяли методом динамического светорассеивания и по их электрофоретической подвижности соответственно с помощью анализатора Zetasizer Nano-ZS (“Malvern”, Великобритания). Измерения проводили для предварительно разбавленных в 10 раз образцов.
ИК-спектроскопия. ИК-спектры полученных комплексов записывали на ИК-Фурье спектрометре Tensor 27 (“Bruker”, Германия) в диапазоне частот 4000–400 см–1. Образцы для исследования готовили в таблетках с KBr.
Определение синергетического потенциала нанокомпозита хитозан-Ag с антибиотиком. При определении синергетического потенциала нанокомпозита хитозан-Ag в сочетании с антибиотиками в качестве тест-культур были выбраны следующие штаммы: грамположительные бактерии Staphylococcus aureus коллекции микроорганизмов Института экспериментальной ветеринарии (Беларусь) (КМИЭВ В161) и грамотрицательные бактерии Escherichia coli (КМИЭВ В88), выращенные на мясо-пептонном агаре (МПА) без антибиотиков.
Определение бактерицидной активности исследуемых образцов проводили с использованием диско-диффузионного метода. Исследуемую бактериальную культуру в дозе 2 × 108 кл./мл засевали газоном на среду АГВ (агар Гивенталя–Ведьминой) в чашки Петри. На стандартные бумажные диски, содержащие определенные дозы (30 мкг) антибиотиков (цефотаксима, цефтриаксона), добавляли по 0.1 мл нанокомпозита хитозан-Ag (Схитозан = 8 мг/мл, СAg = 0.272 мг/мл) и высушивали. Затем диски пинцетом помещали на засеянную поверхность агара и выдерживали в термостате при 37°С в течение 18–20 ч. Результаты оценивали по зоне задержки роста тест-культур вокруг диска.
На контрольные чашки Петри с агаром засевали по 1 мл суспензий, содержащих по 2 × 108 кл. 18-часовой культуры, на засеянную поверхность пинцетом помещали бумажные диски, содержащие определенные дозы разных антибиотиков. Через 24 ч инкубирования при 37°С проводили визуальную оценку наличия роста тест-штамма в опытных пробах по сравнению с ростом тест-штамма в положительном контроле (питательная среда с тест-штаммом без препарата).
Изучение антимикробной активности комплексов хитозан-Аg/цефотаксим. При изучении антимикробных свойств комплексов нанокомпозита хитозан-Ag и цефотаксима в качестве тест-культур были выбраны следующие резистентные штаммы: Proteus vulgaris (КМИЭВ В153), Pseudomonas aeruginosa (КМИЭВ В114), S. aureus (КМИЭВ В161), Streptococcus agalactiae (КМИЭВ В193), E. coli (КМИЭВ В88). Резистентные изоляты были выделены из материала, отобранного при обследовании коров, заболевших маститом и эндометритом, из сельскохозяйственных организаций. Клиническая резистентность подтверждена отсутствием эффекта при использовании максимально допустимых терапевтических доз антибиотика.
Определение чувствительности исследуемых образцов проводили с использованием метода “лунок” (диффузии в агар). Для постановки эксперимента использовали нанокомпозит хитозан-Ag, образец № 2 – цефотаксим, 0.25 мг/мл, образцы № 3, 4 и 5 – комплексы хитозан-Ag/цефотаксим, полученные при соотношении (по массе) антибиотик : хитозан-Ag 1 : 1, 2 : 1 и 4 : 1 соответственно и разбавленные до концентрации 0.25 мг/мл по цефотаксиму. В толще агара, содержащего суточную культуру микроорганизмов в дозе 2 × × 108 кл./мл, стерильно делали лунки диаметром 6 мм. В лунки вносили исследуемые образцы в объеме 60 мкл и помещали в термостат при 37°С на 18–20 ч. В качестве контроля использовали диск с цефотаксимом (30 мкг). Результаты оценивали по зоне задержки роста тест-культур вокруг лунки.
На контрольные чашки Петри с агаром засевали по 1 мл суспензий, содержащих по 2 × 108 кл. 18-часовой культуры тест-штамма. Через 24 ч инкубирования при 37°С проводили визуальную оценку наличия роста тест-штамма в опытных пробах по сравнению с ростом тест-штамма в положительном контроле (питательная среда с тест-штаммом без препарата).
Получение лиофилизированных порошков. Лиофилизированные порошки комплексов хитозан-Ag/цефотаксим получали на лиофильной сушке Freezone 1.0 (“Labconco”, США). В качестве криопротектора при сублимационном высушивании использовали глюкозу (5 мас. %).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Полученные нанокомпозиты хитозан-Ag представляли собой структуру “ядро-оболочка”, имели сферическую форму, размер от 1.0 до 60.0 нм и величину ξ-потенциала ~45 мВ [22].
В качестве активного компонента для получения комплексов были выбраны антибиотики группы цефалоспоринов III поколения широкого спектра действия: цефтриаксон и цефотаксим.
При изменении массового соотношения цефтриаксон : хитозан-Ag в реакционной смеси с 0.5 до 1.25 происходило увеличение эффективности связывания антибиотика с наночастицами на один порядок: с 7.2 ± 0.2 до 71.7 ± 0.2% (рис. 1). Дальнейшее увеличение цефтриаксона в реакционной смеси приводило к плавному снижению эффективности связывания и при 8-кратном избытке антибиотика по отношению к хитозан-Ag этот параметр составлял 14.2 ± 0.3% (рис. 1).
Рис. 1.
Эффективность связывания цефтриаксона (%) с наночастицами хитозан-Ag в зависимости от соотношения цефтриаксон : хитозан-Ag в реакционной смеси.

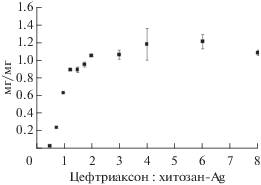
Как видно на рис. 2, содержание цефтриаксона в синтезируемом комплексе постепенно возрастало с 0.04 ± 0.01 до 1.06 ± 0.01 мг/мг хитозан-Ag при изменении соотношения цефтриаксон : : хитозан-Ag с 0.5 до 2.0. При дальнейшем повышении концентрации антибиотика в реакционной смеси его количество в комплексе оставалось неизменным (рис. 2), что свидетельствовало о достижении предельной емкости. Наблюдаемое (рис. 1) уменьшение эффективности связывания цефтриаксона в области его высоких концентраций также можно объяснить достижением максимального количества антибиотика, который способен связаться с наночастицами хитозан-Аg.
Рис. 2.
Содержание цефтриаксона (цефтриаксон/хитозан-Ag, мг/мг) в полученных комплексах в зависимости от соотношения цефтриаксон : хитозан-Ag в реакционной смеси.
Величина ζ-потенциала исходных наночастиц хитозан-Ag составляла 45.4 ± 5.3 мВ. При их взаимодействии с цефтриаксоном наблюдалось постепенное снижение ζ-потенциала формируемого комплекса (табл. 1). Это свидетельствовало об электростатическом взаимодействии между наночастицами хитозан-Ag и цефтриаксоном. Также следует отметить, что при взаимодействии антибиотика с наночастицами хитозан-Ag происходило изменение их гидродинамического диаметра. Так, величина гидродинамического диаметра исходных наночастиц составляла 150 ± 50 нм. При низком содержании цефтриаксона в комплексе наблюдалось некоторое снижение гидродинамического размера (табл. 1), которое могло быть вызвано экранированием зарядов макромолекул хитозана при взаимодействии с противоположно заряженным антибиотиком. При соотношении цефтриаксон : хитозан-Ag в реакционной смеси 1.25 и выше наблюдалось резкое увеличение гидродинамического диаметра и размер частиц комплекса составлял более 1 мкм (табл. 1). В этих условиях достигалась максимальная эффективность связывания антибиотика, и, по-видимому, происходило укрупнение или агрегация частиц.
Таблица 1.
Характеристики синтезированных комплексов хитозан-Ag/цефтриаксон
| Соотношение цефтриаксон : : хитозан-Ag (масс.) | ζ-потенциал, мВ | Гидродинамический диаметр, нм | PdI |
|---|---|---|---|
| 0.5 | 35.0 ± 1.3 | 85 ± 25 | 0.33 ± 0.01 |
| 0.75 | 26.2 ± 1.2 | 95 ± 10 | 0.32 ± 0.11 |
| 1.0 | 39.3 ± 1.8 | 110 ± 55 | 0.63 ± 0.08 |
| 1.25 | 36.6 ± 2.1 | 1300 ± 265 | 0.72 ± 0.22 |
| 1.5 | 31.8 ± 0.4 | 1110 ± 215 | 0.55 ± 0.12 |
| 1.75 | 30.4 ± 1.0 | 1125 ± 245 | 0.53 ± 0.11 |
| 2.0 | 24.4 ± 1.8 | 1610 ± 95 | 0.44 ± 0.02 |
| 3.0 | 20.9 ± 1.4 | 2810 ± 585 | 0.33 ± 0.11 |
| 4.0 | 21.5 ± 1.0 | 2085 ± 235 | 0.36 ± 0.08 |
| 6.0 | 12.0 ± 0.2 | 2275 ± 960 | 0.32 ± 0.11 |
| 8.0 | 17.5 ± 0.3 | 1140 ± 55 | 0.61 ± 0.11 |
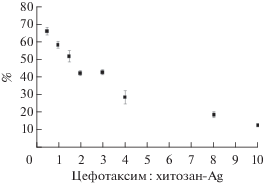
При смешении хитозан-Ag с цефтриаксоном происходило помутнение раствора и выпадение осадка. В отличие от реакционной смеси цефтриаксон/хитозан-Ag при смешении нанокомпозита с цефотаксимом значительного помутнения раствора и выпадения осадка не наблюдалось, то есть происходило образование растворимых комплексов. Как видно на рис. 3 при увеличении соотношения цефотаксим : хитозан-Ag в реакционной смеси от 0.5 до 10 эффективность его связывания снижалась с 66.2 ± 1.5 до 13.0 ± 0.7%.
Рис. 3.
Эффективность связывания цефотаксима (%) с наночастицами хитозан-Ag в зависимости от соотношения цефотаксим : хитозан-Ag в реакционной смеси.
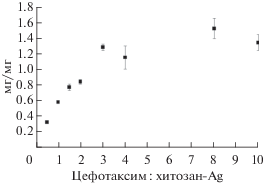
При этом изменение соотношения с 0.5 до 3 приводило к повышению содержания антибиотика в формируемом комплексе в ~4 раза: с 0.33 ± ± 0.01 до 1.29 ± 0.03 мг/мг хитозан-Ag (рис. 4). Дальнейшее увеличение концентрации антибиотика в реакционной смеси не оказывало влияние на его содержание в комплексе (рис. 4).
Рис. 4.
Содержание цефотаксима (цефотаксим/хитозан-Ag, мг/мг) в полученных комплексах в зависимости от соотношения цефотаксим : хитозан-Ag в реакционной смеси.
При формировании комплексов хитозан-Ag/цефотаксим происходило снижение величины ζ-потенциала (до 15.5–33.6 мВ) по сравнению с исходными наночастицами (45.4 ± 5.3 мВ), что, как и в случае с цефтриаксоном, подтверждало электростатический характер взаимодействия между компонентами в образуемом комплексе (табл. 2). Гидродинамический диаметр частиц составлял 120–300 нм, при этом они были достаточно однородными (индекс полидисперсности не превышал 0.50).
Таблица 2.
Характеристики синтезированных комплексов хитозан-Ag/цефотаксим
| Соотношение цефотаксим : : хитозан-Ag (масс.) | ζ-потенциал, мВ | Гидродинамический диаметр, нм | PdI |
|---|---|---|---|
| 0.5 | 21.8 ± 0.6 | 220 ± 5 | 0.41 ± 0.06 |
| 1.0 | 22.3 ± 3.6 | 250 ± 25 | 0.37 ± 0.05 |
| 1.5 | 28.4 ± 0.8 | 260 ± 10 | 0.35 ± 0.06 |
| 2.0 | 33.2 ± 4.7 | 280 ± 25 | 0.47 ± 0.04 |
| 3.0 | 21.9 ± 1.7 | 120 ± 5 | 0.28 ± 0.02 |
| 4.0 | 32.0 ± 0.6 | 300 ± 5 | 0.42 ± 0.01 |
| 6.0 | 24.5 ± 2.1 | 250 ± 20 | 0.39 ± 0.03 |
| 8.0 | 33.6 ± 0.4 | 190 ± 10 | 0.28 ± 0.01 |
| 10.0 | 15.5 ± 0.9 | 160 ± 30 | 0.33 ± 0.02 |
Образование комплексов хитозан-Ag/антибиотик подтверждено методом ИК-спектроскопии на примере комплекса хитозан-Ag/цефотаксим. В ИК-спектре нанокомпозита хитозан-Ag (рис. 5) присутствовали пики при 3418 (валентные колебания O–H и N–H связей функциональных групп хитозана), 1639 (валентные колебания CONH2-группы), 1563 (деформационные колебания δ(NH2)), 1154 (валентные асимметричные колебания C–O–C), 1077 (колебания С–О) и 896 см–1 (деформационные колебания С–Н глюкопиранозного кольца) [22].
Рис. 5.
ИК-спектры нанокомпозита хитозан-Ag (1), цефотаксима (2) и комплекса хитозан-Ag/цефотаксим (3).
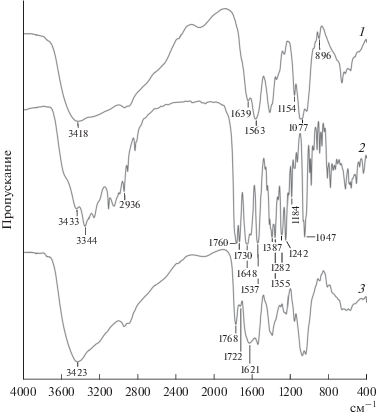
В ИК-спектре цефотаксима (рис. 5) наблюдались характеристические пики при 3433 и 3344 (асимметричные и симметричные валентные колебания N–H и O–H), 2936 (асимметричные валентные колебания CH3), 1760 и 1730 (валентные колебания C=O лактамной группировки и эфирной группы), 1648 (валентные колебания C=O амида), 1610 и 1537 (валентные колебания C=C и C=N), 1387 и 1355 (асимметричные и симметричные колебания C–H), 1282 и 1184 (валентные колебания C–N), 1242 (колебания C–N β-лактамного кольца) и 1047 (колебания C–O эфирной группы) [23–26].
В ИК-спектре комплекса хитозан-Ag/цефотаксим (рис. 5) по сравнению с нанокомпозитом хитозан-Ag появились пики при 1768 и 1722 см–1, соответствующие валентным колебаниям C=O β‑лактамной группировки и эфирной группы антибиотика. При этом наблюдали смещение этих пиков по сравнению с чистым антибиотиком, что указывает на взаимодействие COO– групп цефотаксима и аминогруппы хитозан-Ag. Также отсутствовал пик при 1563 см–1, относящийся к колебаниям NH2-группы [26, 27].
На формирование системы новых водородных связей указывало смещение полосы колебаний O–H от 3418 до 3423 см–1 [26]. Для пика при 1648 см–1 (валентные колебания C=O амида) цефотаксима наблюдался сдвиг до 1621 см–1, что свидетельствовало о возможном участии C=O амида во взаимодействии антибиотика с нанокомпозитом хитозан-Ag [28].
Для изучения синергетического потенциала нанокомпозита хитозан-Ag в сочетании с антибиотиками в качестве тест-культур были выбраны грамположительные бактерии S. aureus (КМИЭВ В161) и грамотрицательные бактерии E. coli (КМИЭВ В88). Антимикробная активность испытанных образцов представлена в табл. 3.
Таблица 3.
Сравнение антимикробной активности образцов на разных тест-штаммах (микробная нагрузка 2 × 108 кл./мл)
| Образец | Зона ингибирования, мм | |
|---|---|---|
| S. aureus | E. coli | |
| Цефотаксим 30 мкг | 22 | 21 |
| Цефотаксим 30 мкг + 0.1 мл хитозан-Ag | 23 | 26 |
| Цефтриаксон 30 мкг | 22 | 25 |
| Цефтриаксон 30 мкг + 0.1 мл хитозан-Ag | 23 | 26 |
Как видно из таблицы, наибольшую бактерицидную активность хитозан-Ag проявлял в сочетании с цефотаксимом в отношении штамма E. coli: зона ингибирования увеличивалась в 1.24 раза при добавлении к диску с антибиотиком аликвоты нанокомпозита. На грамположительные бактерии S. aureus выраженного синергетического действия нанокомпозита хитозан-Ag с исследованными антибиотиками не выявлено.
В связи с этим антимикробную активность по отношению к различным тест-штаммам изучали для комплексов хитозан-Ag/цефотаксим. При изучении антимикробной активности полученных образцов использовали резистентные к цефотаксиму штаммы. Различное антимикробное действие антибиотика на изоляты № 2 и 5 E. сoli, а также № 3 и 7 S. аureus может быть связано с различной чувствительностью указанных штаммов. Комплексы хитозан-Ag/цефотаксим, полученные при соотношении антибиотик : хитозан-Ag 1 : 1 и 2 : 1 (образцы № 3 и 4), не проявляли антимикробное действие против штаммов № 2 E. сoli и № 7 S. аureus, в то время как комплекс хитозан-Ag/цефотаксим, полученный при соотношении антибиотик : хитозан-Ag 4 : 1 (образец № 5), подавлял рост указанных тест-культур (табл. 4). Это можно объяснить тем, что содержание цефотаксима в комплексе, полученном при соотношении 4:1, выше, чем в других комплексах (рис. 4), что было причиной более слабого взаимодействия антибиотика с хитозан-Ag и его свободной диффузии в агар. В случае комплексов, полученных при соотношениях 1 : 1 и 2 : 1, цефотаксим более прочно связан с хитозан-Ag, что затрудняло его высвобождение в питательную среду.
Таблица 4.
Сравнение антимикробной активности образцов на разных тест-штаммах (2 × 108 кл./мл)*
| Тест-культура, изолят | Зона задержки роста, мм | |||||
|---|---|---|---|---|---|---|
| Цефотаксим, 30 мкг | Нанокомпозит хитозан-Ag | образец | ||||
| № 2 | № 3 | № 4 | № 5 | |||
| № 1 P. aeruginosa | 14 | 10 | 10 | – | – | – |
| № 2 E. coli | 21 | 11 | 21 | – | – | 17 |
| № 3 S. aureus | 17 | 8 | 17 | 8 | 8 | 14 |
| № 4 P. vulgaris | 15 | 8 | 8 | 8 | 8 | 9 |
| № 5 E. coli | – | 11 | – | – | – | – |
| № 6 S. agalactiae | – | 10 | – | – | – | – |
| № 7 S. aureus | 14 | 10 | 14 | – | – | 13 |
Следует отметить, что для комплексов хитозан-Ag/цефотаксим (образцы № 3–5) по сравнению с чистым антибиотиком (образец № 2) наблюдалось уменьшение зон задержки роста бактерий либо их отсутствие, за исключением изолята № 4 P. vulgaris (табл. 4). Возможно, это связано с меньшей скоростью диффузии антибиотика в комплексе с хитозаном по сравнению с нативным антибиотиком.
Аналогичные результаты по антимикробной активности комбинаций наночастиц серебра с бета-лактамными антибиотиками были получены в ряде работ. Так, в работе [29] авторы показали, что комбинирование наночастиц серебра, стабилизированных поливинилпирролидоном, с бета-лактамными антибиотиками (биапенемом, азтреонамом, ампициллином) не приводило к увеличению антимикробной активности по отношению к штаммам E. coli, S. typhimurium, B. subtilis и S. aureus. Авторы [30] отмечали, что комбинация наночастиц Ag c цефтриаксоном проявляла улучшенные антибактериальные свойства против E. coli. Диаметр зоны ингибирования увеличивался по сравнению с исходными наночастицами и чистым антибиотиком в 1.76 и 1.29 раз соответственно. В отношении штамма S. aureus указанные комбинации антибактериальных свойств не проявляли. В этой же работе авторы показали, что комбинирование наночастиц серебра с цефазолином, который также относится к цефалоспоринам, не приводило к изменению антибактериальной активности по отношению к E. coli и S. aureus по сравнению с чистым антибиотиком.
Одной из препаративных форм, удобной для практического использования и хранения, являются порошки. Лиофилизированные порошки комплекса хитозан-Ag/цефотаксим, легко редиспергируемые в воде, получены методом сублимационной сушки. Установлено, что лиофильное высушивание не оказывало существенного влияния на ζ‑потенциал, гидродинамический диаметр и полидисперсность комплексов хитозан-Ag/цефотаксим.
*
Методом “зеленой химии” путем химического восстановления нитрата серебра хитозаном синтезированы агрегативно устойчивые положительно заряженные нанокомпозиты хитозан-Ag. Получены комплексы хитозан-Ag/цефтриаксон и хитозан-Ag/цефотаксим, содержащие до 1.06 ± 0.01 и 1.29 ± 0.03 мг антибиотика/1 мг хитозан-Ag соответственно.
Наибольшую бактерицидную активность хитозан-Ag проявлял в сочетании с цефотаксимом в отношении штамма E. coli: зона ингибирования увеличивалась в 1.24 раза. Выраженного синергетического действия нанокомпозита хитозан-Ag с исследованными антибиотиками в отношении грамположительных бактерий S. aureus не выявлено. Установлена эффективность применения комплекса хитозан-Ag/цефотаксим к резистентным изоляту № 2 E. coli, изолятам № 3 и 7 S. aureus.
Полученные комплексы нанокомпозита хитозан-Ag и цефотаксима являются перспективными материалами для биомедицинского применения и ветеринарии при лечении различных бактериальных инфекций.
Работа была выполнена при финансовой поддержке БРФФИ (договор Х20СРБГ-002) и гранта № 337-00-00612/2019-09/02.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Uddin T.M., Chakraborty A.J., Khusro A., Zidan R.M., Mitra S., Emran T.B. et al. // J. Infection and Public Health. 2021. https://doi.org/10.1016/j.jiph.2021.10.020
Раи М.К., Конь Е.В. // Сучасні аспекти військової медицини. 2011. № 18. С. 545–550.
Allahverdiyev A.M., Kon K.V., Abamor E.S., Bagirova M., Rafailovich M. // Expert Review of Anti-Infective Therapy. 2011. V. 9. № 11. P. 1035–1052.
Deng H., McShan D., Zhang Y., Sinha S.S., Arslan Z., Ray P.C., Yu H. // Environ. Sci. Technol. 2016. V. 50. P. 8840–8848.
Krutyakov Y.A., Kudrinskiy A.A., Olenin A.Y., Lisichkin G.V. // Russ. Chem. Rev. 2008. V. 77. P. 233–257.
Букина Ю.А., Сергеева Е.А. // Вестник Казанского технологического университета. 2012. Т. 15. С. 170–172.
Li W.R., Xie X.-B., Shi Q.-S., Zeng H.-Y., Ou-Yang Y.-S., Chen Y.-B. // Appl. Microbiol. Biotechnol. 2010. V. 85. № 4. P. 1115–1122.
Li Y., Hindi K., Watts K.M., Taylor J.B., Zhang K., Li Z., Hunstad D.A., Cannon C.L., Youngs W.J., Wooley K.L. // Chemical Communications. 2010. V. 46. № 1. P. 121–123.
Shanmuganathan R., MubarakAli D., Prabakar D., Muthukumar H., Thajuddin N., Kumar S.S., Pugazhen-dhi A. // Environmental Science and Pollution Research. 2018. V. 25. № 11. P. 10362–10370.
Harshiny M., Matheswaran M., Arthanareeswaran G., Kumaran S., Rajasree S. // Ecotoxicology and Environmental Safety. 2015. V. 121. P. 135–141.
Shah M. R., Ali S., Ateeq M., Perveen S., Ahmed S., Bertinoc M.F., Alib M. // New J. Chemistry. 2014. V. 38. № 11. P. 5633–5640.
Hassan M.H.A., Ismail M.A., Moharram A.M., Shoreit A. // Am. J. Microbiol. Res. 2016. V. 4. P. 132–137.
Ahmed V., Kumar J., Kumar M., Chauhan M.B., Vij M., Ganguli M., Chauhan N.S. // J. Biotechnology. 2013. V. 163. № 4. P. 419–424.
Ketikidis I., Banti C.N., Kourkoumelis N., Tsiafoulis C.G., Papachristodoulou C., Kalampounias A.G., Hadjikakou S.K. // Antibiotics. 2020. V. 9. № 1. P. 25.
Ohanyan S.A., Rshtuni L.R., Grabski H.V., Tiratsuyan S.G., Hovhannisyan A.A. // Biological J. Armenia. 2019. V. 71. № 3. P. 89–96.
Li P., Li J., Wu C., Wu Q., Li J. // Nanotechnology. 2005. V. 16. № 9. P. 1912–1917.
Biao L., Tan S., Wang Y., Guo X., Fu Y., Xu F., Zu Y., Liu Z. // Mater. Sci. Eng. C. 2017. V. 76. P. 73–80.
Гилевская К.С., Машкин М.Е., Красковский А.Н., Кабанова О.В., Степанова Е.А., Кузьминский И.И., Куликовская В.И., Агабеков В.Е. // Журн. неорг. химии. 2021. Т. 66. № 8. С. 1017–1024.
Verlee A., Mincke S., Stevens C.V. // Carbohydr. Polym. 2017. V. 164. P. 268–283.
Abioye A., Sanyaolu A., Dudzinska P., Adepoju-Bello A.A., Coker H.A.B. // Pharm. Nanotechnol. 2020. V. 8. № 1. P. 33–53.
Duceac L.D., Calin G., Eva L., Marcu C., Goroftei E.R.B., Dabija M.G. et al. // Materials (Basel). 2020. V. 13. № 21. P. 4792.
Kulikouskaya V., Zhdanko T., Hileuskaya K., Kraskouski A., Zhura A., Skorohod H., Butkevich V., Kunal Pal, Tratsyak S., Agabekov V. // J. Biomedical Materials Research Part A. 2021. https://doi.org/10.1002/jbm.a.37278
Gunasekaran S., Charles J. // Asian J. Chemistry. 2008. V. 20. № 2. P. 1343–1356.
Consortti L.P., Salgado H.R.N. // J. Pharm. Sci. Emerg. Drugs. 2017. V. 5. № 1. https://doi.org/10.4172/2380-9477.1000118
Kusumaningrum S., Arbianto A.D., Rismana E., Firdayani, Jannah R. // Research J. Pharmaceutical, Biological and Chemical Sciences. 2020. V. 11. № 1. P. 24–31.
Li Z., Wang X., Zhang X., Yang Y., Duan J. // Chemical Engineering J. 2020. https://doi.org/10.1016/j.cej.2020.127494
Mudarisova R.Kh., Kulish E.I., Zinatullin R.M., Tamindarova N.E., Kolesov S.V., Khunafin S.N., Monakova Yu.B. // Russian J. Applied Chemistry. 2006. V. 79. P. 1210–1212.
Halawani E.M., Hassan A.M., El-Rab S.M.F.G. // International J. Nanomedicine. 2020. V. 15. P. 1889–1901.
Vazquez-Muñoz R., Meza–Villezcas A., Fournier P.G.J., Soria–Castro E., Juarez–Moreno K., Gallego–Hernandez A. L., Bogdanchikova N., Vazquez–Duhalt R., Huerta–Saquero A. // PLoS One. 2019. V. 14. № 11. e0224904. https://doi.org/10.1371/journal.pone.0224904
Новикова Г.В., Воробьев С.А., Шидловский И.П. // Омские научные чтения – 2018. Материалы Второй Всероссийской научной конференции. Омск: Омский государственный университет им. Ф.М. Достоевского, 2018. С. 847–849.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


