Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 159-171
Характеристика термотолерантной хитиназы штамма Cohnella sp. IB P-192 и ее применение для получения биоактивных олигомеров хитозана
Е. А. Гильванова 1, Г. Э. Актуганов 1, *, В. Р. Сафина 1, П. Ю. Мильман 1, С. А. Лопатин 2, А. И. Мелентьев 1, Н. Ф. Галимзянова 1, Л. Ю. Кузьмина 1, Т. Ф. Бойко 1
1 Уфимский Институт биологии Уфимского федерального исследовательского центра РАН
450054 Уфа, Россия
2 Институт биоинженерии ФИЦ “Фундаментальные основы биотехнологии” РАН
117312 Москва, Россия
* E-mail: gleakt@anrb.ru
Поступила в редакцию 20.08.2021
После доработки 20.10.2021
Принята к публикации 05.11.2021
- EDN: CLIRZX
- DOI: 10.31857/S0555109922020076
Аннотация
Из культуральной среды умеренно термофильного штамма Cohnella sp. IB-P192 методами ультрафильтрации, аффинной сорбции и гидрофобной хроматографии выделена и охарактеризована термостабильная экзохитиназа. Синтез фермента индуцировался в присутствии коллоидного крабового хитина, достигая максимума при 50°С к 72 ч глубинного культивирования. Молекулярная масса очищенной хитиназы, определенная с помощью денатурирующего гель-электрофореза, составляла 69 кДа, оптимум рН и температуры 7.5 и 70°С соответственно. Фермент сохранял 100% активности при 65°С и был стабилен в интервале рН 5.0–10.5. KM и удельная Vmax очищенной хитиназы при гидролизе коллоидного хитина составляли 0.83 мг × мл–1 и 116.75 мкМ × мл–1 × мин–1 × мг–1 соответственно. Фермент ингибировался ионами Ag+, Hg+2 и незначительно – Cu+2, Ni+2 при концентрации 1 мМ. Ионы Mn+2, Ca+2 и Co+2 (1 мМ), а также твин-80 увеличивали его активность. Хитиназа гидролизовала субстрат по экзо-механизму, образуя диацетилхитобиозу в качестве основного продукта, а на более поздних стадиях реакции (3–4 ч) действовала как N-ацетил-β-D-глюкозаминидаза. Максимальная скорость гидролиза хитозана регистрировалась при степени деацетилирования (СД) полимера 50%, 70°С и отношении [E]/[S] = 1 : 60. Фунгицидная активность образуемых хитоолигомеров зависела от СД исходного полимера и в наибольшей степени возрастала при деструкции хитозана с СД 50%.
Внеклеточные ферменты термофильных микроорганизмов неизменно вызывают интерес, так как могут быть использованы в современной биотехнологии в силу их термостабильности и способности катализировать различные реакции при повышенных температурах [1, 2]. Высокие температуры способствуют улучшению растворимости гидрофобных соединений, снижают вязкость некоторых полимеров, предотвращают микробную контаминацию [3]. Исследования термостабильных хитиназ приобретает все большее значение в связи с возможностью широкого применения этих ферментов в медицине, сельском хозяйстве и защите окружающей среды [4]. Хитиназы применяются при биоконверсии многочисленных отходов промысловой переработки морепродуктов, таких как ракообразные и моллюски, обычно сбрасываемых в водоемы [5]. Термофильные микроорганизмы, продуцирующие хитиназы, могут также широко применяться для биокомпостирования хитин-содержащих отходов [6]. В процессе переработки такого вида сырья для осуществления эффективной деминерализации и депротеинирования, как правило, используются повышенные температуры. По сравнению с термохимическими способами обработки, приводящими к образованию низкокачественных гетерогенных гидролизатов, применение хитиназ и протеаз позволяет осуществлять прямую конверсию хитин-содержащего сырья в биоактивные хитоолигосахариды [5, 7–9]. Термостабильные хитиназы микробного происхождения могут осуществлять эффективную деполимеризацию хитозана со степенью деацетилирования 73% [10, 11]. Некоторые термотолерантные хитиназы проявляют инсектицидные, нематоцидные и антигрибные свойства, что позволяет использовать их в качестве агентов биоконтроля фитопатогенов и патогенов человека, а также насекомых-вредителей и нематод [4]. Повышение термостабильности хитиназ для биотехнологического применения достигается различными способами, включая поиск новых последовательностей термостабильных хитиназ и их клонирование, случайный и направленный мутагенез, генетическую и белковую инженерию [4, 12]. В то же время, поиск и выделение новых микробных продуцентов термотолерантных хитиназ из естественных и техногенных экосистем остается актуальной задачей для оценки разнообразия биохимических механизмов их функционирования в условиях повышенных температур. В настоящее время термофильные хитиназы обнаружены и охарактеризованы у большого круга микроорганизмов, включая археи, бактерии и микромицеты [4]. Довольно часто эти ферменты обнаруживаются у бацилл и близкородственных таксономических групп [6, 13–15]. Бактерии первоначально немногочисленного рода Cohnella, отделенного от рода Paenibacillus в 2006 г. [16], к настоящему времени насчитывают уже более 40 видов, многие из которых являются термофильными. Представители рода рассматриваются как перспективный источник новых ферментов, среди них описаны продуценты термостабильных целлюлаз, протеаз, липаз [17–21], однако термотолерантная хитиназа частично охарактеризована только у одного штамма – Cohnella sp. A01 [22].
Цель работы − характеристика хитиназы нового штамма Cohnella sp. IB-P192, выделенного из аридной почвы, и изучение возможности его использования для получения биологически активных олигомеров хитозана.
МЕТОДИКА
Объектом исследований являлся хитинолитический штамм Cohnella sp. IB-P192, выделенный в 2005 г. из почвенного образца полупустынной зоны штата Аризона (США) при скрининге новых экстремофильных продуцентов циклодекстринглюканотрансферазы (ЦГТ-азы). Штамм был выделен из накопительной культуры на жидкой элективной среде с 0.1% α-циклодекстрина (рН 7.4) при 60°С. Хитинолитическая активность штамма была обнаружена позднее, при изучении его способности к утилизации различных источников углерода. В 2019 г. штамм был депонирован во Всероссийской коллекции микроорганизмов (ВКМ) под номером B-3462.
Культурально-морфологические и некоторые физиолого-биохимические свойства штамма изучали, согласно руководству Берджи [23], и описанным ранее методам [24]. Филогенетическое положение штамма IB-192 устанавливали на основе анализа последовательности гена 16S рРНК. Выделение и очистку геномной ДНК осуществляли в соответствии с протоколом, представленным в работе [25]. Амплификацию 16S рДНК проводили с помощью ПЦР в стандартных условиях, используя универсальные бактериальные праймеры 16SF27 5'-AGAG TTTGATCMTGGCTCAG-3' и 16SR1512 5'-ACGGCTACCTTGTTACG ACTT-3' [26]. Реакционная смесь (20 мкл) состояла из 10 × буфера для Taq-ДНК-полимеразы (2.5 мM MgCl2), по 0.5 мкМ каждого праймера, 2 мкл ДНК-матрицы, 0.8 мМ смеси дНТФ и 1 ед. Taq ДНК-полимеразы (“Евроген”, Россия). ПЦР проводили в амплификаторе MasterCycler Personal (“Eppendorf”, Германия) согласно следующей схеме: денатурация ДНК – 2 мин при 95°С (×1 цикл), отжиг праймеров – 1 мин при 57°С, элонгация – 5 мин при 72°С (×30 циклов). Продукты ПЦР разделяли с помощью горизонтального электрофореза в 1%-ном агарозном геле с маркером длин 100 + bp (“Евроген”, Россия) и визуализировали обработкой геля 0.1%-ным раствором бромистого этидия (“AppliChem”, Германия). Очистку ампликона осуществляли согласно протоколу QIAGEN Gel Purification Kit (“QIAGEN”, Германия). Секвенирование целевого фрагмента проводили с применением набора реактивов “Big Dye Terminator” на автоматическом секвенаторе Genetic Analyser 3500XL “Applied Biosystems” (США). Полученная нуклеотидная последовательность гена 16S рРНК длиной 1494 п.н. депонирована в базе данных NCBI под номером FN432806 (https://www.ncbi.nlm.nih.gov/nuccore/254826544).
Поиск гомологичных последовательностей 16S рРНК в базе GenBank осуществляли с помощью программы BLAST. Множественное выравнивание нуклеотидных последовательностей и построение дендрограммы филогенетического сходства методом присоединения соседей с использованием модели Джукса-Кантора осуществляли с помощью программы Mega X 10.0.4 [27]. Достоверность ветвления оценивали с помощью бутстреп-анализа из заданных 500 альтернативных филогенетических деревьев.
Штамм поддерживали пересевами при 50°С на плотную среду с 0.5% коллоидного хитина или картофельного крахмала, следующего состава (г/л): K2HPO4·3H2O – 1.0; KH2PO4 – 1.0; (NH4)2HPO4 – 0.5; MgSO4·7H2O – 0.2; CaCl2 – 0.01; пептон ферментативный – 3.0; экстракт дрожжевой – 3.0; экстракт кукурузный – 0.5; агар – 16; дистиллированная вода – 1000; рН 6.5–6.8. Для выделения ферментов хитинолитического комплекса штамм выращивали в течение 72 ч в жидкой среде того же состава с 0.5% коллоидного хитина в качестве основного источника углерода на шейкере-инкубаторе Innova 40R (“New Brunswick”, США) при 250 об./мин и 50°С. Влияние температуры на рост штамма Cohnella sp. IB-P192 и продукцию им хитиназы изучали при его культивировании в среде вышеописанного состава, а также мясопептонном бульоне (МПБ) в интервале температур 35–60°С при 250 об./мин. Интенсивность роста бактерий оценивали по оптической плотности при 600 нм после 24 ч культивирования в МПБ, хитиназную активность – после 72 ч культивирования в среде с 0.5% коллоидного хитина.
В работе использовали коллоидный хитин, полученный из очищенного крабового хитина (ООО “Биопрогресс”, Россия), а также хитозан со степенью деацетилирования (СД) 85 и 50% [28].
Количественный анализ хитиназной и хитозаназной активности Cohnella sp. IB-P192, включая вискозиметрическую оценку деполимеризации хитозана, а также определение концентрации белка проводили, как было описано ранее [28, 29]. За единицу хитиназной активности принимали количество фермента, катализирующее образование 1 мкМ-экв N-ацетил-D-глюкозамина за 1 мин в 1 мл реакционной смеси. Выделение и очистку хитиназы проводили согласно схеме, представленной в работе [30].
Степень гомогенности и молекулярную массу очищенного фермента определяли с помощью вертикального электрофореза в 12.5%-ном ПААГ с 0.1% ДДС-Na по Лэммли, используя систему Mini-Protean Tetra Cell (“Bio-Rad”, США) при Vconst = 200 B. В качестве маркеров использовали набор рекомбинантных белков с интервалом ММ 5–250 кДа (“Thermo Scientific”, США). Разделенные белки в геле окрашивали коллоидным раствором Кумасси ярко-синего G-250 в смеси H3PO4 (85%), C2H5OH–H2O (2 : 20 : 80, об./об.), содержащей 8% сульфата аммония.
рН-оптимум очищенной хитиназы определяли в стандартных условиях реакции, инкубируя фермент с 0.5%-ным коллоидным хитином при 50°С в течение 1 ч, в интервале рН 3.0–10.5. В качестве буферных растворов использовали фосфатно-цитратный (0.2 М, рН 3.0–7.5), натрий-фосфатный (0.2 М, рН 7.5–8.0), трис-HCl (0.1 М, рН 8.0–9.0) и карбонатный (0.1 М, рН 9.5–10.5) буферы. Для оценки рН-стабильности хитиназы фермент предварительно инкубировали в присутствии вышеуказанных буферов в течение 24 ч при 5°С, затем доводили инкубированные растворы фермента до рН 6.0 с помощью фосфатно-цитратного буфера и измеряли остаточную активность в стандартных условиях. За 100% принимали активность фермента, не инкубированного в присутствии буферов. Температурный оптимум очищенной хитиназы определяли в интервале 35–75°С в стандартных условиях реакции (0.5% коллоидного хитина, рН 6.0, 1 ч инкубации). Термостабильность фермента оценивали по уровню остаточной активности (%) после 1 ч предварительной инкубации при 35–75°С в отсутствии субстрата. При анализе влияния катионов металлов и ПАВ на активность очищенной хитиназы использовали соли AgNO3, CaCl2, Co(NO3)2, CuSO4, FeSO4, HgCl2, KI, MnCl2, NiCl2, а также ДДС-Na, ПЭГ-300, твин-80 и тритон Х-100. Раствор фермента с активностью около 0.46 ед./мл смешивали с растворами солей или ПАВ до концентрации последних 1.0 и 10 мМ, доводили до конечного объема 1 мл деионизированной водой и инкубировали 60 мин с 0.5%-ным коллоидным хитином при рН 6.0 и 50°С. В контрольном образце (100%) растворителем являлась деионизированная вода.
Влияние субстрата на скорость ферментативной реакции изучали в интервале концентраций коллоидного хитина 0–12 мг/мл. Значения константы Михаэлиса KM и максимальную скорость реакции Vmax рассчитывали в соответствии с графиком зависимости обратных величин [S] и [V] Лайнуивера-Берка, а также на основе экспериментальной оценки 1-часовой кинетики гидролиза 0.5% коллоидного хитина.
Специфичность и механизм действия очищенной хитиназы изучали с помощью тонкослойной хроматографии (ТСХ), а также на основе сравнительной оценки динамики гидролиза хромогенных аналогов хитинового димера (п-нитрофенил-N-ацетил-β-D-глюкозаминид, “Sigma”, США) и тримера (п-нитрофенил-N, N’-диацетил-β-D-хитобиозид, “Sigma”, США). Скорость гидролиза этих субстратов определяли как количество (мкМ) п-нитрофенола, освобождаемого за 1 мин в 1 мл реакционной смеси. Концентрацию свободного красителя определяли спектрофотометрически при 405 нм по калибровочному графику, построенному для коммерческого п-нитрофенола (“Sigma”, США). Образцы ферментативного гидролизата коллоидного хитина очищенной хитиназой (0.44 ед./мл), отобранные после 10, 30, 60, 180 и 240 мин инкубации при 50°С, наносили по 1–2 мкл на пластины Kieselgel 60 F254 (10 × 20 см) (“Merck”, Германия). В качестве подвижной фазы использовали смесь н-бутанол–28%-ный раствор аммиака–метанол–вода (5 : 4 : 2 : 1). После ТСХ пластины высушивали, опрыскивали 0.44%‑ным раствором бензальдегида (“Merck”, Германия) в смеси н-бутанол–концентрированная соляная кислота–этанол (9 : 1.5 : 1) и нагревали в течение 3 мин при 120°С для проявления разделенных продуктов гидролиза. В качестве стандарта использовали смесь коммерческих сахаров, включающую N-ацетил-D-глюкозамин, N, N'-диацетил-β-D-хитобиозу и N, N', N"-триацетил-β-D-хитотриозу (“Sigma”, США).
Молекулярно-массовое распределение олигомерных продуктов частичного гидролиза хитозана (СД 85%) хитинолитическим комплексом Cohnella sp. IB-P192 анализировали с помощью эксклюзионной ВЭЖХ (HP-SEC) на колонке (7.8 × 300 мм) PolySep-GFC-P 4000 (“Phenomenex”, США) в условиях, описанных ранее в работе [28]. ВЭЖХ проводили на жидкостном хроматографе S-2100 (“Sykam”, Германия).
Анализ фунгицидной активности олигомерных продуктов деполимеризации хитозанов со СД 85% и 50% проводили в 96-луночных полистирольных культуральных планшетах (“Corning Inc.”, США) согласно ранее описанной методике [28]. В качестве тест-объектов использовали штаммы фитопатогенных микромицетов из коллекций ВКМ и УИБ РАН – Alternaria alternata (Fr.) Keisl. ВКМ F-3047, Bipolaris sorokiniana(Sacc.) Shoemaker ИБ Г-12, Botrytis cinerea Pers. F-894, Fusarium culmorum (Wm.G.Sm.) Sacc. ВКМ F-844, F. oxysporum ВКМ (Schlecht.) Snyd. et Hans. F-137 и Rhizoctonia solani J.G. Kühn ВКМ F-895.
Эксперименты по оценке ферментативной и фунгицидной активности проводили в трехкратной повторности, статистическую обработку результатов осуществляли с помощью программы OriginPro 2018 (версия b9.5.0.193, “OriginLab Corp.”). Достоверными считали различия между сравниваемыми выборками при p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Новый штамм Cohnella sp. IB-P192 является аэробом, развивающимся преимущественно при температурах 40–60°С, рН 6–8 (оптимум роста рН 6.5) и концентрациях NaCl ≤ 1.5%. Штамм имел каталазоположительную реакцию, утилизировал глюкозу, сахарозу и маннит с образованием кислоты, гидролизовал крахмал, не использовал ацетат, пропионат и цитрат. Согласно морфологическому описанию, штамм представлен неподвижными одиночными и парными клетками палочковидной формы размером 0.5–0.8 × 3–5.0 мкм, образующими субцентрально расположенные эллипсовидные эндоспоры, раздувающие клетки. При росте на минеральных средах штамм формирует небольшие (2–3 мм) круглые матовые колонии с плоской гладкой поверхностью, белого цвета и мягкой консистенцией.
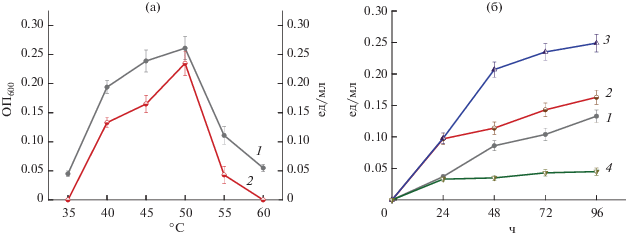
Анализ последовательности гена 16S рРНК выявил высокую гомологию (99.7%) исследуемого штамма с типовым термотолерантным видом Cohnella laevoribosii RI-39Т (рис. 1). Данный штамм был выделен из почвы вулканического происхождения и способен расти в интервале температур 37–60°С [31]. Следует отметить, что единственный штамм Cohnella sp. A01, у которого ранее была частично охарактеризована термостабильная хитиназа [22], образует практически единую ветвь со штаммом IB-P192 на филогенетическом древе (данные не показаны). В то же время, в филогенетическом отношении Cohnella sp. IB-P192 довольно удален (степень гомологии 97%) от типового представителя рода, C. thermotolerans CCUG 47242 [16]. Экологически бактерии рода Cohnella распространены довольно широко, встречаясь в различных природных зонах, хотя жизнеспособные споры новых видов обнаружены даже в вечной мерзлоте субарктических областей Восточной Сибири (Россия) [32]. В целом, распространение этой группы связано с тропическими и субтропическими природными экосистемами, а также локальными местообитаниями, в которых преобладают умеренно повышенные температуры (40–60°С). Большинство представителей Cohnella являются термофильными или термотолерантными бактериями, многие из которых способны к синтезу термостабильных ферментов, перспективных для биотехнологического применения. Ранее охарактеризованный хитинолитический штамм Cohnella sp. A01 был выделен из сточных вод фермы по разведению креветок в засушливой области Абадана со средней летней температурой 55°С [22]. Штамм Cohnella sp. IB-P192, выделенный как перспективный продуцент β-циклодекстринглюканотрансферазы, активно гидролизовал коллоидный хитин (индекс размера зон гидролиза 3.5–4.0) на агаризованной среде при 50°С (рис. 2). В жидкой среде штамм показывал оптимум роста и синтеза хитиназы при 45–50°С (рис. 3а). Биомасса достигала максимума на 24 ч, тогда как наибольший уровень секреции хитиназы достигался после 48–72 ч культивирования (рис. 3б).
Рис. 1.
Филогенетическое древо на основе сравнительного анализа последовательности гена 16S рРНК штамма Cohnella sp. IB-Р192 и ближайших последовательностей типовых представителей рода Cohnella. Цифрами показана статистическая достоверность ветвления, определенная бутстреп-анализом пятисот альтернативных деревьев (приведены значения >50%). Масштаб отражает эволюционное расстояние, соответствующее 5 нуклеотидным заменам на каждые 1000 нуклеотидов. В скобках указаны номера, под которыми последовательности депонированы в базе данных GenBank.
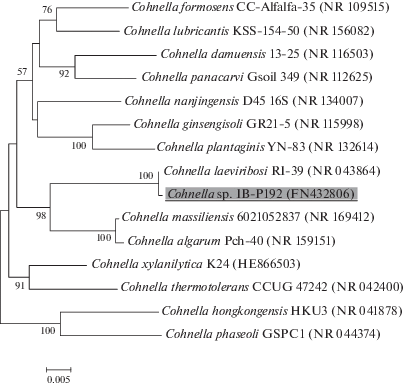
Рис. 2.
Гидролиз коллоидного хитина на чашках Петри с агаризованной средой штаммом Cohnella sp. IB-Р192 после 96 ч инкубации при 50°С.
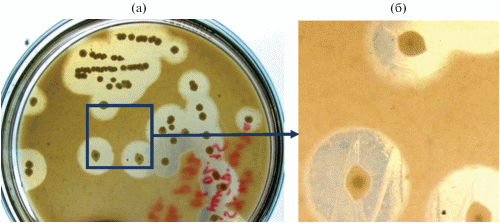
Рис. 3.
Влияние температуры культивирования на бактериальный рост (1) и продукцию (2) внеклеточной хитиназы (а), а также на динамику секреции хитинолитических ферментов (б) штаммом Cohnella sp. IB-Р192 в глубинной культуре (250 об./мин). б: 1 – 40; 2 – 45; 3 – 50; 4 – 55°С.
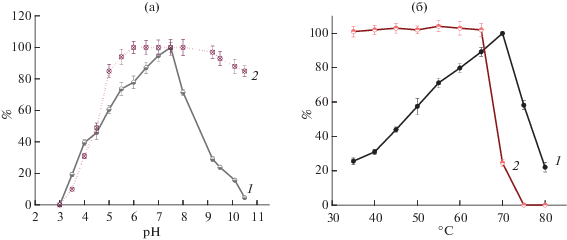
Очистку хитиназы Cohnella sp. IB-P192 проводили методами ультрафильтрации, аффинной сорбции и гидрофобной хроматографии (рис. 4а). В результате адсорбции на коллоидном хитине хитиназы Cohnella sp. IB-P192 распределялись примерно поровну между фракциями связываемых и свободных белков (табл. 1). Согласно данным денатурирующего электрофореза, основная хитиназа с молекулярной массой (ММ) ~ 69 кДа находилась во фракции белков, адсорбирующихся на специфическом субстрате (фракция а) (рис. 4в). Минорная группа с идентичной ММ обнаруживалась во фракции несвязавшихся белков (фракция б), доминирующими среди них были два белка с ММ ~ 62 и 51 кДа (рис. 4в). Эти результаты свидетельствуют о наличии в хитинолитическом комплексе Cohnella sp. IB-P192 примерно равных по соотношению фракций ферментов, различающихся по их способности связываться с хитином. Тем не менее, обе фракции фермента одинаково хорошо очищались от 90% белковых примесей в идентичных условиях гидрофобной хроматографии на фенил-сефарозе (рис. 4б). Наибольшую удельную активность при 44-кратной степени очистки имела доминирующая хитиназа с ММ 69 кДа, способная связываться с хитином (рис. 4 в, табл. 1). Близкие по молекулярной массе термофильные хитиназы были описаны ранее у штаммов Bacillus licheniformis X-7U, Bacillus sp. MH-1, B. licheniformis Mb-2, Paenibacillus timonensis LK-DZ15 [6, 13, 14, 33]. Как и хитиназа Cohnella sp. A01, очищенная хитиназа штамма IB-P192 (69 кДа) проявляла максимальную активность при 70°С, однако, в отличие от нее, полностью инактивировалась за 15 мин инкубации при 80°С (рис. 5б). В то же время, хитиназа Cohnella sp. IB-P192 сохраняла 100% активности в течение часа инкубации при 65°С, что позволило характеризовать ее как умеренно термостабильный фермент. Различие в термостабильности хитиназ может объясняться тем, что фермент Cohnella sp. A01 исследовался авторами как неочищенный препарат после осаждения сульфатом аммония [22]. В отличие от хитиназы Cohnella sp. A01 с рН-оптимумом при рН 4–6, хитиназа штамма IB-P192 имела оптимум рН 7.0–7.5 и была стабильна в интервале рН 5.0–10.5 (рис. 5а). В стандартных условиях анализа активность фермента полностью ингибировалась в присутсвии катионов Ag+, Hg+2 (1–10 мМ) и незначительно (10–20%) – Cu+2, Ni+2 (данные не представлены). Катионы Mn+2, Ca+2 и Co+2 (1 мМ) активировали хитиназу на 15–20%; наибольшая активация (~90%) отмечалась при добавлении в реакционную смесь 1 мМ твина-80. Среди других ПАВ выраженным ингибирующим эффектом (~40%) характеризовался только 1 мМ ДДС-Na.
Рис. 4.
Общая схема очистки хитиназы Cohnella sp. IB-Р192 (а), гидрофобная хроматография на фенил-сефарозе CL 4 B (б) и денатурирующий электрофорез фермента (в) на различных этапах очистки в 12.5%-ном ПААГ с 0.1% ДДС-Na. б: 1 – белок (ОП280); 2 – хитиназная активность (ед/мл); 3 – градиент концентрации сульфата аммония (М) в элюирующем буфере. в: 1 – неочищенный ферментный препарат (КЖ); 2 – фракция А, адсорбированная на коллоидном хитине; 3 – очищенная хитиназа с ММ 69 кДа после гидрофобной хроматографии; 4 – фракция Б несвязанных белков с хитиназной активностью после стадии аффинной сорбции; М – смесь маркерных белков PageRuler Broad Range (Thermo Scientific).
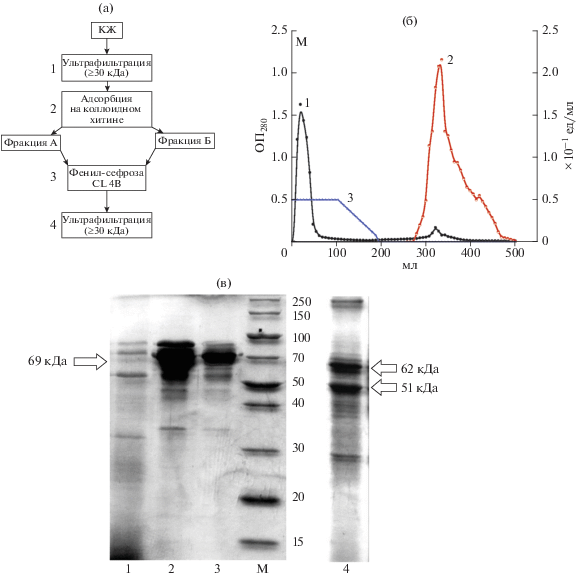
Таблица 1.
Очистка хитиназы Cohnella sp. IB-P192
| Стадия очистки | Активность хитиназы, ед | Белок, мг | Удельная активность хитиназы, ед/мг белка | Степень очистки | Выход фермента, % |
|---|---|---|---|---|---|
| КЖ | 144 | 3696 | 0.039 | 1 | 100 |
| Ультрафильтрация VivaFlow 200, 10 кДа | 122 | 982 | 0.124 | 3.2 | 85 |
| Адсорбция на 1%-ном коллоидном хитине | |||||
| Адсорбированная фракция (А) | 60 | 302 | 0.199 | 5.1 | 42 |
| Неадсорбируемая фракция (Б) | 62 | 680 | 0.091 | 2.3 | 43 |
| Гидрофобная хроматография на фенил-сефарозе CL 4B | |||||
| Очистка фракции А | 33.6 | 41.5 | 0.810 | 21 | 23 |
| Очистка фракции Б | 52.7 | 149 | 0.354 | 9 | 37 |
| VivaPore 10/20 | |||||
| Фракция А | 18.5 | 10.8 | 1.706 | 44 | 13 |
| Фракция Б | 22.2 | 23.9 | 0.929 | 24 | 15 |
Рис. 5.
Влияние рН (а) и температуры (б) инкубации на активность (%, 1) и стабильность (%, 2) очищенной хитиназы Cohnella sp. IB-Р192.
Экспериментальный расчет кинетических характеристик при максимальном разведении фермента, а также анализ зависимости обратных величин [S] и [V], согласно уравнению Лайнуивера-Берка, давали значения константы Михаэлиса и максимальной скорости реакции 0.83 мг/мл и 44.34 мкМ/мл×мин соответственно (рис. 6а, 6б). Анализ в течение 1 ч кинетики гидролиза коллоидного хитина при соотношении фермент-субстрат ~0.18 ед./мг показал несколько меньшую Vmax (37.2 мкМ/мл × мин), регистрируемую в первые 10 мин инкубации (рис. 6 в). Удельная Vmax (116.75 мкМ/мл × мин × мг белка) хитиназы IB-P192 по отношению к коллоидному хитину, а также п-НФ-(GlcNAc)2 (табл. 2) была достаточно высокой по сравнению с другими термостабильными хитиназами [10, 13, 15, 34].
Рис. 6.
Влияние концентрации коллоидного хитина [S] на скорость гидролиза субстрата очищенной хитиназой Cohnella sp. IB-Р192 (а), зависимость между обратными величинами [S] и [V] (график Лайнуивера-Берка) (б) и кинетика ферментативного гидролиза хитина при соотношении фермент-субстрат 0.18 ед/мг (в).
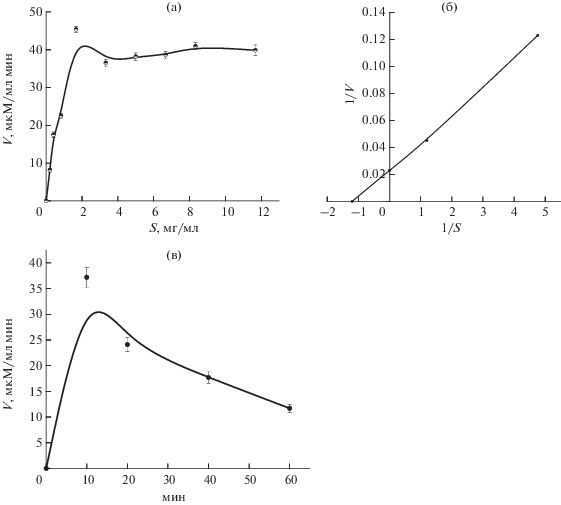
Таблица 2.
Субстратная специфичность очищенной хитиназы Cohnella sp. IB-P192 (фракция А)
| Субстрат, 0.5% | Максимальная скорость гидролиза (60 мин, 50°С) |
|
|---|---|---|
| мкМ/мл × мин | % | |
| Коллоидный хитин | 44.34* | 100 |
| Хитозан растворимый (СД 85%) | 0.45 | 1 |
| Хитозан растворимый (СД 50%) | 23.33 | 53 |
| Na-КМЦ | 0.26 | 0.6 |
| β-1,3-1,4-глюкан | 0.30 | 0.7 |
| Ламинарин (β-1,3-глюкан) | 0.25 | 0.6 |
| Галактоманнан | 0.16 | 0.4 |
| п-НФ-(GlcNAc)2 | 57 259** | — |
| п-НФ-GlcNAc | 5.21** | — |
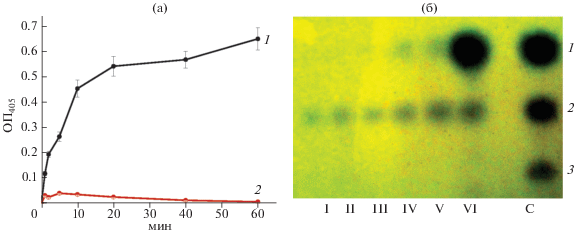
Хитиназа Cohnella sp. IB-P192 показывала типичный образец гидролиза хромогенного аналога хитинового тримера п-НФ-(GlcNAc)2, характерный для большинства бактериальных экзохитиназ (рис. 7а). При используемой концентрации фермента (0.015 ед./мл) скорость гидролиза этого субстрата (>57 тыс. мкМ/мл × мин) на три порядка превышала относительную скорость расщепления п-НФ-GlcNAc, характеризующую уровень N-ацетил-β-D-глюкозаминидазной активности (табл. 2). ТСХ-анализ продуктов расщепления коллоидного хитина очищенным ферментом подтверждает экзо-механизм гидролиза субстрата с образованием димера в качестве основного продукта реакции (рис. 7б). После 3–4 ч ферментативной реакции в реакционной смеси обнаруживались менее значительные примеси мономера, что может быть связано с его накоплением в качестве побочного продукта при избытке в среде димера. Среди бактериальных экзохитиназ описаны ферменты, гидролизующие полимерный хитин с образованием исключительно мономера как единственного продукта реакции [35]. Термостабильная экзохитиназа Paenibacillus barengoltzii также на начальных этапах гидролизовала коллоидный хитин с образованием димера, который после 1 ч реакции частично конвертировался в мономер [34]. Можно предположить, что хитиназа Cohnella sp. IB-P192 расщепляет субстрат по сходному механизму, однако ее специфичность в отношении димера, по-видимому, существенно ниже и требует более высокого фермент-субстратного соотношения. Отчасти это подтверждается образованием высоких концентраций мономера в результате гидролиза хитина при аффинной очистке фермента (рис. 7б). Однако, поскольку адсорбция происходила из неочищенного препарата хитиназы, этот результат может быть связан с действием специфичных N-ацетилглюкозаминидаз, способных связываться с полимерным субстратом.
Рис. 7.
Динамика гидролиза хромогенных аналогов хитинового тримера (1) и димера (2) очищенной хитиназой Cohnella sp. IB-Р192 ([E] = 0.015 ед./мл) (а) и тонкослойная хроматография продуктов ферментативного гидролиза коллоидного хитина (б) при 10 (I), 30 (II), 60 (III), 180 (IV) и 240 (V) мин инкубации. VI – продукты, образуемые адсорбированной хитиназой при гидролизе коллоидного хитина на стадии аффинной сорбции. С – коммерческие стандарты N-ацетил-D-глюкозамина (1), а также его димера (2) и тримера (3).
Субстратная специфичность очищенной хитиназы в отношении хитозана высокой степени деацетилирования (СД 85%) была низкой, однако эффективность гидролиза частично ацетилированного хитозана (СД 50%) этим ферментом была почти сравнима с его действием на хитин (табл. 2). Хитиназа практически не гидролизовала КМЦ и ряд других β-глюканов.
Помимо деполимеризации хитин-содержащих субстратов, бактериальные хитиназы широко изучаются с целью получения водорастворимых биоактивных хитоолигомеров для ограниченной деполимеризации хитозана. Экзохитиназы, подобные ChiA и ChiB из Serratia marcescens, действуют на хитозан как эндо-ферменты и способны эффективно расщеплять полимер с СД до 80% [36]. Использование термостабильных хитиназ может способствовать увеличению глубины деполимеризации и снизить время обработки субстрата. Было изучено действие хитинолитического комплекса (КЖ) Cohnella sp. IB-P192 на хитозан с СД 85 и 50%. Как и при действии очищенного фермента, скорость образования восстанавливающих сахаров при гидролизе хитозана с СД 85% под влиянием КЖ была ~10 раз ниже, чем при действии на частично ацетилированный хитозан (рис. 8в). Несмотря на относительно низкую сахаробразующую активность, хитинолитический комплекс Cohnella sp. IB-P192 снижал вязкость раствора хитозана (СД 85%) в 2.5–3 раза при соотношениях от 1 : 240 до 1 : 60 и температуре 50°С (рис. 8а). Увеличение соотношения фермент – субстрат и температуры инкубации приводило к существенному повышению скорости деполимеризации на начальном этапе (10 мин) реакции (рис. 8а, 8б). Наибольшее снижение вязкости (в 5 раз) раствора субстрата было достигнуто при 70°С и соотношении фермент-субстрат 1 : 120 в первые 5 мин инкубации (рис. 8б). Вискозиметрический анализ ферментативной деполимеризации хитозана с СД 50% показал более глубокое снижение (на 90–99%) вязкости раствора субстрата в первые 2–5 мин инкубации (данные не представлены). Глубина гидролиза хитозана СД 85% до олигомеров, не осаждаемых щелочью, после 1 ч обработки хитинолитическим комплексом Cohnella sp. IB-P192 при стандартных условиях составляла около 22%. ВЭЖХ-анализ молекулярно-массового распределения продуктов реакции, образуемых при соотношении фермент-субстрат 1 : 240, температуре 50°С и времени инкубации 1 ч, выявил наличие олигохитозанов со значениями среднечисловой (Mn) и средневесовой (Mw) молекулярной массы 30.5 и 70.6 кДа, индексом полидисперсности 2.32 при общем выходе ~58% (рис. 9). Полученные данные свидетельствуют о возможности применения хитиназ Cohnella sp. IB-P192 для получения олигомеров хитозана с широким спектром молекулярной массы при минимальном образовании низкомолекулярных хитоолигосахаридов, обладающих незначительной антимикробной активностью.
Рис. 8.
Влияние соотношения фермент-субстрат (а) и температуры инкубации (б) на изменение кинематической вязкости 1.3%-ного раствора хитозана (СД 85%) в 0.1 М натрий-ацетатном буфере, рН 6.0, динамика образования восстанавливающих сахаров (в) при гидролизе хитозанов с СД 85 (1) и 50% (2) неочищенной хитиназой при концентрации 0.04 ± 0.01 ед./мл и 50°С. а: 1 – 1 : 240, 2 – 1 : 120 и 3 – 1 : 60; б: 1 – 50, 2 – 60 и 3 – 70°С (сonst [E]/[S] = 1 : 120).
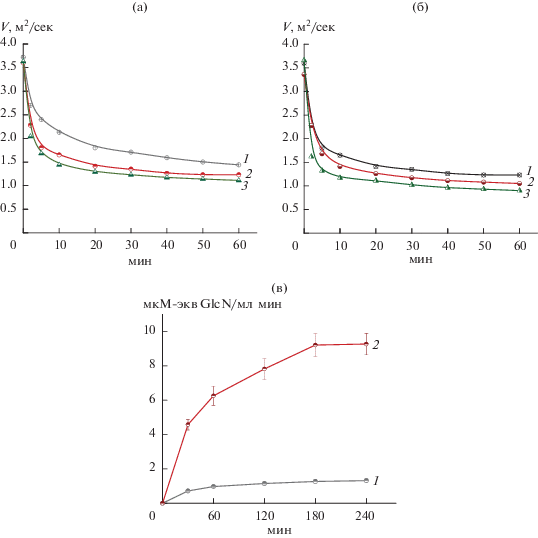
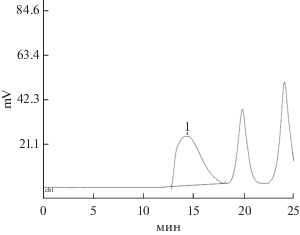
Рис. 9.
Высокоэффективная эксклюзионная хроматография (HP-SEC) олигомерного хитозана, полученного после гидролиза хитозана СД 85% хитинолитическим комплексом Cohnella sp. IB-Р192 в течение 1 ч.
Сравнительный анализ показал снижение фунгицидной активности олигомеров, полученных при гидролизе хитозана с СД 85% в течение 1 ч хитиназным комплексом Cohnella sp. IB-P192 по сравнению с исходным полимером, в отношении штаммов микромицетов Alternaria alternata, Bipolaris sorokiniana, Fusarium culmorum, F. oxysporum и Rhizoctonia solani (табл. 3). Увеличение активности олигомеров отмечалось только против Botrytis cinerea. Снижение антимикробной активности продуктов глубокого ферментативного расщепления хитозана является общепризнанным фактом, однако в случае высших олигомеров эти данные несколько различаются [37].
Таблица 3.
Антигрибная активность хитозанов СД 85 и 50% и их олигомеров, полученных после 1 ч гидролиза хитинолитическим ферментным комплексом (КЖ) Cohnella sp. IB-P192*
| Тест-объект | МИК и ЭД90 для микромицетов, мкг/мл | |||||||
|---|---|---|---|---|---|---|---|---|
| хитозан СД 85% | хитозан СД 50% | |||||||
| исходный полимер | гидролизат | исходный полимер | гидролизат | |||||
| МИК | ЭД90 | МИК | ЭД90 | МИК | ЭД90 | МИК | ЭД90 | |
| A. alternata | 25 ± 5 | 105 ± 15 | 50 ± 7 | 165 ± 18 | 60 ± 7 | 180 ± 14 | 15 ± 5 | 95 ± 14 |
| B. sorokiniana | 20 ± 4 | 65 ± 7 | 30 ± 5 | 80 ± 7 | 35 ± 4 | 105 ± 7 | 15 ± 2 | 70 ± 5 |
| B. cinerea | 120 ± 7 | 235 ± 15 | 65 ± 7 | 190 ± 14 | 110 ± 7 | 215 ± 14 | 10 ± 2 | 90 ± 7 |
| F. culmorum | 50 ± 4 | >150 | 25 ± 4 | 150 ± 14 | 25 ± 6,1 | >200 | 25 ± 4 | 150 ± 14 |
| F. oxysporum | 100 ± 6,8 | >200 | 125 ± 7 | >200 | 100 ± 12 | >200 | 145 ± 14 | ≥225 |
| R. solani | 20 ± 4 | 75 ± 7 | 25 ± 5 | 125 ± 7 | 25 ± 2 | 175 ± 14 | 20 ± 2 | 100 ± 12 |
При относительно небольшом снижении активности, хорошая растворимость хитоолигосахаридов в воде становится более существенным критерием эффективности ферментативной деструкции хитозана. В то же время, оптимизация ключевых параметров процесса (СД исходного полимера, соотношение фермент-субстрат, температура и длительность процесса деполимеризации) позволит увеличить выход олигомеров с более высоким уровнем биологической активности. В отличие от хитозана с СД 85%, ингибирующая активность продуктов гидролиза хитозана с СД 50% ферментным комплексом Cohnella sp. IB-P192 значительно возрастала по отношению большинства тестированных штаммов микромицетов (кроме F. oxysporum) по сравнению с исходным полисахаридом (табл. 3). Эти результаты подтверждают возможности оптимизации ферментативного получения биоактивных хитоолигосахаридов с помощью хитиназы Cohnella sp. IB-P192 путем подбора субстрата с определенной степенью деацетилирования.
Таким образом, в настоящей работе впервые подробно охарактеризована термостабильная экзохитиназа с ММ 69 кДа из нового изолята Cohnella sp. IB-P192, синтез которой индуцируется в присутствии крабового коллоидного хитина. Фермент характеризовался оптимумом температуры 70°С и рН 7.5 и проявлял активность N-ацетил-β-D-глюкозаминидазы на поздних стадиях гидролиза субстрата. Анализ каталитических свойств очищенной хитиназы свидетельствует о высокой удельной скорости гидролиза субстрата Vmax, что позволяет считать данный фермент перспективным для биотехнологической конверсии хитинсодержащих субстратов при повышенных температурах до димера и мономера. Эффективность деполимеризации хитозана исследуемым ферментом возрастала с ростом СД субстрата до 50% и температуры инкубации до 70°С. Хитинолитический комплекс Cohnella sp. IB-P192 может быть использован для ограниченного гидролиза хитозана с целью получения высших олигомеров хитозана (n > 12, Mw > 2 кДа), обладающих значительной фунгицидной активностью (ЭД90 = 70–200 мкг/мл).
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-34-90119, а также в рамках государственного задания Минобрнауки России № 075-00326-19-00 по теме № АААА-А18-118022190098-9.
При проведении исследований использовали оборудование ЦКП “Агидель” УФИЦ РАН.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Haki G.D., Rakshit S.K. // Bioresour. Technol. 2003. V. 89. № 1. P. 17–34. https://doi.org/10.1016/s0960-8524(03)00033-6
Vieille C., Zeikus G.J. // Microbiol. Mol. Biol. Rev. 2001. V. 65. № 1. P. 1–43. https://doi.org/10.1128/MMBR.65.1.1-43.2001
Zeldes B.M., Keller M.W., Loder A.J., Straub C.T., Adams M.W.W., Kelly R.M. // Front. Microbiol. 2015. V. 6. P. 1209. https://doi.org/10.3389/fmicb.2015.01209
Mathew G.M., Madhavan A., Arun K.B., Sindhu R., Binod P., Singhania R.R., Sukumaran R.K., Pandey A. // Appl. Biochem. Biotechnol. 2021. V. 193. № 1. P. 142–164. https://doi.org/10.1007/s12010-020-03416-5
Kumar M., Vivekanand V., Pareek N. // Environmental Microbiology and Biotechnology. Ed. by Singh A., Srivastava S., Rathore D., Pant D. Springer, Singapore, 2020. https://doi.org/10.1007/978-981-15-6021-7_7
Sakai K., Yokota A., Kurokawa H., Wakayama M., Moriguchi M. // Appl. Environ. Microbiol. 1998. V. 64. № 9. P. 3397–402. https://doi.org/10.1128/AEM.64.9.3397-3402.1998
Liang T.-W., Chen Y.-J., Yen Y.-H., Wang S.-L. // Process Biochem. 2007. V. 42. № 4. P. 527–534. https://doi.org/10.1016/j.procbio.2006.10.005
Kumar A., Kumar D., George N., Sharma P., Gupta N. // Int. J. Biol. Macromol. 2018. V. 109. P. 263–272. https://doi.org/10.1016/j.ijbiomac.2017.12.024
Liaqat F., Eltem R. // Carbohydr. Polym. 2018. V. 184. P. 243–259. https://doi.org/10.1016/j.carbpol.2017.12.067
Hobel C.F., Hreggvidsson G.O., Marteinsson V.T., Bahrani-Mougeot F., Einarsson J.M., Kristjánsson J.K. // Extremophiles. 2005 V. 9. № 1. P. 53–64. https://doi.org/10.1007/s00792-004-0422-3
Krolicka M., Hinz S.W.A., Koetsier M.J., Joosten R., Eggink G., van den Broek L.A.M., Boeriu C.G. // J. Agric. Food Chem. 2018. V. 66. № 7. P. 1658–1669. https://doi.org/10.1021/acs.jafc.7b04032
Xu P., Ni Z.-F., Zong M.-H., Ou X.-Y., Yang J.-G., Lou W.-Y. // Int. J. Biol. Macromol. 2020. V. 150. P. 9–15. https://doi.org/10.1016/j.ijbiomac.2020.02.033
Takayanagi T., Ajisaka K., Takiguchi Y., Shimahara K. // Biochim. Biophys. Acta. 1991. V. 1078. № 3. P. 404–410. https://doi.org/10.1016/0167-4838(91)90163-t
Toharisman A., Suhartono M.T., Spindler-Barth M., Hwang J.-K., Pyun Y.-R. // World J. Microbiol. Biotechnol. 2005. V. 21. № 5. P. 733–738. https://doi.org/10.1007/s11274-004-4797-1
Asmani K.L., Bouacem K., Ouelhadj A., Yahiaoui M., Bechami S., Mechri S., Jabeur F., Taleb-Ait Menguellet K., Jaouadi B. // Carbohydr. Res. 2020. V. 495:108089. https://doi.org/10.1016/j.carres.2020.108089
Kämpfer P., Rosselló-Mora R., Falsen E., Busse H.J., Tindall B.J. // Int. J. Syst. Evol. Microbiol. 2006. V. 56. (Pt 4). P. 781–786. https://doi.org/10.1099/ijs.0.63985-0
Yoon M.H., Ten L.N., Im W.T. // J. Microbiol. Biotechnol. 2007. V. 17. № 6. P. 913–918.
Rastogi G., Bhalla A., Adhikari A., Bischoff K.M., Hughes S.R., Christopher L.P., Sani R.K. // Bioresour. Technol. 2010. V. 101. № 22. P. 8798–8806. https://doi.org/10.1016/j.biortech.2010.06.001
Golaki B.P., Aminzadeh S., Karkhane A.A., Yakhchali B., Farrokh P., Khaleghinejad S.H., Tehrani A.A., Mehrpooyan S. // Protein Expr. Purif. 2015. V. 109. P. 120–126. https://doi.org/10.1016/j.pep.2014.10.002
Mosallatpour S., Aminzadeh S., Shamsara M., Hajihosseini R. // Sci. Rep. 2019. V. 9. № 1. P. 19062. https://doi.org/10.1038/s41598-019-55587-9
Saghian R., Mokhtari E., Aminzadeh S. // Sci. Rep. 2021. V. 11. № 1. P. 4573. https://doi.org/10.1038/s41598-021-84267-w
Aliabadi N., Aminzadeh S., Karkhane A.A., Haghbeen K. // Braz. J. Microbiol. 2016. V. 47. № 4. P. 931–940. https://doi.org/10.1016/j.bjm.2016.07.009
Bergey’s Manual of Systematic Bacteriology, 2nd ed. V. 3. The Firmicutes. / Ed. Vos P., Garrity G., Jones D., Krieg N.R., Ludwig W., Rainey F.A., Schleifer K.-H., Whitman W. Springer, 2009. 1450 p.
Gerhardt P., Murray R.G.E. Manual of Methods for General Bacteriology. W.: ASM, 1981. 524 p.
Wilson K. // Curr. Prot. Mol. Biol. 2001. V. 56. № 1. P. 2.4(4): 2.4.1–2.4.5. https://doi.org/10.1002/0471142727.mb0204s56
Lane D.J. 16S/23S rRNA sequencing. // Nucleic Acid Techniques in Bacterial Systematic. /Ed. E. Stackebrandt, M. Goodfellow. N.Y.: John Wiley and Sons, 1991. P. 115–175.
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. // Mol. Biol. Evol. 2018. V. 35. № 6. P. 1547–1549. https://doi.org/10.1093/molbev/msy096
Сафина В.Р., Мелентьев А.И., Галимзянова Н.Ф., Гильванова Е.А., Кузьмина Л.Ю., Лопатин С.А., Варламов В.П., Баймиев Андр.Х., Актуганов Г.Э. // Прикл. Биохимия и микробиология. 2021. Т. 57. № 5. С. 485–495. https://doi.org/10.31857/S0555109921050135
Hëlisto P., Aktuganov G., Galimzianova N., Melentjev A., Korpela T. // J. Chromatogr. B Biomed Sci. Appl. 2001. V. 758. № 2. P. 197–205. https://doi.org/10.1016/s0378-4347(01)00181-5
Актуганов Г.Э., Галимзянова Н.Ф., Терегулова Г.А., Мелентьев А.И. // Прикл. биохимия и микробиология. 2016. Т. 52. № 5. С. 520–526. https://doi.org/10.7868/S0555109916050020
Cho E.A., Lee J.S., Lee K.C., Jung H.C., Pan J.G., Pyun Y.R. // Int. J. Syst. Evol. Microbiol. 2007. V. 57. (Pt 12). P. 2902–2907. https://doi.org/10.1099/ijs.0.64844-0
Kudryashova E.B., Karlyshev A.V., Ariskina E.V., Streshinskaya G.M., Vinokurova N.G., Kopitsyn D.S., Evtushenko L.I. // Int. J. Syst. Evol. Microbiol. 2018. V. 68. № 9. P. 2912–2917. https://doi.org/10.1099/ijsem.0.002919
Yahiaoui M., Bouacem K., Harir M., Asmani K., Mechri S., Jaouadi B. // Proceedings of the MOL2NET. Basel: MDPI by MOL2NET, V. 6. 2021. https://doi.org/10.3390/mol2net-07-09377
Fu X., Yan Q., Yang S., Yang X., Guo Y., Jiang Z. // Biotechnol Biofuels. 2014. V. 7:174. https://doi.org/10.1186/s13068-014-0174-y
Tran T.N., Doan C.T., Nguyen M.T., Nguyen V.B., Vo T.P.K, Nguyen A.D., Wang S.L. // Polymers (Basel). 2019. V. 11. № 10:1600. https://doi.org/10.3390/polym11101600
Sørlie M., Horn S.J., Vaaje-Kolstad G., Eijsink V.G.H. // React. Funct. Polym. 2020. V. 148:104488. https://doi.org/10.1016/j.reactfunctpolym.2020.104488
Варламов В.П., Ильина А.В., Шагдарова Б.Ц., Луньков А.П., Мысякина И.С. // Успехи биологической химии. 2020. Т. 60. С. 317–368.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


