Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 146-150
Синтез селенсодержащих производных хитозана и их антибактериальная активность
А. Р. Егоров 1, *, А. А. Артемьев 1, В. А. Козырев 1, Д. Н. Сикаона 1, В. В. Рубаник 2, В. В. Рубаник мл. 2, И. С. Критченков 3, Н. З. Ягафаров 1, 4, О. М. Хубиев 1, Т. А. Терёшина 1, Е. К. Култышкина 1, Б. Меджбур 1, В. Н. Хрусталёв 1, 5, А. С. Критченков 1, 2, **
1 Российский университет дружбы народов
117198 Москва, Россия
2 Институт технической акустики НАН Беларуси
210009 Витебск, Беларусь
3 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
4 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, Россия
5 Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Россия
* E-mail: sab.icex@mail.ru
** E-mail: kritchenkov-as@rudn.ru
Поступила в редакцию 20.08.2021
После доработки 25.10.2021
Принята к публикации 05.11.2021
- EDN: UUALID
- DOI: 10.31857/S0555109922020052
Аннотация
Взаимодействие хитозана с 3-(хлорметил)-[1,2,4]селендиазоло[4,5-a]пиридин-4-ия бромидом приводит к образованию водорастворимых селенсодержащих катионных производных хитозана. Получены производные хитозана со степенью замещения 0.15, 0.45 и 0.65. Производные характеризовались выраженной антибактериальной активностью in vitro в отношении Staphylococcus aureus и Escherichia coli, причем антибактериальная активность производных возрастала с увеличением степени замещения. Антибактериальная активность высокозамещённого производного была сопоставима с антибактериальной активностью традиционных антибиотиков ампициллина и гентамицина.
В связи с неуклонным ростом резистентности возбудителей нозокомиальных и внебольничных инфекций к антимикробным лекарственным средствам разработка и синтез новых эффективных антибактериальных препаратов является одной из приоритетных задач современной фармакологии. Среди различных соединений с антибактериальной активностью хитозан выгодно отличается биосовместимостью, гипоаллергенностью, биодеградируемостью и отсутствием токсичности.
Хитозан представляет собой линейный природный полимер, состоящий из звеньев глюкозамина, чередующихся со звеньями N-ацетилглюкозамина. Производные хитозана часто характеризуются выраженной антибактериальной активностью [1]. Известно, что производные хитозана обладают сразу несколькими механизмами антибактериального действия, которые по своей сути являются универсальными физико-химическими механизмами: электростатическое взаимодействие поликатиона с отрицательно заряженной поверхностью бактериальной клетки, хелатирование и связывание важных для микробной клетки ионов и нутриентов и др. В связи с комплексным сложным антибактериальным действием производных хитозана проявление резистентности бактерий к данным полимерам в ближайшем будущем маловероятно, если вообще возможно [2].
В сложном механизме антибактериального действия хитозана ключевым моментом является взаимодействие хитозанового поликатиона с отрицательно заряженной поверхностью бактериальной клетки. Хитозановый поликатион формируется благодаря оснóвным свойствам первичных аминогрупп макромолекулы хитозана. Электростатическое взаимодействие такого поликатиона с бактериальной клеткой приводит как минимум к двум неблагоприятным для клетки последствиям: резкому изменению проницаемости мембраны, которое вызывает внутренний осмотический дисбаланс и, следовательно, ингибирует рост микроорганизмов. Кроме того происходит гидролитическое расщепление пептидогликанов в стенке микроорганизма, что приводит к утечке внутриклеточных электролитов, таких как ионы калия, а также важных компонентов органической природы, таких как белки, нуклеиновые кислоты, глюкоза, лактатдегидрогеназа и др. [3]. Эти неблагоприятные для бактериальной клетки процессы в конечном итоге приводят к ее гибели.
Особенностями хитозана, сильно ограничивающими его антибактериальный эффект являются его плохая растворимость в воде и невысокая катионная плотность. Введение катионного заместителя способно преодолеть эти ограничения [4–6]. Обычно для этих целей используют химическую модификацию хитозана заместителем, содержащим кватернизованный атом азота.
Известно также, что ряд селенсодержащих гетероциклов характеризуется выраженным антибактериальным эффектом и фармакологической активностью [7]. В связи с этим, селенсодержащие производные хитозана представляют несомненный интерес как потенциальные антибактериальные агенты, однако до настоящего исследования они не были описаны в литературе.
Таблица 1.
Условия синтеза и степени замещения производных
| СЗ | Шифр производного | T, °C | pH | СЗN | СЗO | МС* | Время |
|---|---|---|---|---|---|---|---|
| 0.15 | Х-Se-15 | 60°C | 3 | 0.15 | 0 | 1 : 2.2 | 7 ч |
| 0.45 | Х-Se-45 | 60°C | 3 | 0.45 | 0 | 1 : 6.0 | 7 ч |
| 0.65 | Х-Se-65 | 60°C | 3 | 0.50 | 0.15 | 1 : 13.5 | 7 ч |
Цель работы – проведение химической модификации хитозана селенсодержащим катионным гетероциклическим фрагментом и исследовании антибактериальной активности полученных производных хитозана в сравнении с исходным хитозаном и антибиотиками гентамицином и ампициллином в отношении грамположительных и грамотрицательных бактерий (Staphylococcus aureus и Escherichia coli).
МЕТОДИКА
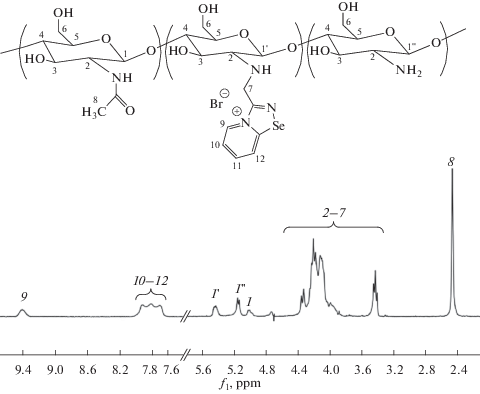
В настоящем исследовании использовали крабовый хитозан (ООО “Биопрогресс”, Россия) со средней молекулярной массой 3.6 × 104, степенью ацетилирования 0.26, влажностью 8.8%, 3-(хлорметил)-[1, 2, 4]селендиазоло[4,5-a]пиридин-4-ия бромид, любезно предоставленный А.Г. Цховребовым (Российский университет дружбы народов, Россия). Диализные мембраны MWCO 12.000–14.000 были приобретены в Orange Scientific (“Braine-l’Alleud”, Бельгия). Спектры ЯМР 1Н регистрировали на приборе Bruker Avance (“Bruker”, США) II+ 400 MHz в растворе D2O/CF3COOH 100/1 при 70°С. Интегральную интенсивность сигналов H-1 глюкозаминных фрагментов хитозана и его производных принимали за 1.
Синтез селенсодержащих производных хитозана проводили следующим образом. 0.1 г хитозана растворяли в 10 мл 1%-ной уксусной кислоты, рН 3.0, и добавляли 2.2, 6.0 или 13.5 эквивалентов 3-(хлорметил)-[1, 2, 4]селендиазоло[4,5-a]пиридин-4-ия бромида. Реакционную смесь укупоривали, барботировали аргоном, перемешивали при 60°C в течение 7 ч на магнитной мешалке. Образовавшиеся полимеры осаждали ацетоном, отмывали от примесей низкомолекулярных соединений метанолом, диэтиловым эфиром, растворяли в дистиллированной воде и диализовали против дистиллированной воды 3 сут, затем лиофильно высушивали.
Антибактериальную активность полученных производных хитозана изучали методом диффузии в агар в отношении штаммов S. aureus RCMB 010027 и E. coli RCMB 010051 (коллекция микроорганизмов Витебского государственного медицинского университета, Беларусь). В качестве коммерчески доступных антибиотиков для сравнения в случае S. aureus использовали ампициллин, а в случае E. coli – гентамицин (“Aldrich”, США). Активность определяли путем измерения диаметра зоны ингибирования (в мм). Каждую зону ингибирования измеряли после суточного выращивания в термостате при 37°С. Опыты повторяли не менее трех раз [8].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Селенсодержащие производные хитозана были получены путём обработки хитозана 3-(хлорметил)-[1, 2, 4]селендиазоло[4,5-a]пиридин-4-ия бромидом (рис. 1). Реакцию проводили при 60°C, рН 3, в течение 7 ч.
Рис. 1.
Синтез селенсодержащих производных хитозана: 1 – хитозан; 2 – (хлорметил)-[1, 2, 4]селенадиазоло[4,5-a]пиридиния бромид; 3 – N-([1, 2, 4]селенадиазоло[4,5-a]пиридин-3-илметил) хитозан; 4 – N,O-([1, 2, 4]селенадиазоло[4,5-a]пиридин-3-илметил) хитозан; I – реакция при небольшом избытке реагента 3-(хлорметил)-[1, 2, 4]селендиазоло[4,5-a]пиридин-4-ия бромида; II – реакция при большом избытке реагента 3-(хлорметил)-[1, 2, 4]селендиазоло[4,5-a]пиридин-4-ия бромида.
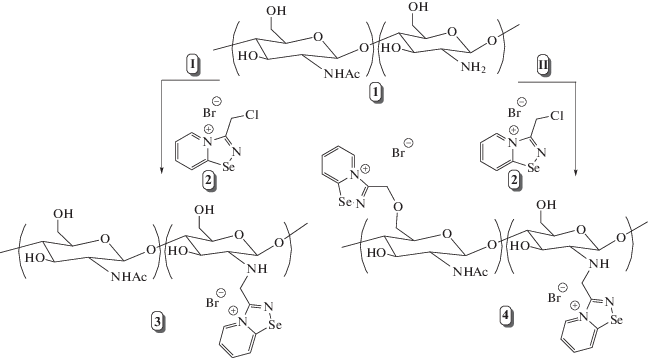
Варьируя избыток 3-(хлорметил)-[1, 2, 4]селендиазоло[4,5-a]пиридин-4-ия бромида, были получены производные хитозана с низкой (0.15), средней (0.45) и высокой (0.65) степенью замещения (СЗ). В случае небольшого избытка реагента при синтезе низко- и среднезамещённых производных реакция протекала селективно по аминогруппе хитозана с образованием N-замещeнных полимеров (рис. 1, реакция I). В случае использования большого избытка регента (13.5-кратного) образуются высокозамещeнные производные (СЗ = 0.65), при этом доля N-замещения (СЗN) составляла 0.50, а доля O-замещения (СЗO) – 0.15 (рис. 1, реакция II). Строение полученных соединений было подтверждено с помощью спектроскопии ЯМР на ядрах 1Н. Типичный спектр приведен на рис. 2.
Антибактериальная активность полученных производных была изучена in vitro с использованием метода диффузии в агар. Результаты исследований представлены в табл. 2.
Таблица 2.
Антибактериальная активность полученных производных
| Образец | Микроорганизм | |
|---|---|---|
| S. aureus | E. coli | |
| зона ингибирования, мм* | ||
| Хитозан | 14.3 ± 0.1 | 11.4 ± 0.3 |
| Ампициллин | 30.3 ± 0.1 | – |
| Гентамицин | – | 22.2 ± 0.3 |
| B | 30.8 ± 0.3 | 21.4 ± 0.3 |
| C | 30.4 ± 0.1 | 21.6 ± 0.2 |
| Х-Se-15 | 20.6 ± 0.1 | 12.4 ± 0.3 |
| Х-Se-45 | 26.8 ± 0.3 | 17.6 ± 0.2 |
| Х-Se-65 | 34.4 ± 0.2 | 26.3 ± 0.2 |
Данные, приведeнные в табл. 2 свидетельствуют о том, что антибактериальная активность всех полученных производных хитозана превышала таковую для исходного хитозана. При этом антибактериальный эффект производных повышался с увеличением степени замещения. С одной стороны, данный факт может быть объяснeн повышением катионной плотности при увеличении доли катионного заместителя в макромолекуле. С другой стороны, возможно, введенный гетероциклический селенсодержащий заместитель характеризуется сам по себе наличием выраженного антибактериального эффекта. Для проверки данного предположения была исследована антибактериальная активность соответствующих введённому заместителю а низкомолекулярных соединений б и в (рис. 3).
Было показано, что низкомолекулярные соединения б и в характеризовались выраженной антибактериальной активностью в отношении как S. aureus, так и E. coli, причем их антибактериальная активность сопоставима с таковой для антибиотиков ампициллина и гентамицина. Следует также отметить, что высокозамещeнное селенсодержащее производное хитозана Х-Se-65 характеризовалось антибактериальным эффектом, превышающим действие ампициллина и гентамицина. Этот факт может быть объяснeн симбатным эффектом введeнного в хитозановую матрицу антибактериального селенсодержащего фармакофора и полимерной цепи. По-видимому, это связано с тем, что полимерная цепь способна принимать конформацию, обеспечивающую наиболее сильное еe связывание с мембраной микробной клетки по сравнению с низкомолекулярным соединением и, следовательно, что приводит к более выраженной дисфункции клеточной мембраны.
Таким образом, в результате работы получено высокоактивное антибактериальное катионное селенсодержащее производное хитозана, представляющее несомненный интерес для дальнейших исследований in vivo.
Работа выполнена при финансовой поддержке Программы стратегического академического лидерства РУДН “Приоритет-2030”, РФФИ (№№ 20-53-04027 и 20-53-00009) и БРФФИ (Т20Р-375 и Х21РМ-081) в рамках научных проектов, РФФИ и ВАНТ в рамках научного проекта № 20-53-54006, РФФИ в рамках научных проектов №№ 19-016-00077, 19-33-60039 и 20-04-60014.
Список литературы
Seidi F., Yazdi M. K., Jouyandeh M., Dominic M., Naeim H., Nezhad M. N., Bagheri B., Habibzadeh S., Zarrintaj P., Saeb M. R., Mozafari M. // Int. J. Biol. Macromol. 2021. V. 183. P. 1818–1850.
Tien N.D., Lyngstadaas S.P., Mano J.F., Blaker J.J., Haugen H.J. // Molecules. 2021. V. 26. № 9. https://doi.org/10.3390/molecules26092683
Ke C.L., Deng F.S., Chuang C.Y., Lin C.H. // Polymers. 2021. V. 13. № 6. https://doi.org/10.3390/polym13060904
Kritchenkov A.S., Egorov A.R., Dysin A.P., Volkova O.V., Zabodalova L.A., Suchkova E.P., Kurliuk A.V., Shakola T.V. // Int. J.Biol. Macromol. 2019. V. 137. P. 592–603.
Kritchenkov A.S., Egorov A.R., Artemjev A.A., Kritchenkov I.S., Volkova O.V., Kurliuk A.V., Shakola T.V., Rubanik V.V., Tskhovrebov A.G., Yagafarov N.Z., Khrustalev V.N. // Int. J. Biol. Macromol. 2020. V. 143. P. 143–152.
Kritchenkov A.S., Egorov A.R., Volkova O.V., Kritchenkov I.S., Kurliuk A.V., Shakola T.V., Khrustalev V.N. // Int. J. Biol. Macromol. 2019. V. 139. P. 103–113.
Semenov K.N., Charykov N.A., Keskinov V.A., Kritchenkov A.S., Murin I.V. // Industrial & Engineering Chemistry Research. 2013. V. 52. № 46. P. 16095–16100.
Bioassay Techniques for Drug Development. / Ed. A.-u.-Rahman, M.I. Choudhary, W.J. Thomson. Harwood Academic Publishers. 2005.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология