Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 140-145
Синтез биологически активной композиции хитозан-наночастицы селена
К. В. Апрятина 1, *, Е. И. Мурач 2, С. В. Амарантов 3, Е. И. Ерлыкина 2, В. С. Веселов 1, Л. А. Смирнова 1
1 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
603022 Нижний Новгород, Россия
2 Приволжский исследовательский медицинский университет
603005 Нижний Новгород, Россия
3 ФНИЦ “Кристаллография и фотоника”, Институт кристаллографии им. А.В. Шубникова РАН
119333 Москва, Россия
* E-mail: apryatina_kv@mail.ru
Поступила в редакцию 25.07.2021
После доработки 17.09.2021
Принята к публикации 02.10.2021
- EDN: QJRVRU
- DOI: 10.31857/S0555109922020027
Аннотация
Разработана биологически активная композиция хитозан–наночастицы селена. Наночастицы селена характеризуются полимодальным распределением по размерам со средними радиусами 2–3 нм и ~37 нм. Главными активными центрами комплексообразования с наночастицами являются амино- и гидроксильные группы хитозана. В опытах по культивированию фибробластов клеточной линии hTERT BJ-5ta на пленках образцов показана высокая биосовместимость композиции. Композиция хитозан-наночастицы селена оказывала корригирующее действие на окислительные процессы организма, снижая активность свободно-радикального окисления в крови животных. Свойства комплекса делают его перспективным для использования в составе антиоксидантных и адаптогенных препаратов.
Селен – эссенциальный элемент антиоксидантной системы защиты организма человека, обладающий иммуномодулирующим и антиканцерогенным действием, участвующий в регуляции метаболизма тиреоидных гормонов [1–6]. Селен включен в селенопротеины, которые имеют широкий спектр биологического действия, в том числе антиоксидантного и противовоспалительного. В геноме человека 25 генов селенопротеинов. Селен содержится в форме селеноцистеина в различных антиоксидантных ферментах, таких как глутатионпероксидаза, тиоредоксинредуктаза, а также в селенопротеине P, участвующем в транспорте селена. Селен работает как окислительно-восстановительный центр всех этих белков и необходим для их биохимической активности. Низкий уровень селена в организме может привести к повышенному риску смертности, снижению иммунитета и когнитивных функций [7]. У человека хроническая недостаточность селена проявляется кардиомиопатией, способной провоцировать приступы стенокардии и инфаркт миокарда. Нередко дисфункция щитовидной железы связана не с недостаточностью йода, а с дефицитом селена в организме. В последнее время высказываются предположения о том, что дефицит селена коррелирует с тяжестью протекания или смертностью от COVID-19 [8, 9]. Селен включается в пищевую цепь через растения, потребляемые людьми и животными. Растения поглощают селен непосредственно из почвы, поэтому потребление его населением в значительной степени зависит от географического района [10, 11]. Недостаток селена в организме является фактором риска развития различных патологий. Соединения селена защищают клеточные мембраны от воздействия свободных радикалов и предотвращают их генерирование, снижая риск возникновения опухолей и развития болезней сердца и кровеносных сосудов. Важно отметить, что селен является незаменимым элементом для функционирования многих биологических процессов у людей, он относится к микроэлементам и концентрационный интервал между его функциональностью и токсичностью очень узок [12, 13].
Микроэлемент применяется в терапии ряда заболеваний, в том числе онкологических [14]. В существующих препаратах селен представлен преимущественно в виде оксианионов селената или селенита (селенометионин, селеноцистеин, метилселеносцистеин и селенит натрия), которые при высоких концентрациях токсичны. Необходимо подчеркнуть, что биологическая активность селена зависит от его химической формы и структуры. Например, элементарный селен нерастворим в воде и долгое время считался биологически инертным. В настоящее время интенсивно изучается селен в наноструктурной форме, что нашло отражение во многих современных исследованиях [15–19]. По сравнению с органическими и неорганическими формами селена, наночастицы (НЧ) селена демонстрируют более низкую токсичность и превосходную антиоксидантную, иммуномодулирующую, бактерицидную и противоопухолевую активность. Основное преимущество НЧ селена, по сравнению с другими формами, – гораздо более низкая токсичность, что позволяет применять его в дозах, значительно превышающих суточную потребность. Кроме того, наноселен обладает так называемым размерным эффектом, проявляющимся в том, что частицы меньших размеров являются биологически более активными, лучше накапливаются в тканях [20, 21]. Ведется активная работа по синтезу и изучению биологического действия наноселена в различных матрицах-носителях. В качестве матрицы для НЧ используют, среди прочих, бычий сывороточный альбумин [19], каррагинан [22], пищевая добавка – гуммиарабик [22, 23], полисахарид склероция съедобного гриба Pleurotus tuber-redium [24].
Актуальной остается проблема проникновения НЧ селена из полости кишечника в кровь при пероральном применении, их направленной доставки к различным органам и пролонгированного выделения. Одним из наиболее перспективных полимеров для создания такой биологически активной композиции, способной к контролируемой адресной доставке НЧ во внутреннюю среду организма и их пролонгированному выделению является полисахарид хитозан, в связи с его нетоксичностью, транспортными и другими полифункциональными свойствами [25–27]. Можно предположить, что сочетание антиоксидантных свойств НЧ селена и хитозана позволит создать высокоэффективные препараты широкого спектра действия, а также разработать препараты для перорального применения, обладающие эффективным иммуномодулирующим и антиоксидантным действием.
Цель работы – синтез биосовместимых НЧ селена, стабилизированных хитозаном, и оценка влияния нанокомпозиций при их пероральном введении на свободнорадикальные процессы в организме экспериментальных животных.
МЕТОДИКА
В работе использовали хитозан с молекулярной массой (ММ) 2.0 × 105, степень деацетилирования 85% (ООО “Биопрогресс”, Московская обл., Россия) без дополнительной очистки (массовая доля нерастворимых веществ – 0.25%); янтарную кислоту марки “ч”; натрий селенистокислый марки “ч” (ТУ 6-09-17-209-88, Россия); аскорбиновую кислоту; бромид калия марки “ч”.
НЧ селена получали путем окислительно-восстановительной реакции между аскорбиновой кислотой и прекурсором НЧ – селенистокислым натрием, в растворах стабилизатора полисахарида хитозана (3 мас. %) в 2%-ной янтарной кислоте. Получение и формирование НЧ контролировали спектрофотометрическим методом. Раствор помещали под УФ-лампу мощностью 1600 мВт/м2 на фиксированном расстоянии 15 см от лампы при температуре 35°С для ускорения процесса восстановления НЧ. Пробы из раствора отбирали через каждые 30 мин, разбавляли в 10 раз дистиллированной водой и снимали спектр абсорбции образца относительно воды на УФ-спектрометре Shimadzu UV-1650PC (Япония). Максимум полосы поглощения наблюдали при 250–280 нм, что соответствовало абсорбции аскорбиновой кислоты [28].
Размерные характеристики НЧ селена в растворах хитозана были определены методом малоуглового рассеяния рентгеновских лучей (РМУ) на экспериментальной станции “БиоМУР” в НИЦ “Курчатовский институт” (Россия).
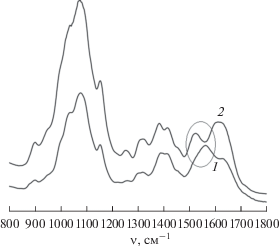
Методом инфракрасной спектроскопии на ИК-спектрометре Infralum-FT801 (“СИМЕКС”, Россия) определяли функциональные группы хитозана, участвующие в стабилизации НЧ селена, в диапазоне частот 500–4000 см–1 с разрешением 2 см–1. Образцы исходного хитозана и композиции, содержащей НЧ селена, сушили вакуумированием до постоянной массы. Далее их измельчали и смешивали с KBr при соотношении образец/KBr 1 : 20. Смесь прессовали на ИК-гидравлическом прессе при давлении 400 кг/см2.
Для исследования биосовместимости материала изготавливали пленки методом полива на лавсановую подложку из растворов сукцината хитозана и композиций с НЧ селена на его основе. Пленки были получены в условиях равномерного испарения растворителя до постоянной массы при комнатной температуре, средняя толщина пленок – 0.1 мм. Затем образцы отмывали от кислоты спиртовым раствором щелочи и многократной промывкой водой доводили значение pH до нейтрального. Пленки были исследованы на адгезию, цитотоксичность и рост клеток на их поверхности при культивировании фибробластов человека клеточной линии hTERT BJ-5ta. Пленки материала помещали в лунки 6-луночного планшета для культивирования клеток и заполняли 500 мкл среды DMEM. Клетки высевали на поверхность пленки с плотностью 1.6 × 105/см2 и культивировали в течение 24 ч. Визуализацию клеток и оценку их жизнеспособности оценивали методом люминесцентной микроскопии. В качестве красителя для окрашивания фибробластов использовали раствор акридинового оранжевого в фосфатном буфере 2 × 10–4%. Краситель избирательно взаимодействует с ДНК и РНК в ядре и митохондриях клетки, путем интеркаляции или электростатического притяжения соответственно. Это позволяет оценить общее состояние клеток – активность, пролиферацию и апоптоз. Пленки анализировали на инверторном микроскопе Olympus IX71 (Япония/Германия) с использованием “зеленого” фильтра (эмиссия 510–555 нм, возбуждение 460–495 нм), что позволяло визуализировать ядра живых клеток зеленого цвета.
Антиоксидантные свойства композиции хитозан-НЧ селена исследовали in vivo на экспериментальных животных – нелинейных белых крысах. Животных разделили на 4 группы по 3 особи в каждой. К первой группе отнесли интактных животных, второй группе перорально вводили раствор сукцината хитозана, третьей группе вводили раствор сукцината хитозана, содержащий селен в ионной форме в концентрации в 3 раза превышающей LD50 для крыс [13], четвертой группе вводили НЧ селена, стабилизированные хитозаном, в той же концентрации, что и для третьей группы. Оценка свободнорадикальной активности проводилась по содержанию в плазме крови экспериментальных животных продуктов перекисного окисления липидов (ПОЛ) – диеновых и триеновых конъюгатов (ДК, ТК), оснований Шиффа (ОШ) через 3 сут после ежедневного перорального введения растворов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез НЧ селена в растворах хитозана. В работе использовали метод химического синтеза НЧ селена с одновременной их стабилизацией полисахаридом хитозаном. Основным преимуществом этого метода являются простота синтеза, а используемые как восстановитель аскорбиновая кислота и как стабилизатор хитозан, являются нетоксичными и биосовместимыми компонентами.
НЧ селена образуются по следующей реакции:
Аскорбиновая кислота в процессе реакции переходит в дегидроаскорбиновую кислоту. Ход реакции контролировали спектрофотометрическим методом по изменению/возникновению и убыванию полосы поглощения, характерной для аскорбиновой кислоты в области длин волн 250–280 нм (рис. 1) [28]. Показано, что пик полосы поглощения, соответствующий аскорбиновой кислоте, полностью пропадал через 2.5 ч. При этом в процессе восстановления ионов селена и образования НЧ Se окраска раствора менялась с бледно-желтой на ярко-красную.
Рис. 1.
Кривые поглощения аскорбиновой кислоты в процессе формирования НЧ селена в растворе хитозана: 1 – 0, 2 – 30, 3 – 60, 4 – 90 мин.
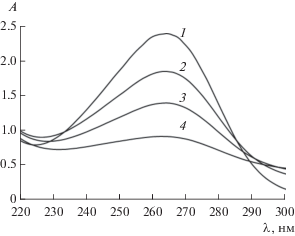
Подтверждением того, что аскорбиновая кислота расходуется на восстановление ионов селена, являются результаты опыта, в котором в растворе отсутствовал селенит натрия. В этом случае изменение полос поглощения аскорбиновой кислоты в растворах хитозана во времени не наблюдалось.
Образование НЧ селена подтверждали следующим образом. При добавлении холодной концентрированной серной кислоты к разбавленному раствору хитозана, связанному с НЧ селена, появлялась зеленая окраска, свидетельствующая об образовании соли SeSO3. При разбавлении получившегося раствора образуется красный осадок селена вследствие протекания реакций:
(1)
${\text{Se}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} \to {\text{SeS}}{{{\text{O}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(2)
$2{\text{SeS}}{{{\text{O}}}_{3}} \to 2{\text{S}}{{{\text{O}}}_{2}} + {\text{Se}}{{{\text{O}}}_{2}} + {\text{Se}}.$Определение размерных характеристик НЧ селена. Размерные характеристики НЧ селена были определены методом малоуглового рассеяния рентгеновских лучей (рис. 2).
Рис. 2.
Экспериментальные кривые РМУ (а) раствора хитозана, содержащего НЧ селена (1), без НЧ (2), разностная от них (3), кривая распределения НЧ селена по размерам (4); б – вычисленные распределения по размерам НЧ селена в растворе хитозана: распределение (DV) НЧ селена (1) соответствует кривой (4) на рис. 2а; 2 – кривая суммы разложения DV на гауссовы компоненты (3).
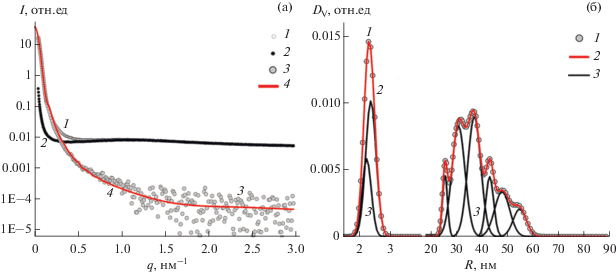
На рис. 2a точками (1) и (2) представлены экспериментальные кривые малоуглового рассеяния I(q), где q – модуль вектора рассеяния. Точки (1) соответствуют образцу раствора хитозана с НЧ селена и (2) без НЧ, (3) – разностная от них кривая, из которой вычислялось распределение НЧ селена – DV. На рис. 2б представлено распределение НЧ селена по объемам DV, как функция их радиусов – R, вычисленное из разностной кривой (3) на рис. 2а. Точкам (1) в полученном распределении (DV) на рис. 2б соответствует кривая (4) на рис. 2а. Показано, что дисперсия НЧ селена характеризуются полимодальным распределением по размерам со средними радиусами 2–3 нм (33.4 мас. %) и ~37 нм (66.6 мас. %), при этом узкодисперсная часть состоит из двух компонент, широкодисперсная — из шести компонент.
Методом ИК-спектрометрии определили, какие функциональные группы хитозана участвовали в стабилизации НЧ селена. Из рис. 3 видно характерное смещение полос хитозана с 1570 см–1 до 1536 см–1 соответствующее валентным колебаниям N-H аминогрупп полисахарида, а также смещение полос в области 3400 см–1, отвечающие колебаниям гидроксильных групп полимера, что свидетельствовало об их участии в стабилизации НЧ селена.
Таким образом, главными активными центрами комплексообразования с НЧ селена являются амино- и гидроксильные группы полисахарида.
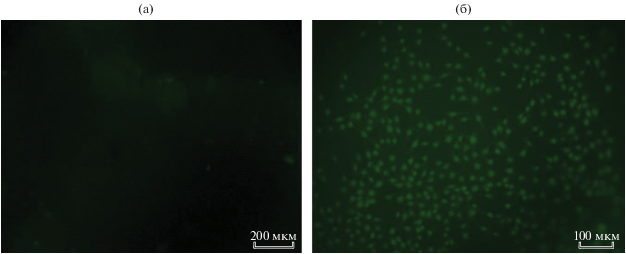
Исследование биосовместимости композиции. Были проведены исследования биосовместимости образцов пленок in vitro по адгезии и пролиферации клеток фибробластов как предшественников соединительной ткани после 24 ч их инкубации на поверхности пленок. На рис. 4б наблюдалось равномерное распределение фибробластов, их рост и деление на поверхности пленки композита хитозан-НЧ селена, что указывало на высокую степень биосовмесимости данного образца. В то же время, на образце, содержащем ионный селен в той же концентрации (рис. 4а) клетки после их культивирования погибли и не просматриваются.
Рис. 4.
Пленки образцов, после нанесения на поверхность фибробластов клеточной линии hTERT BJ-5ta: а – композит на основе хитозана, содержащий ионный селен, [Se+4] = 0.012 моль/л; б – композит на основе хитозана, содержащий НЧ селена, [Se0] = 0.012 моль/л.
Изучение антиоксидантных свойств. Известно, что повышенное продуцирование свободных радикалов кислорода и накопление продуктов ПОЛ вызывают ряд изменений в мембранах клеток организма, приводящих к ослаблению гидрофобных связей мембран, увеличению проницаемости и в итоге нарушению работы клеток или их гибели. В работе провели исследование влияния препаратов хитозана; хитозана, содержащего Na2SeO3 в концентрации, в 3 раза превышающей LD50 для крыс [13] и нанокомпозиции хитозан-НЧ селена в той же концентрации на активность ПОЛ. Оценка проводилась по содержанию в плазме крови экспериментальных животных продуктов ПОЛ – диеновых и триеновых конъюгатов (ДК, ТК), оснований Шиффа (ОШ) через 3 сут после ежедневного перорального введения (табл. 1).
Таблица 1.
Содержание продуктов ПОЛ в плазме крови крыс через 3 сут после перорального введения растворов: хитозана, хитозана с Na2SeO3 и нанокомпозита
| Препарат | Продукты ПОЛ | ||
|---|---|---|---|
| ДК | ТК | ОШ | |
| Без введения препаратов | 0.171 ± 0.09 | 0.438 ± 0.35 | 35.39 ± 17.72 |
| Хитозан | 0.163 ± 0.051 | 0.634 ± 0.39 | 85.15 ± 36.31 |
| Хитозан+Na2SeO3 | 0.7054 ± 0.48** | 2.73 ± 0.48 | 144.6 ± 20.8* |
| Хитозан + НЧ селена | 0.175 ± 0.021*** | 0.119 ± 0.05*** | 15.93 ± 9.47** |
Было установлено, что введение раствора хитозана не приводило к существенным изменениям в активности процессов ПОЛ. Хитозан может рассматривается как потенциальный антиоксидант и “ловушка” для свободных радикалов. Неферментативные системы антиоксидантной защиты включают вещества, которые выполняют, в основном, роль ловушек (перехватчиков) свободных радикалов. Они “тушат” свободные радикалы, забирают избыток энергии, тормозят развитие цепной реакции образования новых радикалов.
В 3 экспериментальной группе (хитозан + + Na2SeO3, в концентрации в 3 раза превышающей LD50 для крыс) отмечалось увеличение содержания продуктов ПОЛ – ДК, ТК, ОШ в 3–5 раз. Это может быть обусловлено тем, что биологические эффекты соединений селена являются дозозависимыми, то есть селен может выступать в роли и прооксиданта. Он способен активировать ПОЛ и снижать активность супероксиддисмутазы [5]. Селен косвенно участвует в образовании АФК при окислении тиолов, так как способен образовывать внутримолекулярную связь S–Se с тиольными группами [6]. Также соединения селена при взаимодействии с глутатионом образуют промежуточные метаболиты (GS–SeH, GS–Se–SG), которые в конечном итоге могут взаимодействовать с кислородом с образованием свободных радикалов [4].
В 4 группе экспериментальных животных, которым был введен нанокомплекс “хитозан + НЧ селена”, содержание ДК соответствовало интактным животным, а содержание ТК и ОШ уменьшилось в 2 и 4 раза соответственно, что может быть связано с антиоксидантным действием НЧ селена. Селен выступает в роли активатора ферментов антиоксидантной защиты, которые способны эффективно блокировать реакции свободно-радикального окисления.
Таким образом, полученные результаты свидетельствовали о том, что применение нанокомплекса “хитозан + НЧ селена” оказывало влияло на окислительные процессы организма, снижая активность свободно-радикального окисления в крови животных. Это позволяет рекомендовать использование нанокомплекса в качестве компонента в составе адаптогенных нанокомплексов для повышения их эффективности.
Исследование выполнено при частичной финансовой поддержке Российского научного фонда № 21-73-00188 (https://rscf.ru/project/21-73-00188/) и Научно-образовательного центра Нижегородской области “Техноплатформа 2035” в рамках соглашения № 16-11-2021/48. Работа поддержана Министерством науки и высшего образования РФ в рамках Государственного задания ФНИЦ “Кристаллография и фотоника” Российской академии наук и осуществлена в Научно-исследовательской лаборатории химии природных соединений и их синтетических аналогов, созданной в рамках Государственного задания при НОЦ “Техноплатформа 2035”.
Список литературы
Hariharan S., Dharmaraj S. // Inflammopharmacology. 2020. V. 28. P. 667–695.
Avery J.C., Hoffmann P.R. // Nutrients. 2018. V. 10. № 9. P. 1–20.
Kuršvietienė L., Mongirdienė A., Bernatonienė J., Šulinskienė J., Stanevičienė I. // Antioxidants (Basel). 2020. V. 9. № 80. P. 1–11.
Drake E.N. // Medical Hypotheses. 2006. V. 67. № 2. P. 318–322.
Qiao B., He B., Cai J., Lam A. K.-Y., He W. // Oncotarget. 2017. V. 8. № 69. P. 113614–113621.
Ali M.S., Hussein R.M., Kandeil M.A. // Reports of Biochemistry and Molecular Biology. 2019. V. 8. № 3. P. 216–226.
Kieliszek M., Bano I., Zare H. // Biological Trace Element Research. 2021. https://doi.org/10.1007/s12011-021-02716-z
Moghaddam A., Heller R.A., Sun Q., Seelig J., Cherkezov A., Seibert L. et al. // Nutrients. 2020. V. 12. № 7. https://doi.org/10.3390/nu12072098
Khatiwada S., Subedi A. // Current Nutrition Reports. 2021. V. 10. P. 125–136.
Saha U., Fayiga A., Sonon L. // International J. Applied Agricultural Sciences. 2017. V. 3. № 1. P. 1–18.
Голубкина Н.А., Синдирева А.В., Зайцев В.Ф. // Юг России: экология, развитие. 2017. Т. 12. № 1. С. 107–127.
Garousi F. // Acta Agraria Debeceniensis. 2015. № 64. P. 33–38.
Крюков В., Глебова И., Зиновьев С., Шевяков А. // Комбикорма. 2018. № 3. С. 90–92.
Tan H.W., Mo H.-Y., Lau A.T.Y., Xu Y.-M. // Int. J. Mol. Sci. 2019. V. 20. № 1. https://doi.org/10.3390/ijms20010075
Zhao G., Wu X., Chen P., Zhang L., Yang C. S., Zhang J. // Free Radical Biology and Medicine. 2018. V. 126. P. 55–66.
Filipović N., Ušjak D., Milenković M.T., Zheng K., Liverani L., Boccaccini A.R. et al. // Frontiers in Bioengineering and Biotechnology. 2021. https://doi.org/10.3389/fbioe.2020.624621
Ikram M., Javed B., Raja N.I., Mashwani Z.-ur-R. // International J. Nanomedicine. 2021. V. 16. P. 249–268.
Hosnedlova B., Kepinska M., Skalickova S., Fernandez C., Ruttkay-Nedecky B., Peng Q. et al. // International J. Nanomedicine. 2018. V. 13. P. 2107–2128.
Chung S., Zhou R., Webster T.J. // International J. Nanomedicine. 2020. V. 15. P. 115–124.
Ikram M., Javed B., Raja N.I., Mashwani Z. // International J. Nanomedicine. 2021. V. 16. P. 249–268.
Nayak V., Singh RB K., Singh A.K., Singh R.P. // New J. Chemistry. 2021. V. 45. № 6. P. 2849–2878.
Song X., Chen Y., Sun H., Liu X., Leng X. // Carbohydrate Polymers. 2021. V. 255. 117379.
Kong H., Yang J., Zhang Y., Fang Y., Nishinari K., O Phillips G. // Int. J. Biol. Macromol. 2014. № 65. P. 155–162.
Bhardwaj K., Sharma A., Tejwan N., Bhardwaj S., Bhardwaj P., Nepovimova E. et al. // J. Fungi. 2020. V. 6. 351. https://doi.org/10.3390/jof6040351
Chen R.-R., Li Y.-J., Chen J.-J., Lu C.-L. // Carbohydrate Polymers. 2020. V. 247. 116740. https://doi.org/10.1016/j.carbpol.2020.116740
Mohammed A.S.A., Naveed M., Jost N. // J. Polymers and the Environment. 2021. V. 29. P. 2359–2371.
Lyu F., Xu X., Zhang L. // J. Materials Chemistry B. 2020. V. 8. P. 9652–9667.
Yang J.M.D., Klassen H., Pries M., Wang W., Nissen M.H. // Stem Cells. 2006. V. 24. № 12. P. 2766–2775.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология