Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 132-139
Модифицирование химической структуры, морфологии и цитосовместимости пленок хитозана в низкочастотной плазме
Т. С. Демина 1, 2, *, П. Ю. Бикмулина 3, А. В. Бирдибекова 2, А. С. Курьянова 1, 4, А. А. Фролова 3, П. И. Котенева 1, Н. А. Аксенова 1, 4, Н. В. Кошелева 1, 3, 5, 6, Т. М. Хлебникова 1, Т. А. Акопова 2, П. С. Тимашев 1, 3, 4, 5, 7
1 Институт регенеративной медицины, Первый Московский государственный медицинский университет
им. И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
119991 Москва, Россия
2 Институт синтетических полимерных материалов им. Н.С. Ениколопова РАН
117393 Москва, Россия
3 Центр “Цифрового биодизайна и персонализированного здравоохранения”, Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации
(Сеченовский Университет)
119991 Москва, Россия
4 Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
119991 Москва, Россия
5 Лаборатория клинических смарт-нанотехнологий Научно-технологического парка биомедицины,
Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
119991 Москва, Россия
6 Научно-исследовательский институт общей патологии и патофизиологии
125315 Москва, Россия
7 Химический факультет, МГУ им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: detans@gmail.com
Поступила в редакцию 30.08.2021
После доработки 02.11.2021
Принята к публикации 05.11.2021
- EDN: SQDDHU
- DOI: 10.31857/S0555109922020039
Аннотация
Изучено влияние обработки пленок хитозана в плазме низкочастотного разряда пониженного давления на химическую структуру, морфологию и свойства их поверхности, в том числе на способность поддерживать адгезию и пролиферацию кератиноцитов человека. Показано, что обработка в плазме приводила к образованию на поверхности полярных кислородсодержащих групп, снижению шероховатости и увеличению гидрофильности поверхности. Пленочные образцы хитозана были цитосовместимы и не снижали жизнеспособности кератиноцитов как в форме экстрактов, так и при непосредственном культивировании клеток на пленках. Обработка пленок хитозана в плазме повышала адгезивные свойства для клеток и активировала пролиферацию кератиноцитов на них, что важно для применения хитозансодержащих материалов в качестве раневых покрытий.
Задача улучшения биосовместимости полимерных материалов и повышения их способности стимулировать и направлять процесс регенерации различных тканей является одной из ключевых проблем тканевой инженерии [1–3]. Поведение субстрат-зависимых клеток на поверхности зависит от поверхностной энергии и гидрофильно-гидрофобного баланса, что в свою очередь определяется морфологией и химическим составом [4]. Химическую структуру поверхности можно варьировать с использованием химических реагентов и путем иммобилизации дополнительных биоактивных соединений [5, 6]. Однако важным критерием в выборе подхода к модифицированию поверхности является возможность избежать или снизить применение дополнительных реагентов. Воздействие низкотемпературной плазмы (ионизированного газа) является одним из наиболее быстрых и эффективных подходов к регулированию биосовместимости и взаимодействия материал/клетки [7–9]. Результатом плазмохимической обработки является изменение морфологии и химического состава поверхностного слоя, что в результате влияет на свойства поверхности, в том числе на способность поддерживать адгезию и рост клеток млекопитающих и человека. Однако эффект обработки в плазме на взаимодействие материал/клетки предсказать затруднительно. В литературе приведены разрозненные данные, по-видимому это связано с вариациями условий обработки, природы рабочего газа и типа разряда, которые определяют химический состав и изменения в морфологии поверхности после обработки [10, 11]. Низкочастотный разряд пониженного давления наиболее часто реализуется в коммерческих установках и позволяет проводить процесс в заданных условиях с использованием рабочего газа требуемого состава. Ранее было показано, что на эффективность процесса также значительно влияют характеристики исходного полимера [12]. Для целенаправленного модифицирования поверхности требуются детальные исследования влияния обработки в плазме на биосовместимость по отношению к различным клеточным культурам, в том числе на целевые линии, обеспечивающие стимуляцию регенерации.
Модифицирование в плазме в основном используют для обработки изделий из синтетических полимеров с целью повышения гидрофильности их поверхности и/или ее активации [13–16]. В случае природных полимеров целью может быть регулирование адгезии клеток, их пролиферации и дифференцировки [10, 17, 18]. Хитозан – производное природного полисахарида хитина, − один из наиболее активно исследуемых природных полимеров для биомедицинского назначения [19–22]. Материалы на его основе обладают высокой биосовместимостью и их можно использовать в качестве подложек для культивирования клеток in vitro. Способность к биодеградации in vivo определяет интерес к нему при создании матриксов для тканевой инженерии, которые должны выступать в качестве временной подложки для прикрепления и роста клеток, а в последующем замещаться биотканью. В клиническую практику изделия на основе хитозана входят раневыми повязками и перевязочными материалами для терапии ожогов и ран, в том числе хронических [23–25]. В рамках этого применения важны как бактериостатические свойства хитозана, так и способность стимулировать рост целевых клеток, в том числе кератиноцитов в процессах ранозаживления [26]. В литературе представлено значительное количество работ по исследованию влияния обработки в плазме материалов из хитозана на их способность поддерживать адгезию и рост различных клеточных линий, в т. ч. фибробластов [12, 27], остеобластов [17, 28], но данных по влиянию обработки на адзезию и пролиферацию кератиноцитов не найдено.
Цель работы − изучение влияния обработки пленок хитозана в низкотемпературной низкочастотной плазме на их морфологию, химическую структуру и свойства поверхности, в том числе на способность поддерживать адгезию и рост кератиноцитов, обеспечивающих процесс эпителизации при заживлении ран.
МЕТОДИКА
Получение пленок хитозана и их модифицирование в низкотемпературной плазме. В работе использовали хитозан с молекулярной массой 350 кДа и степенью ацетилирования 0.14 фирмы “Сонат” (Россия), который ранее показал наилучшую цитосовместимость по отношению к фибробластам мыши L929 [12]. Пленки хитозана формировали методом полива из 1% раствора в 2% CH3COOH на полистирольной чашке Петри. Сушку проводили в беспылевом шкафу и переводили в основную форму путем выдерживания в 25, 10, 5 и 1% водных растворах аммиака, промывали дистиллированной водой и вновь сушили в беспылевом шкафу. Для дальнейших исследований использовали поверхность пленки, сформированнную на границе раздела раствор/чашка Петри. Поверхность пленок обрабатывали в плазме на установке CUTE-1MPR (“Femto Science Inc.”, Корея) при частоте 40 кГц, мощности 50 Вт в течение 60 с, используя синтетический воздух в качестве рабочего газа (15 Па). Интервал времени между обработкой в плазме и дальнейшими экспериментами составлял не более 2 ч.
Исследование химической структуры, морфологии и свойств поверхности пленок. Исследование микрорельефа поверхности пленок до и после обработки в плазме проводили с помощью атомно-силового микроскопа (АСМ) Bioscope Resolve фирмы Bruker (США), совмещенного с инвертированным оптическим микроскопом Axio Observer фирмы Carl Zeiss (Германия). Для сканирования поверхности использовался кантилевер ScanAsyst Air с номинальной жeсткостью k = 0.4 Н/м, радиусом острия r = 2 нм, сканирование происходило на воздухе в режиме PFQNM.
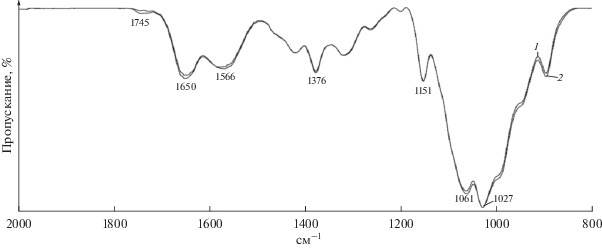
Исследование химической структуры поверхности исходной пленки хитозана и после ее обработки в плазме проводили методом ИК-Фурье-спектроскопии многократного нарушенного полного внутреннего отражения (МНПВО) на установке Spectrum Two (“Perkin-Elmer”, США), оснащенном высокопроизводительным детектором LiTaO3, стандартной оптической системой с окнами из KBr для сбора данных в спектральном диапазоне 8300–350 см–1 с разрешением 0.5 см–1. При помощи специальной плоской металлической головки, входящей в состав держателя образцов, пленки прижимались к рабочей поверхности элемента МНПВО. Спектры исходного и обработанного в плазме хитозана были нормализованы с использованием интенсивности колебаний C–O–С полосы гликозидной связи (1027 см–1) в качестве внутреннего стандарта.
Измерение краевых углов смачивания проводили методом сидячей капли с помощью гониометра Acam-MSC01 (“Apex Instruments”, Индия). Для измерений использовали две тестовые жидкости (дистиллированная вода и глицерин), по значениям краевых углов смачивания (θ ± 1°) рассчитывали работу адгезии (Wa), полную поверхностную энергию (γ), ее полярный (γр) и дисперсионный (γd) компоненты.
Культивирование клеток. Использовали линию кератиноцитов человека НаСаТ. Для экспансии и получения достаточного количества клеток культивирование проводили на адгезивных чашках Петри в стандартных условиях при 37°С и 5% СО2 в ростовой среде DMEM/F12 (1 : 1, “БиолоТ”, Россия) с добавлением гентамицина (50 мкг/мл, “ПанЭко”, Россия) и эмбриональной телячьей сыворотки FBS (10%, “Thermo Fisher”, США). Каждые 3 сут производили смену ростовой среды, после достижения 90% конфлюентности клеточную культуру пассировали с использованием растворов Версена и 0.25%-ного трипсина (“БиолоТ”, Россия).
Стерилизация образцов. Полученные пленки хитозана стерилизовали в 96% этаноле (3 смены по 10 мин), а затем производили замену этанола на стерильный фосфатно-солевой буфер и трижды промывали. Далее, в стерильных условиях из пленок вырезали круглые образцы диаметром 1 см для дальнейших экспериментов.
Определение биосовместимости пленок хитозана. Для анализа биосовместимости хитозановых пленок был проведен ряд тестов по определению цитотоксичности экстрактов, адгезивности пленок и жизнеспособности кератиноцитов на их поверхности.
Анализ цитотоксичности экстрактов пленок хитозана. Экстракты готовили путем инкубации 6 см2 каждой из пленок в 1 мл ростовой среды при температуре 37оС в течение 24 ч. Из полученных экстрактов (100%) готовили серию двукратных разведений (50, 25, 12.5, 6.25, 3.13, 1.56, 0.78%), был предусмотрен негативный контроль – ростовая среда без добавок (0%). В качестве положительного контроля использовали серию концентраций денатурирующего белка и разрушающего клетки детергента ДДС-Na: максимальная концентрация (100%) составляла 1 мг/мл, также готовили двукратные разведения (50, 25, 12.5, 6.25, 3.13%, 1.56%, 0.78%).
Клетки высевали на поверхность лунок 96-луночного планшета в соответствующей ростовой среде. Через 24 ч ростовую среду в лунках заменяли на экстракт пленки, раствор ДДС-Na (положительный контроль) либо ростовую среду (негативный контроль). Еще через 24 ч анализировали жизнеспособность и метаболическую активность клеток с помощью колориметрического теста AlamarBlue assay (AlamarBlue Cell Viability Reagent, “ThermoFisher Scientific”, США) и пролиферацию клеток определяли по концентрации двуцепочечной ДНК с помощью PicoGreen assay (Quant-iT PicoGreen dsDNA Assay Kit, “ThermoFisher Scientific”, США). Тест на метаболическую активность проводили следующим образом: в лунки добавляли аламаровый синий в количестве 10% от объема культуральной среды, инкубировали 2 ч при 37°С и 5% СО2. Измерения флуоресценции проводили с использованием планшетного спектрофлуориметра Victor Nivo (“PerkinElmer”, США) при длине волны возбуждения 580/20 и эмиссии 625/30 нм. Далее лунки 3 раза промывали фосфатным буфером, добавляли дистиллированную воду и проводили 3 цикла заморозки-разморозки планшетов для лизирования клеток. Тест на определение концентрации ДНК проводили в соответствии с рекомендациями производителя, измерение флуоресценции образцов осуществляли на спектрофлуориметре Victor Nivo (“PerkinElmer”, США) при длине волны возбуждения 480/30 нм и эмиссии 530/30 нм.
Анализ контактной цитотоксичности и адгезивных свойств пленок хитозана. Предварительно стерилизованные и подготовленные пленки хитозана засевали клетками в количестве 2 × 104 кл./см2 пленки. Образцы культивировали в течение 3 сут в стандартных условиях (37°С, 5% СО2) и затем проводили анализ метаболической активности с помощью теста AlamarBlue assay (AlamarBlue Cell Viability Reagent, “ThermoFisher Scientific”, США) и темпов пролиферации клеток с помощью теста PicoGreen assay (Quant-iT PicoGreen dsDNA Assay Kit, “ThermoFisher Scientific”, США) аналогично тому, как описано для экстрактов выше. Относительную метаболическую активность определяли по соотношению данных метаболической активности по AlamarBlue Assay к коррелирующему с числом клеток количеству ДНК в образцах, определенному с помощью PicoGreen assay.
Для исследуемых проб и контролей было поставлено по три повторности. Проверку нормальности распределения полученных данных проводили с помощью критерия Шапиро-Уилка, сравнение данных осуществляли методом однофакторного дисперсионного анализа. Данные представлены в виде средних значений ± стандартные отклонения. Различия признавали значимыми при р менее 0.05.
Анализ жизнеспособности и морфологии клеток на поверхности пленок хитозана. Часть пленок, заселенных клетками, культивировали в течение 7 сут для дальнейшей оценки жизнеспособности и морфологии клеток. В процессе культивирования морфологию клеток оценивали с помощью светового микроскопа с фазовым контрастом (“Carl Zeiss”, Axio Vert. A1, Германия). Через 7 сут проводили тест на наличие живых и мертвых клеток (Live/Dead assay), образцы окрашивали (30 мин, 37°C, 5% CO2) накапливающимся в живых клетках кальцеином (0.5 мг/мл, Calcein-AM, “Sigma-Aldrich”, Германия) и проникающим в мертвые и погибающие клетки йодидом пропидия (1.5 мкМ, “ThermoFisher Scientific”, США), ядра докрашивали бис-бензимидом (0.004 мг/мл, Hoechst 33258, “ThermoFisher Scientific, США). После окраски образцы промывали средой DMEM/F12 (1 : 1, "БиолоТ”, Россия) и помещали в ростовую среду для анализа на лазерном сканирующем конфокальном микроскопе LSM 880 (“Carl Zeiss”, Германия) с использованием возбуждающих лазеров с длинами волн 405 нм (Hoechst 33258), 488 нм (кальцеин) и 594 нм (йодид пропидия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Химическая структура, морфлогия и свойства поверхности пленок хитозана. Взаимодействие активных компонентов плазмы (электроны, ионы, нейтральные химически активные частицы, УФ-излучение) с поверхностью материалов сопровождается двумя основными процессами: изменением морфологии поверхности и ее химической структуры [29, 30].
Исследование морфологии поверхности методом АСМ показало, что обработка в плазме снижала среднеквадратичную шероховатость поверхности в два раза с 13.5 ± 0.8 до 7.9 ± 1.2 нм (рис. 1). У пленок после обработки в плазме наблюдается больший разброс значений шероховатости, что могло быть связано с появлением на поверхности образцов структур, которые можно отнести к остаткам щелочи или солей. Изменение в морфологии поверхности связано с типом воздействующих на поверхность активных компонентов. В случае низкочастотной плазмы воздействуют различные активные компоненты плазмы, которые могут приводить не только к травлению поверхности, но и изменению ее химической структуры.
На ИК-МНПВО-спектрах исходных пленок хитозана в низкочастотной области спектра наблюдаются все основные характеристические полосы: интенсивная полоса поглощения валентных колебаний пиранозного кольца (1030–1070 см–1); ассиметричные валентные колебания C–O–С ацетальной связи (1150 см–1); симметричные νCH, δCH, δNH, ${{{{\delta }}}_{{{\text{C}}{{{\text{H}}}_{{\text{2}}}}}}}$ (1320–1390 см–1); полоса валентных колебаний карбонильной группы амидной связи (Амид I) при 1650 см–1 (рис. 2). Широкая полоса в области 1550–1600 см–1 была огибающей полос деформационных колебаний аминогрупп хитозана и валентных колебаний карбоксилат-ионов (при 1566 см–1). Полоса при 1376 см–1 относилась к симметричным колебаниям СОО(–). Появление полос поглощения при 1710 и 1740 см–1 на ИК-спектрах пленок после обработки в плазме обусловлено формированием карбоксильных групп – характерном процессе при модифицировании полимеров в кислородсодержащей плазме, и образовании сложноэфирных связей, соответственно. Увеличение относительной интенсивности полосы Амид I в спектрах модифицированных пленок говорит также о протекании процессов амидирования хитозана, что возможно с учетом наличия остаточных солевых связей в образцах.
Исследование смачиваемости поверхности показало, что обработка в плазме пленок приводит к гидрофилизации поверхности: краевой угол смачивания по воде уменьшался в ∼2 раза (табл. 1). Расчет значений работы адгезии и поверхностной энергии выявил значительное их увеличение. В основном повышение поверхностной энергии связано с увеличением ее полярного компонента (∼2 раза), что хорошо согласуется с данными ИК-спектроскопии.
Таблица 1.
Влияние обработки в плазме на поверхностные характеристики пленок хитозана
| Пленка хитозана | θ, градусов | Wa, мДж/м2 | γ, мДж/м2 | ||||
|---|---|---|---|---|---|---|---|
| вода | глицерин | вода | глицерин | γ | γp | γd | |
| Исходная пленка | 71 | 71 | 97 | 84 | 32 | 25 | 7 |
| Обработанная в плазме | 40 | 42 | 129 | 111 | 58 | 47 | 11 |
Биосовместимость пленок хитозана. В настоящей работе показано отсутствие цитотоксичности по отношению к кератиноцитам человека экстрактов исходных пленок хитозана и после обработки в плазме. Для всех концентраций экстрактов пленок хитозана не выявлено снижения метаболической активности и пролиферации кератиноцитов, метаболическая активность в присутствии экстрактов соответствовала уровням контрольных образцов в ростовой среде (рис. 3а), а концентрация ДНК составляла в среднем 90 нг/мл (рис. 3в). В положительном контроле при воздействии раствора детергента ДДС-Na на клеточные культуры наблюдали значительное снижение жизнеспособности, летальная концентрация ДДС-Na составила 0.0078 мг/мл (рис. 3а, 3в).
Рис. 3.
Цитотоксичность экстрактов пленок из хитозана (1), хитозана, обработанного в плазме (2) для кератиноцитов человека (а и в): 3 – положительный контроль – серия разведений ДДС-Na: а –метаболическая активность (AlamarBlue assay). в – количество клеток в пробах по количеству ДНК (PicoGreen assay). По оси Х отложены степени разведения экстрактов (100% = 6 см2/мл) и ДДС (100% = 1 мг/мл); б – контактная цитотоксичность пленок из хитозана для кератиноцитов человека без обработки и обработанного в плазме; г – пролиферативная активность кератиноцитов на пленках (*p < 0.05 относительно отмеченных групп сравнения).
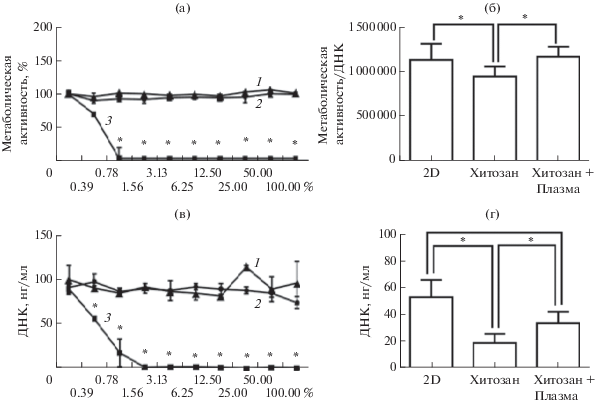
Анализ контактной цитотоксичности полученных пленок показал, что пролиферация кератиноцитов на поверхности хитозана ниже, чем на поверхности культурального пластика. Однако относительная метаболическая активность, то есть отношение метаболической активности к числу кератиноцитов на образцах хитозана, не снижалось по сравнению с контролем, что свидетельствовало об отсутствии токсичности пленок. Более того, обработка в плазме на 15% стимулировала относительную метаболическую активность кератиноцитов (рис. 3б). Обработка в плазме увеличила адгезию клеток на пленках и стимулировала пролиферацию кератиноцитов. На обработанных в плазме пленках хитозана ДНК было на 75% больше, чем на исходных пленках хитозана, и это количество составило 74% от контрольной культуры на поверхности культурального пластика (рис. 3г). Данные результаты можно объяснить более подходящими свойствами поверхности пленок, обработанных в плазме, для культивирования клеток. Увеличение гидрофильности поверхности облегчает как первоначальную адгезию клеток на этапе посева, так и дальнейшее распластывание и миграцию клеток по поверхности. Более того, наличие дополнительных функциональных групп на таких пленках также может вносить свой вклад в улучшение адгезии клеток. Наличие большого числа контактов клетка-матрикс обеспечивает необходимые условия для поддержания активного метаболизма. Кроме того, эффективная адгезия обеспечивает правильную работу цитоскелета, который в свою очередь влияет на клеточный цикл и усиливает пролиферацию. Ранее контактная цитосовместимость исследуемых пленок хитозана была показана по отношению к фибробластам мыши L929 [12]. Выделить отдельную характеристику поверхности, определяющую цитосовместимость, сложно, так как и морфология и химическая структура, вносят вклад во взаимодействие материал/клетка и меняются после обработки в плазме [31]. Показано, что цитосовместимость образца также может существенно различаться по отношению к разным типам клеток, в том числе после модифицирования [26, 31].
Полученные результаты согласуются с данными световой микроскопии роста кератиноцитов на поверхности пленок хитозана: обработка в плазме стимулировала формирование плотного эпителиального пласта через 7 сут, тогда как на поверхности исходных пленок формировались разрозненные островки эпителия (рис. 4а и 4б). Дополнительно на 7 сут культивирования был проведен тест на живые и мертвые клетки (Live/Dead assay), погибшие клетки практически отсутствовали, адгезировавшиеся на пленках кератиноциты имели стандартную морфологию эпителия с плотными контактами между клетками и были жизнеспособны (рис. 4в, 4г). Данные микроскопии коррелируют с результатами контактного теста на цитотоксичность – на более гидрофильных модифицированных пленках клетки адгезируют лучше. Свойства поверхности обеспечивают благоприятные условия для миграции, распластывания клеток, что делает возможным формирование единого плотного клеточного пласта в относительно короткие сроки.
Рис. 4.
Кератиноциты линии НаСаТ, через 7 сут культивирования (а, б), их жизнеспособность (в, г) на поверхности пленок из необработанного (а, в) и обработанного в плазме (б, г) хитозана: а, б – фазово-контрастная световая микроскопия; в, г – окраска Live/Dead и бис-бензимидом. Стрелками отмечены края эпителиального слоя на поверхности пленки, масштаб (световая микроскопия) ×50 мкм, лазерная сканирующая конфокальная микроскопия ×100 мкм.

Таким образом, пленочные образцы хитозана, в том числе после обработки в плазме, не обладали цитотоксическими эффектами и не снижали жизнеспособность НаСаТ как в форме экстрактов, так и при непосредственном культивировании клеток кератиноцитов на поверхности пленок из хитозана. Полученные результаты согласуются с результатами работы [32], где было показано отсутствие цитотоксичности хитозана для кератиноцитов, и дополняют их анализом пролиферации и морфологии клеток на сформированных из хитозана пленках. Полученные результаты согласовывались с известными данными по улучшению адгезионных свойств и биосовместимости пленок хитозана по отношению к другим типам клеток после обработки в плазме [33, 34]. Обработка хитозана в плазме стимулировала адгезию и пролиферацию кератиноцитов, что может найти широкое применение в усовершенствовании перевязочных материалов для заживления ран и стимуляции эпителизации.
Исследование выполнено за счет гранта Российского научного фонда (проект № 18-15-00401).
Список литературы
Ma Z., Mao Z., Gao C. // Colloids Surfaces B Biointerfaces. 2007. V. 60. № 2. P. 137–157.
Amani H., Arzaghi H., Bayandori M., Dezfuli A.S., Pazoki-Toroudi H., Shafiee A., Moradi L. // Adv. Mater. Interfaces. 2019. V. 6. № 13. P. 1900572. https://doi.org/10.1002/admi.201900572
Richbourg N.R., Peppas N.A., Sikavitsas V.I. // J. Tissue Eng. Regen. Med. 2019. V. 13. № 8. P. 1275–1293.
Chen L., Yan C., Zheng Z. // Mater. Today. 2018. V. 21. № 1. P. 38–59.
Liu Y., Zhang Z., Lv H., Qin Y., Deng L. // J. Bioact. Compat. Polym. 2018. V. 33. № 2. P. 134–145.
Asghari Sana F., Çapkın Yurtsever M., Kaynak Bayrak G., Tunçay E.Ö., Kiremitçi A.S., Gümüşderelioğlu M. // Cytotechnology. 2017. V. 69. № 4. P. 617–630.
Chu P.K., Chen J.Y., Wang L.P., Huang N. // Mater. Sci. Eng. R Reports. 2002. V. 36. № 5–6. P. 143–206.
Desmet T., Morent R., De Geyter N., Leys C., Schacht E., Dubruel P. // Biomacromolecules. 2009. V. 10. № 9. P. 2351–2378.
Sun W., Liu W., Wu Z., Chen H. // Macromol. Rapid Commun. 2020. V. 41. № 8. P. 1900430. https://doi.org/10.1002/marc.201900430
Asadian M., Onyshchenko I., Thukkaram M., Esbah Tabaei P.S., Van Guyse J., Cools P., Declercq H., Hoogenboom R., Morent R., De Geyter N. // Carbohydr. Polym. 2018. V. 201. P. 402–415.
Демина Т.С., Гильман А.Б., Акопова Т.А., Зеленецкий А.Н. // Химия высоких энергий. 2014. Т. 48. № 5. P. 339–349.
Demina T.S., Drozdova M.G., Yablokov M.Y., Gaidar A.I., Gilman A.B., Zaytseva–Zotova D.S., Markvicheva E.A., Akopova T.A., Zelenetskii A.N. // Plasma Process. Polym. 2015. V. 12. № 8. P. 710–718.
Kudryavtseva V., Stankevich K., Gudima A., Kibler E., Zhukov Y., Bolbasov E., Malashicheva A., Zhuravlev M., Riabov V., Liu T., Filimonov V., Remnev G., Klüter H., Kzhyshkowska J., Tverdokhlebov S. // Mater. Des. 2017. V. 127. P. 261–271.
Демина Т.С., Гильман А.Б., Зеленецкий А.Н. // Химия высоких энерий. 2017. Т. 51. № 4. P. 317–328.
Demina T.S., Piskarev M.S., Romanova O.A., Gatin A.K., Senatulin B.R., Skryleva E.A., Zharikova T.M., Gilman A.B., Kuznetsov A.A., Akopova T.A., Timashev P.S. // Materials. 2020. V. 13. № 3. P. 508.https://doi.org/10.3390/ma13030508
Nikitin D., Lipatova I., Naumova I., Sirotkin N., Pleskunov P., Krakovský I., Khalakhan I., Choukourov A., Titov V., Agafonov A. // Plasma Chem. Plasma Process. 2020. V. 40. № 1. P. 207–220.
Li Y., Kim J.H., Choi E.H., Han I. // Sci. Rep. 2019. V. 9. № 1. P. 3712.https://doi.org/10.1038/s41598-019-40371-6
Demina T., Zaytseva-Zotova D., Yablokov M., Gilman A., Akopova T., Markvicheva E., Zelenetskii A. // Surf. Coatings Technol. 2012. V. 207. P. 508–516.
Ahmed S., Annu, Ali A., Sheikh J. // Int. J. Biol. Macromol. 2018. V. 116. P. 849–862.
Ahsan S.M., Thomas M., Reddy K.K., Sooraparaju S.G., Asthana A., Bhatnagar I. // Int. J. Biol. Macromol. 2018. V. 110. P. 97–109.
Choi C., Nam J.P., Nah J.W. // J. Ind. Eng. Chem. 2016. V. 33. P. 1–10.
Varlamov V.P., Il’ina A.V., Shagdarova B.T., Lunkov A.P., Mysyakina I.S. // Biochem. 2020. V. 85. P. 154–176.
Alven S., Aderibigbe B.A. // Int. J. Mol. Sci. 2020. V. 21. № 24. P. 9656.https://doi.org/10.3390/ijms21249656
Miguel S.P., Moreira A.F., Correia I.J. Chitosan based-asymmetric membranes for wound healing: A review // Int. J. Biol. Macromol. 2019. V. 127. P. 460–475.
Matica M.A., Aachmann F.L., Tøndervik A., Sletta H., Ostafe V. // Int. J. Mol. Sci. 2019. V. 20. № 23. P. 5889.https://doi.org/10.3390/ijms20235889
Sangsanoh P., Suwantong O., Neamnark A., Cheepsunthorn P., Pavasant P., Supaphol P. // Eur. Polym. J. 2010. V. 46. № 3. P. 428–440.
Zhu X., Kerm S.C., Chan-Park M.B.E., Seng T.L. // J. Biomed. Mater. Res. Part A. 2005. V. 73. № 3. P. 264–274.
Wu Y.C., Lee T.M., Lin J.C., Shaw S.Y., Yang C.Y. // J. Biomater. Sci. Polym. Ed. 2010. V. 21. № 5. P. 563–579.
Trimukhe A.M., Pandiyaraj K.N., Tripathi A., Melo J.S., Deshmukh R.R. // Adv. Structur. Mater. 2017. V. 66.https://doi.org/10.1007/978-981-10-3328-5_3
Poncin-Epaillard F., Legeay G. // J. Biomater. Sci. Polym. 2003. V. 14. № 10. P. 1005–1028.
Cheng Q., Lee B.L.-P., Komvopolulos K., Yan Z., Le S. // Tissue Eng. Part A. 2013. V. 19. № 9–10. P. 1188–1198.
Argenziano M., Bressan B., Luganini A., Finesso N., Genova T., Troia A., Giribaldi G., Banche G., Mandras N., Cuffini A.M., Cavalli R., Prato M. // Mar. Drugs. 2021. V. 19. № 2.https://doi.org/10.3390/md19020112
Luna S.M., Silva S.S., Gomes M.E., Mano J.F., Reis R.L. // J. Biomater. Appl. 2011. V. 26. № 1. P. 101–116.
Lee C.-M., Yang S.-W., Jung S.-C., Kim B.-H. // J. Nanosci. Nanotechnol. 2017. V. 17. № 4. P. 2747–2750.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология