Прикладная биохимия и микробиология, 2022, T. 58, № 2, стр. 123-131
Влияние структуры альгинат-хитозановых материалов на кинетику высвобождения усниновой кислоты
Н. А. Горшкова 1, *, О. С. Бровко 1, И. А. Паламарчук 1, К. Г. Боголицын 1
1 Федеральный исследовательский центр комплексного изучения Арктики им. академика Н.П. Лаверова УрО РАН
163000 Архангельск, Россия
* E-mail: nat.gorshkova@mail.ru
Поступила в редакцию 09.08.2021
После доработки 29.09.2021
Принята к публикации 05.11.2021
- EDN: GATGLS
- DOI: 10.31857/S0555109922020088
Аннотация
На основе интерполимерного комплекса альгинат натрия-хитозан с применением лиофильной и сверхкритической сушки синтезированы пористые материалы криогели и аэрогели. Показано, что площадь удельной поверхности аэрогелей благодаря развитой мезопористой структуре была в ~10 раз выше, чем криогелей, и составляла 260 м2/г. Полиэлектролитная природа полученных материалов, формоустойчивость, высокое водопоглощение (15 и 45 г/г для криогеля и аэрогеля соответственно) позволяют применять полученные материалы для сорбционно-аппликационной терапии. Для придания антимикробных свойств материалы импрегнировали усниновой кислотой, выделенной из лишайника Usnea subfloridana, обладающей антибактериальной активностью относительно бактерии Escherichia coli и микроорганизмов вида Staphylococcus aureus и Bacillus subtilis. Показано, что минимальная ингибирующая концентрация усниновой кислоты для этих тест-культур составляла 0.03 мг/мл. Полученные материалы способны к медленному высвобождению усниновой кислоты в течение 5 ч, при этом ее максимальное высвобождение составляло 60% для аэрогеля и 30% для криогеля. Кинетика высвобождения усниновой кислоты из обоих материалов адекватно описывается уравнением Корсмейера–Пеппаса.
Интенсивное развитие химии медико-биологических полимеров обусловлено непрерывно растущим уровнем медицинских технологий и возникающей в связи с этим необходимостью создания новых материалов для восстановления и обеспечения нормальной жизнедеятельности организма. Актуальность разработки и совершенствования раневых покрытий диктуется задачами современной реконструктивной хирургии и низкой эффективностью традиционных перевязочных материалов [1, 2]. В связи с этим в настоящее время большое внимание уделяется разработке новых раневых покрытий на основе полисахаридов, выделенных из морских гидробионтов, что обусловлено их уникальной структурой и свойствами: биосовместимостью, биоразлагаемостью, низкой токсичностью и широким спектром биологической активности. Наиболее изученными и перспективными среди морских полисахаридов для применения в составе перевязочных средств являются альгинат натрия и хитозан. На их основе разработано значительное количество раневых покрытий различных типов с широкими возможностями применения, что связано не только с большим спектром их свойств, но и их распространенностью и возобновляемостью в природе, простотой извлечения, возможностью достижения высокой степени очистки и сравнительно невысокой ценой [3, 4].
Большинство из представленных на российском рынке раневых покрытий на основе альгинатов и хитозанов выпускается в виде однокомпонентных сшитых лиофилизированных губок и нетканых кровеостанавливающих салфеток, которые за счет высокой гидрофильности формируют на поверхности раны гель, в результате чего такие материалы обладают слабыми механическими свойствами и требуют использования вторичной повязки. Высокая скорость деградации альгинатных и хитозановых покрытий при контакте с раневой средой ограничивает область их практического применения лечением умеренно экссудирующих ран и приводит к быстрому высвобождению из них лекарственных веществ (ЛВ) [5, 6].
Изменяя такие факторы, как вид и количество используемых биополимеров, их соотношение, условия получения биополимерной системы и методы сушки, можно обеспечить ту или иную степень и скорость высвобождения активного вещества из раневого покрытия, тем самым придав ему необходимую терапевтическую эффективность.
В связи с этим, интерес в качестве основы для создания раневого покрытия могут представлять интерполимерные комплексы (ИПК) на основе полисахаридов альгината и хитозана [7–9]. Особенность ИПК заключается в сочетании свойств, как исходных полиэлектролитов, на основе которых они были получены, так и новых свойств, образующихся в результате комплексообразования. Таким образом, интерполимерное комплексообразование является одним из эффективных методов формирования и управления структурой, что может быть использовано для направленного получения материалов на основе ИПК с заранее заданными текстурными и физико-химическими характеристиками. Совмещение в одном материале альгината натрия и хитозана позволит повысить прочность получаемых материалов, придать им формоустойчивость во влажном состоянии и обеспечить необходимую скорость высвобождения ЛВ [10–13].
Исключительно важную роль при создании раневых покрытий на основе ИПК играют процессы удаления растворителя из геля, так называемой сушки геля, которая может значительно влиять на структуру и свойства получаемых материалов (величина удельной поверхности, распределение пор, плотность, прочность и др.). В настоящее время для получения пористых материалов преимущественно используют два вида сушки: лиофильную и сверхкритическую (СК-сушка). Метод лиофильной сушки, заключающийся в обезвоживании геля в условиях вакуума за счет возгонки жидкости из твердого состояния (лед) сразу в пар, позволяет получить высокопористый материал. Однако в отличие от СК-сушки он приводит к разрушению первоначальной структуры геля за счет роста крупных кристаллов при его замораживании. СК-сушка представляет собой вытеснение растворителя из пор матрицы аэрогеля флюидом, находящимся в сверхкритических условиях, благодаря чему при сушке отсутствует межфазная граница и связанные с этим капиллярные эффекты, что позволяет сохранить структуру образца, предотвратить его растрескивание и усадку. Таким образом, при создании полимерной матрицы с заданными текстурными характеристиками необходимо также правильно подобрать метод сушки гидрогелей [14–16].
Учитывая высокую резистентность микроорганизмов к применяемым в настоящее время лекарственным средствам, имеется высокая потребность в разработке новых эффективных материалов, не содержащих синтетических антибактериальных средств, но обладающих антимикробными и регенеративными свойствами. Перспективным в качестве антимикробного и ранозаживляющего вещества является использование лишайниковых кислот, наибольшую известность среди которых получила усниновая кислота (УК) – антибиотик фенольной природы, обладающий бактериостатическим и бактерицидным действием относительно грамположительных бактерий и бактерий, устойчивых к действию антибиотиков [17]. При этом, весомыми преимуществами УК, по сравнению с другими антибиотиками, являются ее природное происхождение и термостабильность. В ряде работ [18–20] сообщалось о применении УК в составе перевязочных материалов. Однако, антимикробная активность УК может быть улучшена путем ее иммобилизации в эффективный носитель, позволяющий контролировать скорость ее высвобождения.
Типичным продуцентом УК является лишайник рода Usnea, в котором это соединение является основным метаболитом [21]. Все виды этого рода лишайников – эпифиты, обитающие на коре и ветвях деревьев, и при лесозаготовке являются отходами вместе с корой и ветвями деревьев. В связи с этим, производство УК на базе утилизации отходов при лесоповалах должно быть экономически выгодно и оправданно для медицинского применения.
Цель работы – получение пористых материалов на основе интерполимерного комплекса альгинат натрия-хитозан, импрегнированных усниновой кислотой, выделенной из лишайников рода Usnea subfloridana, и оценка возможности применения полученных материалов в качестве раневых покрытий.
МЕТОДИКА
В работе использовали альгинат натрия (АЛNa) (“Sigma-Aldrich”, США) с молекулярной массой (ММ) 100 кДа и хитозан (ХТ) с ММ 200 кДа, степенью деацетилирования (СД) 0.89 (ООО “Биопрогресс”, Россия). ММ биополимеров определены методом капиллярной вискозиметрии с расчетом по уравнениям Марка–Куна–Хаувинка: для ХТ – $\left[ \eta \right] = {\text{1}}{\text{.38}} \times {\text{1}}{{{\text{0}}}^{{ - {\text{4}}}}}\,{{{\text{M}}}^{{{\text{0}}{\text{.85}}}}}$ [22], для АЛNa – $\left[ \eta \right] = {\text{3}}{\text{.41}} \times {\text{1}}{{{\text{0}}}^{{ - {\text{3}}}}}\,{{{\text{M}}}^{{{\text{1}}{\text{.02}}}}}$ [23]. СД определена методом кондуктометрического титрования [24].
Гидрогели получали смешением водного раствора анионоактивного АЛNa и уксуснокислого раствора катионоактивного ХТ с концентрацией 0.25% при эквимолярном соотношении компонентов. Расчет степени связывания полиэлектролитов в комплекс и мольного состава реакционной смеси проводили, как описано в работе [25].
Для получения аэрогелей водную фазу в структуре гидрогеля ИПК замещали ацетоном марки ч. д. а. (99.5%), затем образцы сушили в токе сверхкритического СО2 при скорости потока 1 мл/мин, температуре 40°С и давлении 10 МПа на установке MV-10ASFE (“Waters”, США). Для получения криогелей предварительно замороженные при –18°C коллоидные водные дисперсии ИПК АЛNa-ХТ лиофильно высушивали в вакууме на аппарате Lyovapor™ L-200 (“Buchi”, Индия) при давлении 0.03 мБар.
Параметры пористой структуры материалов получены методом низкотемпературной адсорбции азота (77.4 К) на анализаторе удельной поверхности ASAP 2020 MP (“Micromeritics”, США). Образцы предварительно подвергали дегазации при 90°С в течение 2 ч до остаточного давления 0.7 мПа.
Влагопоглощение материалов изучали гравиметрическим методом в дистиллированной воде [26]. Материалы погружали в чашу с раствором, накрывали крышкой и выдерживали в термостате при температуре 37°С. Образцы перед взвешиванием промокали фильтровальной бумагой.
Результаты оценивали по показателю степени набухания (q, г/г), который рассчитывали по формуле (1):
где ${{m}_{{1{\text{\;}}}}},{{m}_{{2{\text{\;}}}}}$ – масса аэрогеля до и после набухания, г.УК выделяли из лишайников вида Usnea subfloridana методом сверхкритической флюидной экстракции на установке MV-10ASFE (“Waters”, США). Измельченные талломы лишайника (~1.0 г) обрабатывали сверхкритическим СО2 при скорости потока 2 мл/мин, температуре 85°С и давлении 15 МПа в течение 80 мин.
Количество УК в экстрактах определяли методом ВЭЖХ с использованием жидкостного хроматографа LCMS-2020 (“Shimadzu”, Япония) при спектрофотометрическом детектировании. Условия хроматографирования: подвижная фаза – 0.5% водный раствор муравьиной кислоты : ацетонитрил (30 : 70); колонка RestekUltra C18 3.0 × × 100 мм, зерно 3 мкм; скорость потока подвижной фазы 0.5 мл/мин, объем вводимой пробы 5 мкл. Для калибровки в качестве стандартного образца использовали УК (“Sigma-Aldrich”, США).
Введение УК в матрицу аэрогеля проводили путем погружения навески соответствующего материала в спиртовой раствор УК с последующим выдерживанием в течение 5 ч при 20°С. Кинетику высвобождения УК изучали в забуференном фосфатом физиологическом растворе при рН 7.4 и температуре 37°С. Количество высвободившейся УК из материала определяли спектральным методом на спектрофотометре UV-1800 (“Shimadzu”, Япония) при длине волны 263 нм.
Антимикробную активность УК определяли диско-диффузионным методом. В качестве тест-культур использовали штаммы трех видов грамположительных микроорганизмов: Staphylococcus aureus ATCC 6538, Pseudomonas aeruginosa ATCC 27853 и Bacillus subtilis ATCC 6633; грамотрицательной бактерии Escherichia coli ATCC 25922, а также условно патогенного представителя микрофлоры человека Proteus mirabilis ATCC 3177.
Инокулянт тест-микроорганизмов соответствовал по плотности 0.5 по стандарту МакФарланда, который эквивалентен концентрации примерно 1.5 × 108 КОЕ/мл. Для получения бактериального газона производили посев 1 мл инокулянта на чашку Петри со средой АГВ. Сверху накладывали бумажный диск диаметром 6.0 мм, пропитанный раствором УК с концентрацией 0.03–3.0 мг/мл. Чашки Петри с исследуемыми образцами инкубировали в течение 24 ч при 37°С (Bacillus subtilis культивировали при 30°С). Степень антибактериальной активности оценивали по диаметру зоны задержки роста тест-культуры: очень высокая чувствительность – 20 мм, умеренная – 15–19 мм, слабая – 9–14 мм, отсутствие чувствительности – менее 8 мм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что свойства пористого гелевого материала определяются как свойствами его предшественника – гидрогеля, так и способом удаления из него растворителя. В связи с этим, ключевой стадией при создании пористых матриц на основе АЛNa и ХТ является построение прочного каркаса гидрогеля в результате формирования структуры ИПK, поскольку от этого зависит способность материала противостоять усадочным напряжениям в процессе сушки [27].
Наличие полярных групп ионного и неионного характера в макромолекулах АЛNa и ХТ способствует формированию ИПК в общем растворителе без значительных энергетических затрат в результате образования межмолекулярных ионных, водородных связей и дисперсионных взаимодействий. При стехиометрическом соотношении АЛNa и ХТ образуется нерастворимый ИПК в виде гидрогеля, представляющего собой прочную трехмерную структуру, узлами которой являются ионные связи между звеньями компонентов [25, 27]. Важнейшей задачей при последующей сушке полученных гидрогелей ИПК АЛNa-ХТ является бездефектный перевод коагуляционной структуры материалов в конденсационную и формирование при этом плотной, однородной и прочной структуры. Удаление растворителя из пористой структуры гелей проводили двумя методами: лиофильной и СК-сушки.
На рис. 1 показаны электронные микрофотографии и внешний вид материалов на основе ИПК АЛNa-ХТ, полученных лиофильной и СК-сушкой соответственно. Для криогелей характерна пористая морфология, являющаяся результатом процессов формирования структуры материалов, так как при замораживании гидрогеля происходит образование крупных кристаллов льда, которые при последующей лиофильной сушке оставляют пустоты.
Рис. 1.
Микрофотографии и фотографии: криогеля (а, в) и аэрогеля (б, г) ИПК АЛNa-ХТ при эквимолярном соотношении компонентов.

Образцы, полученные сушкой в сверхкритическом CO2, представляют собой трехмерную нанофибриллированную структуру, образованную переплетающимися волокнами диаметром 15–25 нм и длиной 50–80 нм, между которыми просматриваются пустоты – мезопоры. В отличие от аэрогелей в криогелях трудно выделить отдельные структурные элементы, волокна материала плотно прилегают друг к другу.
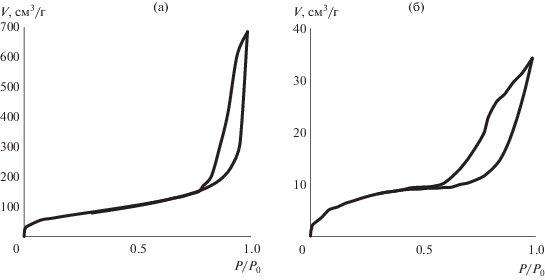
Влияние способа сушки на структуру материалов подтверждается расчетами их пористости (табл. 1, рис. 2). Оба полученных материала характеризуются развитой пористой структурой, при этом, площадь удельной поверхности аэрогелей в ~10 раз выше, чем криогелей, и составляет 260 м2/г.
Таблица 1.
Текстурные характеристики альгинат-хитозановых материалов
| Образец | Удельная поверхность, м2/г | Объем пор, см3/г | Средний диаметр пор, нм |
|||
|---|---|---|---|---|---|---|
| общая | мезопор | общий | микро | мезопор | ||
| Аэрогель | 260 ± 15 | 249 ± 13 | 1.06 ± 0.12 | 0.020 ± 0.004 | 1.03 ± 0.10 | 16.3 ± 1.9 |
| Криогель | 28 ± 2 | 12 ± 1 | 0.05 ± 0.01 | 0.007 ± 0.001 | 0.05 ± 0.01 | 7.7 ± 0.8 |
На изотермах адсорбции азота для аэрогеля и криогеля наблюдалась широкая петля гистерезиса, что связано с вторичными процессами капиллярной конденсации в результате полного заполнения мезопор при относительно высоком давлении. Однако, если аэрогель можно отнести к корпускулярным пористым телам, то криогель имеет изотерму адсорбции, характерную для губчатых тел. Причем поры во всем объеме криогеля являются взаимосвязанными, поскольку при замерзании кристаллы растворителя растут, как правило, от периферии сосуда к центру до момента соприкосновения с гранью другого кристалла. Петли гистерезиса на изотермах адсорбции обоих образцов близки к типу Н1 по классификации ИЮПАК, что также подтверждает наличие открытых с обоих концов капилляров [28]. Структуры такого типа характеризуются чрезвычайно высокой скоростью впитывания жидкости [29].
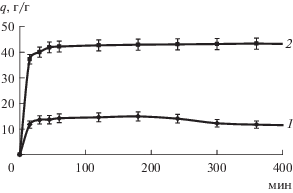
Известно, что диффузионно-транспортные свойства носителей лекарственных препаратов определяются характеристиками набухания во внешней среде [30]. На рис. 3 представлены кинетические кривые поглощения воды аэрогелем и криогелем, которые имеют вид, типичный для ограниченно набухающих материалов [31]. Вода, проникая в структуру ограниченно набухающих материалов, вызывает увеличение их диэлектрической проницаемости и снижает энергию ионной связи ${{--{\text{СО}}{{{\text{О}}}^{--}}} \mathord{\left/ {\vphantom {{--{\text{СО}}{{{\text{О}}}^{--}}} {--{\text{NH}}_{3}^{ + }}}} \right. \kern-0em} {--{\text{NH}}_{3}^{ + }}},$ при этом функциональные группы, образующие эту связь частично или полностью ионизируются. Поверхность материалов в водной среде гидратируется. Заряженные группы –СОО– и $--{\text{NH}}_{3}^{ + },$ входящие в состав полимерной матрицы, остаются неподвижными, а подвижные коионы Na+ и СН3СОО– образуют диффузную оболочку около заряженной поверхности ИПK. При этом криогели и аэрогели, поглощая воду, начинают набухать. Кроме того, набуханию материалов способствует осмотическое давление, создаваемое противоионами, которые перемещаются внутри материала, но не имеют возможности его покинуть (энтропийный фактор). Таким образом, набухание материалов на основе ИПК определяется двумя факторами: с одной стороны, осмотическим давлением и сродством полимеров к воде, а с другой – плотностью поперечных связей полимеров.
Представленные на рис. 3 данные, свидетельствуют о высокой скорости набухания обоих образцов, при этом, благодаря развитой мезопористой структуре максимальное водопоглощение аэрогеля (45 г/г) в три раза выше, чем криогеля (15 г/г). Согласно литературным данным, влагопоглощающая способность материалов на основе альгинатов варьирует в широком диапазоне от 7 до 35 г/г [32], при этом большинство полученных авторами материалов не обладали формоустойчивостью, что затрудняло их прямое сравнение. При этом, высокая сорбционная емкость аэрогелей позволяет отнести полученные материалы к суперадсорбентам.
Для придания полученным аэрогелям и криогелям бактерицидных свойств в матрицу материалов вводили УК. Важным критерием оценки эффективности потенциального ЛВ является спектр его антимикробного действия, то есть активность по отношению к разным группам микроорганизмов. Известно, что антибактериальная активность УК сильно зависит от характера оптического вращения, причем рядом исследований показано, что лишайник U. subfloridana является продуцентом D(+) изомера УК, который, как правило, более активен [33].
Результаты исследования антибактериальной активности УК, выделенной из лишайника U. subfloridanа, представлены в табл. 2 и на рис. 4. Наиболее высокую антибактериальную активность УК проявляет в отношении B. subtilis и S. aureus, зона ингибирования роста микроорганизмов для которых составляла 15–45 и 9–33 мм, соответственно.
Таблица 2.
Антибактериальная активность УК, выделенной из лишайника U. subfloridana
| Концентрация УК (мг/мл) | Диаметр зон ингибирования роста, мм | ||||
|---|---|---|---|---|---|
| Escherichia coli | Staphylococcus aureus | Pseudomonas aeruginosa | Bacillus subtilis | Proteus mirabilis | |
| 0.03 | 0 | 9 ± 2 | 0 | 15 ± 3 | 0 |
| 0.15 | 0 | 11 ± 1 | 0 | 35 ± 1 | 0 |
| 0.3 | 12 ± 2 | 13 ± 2 | 4 ± 1 | 37 ± 3 | 0 |
| 3.0 | 41 ± 3 | 33 ± 1 | 6 ± 3 | 45 ± 2 | 0 |
Рис. 4.
Образцы чашек Петри с сформированными зонами угнетения роста тест-культур после внесения УК: а – E. coli, б – S. aureus, в – P. aeruginosa, д – B. subtilis
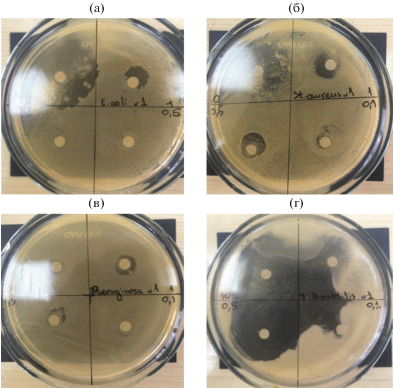
Минимальная ингибирующая концентрация УК для этих тест-культур составляла 0.03 мг/мл. Наименьший ингибирующий эффект наблюдается на тест культуре Pseudomonas aeruginosa (от 4 до 6 мм). Не выявлена антибактериальная активность УК в отношении Proteus mirabilis. При этом, для всех исследуемых культур микроорганизмов антибактериальная активность УК увеличивалась с увеличением ее концентрации.
Наиболее высокая антибактериальная активность УК выявлена при ее концентрации 3.0 мг/мл против грамотрицательной бактерии E. coli и грамположительных S. aureus и B. subtilis, которые являются наиболее частыми возбудителями раневых инфекций.
Следует отметить, что полученные результаты исследования антибактериальной активности УК по отношению к бактериальным культурам сопоставимы с действием промышленно выпускаемых антибиотиков [34]. Таким образом, полученные результаты подтверждают возможность использования УК, выделенной из лишайника U. subfloridana в составе раневых покрытий в качестве альтернативы синтетическим ЛВ.
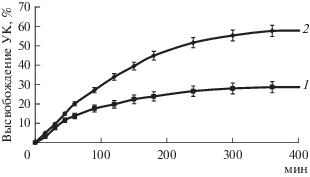
Введение УК в матрицу материалов проводили в статических условиях путем их погружения в спиртовой раствор УК с последующим выдерживанием в течение 5 ч при 20°С. Содержание УК в матрице аэрогеля составило 0.7, а в криогеле – 0.2 г/г. На рис. 5 отражен кинетический профиль высвобождения УК в забуференном фосфатом физиологическом растворе при рH 7.4, моделирующем раневую среду.
Кинетика высвобождения УК имела долговременный пролонгированный характер с постепенным выходом ЛВ. В течение 5 ч происходило медленное высвобождение УК из матрицы обоих материалов, при этом максимальное высвобождение УК составляло 60% от количества загруженной в матрицу УК для аэрогеля и 30% для криогеля, что обусловлено особенностями пористой структуры носителей. Такая продолжительность высвобождения позволяет равномерно доставлять ЛВ к раневой поверхности и открывает перспективы использования полученных материалов в качестве основы для создания раневых покрытий.
Для описания полученных экспериментальных данных с учетом того, что основной вклад в процессы высвобождения вносит диффузия, использовали три широко применяемые в химико-фармацевтической научной литературе эмпирические модели: модель кинетики первого порядка (2), а также модели, основанные на уравнениях Хигучи (3) и Корсмейера–Пеппаса 4) [35]:
(2)
${\text{ln}}(1{\text{ }}--{{{{M}_{t}}} \mathord{\left/ {\vphantom {{{{M}_{t}}} {{{M}_{0}}}}} \right. \kern-0em} {{{M}_{0}}}}) = {{k}_{1}}--{{k}_{2}}t,$Mt и M0 – количество высвободившегося и изначально загруженного ЛП в полимерную матрицу в момент времени t.
(3)
${{M}_{t}} = {{k}_{{\text{н}}}}{{t}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$Рассчитанные кинетические параметры высвобождения УК из аэрогеля и криогеля ИПК АЛNa-ХТ приведены в табл. 3. Полученные экспериментальные результаты лучше всего описываются моделью Корсмейера–Пеппаса. Для данной модели квадрат коэффициента корреляции самый высокий 0.95–0.99, поскольку в отличие от модели первого порядка и Хигучи данная модель учитывала проникновение среды в матрицу материалов и их набухание.
Таблица 3.
Кинетические параметры высвобождения УК из материалов ИПК АЛNa-ХТ
| Материал | Модель | ||||||
|---|---|---|---|---|---|---|---|
| первого порядка | Хигучи | Корсмейера–Пеппаса | |||||
| k1 | R2 | kн | R2 | kKP | n | R2 | |
| Аэрогель | 0.11 | 0.96 | 3.50 | 0.97 | 1.10 | 0.73 | 0.99 |
| Криогель | 0.04 | 0.82 | 1.53 | 0.94 | 1.00 | 0.59 | 0.95 |
Константа n в уравнении Корсмейера–Пеппаса характеризует тип диффузии и позволяет оценить механизм высвобождения ЛВ. Если значение n ≤ 0.5, то высвобождение ЛВ происходит за счет диффузии, подчиняющейся законам Фика; значение в диапазоне 0.5 < n < 1.0 свидетельствует об аномальном транспорте, не подчиняющемся законам Фика (скорость диффузии сопоставима со скоростью релаксации макромолекул); при n > 1.0 – предполагается релаксационно-контролируемый транспорт [36]. При высвобождении УК из аэрогеля и криогеля преобладает аномальный транспорт (0.73 и 0.59 соответственно) (табл. 3).
Таким образом, показана возможность использования полученных аэрогелей и криогелей на основе ИПК АЛNa-ХТ для создания раневых повязок с включением природного лекарственного вещества (усниновая кислота), обеспечивающих пролонгированное поступление лекарственного препарата к раневой поверхности, позволяющее избежать передозировки препарата и связанных с этим побочных эффектов. Высокая эффективность полученных материалов позволяет использовать их в более широко для лечения ран по сравнению с представленными на российском рынке раневыми покрытиями на основе альгинатов и хитозанов. Несмотря на широкий ассортимент синтетических антибактериальных и противовоспалительных раневых покрытий, препараты на растительной основе могут занять достойное место при лечении различных поражений кожи.
* *
На основе интерполимерного комплекса альгинат натрия–хитозан стехиометрического состава с применением лиофильной и СК-сушки получены криогели и аэрогели. Установлено, что материалы, высушенные в сверхкритических условиях, характеризуются более развитой пористой структурой по сравнению с материалами, полученными лиофильной сушкой: объем пор аэрогелей составляет 1.06 см3/г, что в 20 раз больше, чем у криогелей, а удельная поверхность аэрогелей и криогелей составляла 260 и 28 м2/г соответственно. Показано, что оба материала обладали высокой влагопоглощающей способностью, при этом максимальное водопоглощение аэрогеля (45 г/г) в 3 раза выше, чем криогеля (15 г/г). Для придания полученным аэрогелям и криогелям бактерицидных свойств в матрицу материалов вводили усниновую кислоту, выделенную из лишайника U. subfloridana, которая активна против грамотрицательной бактерии E. coli и грамположительных микроорганизмов: S. aureus и B. subtilis. Кинетика высвобождения усниновой кислоты из полимерных матриц имеет долговременный пролонгированный характер с постепенным выходом лекарственного вещества: в течение 5 ч происходило медленное высвобождение усниновой кислоты из матрицы обоих материалов, при этом ее максимальное высвобождение составляло 60% для аэрогеля и 30% для криогеля, что обусловлено особенностями пористой структуры носителей. Полученные экспериментальные результаты лучше всего описываются моделью Корсмейера–Пеппаса, которая в отличие от модели первого порядка и Хигучи учитывает проникновение среды в матрицу материалов и их набухание. Такая продолжительность высвобождения усниновой кислоты из материалов позволяет равномерно доставлять лекарство в рану и открывает перспективы их использования для создания раневых покрытий.
Исследования проведены в ходе выполнения государственного задания ФГБУН ФИЦКИА УрО РАН 2018–2021 г. “Физико-химические, генетические и морфологические основы адаптации растительных объектов в условиях изменяющегося климата высоких широт” (№ АААА-А18-118012390231-9) с использованием оборудования ЦКП НО “Арктика” (САФУ) и ЦКП КТ РФ-Арктика (ФИЦКИА УрО РАН).
Список литературы
Куринова М.А., Гальбрайх Л.С., Скибина Д.Э. // Современная медицина: актуальные вопросы. 2015. Т. 10–11. № 43. С. 137–145.
Белов А.А., Ванюшенкова А.А., Досадина Э.Э., Ханафина А.А. // Раны и раневые инфекции. Журн. им. профессора Б.М. Костючёнка. 2018. Т. 5. № 1. С. 508–510.
Островский Н.В., Белянина И.Б. // Журн. Неотложная хирургия им. И.И. Джанелидзе. 2021. № 1. С. 50–51.
Кузнецова Т.А., Беседнова Н.Н., Усов В.В., Андрюков Б.Г. // Вестник хирургии им. И.И. Грекова. 2020. Т. 179. № 4. С. 109–115.
Липатов В.А., Северинов Д.А., Саакян А.Р. // Innova. 2019. Т. 1. № 14. С. 48–52.
Михайлов Г.М., Лебедева М.Ф., Пинаев Г., Юдинцева Н.М., Блинова М.И., Панарин Е.Ф. // Гены и клетки. 2006. Т. 1. № 4. С. 56–61.
Rencber S., Cheaburu–Yilmaz C.N., Kose F.A., Karavana S.Y., Yilmaz O. // Cellulose chemistry and technology. V. 53. P. 655–665.
Бровко О.С., Паламарчук И.А., Вальчук Н.А., Чухчин Д.Г., Боголицын К.Г., Бойцова Т.А. // Журн. физической химии. 2017. Т. 91. № 8. С. 1420–1425.
Бровко О.С., Паламарчук И.А., Вальчук Н.А., Бойцова Т.А., Боголицын К.Г., Чухчин Д.Г. // Известия Уфимского научного центра РАН. 2016. Т. 3. № 1. С. 19–22.
He J., Zhong C., Mi J. // Drug Delivery. 2005. V. 12. № 5. P. 251–259.
Бровко О.С., Паламарчук И.А., Вальчук Н.А., Бойцова Т.А., Боголицын К.Г. // Известия Уфимского научного центра РАН. 2018. Т. 3. № 2. С. 45–49.
Вальчук Н.А., Бровко О.С., Паламарчук И.А., Бойцова Т.А., Боголицын К.Г., Ивахнов А.Д., Чухчин Д.Г., Богданович Н.И. // Сверхкритические флюиды: теория и практика. 2018. Т. 13. № 3. С. 83–89.
Moin A., Gangadharappa H.V., Adnan M., Rizvi S.M., Ashraf S.A., Patel M., Allam A.N. // Drug Design, Development and Therapy. 2020. V. 14. P. 5325–5332.
Baldino L., Cardea S., De Marco I., Reverchon E. // The J. Supercritical Fluids. 2014. V. 90. P. 27–34.
Ruiz-Caro R., Veiga-Ochoa M.D. // Molecules. 2009. V. 14. № 11. P. 4370–4386.
Горшкова Н.Д., Бровко О.С., Паламарчук И.А., Ивахнов А.Д., Боголицын К.Г., Богданович Н.И., Чухчин Д.Г. // Сверхкритические флюиды: теория и практика. 2020. Т. 15. № 3. С. 11–20.
Cocchietto M.A // Naturwissenschaften. 2002. V. 89. № 4. P. 137–146.
Zhang Z., Zheng Y., Li Y., Bai H., Ma T., Song X., Gao L. // Biomedicine and Pharmacotherapy. 2018. V. 97. P. 587–593.
Jin J., Dong Y., He L. // J. Chinese Medicinal Materials. 2005. V. 28. № 2. P. 109–111.
Bruno M., Trucchi B., Burlando B., Ranzato E., Martinotti S., Akkol E. K., Verotta L. // Bioorganic and Medicinal Chemistry. 2013. V. 21. № 7. P. 1834–1843.
Lucarini R., Tozatti M.G., de Oliveira Salloum A.I., Crotti A.E., Silva M.L., Gimenez V.M., Cunha W.R. // African J. Biotechnology. 2012. V. 11. № 20. P. 4636–4639.
Pogodina N.V., Pavlov G.M., Bushin S.V., Mel’nikov A.B., Lysenko Y.B., Nud’ga L.A., Tsvetkov V.N. // Polymer Science USSR. 1986. V. 28. P. 251–259.
Holme H.K., Davidsen L., Kristiansen A., Smidsrod O. // Carbohydrate Polymer. 2008. V. 73. P. 656–664.
Raymond L., Morin F.G., Marchessault R.H. // Carbohydrate Research. 1993. V. 246. № 1. P. 331–336.
Brovko O.S., Palamarchuk I.A., Boitsova T.A., Bogolitsyn K.G., Valchuk N.A., Chukhchin D.G. // Macromolecular Research. 2015. V. 23. № P. 1059–1067.
Nischwitz S.P., de Mattos I.B., Hofmann E., Groeber-Becker F., Funk M., Mohr G.J., Kamolz L.P. // Burns. 2019. V. 45. P. 1336–1341.
Gorshkova N., Brovko O., Palamarchuk I., Bogolitsyn K., Ivakhnov A., Bogdanovich N., Chukhchin D., Arkhilin M. // J. Sol-Gel Science and Technology. 2020. V. 95. № 1. P. 101–108.
Sultan M., Miyazaki T., Koyama S. // Renewable Energy. 2018. V. 121. P. 441–450.
Yasinskaya N.N., Murycheva V.V., Razumeev K.E. // Fibre Chemistry. 2020. V. 52. P. 28–33.
Vilar G., Tulla-Puche J., Albericio F. // Current drug delivery. 2012. V. 9. Is. 4. P. 367–394.
Воробьева Е., Крутько Н. Полимерные комплексы в водных и солевых средах. Минск: Белорусская наука, 2017. 177 с.
Cai J., Chen X. // RSC advances. 2018. V. 8. № 69. P. 39463–39469.
Cansaran-Duman D., Halici M.G. // Turk Hijyen ve Deneysel Biyoloji Dergisi. 2012. V. 69. № 3. P. 127–134.
Лобанова И.Е., Андреева И.С., Высочина Г.И., Соловьянова Н.А. // Растительный мир Азиатской России. 2017. Т. 2. № 26. С. 85–91.
Wang Y., Wang J., Yuan Z., Han H., Li T., Li L., Guo X. // Colloids and Surface B. 2017. V. 152. P. 252–259.
Siepmann J., Peppas N.A. // Advanced Drug Delivery Reviews. 2001. V. 48. P. 139–157.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология