Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 594-604
Влияние бактерий Bacillus subtilis и сигнальных молекул на состояние про-/антиоксидантной системы и экспрессию генов защитных белков у растений картофеля при инфицировании возбудителем фитофтороза и недостатке влаги
Л. Г. Яруллина 1, *, В. О. Цветков 2, Г. Ф. Бурханова 1, Е. А. Черепанова 1, А. В. Сорокань 1, Е. А. Заикина 1, И. С. Марданшин 3, Ж. Н. Калацкая 4, Н. В. Балюк 4
1 Институт биохимии и генетики – обособленное структурное подразделение Уфимского федерального исследовательского центра Российской академии наук
450054 Уфа, Россия
2 Башкирский государственный университет
450076 Уфа, Россия
3 Башкирский научно-исследовательский институт сельского хозяйства – обособленное структурное подразделение Уфимского федерального исследовательского центра Российской академии наук
450059 Уфа, Россия
4 Институт экспериментальной ботаники им. В.Ф. Купревича НАН Беларуси
220072 Минск, Беларусь
* E-mail: yarullina@bk.ru
Поступила в редакцию 12.05.2021
После доработки 21.06.2021
Принята к публикации 02.07.2021
Аннотация
Исследовано влияние бактерий Bacillus subtilis в сочетании с салициловой (СК) и жасмоновой (ЖАК) кислотами на состояние про-/антиоксидантной системы (содержание пероксида водорода, активность каталазы, пероксидазы, супероксиддисмутазы), содержание пролина, транскрипционную активность генов PR-1, PR-6 и PR-9 и изменение протеома листьев в связи с развитием устойчивости картофеля к возбудителю фитофтороза – оомицету Phytophthora infestans (Mont.) de Bary при недостатке влаги. Растения, выращенные из микроклубней сорта Ранняя Роза, опрыскивали суспензией B. subtilis (108 кл./мл) и смесью бактерий с СК (10–6 M), ЖАК (10–7 M), СК + ЖАК. Через 3 сут после обработки растения инфицировали P. infestans (105 спор/мл) и культивировали в условиях искусственно создаваемой почвенной засухи путем сокращения полива. При достижении влажности почвы 40 ± 5% от полной влагоемкости (7 сут после инфицирования) в растениях оценивали биохимические параметры. Выявлено снижение степени развития P. infestans на листьях при обработке B. subtilis в сочетании с СК и ЖАК. Механизм активации защитных систем растений картофеля бактериями рода Bacillus и сигнальными молекулами в условиях засухи был связан с накоплением Н2О2, повышением активности антиоксидантных ферментов и экспрессии генов PR-белков. В протеоме листьев картофеля обнаружены различия в присутствии 19 полипептидов в диапазоне pI от 4.0 до 9.0 с молекулярными массами от 30 до 125 кДа. Обработка B. subtilis в сочетании только с ЖАК наиболее существенно изменяла спектр белков, как у здоровых, так и у инфицированных растений. Выявленные различия в активации синтеза защитных белков под влиянием бактерий B. subtilis и сигнальных молекул позволяют предположить наличие дифференциальных путей формирования устойчивости к P. infestans у растений картофеля с их участием.
Повышение устойчивости растений к патогенам и неблагоприятным агроклиматическим условиям является актуальной задачей растениеводства, поскольку в естественных условиях возделываемые культуры одновременно или последовательно подвергаются воздействию стрессовых факторов различной природы. В этой связи наиболее перспективными представляются микробиологические подходы, основанные на использовании потенциала растений и почвенных микроорганизмов. Основой биобезопасных препаратов для защиты растений от биотических и абиотических стрессов являются стимулирующие рост растений бактерии (СРРБ) [1]. В этом отношении особенно привлекательны высокоэффективные бактерии рода Bacillus, способные длительное время сохранять жизнеспособность. Среди абиотических факторов, формирующих продуктивность растений, наиболее важным является наличие воды. Рост и развитие картофеля, а также урожайность, сильно зависят от влажности почвы, и эта зависимость выражена гораздо сильнее, чем у других видов сельскохозяйственных культур [2]. Известно, что ризобактерии могут значительно повысить засухоустойчивость растений [3].
Особенностью СРРБ является их способность воздействовать на рост растений непосредственно за счет синтеза различных метаболитов гормональной и сигнальной природы, таких как ауксины, цитокинины, гиббереллины, абсцизовая, салициловая (СК) и жасмоновая (ЖАК) кислоты [4]. Считается, что обработка растений СРРБ способствует развитию индуцированной системной устойчивости (ИСУ), опосредованной действием жасмоновой кислоты, маркером развития которой является индукция экспрессии защитного белка PR-6. Однако показано, что формирование устойчивости пшеницы к патогенам под действием бактерий рода Bacillus может развиваться и через салицилатный сигналинг по типу системной приобретенной устойчивости (СПУ), маркером развития которой служит индукция экспрессии защитного белка PR-1 [5].
Показано, что экзогенно применяемая салициловая кислота, помимо повышения устойчивости к патогенам, повышает устойчивость растений к ряду абиотических стрессов, аналогичные данные были получены при обработке жасмонатом [6]. Таким образом, значительный интерес представляет выяснение механизмов индуцирования устойчивости растений к патогенам и абиотическим стрессам под действием бактерий рода Bacillus в комплексе с сигнальными молекулами.
Цель работы – изучение особенности формирования защитного ответа у растений картофеля бактериями Bacillus subtilis в сочетании с сигнальными молекулами, связанного с состоянием про-антиоксидантной системы и экспрессией генов патоген-индуцируемых белков, в ответ на инфицирование Phytophthora infestans при недостатке влаги.
МЕТОДИКА
Объекты исследования. В опытах использовали растения картофеля Solanum tuberosum (Чишминская опытная станция Башкирского НИИ сельского хозяйства, Уфа, Россия), выращенные из микроклубней восприимчивого сорта Ранняя роза. Клубни высаживали в емкости с грунтом (“TerraVita”, Норд Палп, торф верховой разной степени разложения, очищенный речной песок, перлит, комплексные минеральные удобрения, биогумус, pH 6.0–6.5) на глубину 3–4 см. Растения выращивали на светоплощадке с фотопериодом 16 ч (освещенность 8000–10 000 люкс) при температуре 20–22°С.
Бактерии B. subtilis 26Д из коллекции лаборатории биохимии иммунитета растений Института биохимии и генетики Уфимского федерального исследовательского центра РАН (Уфа, Россия) культивировали в среде LB (Lysogeny Broth) в течение 24 ч, затем суспензию разбавляли дистиллированной водой до необходимой концентрации.
Для заражения растений использовался P. infestans из коллекции лаборатории биохимии иммунитета растений Института биохимии и генетики Уфимского федерального исследовательского центра РАН (Уфа, Россия). Патоген выращивали на картофельном агаре с декстрозой в течение 7 сут после повторного выделения из инфицированных мини-клубней картофеля для восстановления агрессивности патогена. Поверхность колоний изолята P. infestans заливали дистиллированной водой и инкубировали при 4°C в течение 30 мин. Концентрацию спорангиев оценивали с помощью камеры Фукса–Розенталя, суспензию спор разводили до титра 1 × 105 спор/мл.
Обработка растений. На 15 сут после прорастания растений часть из них опрыскивали суспензией из расчета 5 мл на 1 растение бактерий B. subtilis 26Д (108 клеток / мл) и смесью бактерий с СК (10–6 М), ЖАК (10–7 M) или СК (10–6 M) + ЖАК (10–7 M) [7]. В контроле опрыскивали 5 мл дистиллированной воды на 1 растение. На 3 сут после инокуляции B. subtilis 26Д растения опрыскивали 5 мл 1 × 105 спор/мл суспензии P. infestans. В качестве контрольных использовали растения, не инокулированные бактериями и не инфицированные фитофторой.
Дефицит влаги создавали за счет сокращения полива. При появлении видимых симптомов засухи (увядание растений) через 7 сут после заражения P. infestans (влажность почвы 40% ± 5 от полной влагоемкости) [7] определяли активность ферментов, содержание H2O2 и пролина в листьях. Часть листьев каждого растения замораживали в жидком азоте и хранили при –70°C для выделения РНК и белков. О развитии болезни судили по проценту пораженной площади от общей площади листовой пластинки (степень поражения) на 7 сут после заражения растений P. infestans. Листья фотографировали, полученные изображения анализировали в компьютерной программе ImageJ (“NIH”, США).
Определение содержания H2O2. Для определения содержания H2O2 методом, описанным в работе [8] с модификациями, листья гомогенизировали в ступке при 4°C в 25 мМ фосфатном буфере (ФБ), pH 6.2, в соотношении 1 : 3, и центрифугировали в течение 10 мин при 10 000 g и 4°C с использованием микроцентрифуги 5415R (“Eppendorf”, Германия). Супернатант использовали для определения содержания H2O2 с использованием ксиленолового оранжевого. Реагент содержал 0.074% соли Мора (Fe2(NH4)2SO4, чистота 99.997%) в 5.81% серной кислоте и 0.009% ксиленолового оранжевого в 1.82%-ном сорбите (в соотношении 1 : 100). Реакционную смесь инкубировали 40 мин при комнатной температуре, затем измеряли оптическую плотность при 560 нм с использованием люминесцентной спектрометрической ячейки Perkin Elmer LS 55 (США) против холостого опыта, содержащего воду вместо образца. Концентрацию пероксида водорода определяли по предварительно построенной калибровочной кривой.
Определение активности супероксиддисмутазы (СОД). Активность СОД (КФ 1.15.1.1.) измеряли описанным методом [9] с некоторыми модификациями. Листья гомогенизировали при 4°C в 50 мМ ТрисHCl-буфере (pH 7.4) в соотношении 1 : 10 и экстрагировали в течение 30 мин. Перед анализом растительные экстракты центрифугировали 10 мин при 10000 g и 4°C на центрифуге 5415R (“Eppendorf”, Германия) и отбирали супернатант для измерения активности СОД. К 2 мл реагента 1 (0.1 мМ ЭДТА с 0.5 мМ феназинметосульфата и 0.6 мМ нитросинего тетразолия в 0.15 М-ном Na-фосфатном буфере, pH 7.8) добавляли 100 мкл реагента 2 (150 мМ Трис-буфер, pH 8.0 с 1.25 мМ ЭДТА и 0.1 мМ НАДН) и 100 мкл надосадочной жидкости образца, хорошо перемешивали и сразу же измеряли в люминесцентной спектрометрической ячейке Perkin Elmer LS 55 (США) при 540 нм. Затем через 10 мин было проведено повторное измерение. Разницу в оптической плотности использовали для расчета процента блокирования восстановления нитросинего тетразолия. За единицу активности принимали U = = (D10 – D0)/D0 × 100%, где D0 – оптическая плотность в момент приготовления смеси, D10 – оптическая плотность через 10 мин. Активность СОД выражали в единицах/мг белка.
Определение активности каталазы (КАТ). Для определения активности каталазы (КФ 1.11.1.6) методом [10] с модификациями растительную ткань гомогенизировали при 4°C в 50 мМ ФБ (pH 7.8) в соотношении 1 : 10. После центрифугирования при 10 000 g и 4°C на микроцентрифуге 5415R (Eppendorf, Германия) супернатант использовали для анализа активности фермента. Реакцию инициировали добавлением надосадочной жидкости к 65 мМ пероксида водорода в 50 мМ растворе ФБ (pH 7.8), смесь выдерживали при комнатной температуре в течение двух минут. Реакцию останавливали добавлением 32.4 мМ молибдата аммония. В контрольную пробу вместо супернатанта добавляли дистиллированную воду. Интенсивность проявленной окраски измеряли на Perkin Elmer LS 55 (США) при 410 нм. Активность каталазы рассчитывали по формуле: U = (Aк – ‒ Aо)/(KVT), где Aк и Aо – абсорбция контрольных (содержащих воду вместо образца) и опытных образцов, соответственно, V – объем пробы, 0.1 мл, T – время инкубации, 600 с, K – коэффициент молярного поглощения H2O2, равный 22.2 × × 103 моль–1 см–1. Активность КАТ выражали в единицах/ мг белка.
Определение активности пероксидазы (ПО). Для определения активности пероксидазы (КФ 1.11.1.7) методом описанным в работе [11] с модификациями листья гомогенизировали при 4°C в 10 мМ ФБ, pH 6.2. Соотношение массы образца листьев к объему ФБ составляло 1 : 3. Экстракт центрифугировали 20 мин при 10 000 g при +4°C на центрифуге 5415R (“Eppendorf”, Германия). Пероксидазную активность супернатанта определяли микрометодом окисления субстрата 20 мМ ортофенилендиамина 10 мМ пероксидом водорода, развитие окраски останавливали 4 н. H2SO4. Оптическую плотность раствора измеряли при 490 нм на приборе Perkin Elmer LS 55 (США). За единицу активности фермента принимали изменение оптической плотности раствора за 1 мин. Активность ПО выражали в ед./мг белка.
Определение содержания белка. Содержание белка в образцах определяли по методу Брэдфорд, используя бычий сывороточный альбумин в качестве стандарта [12]. Поглощение измеряли при 595 нм.
Определение содержания пролина. Навеску растений заливали 2.5 мл стерильной дистиллированной воды. Пробирки помещали в водяную баню, которую затем доводили до кипения, после чего пробирки вынимали и охлаждали. К 2 мл холодного образца добавляли 2 мл реагента нингидрина и 2 мл ледяной уксусной кислоты, помещали на водяную баню и кипятили в течение часа, затем охлаждали. Оптическую плотность продуктов реакции измеряли на спектрофотометре при 522 нм.
Определение транскрипционной активности генов PR-белков. РНК выделяли из растений с помощью тризола (“Molecular Research Center, Inc.”, США). Навеску листьев гомогенизировали в жидком азоте. Для получения кДНК на основе мРНК исследуемых образцов проводили реакцию обратной транскрипции с использованием обратной транскриптазы M-MuLV согласно протоколу поставщика. Анализ накопления транскриптов генов PR-1 (номер GenBank AY050221), PR-6 (номер GenBank JX683427) и PR-9 (номер GenBank M21334) проводили с помощью количественной ПЦР в реальном времени. кДНК разводили в пять раз и использовали непосредственно в качестве матрицы для количественной ПЦР (qPCR). Количественная ПЦР проводилась методом полимеразной цепной реакции в реальном времени с использованием N', N'-диметил-N-(4-((E)-(3-метил-1,3-бензотиазол-2-илиден) метил)-1-фенилхинолин-1-иум-2-ил) -N-пропилпропан-1,3-диамина (SYBR GreenI) (“Synthol”, Россия) на приборе CFX Connect Real-Time System (“Bio-Rad”, США). Программа qPCR: 50°C в течение 2 мин; 95°С – 10 мин; 40 циклов при 95°C в течение 15 с и при 60°C в течение 1 мин. Каждую количественную ПЦР проводили в трех повторностях. После заключительного цикла ПЦР был проведен анализ кривой плавления для определения специфики реакции (при 95°C в течение 15 с, 60°C в течение 1 мин и 95°C в течение 15 с). Эффективность каждой пары праймеров была определена с использованием серии 10-кратных разведений кДНК для надежного определения кратных изменений. Измерения транскрипционной активности гена (оценка количества копий мРНК для каждого гена) проводили относительно эталонного гена St_act (“ген домашнего хозяйства”, актин, номер GenBank X55749) с использованием программного обеспечения “CFX Connect Real-Time System” (“Bio-Rad”, США). Анализ данных проводили с помощью программного пакета Lasergene от “DNASTAR, Inc.” (США). Праймеры, использованные в работе, приведены в табл. 1 , дополнительные материалы.
Двумерный электрофорез. 450 мг листьев гомогенизировали в жидком азоте, ресуспендировали в 1 мл буферного раствора (0.7 M сахароза, 0.5 Hepes-KOH, pH 7.5, 0.1 M KCl, 2% меркаптоэтанол, 1 мМ ЭГТА, 1 мМ ФМСФ, 0.1 мМ ортованадат натрия) и инкубировали в течение 30 мин при 4°С. Белки экстрагировали фенольным раствором по методике [13]. К 1 мл фенола, насыщенного трис-HCl, добавляли 1 мл образца белка, полученную смесь инкубировали при –20°C в течение 30 мин, затем центрифугировали в течение 30 мин при 3000 g. Белки из фенольной фазы осаждали четырехкратным объемом 0.1 М ацетата аммония в этаноле при –20°C в течение 10 ч.
Полученный осадок трижды промывали ацетатом аммония и растворяли в лизис-буфере (8 М мочевина, 2 М тиомочевина, 1% ЧАПС, 30 мМ дитиотреитол (ДТТ), 20 мМ Трис, 0.3%-ный раствор амфолитов).
Изоэлектрическое фокусирование белков проводили на приборе Protean IEF (“Bio-Rad”, США). Для разделения белков по изоэлектрической точке использовали готовые 7-сантиметровые стрипы (“Bio-Rad”, США), диапазон pH 3–10. Перед фокусировкой проводили пассивную регидратацию в течение 12 ч при 20°C. Фокусировку проводили при напряжении 4000 В (20 000 В ч) в течение 22 ч, затем напряжение поддерживали на уровне 500 В до конца процесса. После изоэлектрического фокусирования стрипы выдерживали в течение 15 мин последовательно в растворах 2%-ного ДТТ и 2.5% йодацетамида в буферных растворах с 25% глицерина, затем промывали в 25 мМ трис-глициновом буфере, pH 8.3.
Электрофорез проводили в 10%-ном ПААГ с Na-ДДС. Полоски и белки-маркеры на фильтровальной бумаге помещали на полиакриламидный гель и проливали 1%-ным раствором агарозы в трис-глициновом буферном растворе. Электрофорез проводили при напряжении 90–120 В, гели стабилизировали в 50%-ном этаноле в течение 10 мин, затем окрашивали 0.1%-ным раствором Кумасси G-250. Изображения гелей анализировали в компьютерной программе ImageJ (“NIH”, США).
Статистическая обработка. Эксперименты включали 5 биологических повторностей для биохимических показателей и 15 – для транскрипционной активности. На гистограммах показаны выборочные средние и их 95%-ные доверительные интервалы. Различия исследуемых параметров анализировали с помощью теста Краскела–Уоллиса в программе Statistica 8 (Statsoft, США). Для выявления условий опыта, в наибольшей степени влияющих на спектр белков листьев, проводили факторный анализ (анализ главных компонент). На диаграмме рассеяния показаны главные компоненты (“фактор 1", "фактор 2"), описывающие дисперсию значений содержания отдельных белков (интенсивности пятен на электрофореграммах) в различных вариантах опыта. Для определения степени сходства спектров белков листьев в различных вариантах опыта проводили кластерный анализ данных о содержании отдельных белков (евклидово расстояние, метод объединения групп – UPGMA).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние бактерий Bacillus subtilis и сигнальных молекул на инфицирование растений картофеля P. infestans и содержание H2O2. Сравнительный анализ степени пораженности фитофторозом листьев восприимчивого сорта картофеля при недостатке влаги выявил различия в скорости роста оомицета P. infestans в вариантах с инокуляцией бактериями и сигнальными молекулами (рис. 1а). Так, в отсутствие обработки степень пораженности составила 64%, предварительная обработка B. subtilis, в том числе в сочетании с СК и ЖАК, снижала пораженность листьев на 15–30%. Предобработка B. subtilis в сочетании с ЖАК оказала наиболее эффективное защитное действие (рис. 1–4). Ранее было показано, что обработка ЖАК и B. subtilis 26Д снижала развитие P. infestans на клубнях картофеля [14].
Рис. 1.
Влияние обработки B. subtilis и сигнальными молекулами на степень развития симптомов фитофтороза (%), вызванных P. infestans, на листьях картофеля в условиях засухи (а) и на содержание H2O2 в листьях (б): 1 – контроль; 2 – B. subtilis; 3 – B. subtilis + СК; 4 – B. subtilis + ЖАК; 5 – B. subtilis + СК + ЖАК. I – незараженные, II – зараженные P. infestans растения. Достоверно различающиеся значения обозначены разными буквами.
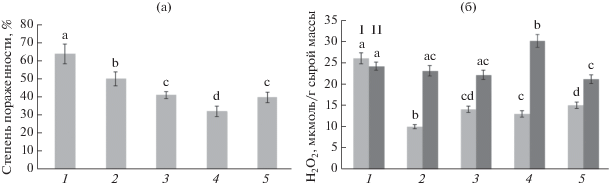
Рис. 2.
Влияние обработки B. subtilis и сигнальными молекулами на активность СОД (а), каталазы (б), пероксидазы (в) и содержание пролина (г) в листьях картофеля: 1 – контроль; 2 – B. subtilis; 3 – B. subtilis + СК; 4 – B. subtilis + ЖАК; 5 – B. subtilis + СК + ЖАК. I – незараженные, II – зараженные P. infestans растения. Достоверно различающиеся значения обозначены разными буквами.

Рис. 3.
Влияние обработки B. subtilis и сигнальными молекулами на транскрипционную активность генов PR-белков. 1 – контроль (без заражения); 2 – B. subtilis; 3 – B. subtilis + СК; 4 – B. subtilis + ЖАК; 5 – B. subtilis + СК + ЖАК. I – незараженные, II – зараженные P. infestans растения. Достоверно различающиеся значения обозначены разными буквами.
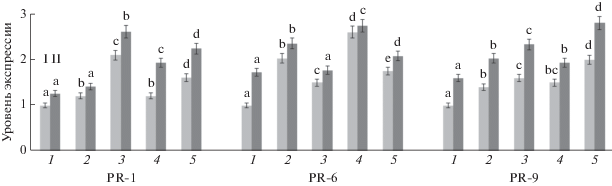
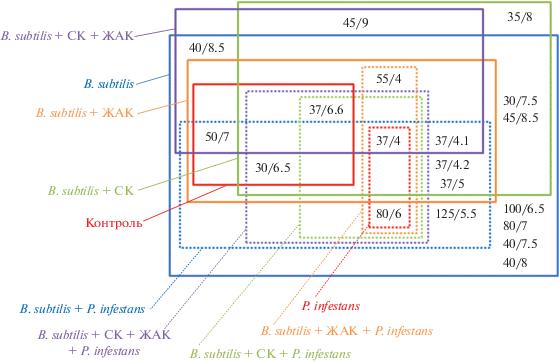
Рис. 4.
Присутствие различных белков (молекулярная масса (кДа)/pI) в листьях картофеля в различных вариантах опыта.
Повышение устойчивости картофеля к P. infestans под влиянием комплекса Bacillus spp. с сигнальными молекулами может быть связано с изменением концентрации Н2О2 в тканях растений [15]. Исследования показали, что концентрация Н2О2 в обработанных растениях в условиях засухи была ниже, чем в необработанных (рис. 1б). Это может быть связано с защитным действием метаболитов B. subtilis. Известно, что под действием Bacillus subtilis повышалась активность антиоксидантных ферментов и уровень пролина в растениях [16]. В то же время у растений, обработанных бактериями и сигнальными молекулами, при заражении P. infestans в условиях засухи уровень пероксида водорода в листьях заметно увеличивался, особенно при обработке B. subtilis + ЖАК (рис. 1б). H2O2 можно рассматривать как наиболее важную молекулу, участвующую в передаче внутриклеточных сигналов, которые регулируют экспрессию генов и активность защитных систем [17], включая увеличение концентрации ионов кальция в цитозоле, что играет важную роль в передаче сигнальной информации в геном растения. Было показано, что H2O2 участвует в активации экспрессии генов стрессовых белков [15]. Вероятно, сочетание представителей рода Bacillus с сигнальными молекулами усиливает генерацию АФК и передачу сигналов, запускающих другие защитные механизмы, предотвращающие развитие патогенов.
Изменение активности антиоксидантных ферментов и содержания пролина в листьях картофеля при обработке B. subtilis в сочетании с СК и ЖАК. Изменение концентрации H2O2 в тканях растений в процессе патогенеза может происходить в результате многих метаболических процессов, но в большей степени это происходит в результате изменения активности антиоксидантных ферментов [18].
Одним из важных ферментов антиоксидантной системы растений, участвующих в утилизации активных форм кислорода (АФК), является СОД. При заражении растений P. infestans наблюдалось повышение активности СОД (рис. 2а), обработка бактериями усиливала этот эффект. Однако обработка бактериями в сочетании с СК или ЖАК, наоборот, приводила к снижению активности СОД у инфицированных растений. У незараженных растений на фоне засухи достоверное повышение активности СОД выявлено в варианте с обработкой растений бактериями в сочетании с СК, ЖАК или одновременно СК и ЖАК. Таким образом, использование бактерий B. subtilis 26Д стимулирует активность СОД у инфицированных и неинфицированных растений картофеля в условиях засухи. Известно, что активность СОД может изменяться разнонаправленно в зависимости от интенсивности и продолжительности воздействия стрессового фактора [19]. Снижение активности СОД при стрессе способствует дальнейшему увеличению продукции АФК и развитию окислительного повреждения клеток и тканей растений [20]. Следовательно, эффективное функционирование СОД во многом определяется функционированием других компонентов защитных систем, в частности, утилизирующих пероксид водорода (каталазы, пероксидазы, ферменты аскорбат-глутатионового цикла).
Каталаза является важнейшим антиоксидантным ферментом [21]. Исследования показали, что у растений, инфицированных P. infestans, в условиях засухи наблюдалось снижение активности каталазы (рис. 2б). У инфицированных растений, обработанных только бактериями или в сочетании с СК или ЖАК, активность каталазы значительно увеличивалась. Более того, в вариантах с обработкой B. subtilis + СК и B. subtilis + ЖАК повышение активности КАТ происходило и у незараженных растений на фоне засухи.
Активность каталазы может значительно изменяться при участии сигнальных молекул. H2O2 является не только сигнальной молекулой, но и субстратом каталазы. В то же время, ее влияние на активность каталазы у растений неоднозначно. Так, в проростках пшеницы H2O2, в зависимости от концентрации, ингибировала [22] или стимулировала [23] активность каталазы. Салициловая кислота также обладает способностью ингибировать каталазу [24], что является одним из механизмов развития реакции сверхчувствительности. Ингибирование фермента под действием СК может приводить к дальнейшей активации экспрессии гена каталазы и усилению синтеза фермента [25].
Пероксидаза – фермент, участвующий как в генерации, так и в утилизации Н2О2 [11]. Известно, что обширное мультигенное семейство классических пероксидаз растений класса III, входящих в семейство защитных белков семейства PR-9, участвует в укреплении клеточных стенок за счет окислительных реакций, катализирующих процессы полимеризации фенольных соединений в лигнин клеточных стенок, повышая их устойчивость к разрушению фитопатогенами. Активность пероксидазы увеличивалась у незараженных растений на фоне засухи только в вариантах с обработкой B. subtilis в сочетании с сигнальными молекулами (рис. 2в). Однако при заражении растений P. infestans значительное увеличение активности пероксидазы происходило у растений, обработанных только B. subtilis, а также в сочетании с ЖАК и СК + ЖАК (рис. 2в). Ранее было показано, что сочетание B. subtilis 26Д и СК способствовало активации пероксидазы у инфицированных P. infestans растений картофеля в условиях оптимальной влажности [26]. В то же время у инфицированных растений, обработанных B. subtilis 26Д и ЖАК, активность фермента значительно не изменялась. Вероятно, регуляция содержания H2O2 в растениях картофеля под действием бактерий B. subtilis в сочетании с сигнальными молекулами на фоне засухи может происходить разными путями: через активацию СОД, снижение активности каталазы и в результате модулирующего воздействия на активность пероксидазы. Баланс между синтезом и инактивацией АФК имеет решающее значение для поддержания метаболизма растений и повышения их устойчивости к стрессовым факторам различной природы [27].
Исследования выявили антистрессовый эффект обработки бактериями B. subtilis 26Д растений картофеля в условиях засухи. Так, в растениях, обработанных B. subtilis, уровень пролина в листьях незараженных растений увеличивался в несколько раз (рис. 2г). Сочетание бактерий с ЖАК, но особенно с СК, снижало стимулирующее действие B. subtilis на уровень пролина в неинфицированных растениях. Однако, в варианте B. subtilis 26Д + СК + ЖАК содержание пролина было сопоставимо с уровнем у растений, обработанных бактериями. Аналогичная тенденция влияния сочетания бактерий и сигнальных молекул на уровень пролина сохранялась и в инфицированных растениях (рис. 2г).
Известно, что пролин играет роль осмопротектора при засухе, накапливаясь в цитозоле растительных клеток [28]. Защитный эффект пролина обусловлен его участием в стабилизации мембран, структуры белковых молекул и снижении уровня АФК. Также пролин, сочетающий функции антистрессового метаболита и соединения, задействованного в регуляции клеточных процессов, является одним из индикаторов активации системной защиты растений, выполняя сигнальную функцию при взаимодействии растений с патогенами [29]. Показано значительное накопление пролина в растениях при инокуляции эндофитными бактериями Bacillus subtilis, что положительно коррелировало с устойчивостью к болезням [30].
Влияние бактерий B. subtilis и сигнальных молекул на транскрипционную активность генов PR-белков в растениях картофеля при заражении P. infestans. Системная устойчивость растений к болезням, являющаяся неспецифической, основана на экспрессии многих защитных генов [31]. Как видно на рис. 3, инфицирование и обработка B. subtilis, особенно в сочетании с сигнальными молекулами, стимулировали накопление транскриптов генов PR-1 (секретируемый антимикробный белок), PR-6 (ингибиторы протеиназ) и PR-9 (пероксидаза) в растениях картофеля. Так, ген PR-1 наиболее интенсивно экспрессировался у растений, обработанных бактериями в сочетании с СК. Обработка B. subtilis в сочетании с ЖАК приводила к значительному увеличению уровня транскрипции гена PR-6 у неинфицированных и инфицированных растений по сравнению с контролем.
Следует обратить внимание, что обработка бактериями B. subtilis в отсутствие сигнальных молекул оказывала значительное влияние на повышение уровня экспрессии PR-1 и PR-6 у незараженных растений в условиях засухи. Комбинация бактерий с СК и ЖАК в данном случае имела, как правило, меньший, а в некоторых случаях даже отрицательный эффект, например, экспрессия PR-6 снижалась в присутствии СК. У инфицированных растений, обработанных бактериями в сочетании с СК или ЖАК, значительно повышалась экспрессия PR-белков. В неинфицированных растениях экспрессия PR-9 увеличивалась при обработке B. subtilis как в отсутствие, так и в комбинации с СК или ЖАК, но комбинированный эффект СК и ЖАК вызывал большее увеличение экспрессии PR-9. Ранее было показано, что ЖАК может нейтрализовать способность B. subtilis 26Д стимулировать транскрипционную активность гена PR-9 в условиях нормальной влажности [26]. Супрессивный эффект совместной обработки B. subtilis 26Д + ЖАК выражался в снижении транскрипции генов PR-2, PR-3 и PR-9 в растениях пшеницы по сравнению с растениями, обработанными только B. subtilis 26Д или ЖАК. Следовательно, совместное влияние засухи и заражения патогеном приводит к дополнительным изменениям транскрипционной активности PR-генов растений по сравнению с инфицированными растениями, выращенными в нормальных условиях.
Вероятно, сочетание бактерий B. subtilis 26Д с сигнальными молекулами усиливает генерацию H2O2 и передачу сигналов, запускающих работу защитных механизмов, которые повышают устойчивость растений к стрессовым факторам биотической и абиотической природы за счет индукции транскрипционной активности генов защитных белков.
Возможно, что способствуя генерации активных форм кислорода (АФК), бактерии рода Bacillus вызывают передачу сигналов, запускающих другие защитные механизмы. Было показано, что обработка растений Bacillus subtilis способствует ИСУ, опосредованной действием ЖАК. Однако формирование устойчивости пшеницы к патогенам под влиянием бактерий рода Bacillus также может развиваться через салицилатный сигнальный путь по типу системной СПУ [5]. Среди изученных генов PR-белков, определяющих развитие СПУ, ген PR-1 регулируется СК-зависимым сигнальным каскадом [32]. Ответы на СК зависят от регуляторного белка, называемого ассоциированным с патогенезом – 1 NPR-1. Его синтез активируется через окислительно-восстановительные пути посредством накопления СК. Белок NPR-1 переносится в ядро, где действует через факторы транскрипции, не связываясь непосредственно с ДНК. Воздействие эндофитных бактерий приводит к усилению биосинтеза ЖАК и развитию ИСУ, маркером которой является экспрессия гена PR-6 (ингибитор протеазы) [33]. Долгое время считалось, что СК- и ЖАК-опосредованные сигнальные пути обладают антагонистическим действием [34]. Однако разделение сигнальных путей является весьма условным. Появляются новые данные об альтернативных индукторах и участниках формирования устойчивости растений к стрессу [6].
Влияние бактерий Bacillus subtilis и сигнальных молекул на протеом листьев картофеля при заражении P. infestans. Одним из способов выявления специфичности изменений экспрессии генов под влиянием заражения растений патогенами или воздействия сигнальных молекул и метаболитов эндофитных бактерий может быть исследование протеома. Методом двумерного электрофореза белков листьев S. tuberosum идентифицировано 19 белков, наличие которых в листьях различалось в зависимости от варианта опыта (рис. 4).
Наибольшее количество белков наблюдалось в листьях растений, обработанных B. subtilis, четыре белка (Mr/pI 100/6.5, 80/7, 40/7.5, 40/8) присутствовали только в этом варианте опыта. Белок с Mr/pI 35/8 наблюдался только при обработке B. subtilis + СК в отсутствие ЖАК, белок с Mr/pI 45/9 наблюдался как в отсутствие, так и в присутствии ЖАК. Белок с Mr/pI 40/8.5 присутствовал только в растениях, обработанных B. subtilis, и растениях, обработанных B. subtilis вместе с двумя сигнальными молекулами. При заражении P. infestans наибольшее количество белков также наблюдалось при обработке B. subtilis при отсутствии сигнальных молекул. Белок с Mr/pI – 55/4, который присутствовал во всех неинфицированных растениях, наблюдался во время заражения только при обработке B. subtilis + ЖАК. Белок с Mr/pI – 50/7 в инфицированных растениях присутствовал только при обработке B. subtilis без СК и ЖАК.
В результате кластерного анализа все растения, инфицированные P. infestans, а также неинфицированные и необработанные, оказались наиболее близкими по спектру синтезируемых белков (рис. 5а). Среди этих вариантов наиболее существенные различия наблюдались у инфицированных растений, обработанных B. subtilis. Растения, обработанные B. subtilis с СК или ЖАК, или их смесью, образовывали другую группу со схожими спектрами белков. Наибольшие различия в спектре белков наблюдали у неинфицированных растений, обработанных B. subtilis в отсутствие СК и ЖАК. Таким образом, обработка B. subtilis в отсутствие сигнальных молекул существенно изменяла спектр растительных белков, что особенно выражено у незараженных растений. Можно предположить, что инфицирование P. infestans и обработка сигнальными молекулами активирует защитные механизмы растений, предотвращая изменения в спектре белков, вызываемые симбиотическими бактериям.
Рис. 5.
Кластерный анализ вариантов опыта в соответствии с присутствием различных белков в листьях (а). Анализ главных компонент дисперсии содержания белков в листьях (б).
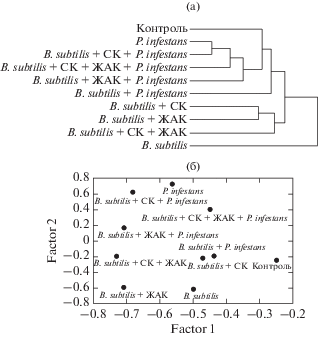
Наибольшие изменения в спектре белков у инфицированных растений, обработанных B. subtilis в смеси с сигнальными молекулами, были вызваны ЖАК: растения, обработанные СК или смесью СК и ЖАК, в меньшей степени отличались от контрольных зараженных растений. Как известно, жасмонаты регулируют процессы развития растений и адаптации к внешним биотическим и абиотическим стрессорам [35].
Следует отметить, что во всех вариантах обработки, за исключением контроля, наблюдали присутствие белка хлоропластов, вовлеченного в генерацию АФК (oxygen-evolving enhancer protein 1). Наибольшее содержание этого белка отмечалось в обработанных B. subtilis незараженных и зараженных растениях, а также в зараженных растениях, обработанных B. subtilis + ЖАК. Известно, что окислительный взрыв является сигналом для реакции сверхчувствительности (СВЧ), которая тесно связана с эффективным ответом растений на инфицирование патогеном. Имеются данные о взаимосвязи белка окислительного взрыва RPH1 с устойчивостью растений к Phytophthora brassicae [36].
Результаты факторного анализа (рис. 5б) показывают корреляцию обработки ЖАК с первым компонентом дисперсии (варианты опыта с обработкой ЖАК расположены преимущественно в левой части диаграммы), а инфицирования P. infestans – со вторым компонентом (варианты с инфицированием преимущественно в верхней части). Таким образом, обработка ЖАК и инфицирование P. infestans, по-видимому, являются основными параметрами, вызывающими изменения в спектре растительных белков. В целом можно сделать вывод, что инфицирование возбудителем фитофтороза, обработка эндофитными бактериями и сигнальными молекулами вызывают сложные ответные реакции у растений, в которые вовлечены множество защитных белков.
Таким образом, полученные результаты исследований показывают, что механизм активации защитных систем растений картофеля эндофитными бактериями рода Bacillus и сигнальными молекулами – СК и ЖАК – опосредуется накоплением пероксида водорода и повышением активности ферментов, регулирующих его уровень, а также PR-белками. Развитие защитных реакций при засухе приводит к значительным изменениям спектра и относительного содержания отдельных белков, как у здоровых, так и у инфицированных растений. Выявленные различия в активации транскрипционной активности генов PR-белков под влиянием бактерий B. subtilis и сигнальных молекул позволяют предположить наличие дифференциальных путей формирования устойчивости к P. infestans у растений картофеля с их участием.
Работа выполнялась частично по теме госзадания (№ гос. регистрации AAAA-A21-121011990120-7), а также при финансовой поддержке Российского фонда фундаментальных исследований и Белорусского республиканского фонда фундаментальных исследований в рамках научного проекта № 20-516-00005, на оборудовании Центра коллективного пользования “Биомика” (Отделение биохимических исследований и нанобиотехнологии Регионального центра коллективного пользования “Агидель”) и Уникальной научной установки “Кодинк”.
Список литературы
Verma P., Yadav A.N., Kumar V., Singh D.P., Saxena A.K. // Plant-Microbe Interactions in Agro-Ecological Perspectives. / Eds. D.P. Singh, H.B. Singh, R. Prabha. Singapore: Springer, 2017. P. 543–580.
Burton W.G. // American Potato Journal. 1981. V. 58. P. 3–14.
Coleman-Derr D., Tringe S.G. // Front Microbiol. 2014. V. 5. P. 283. https://doi.org/10.3389/fmicb.2014.00283
Berg G. // Appl. Microboil.Biotehnol. 2009. V. 84. P. 11–18. https://doi.org/10.1007/s00253-009-2092-7
Burkhanova G.F., Veselova S.V., Sorokan’ A.V., Blagova D.K., Nuzhnaya T.V., Maksimov I.V. // Appl. Biochem. Microbiol. 2017. V. 53. № 3. P. 346–352. https://doi.org/10.18699/VJ19.561
Chanda B., Xia Y., Mandal M.K., Sekine K.T., Gao Q.M., Selote D. // Nat. Genet. 2011. V. 43. P. 421–427. https://doi.org/10.1038/ng.798
Batool T., Ali S., Seleiman M.F., Naveed N.H., Ali A., Ahmed K., Abid M., Rizwan M., Shahid M.R., Alotaibi M., Al-Ashkar I., Mubushar M. // Sci. Rep. 2020. V. 10. № 1. P. 169–175. https://doi.org/10.1002/smll.200400053
Jiang Z.Y., Woollard A.C.S., Wolff S.P. // FEBS Lett. 1990. V. 268. P. 69–71.
Bonnet M., Camares O., Veisseire P. // J. Experimental Botany. 2000. V. 51. P. 945–953.
Hadwan M.H., Abed H.N. // Data in Brief. 2016. V. 6. P. 194–199. https://doi.org/10.1016/j.dib.2015.12.012
Fornera S., Walde P. // Analytical Biochemistry. 2010. V. 407. № 2. P. 293–295. https://doi.org/10.1016/j.ab.2010.07.034
Bradford M.M. // Anal. Biochem. 1976. V. 72. P. 248–254
Vincent D., Wheatley M., Cramer G. // Electrophoresis. 2006. V. 27. P. 1853–1865. https://doi.org/10.1002/elps.200500698
Yarullina L.G., Kasimova R.I., Ibragimov R.I., Akhatova A.R., Umarov I.A., Maksimov I.V. // Appl. Biochem. Microbiol. 2016. V. 52. № 1. P. 71–78. https://doi.org/10.1134/S0003683816010154
Pfannschmidt T., Bräutigam K., Wagner R., Dietzel L., Schröter Y. // Ann. Bot. 2009. V. 103. P. 599–607. https://doi.org/10.1093/aob/mcn081
Lastochkina O.V., Aliniaeifard S., Seifikalhor M., Yuldashev R., Pusenkova L., Garipova S. //Wheat Production in Changing Environments. Responses, Adaptation and Tolerance. / Eds. M. Hasanuzzaman, K. Nahar, A. Hossain. Singapore: Springer, 2019. P. 579–614.
Galvez-Valdivieso G., Fryer M.J., Lawson T., Slattery K., Truman W., Smirnoff N., Asami T., Davies W.J., Jones A.M., Baker N.R. // Plant Cell. 2009. V. 21. P. 2143–2162. https://doi.org/10.1105/tpc.108.061507
Smirnoff N., Arnaud D. // New Phytologist. 2019. V. 221. № 3. P. 1197–1214. https://doi.org/10.1111/nph.15488
Rizhsky L., Liang H., Mittler R. // J. Biol. Chem. 2003. V. 278. P. 38921–38925. https://doi.org/10.1074/jbc.M304987200
Jiang Y., Huang B. // Crop Sci. 2001. V. 41. № 2. P. 436–442. https://doi.org/10.2135/cropsci2001.412436x
Pradedova E.V., Isheeva O.D., Salyaev R.K. // Russ. J. Plant Physiol. 2011. V. 58. № 1. P. 36–44. https://doi.org/10.1134/S1021443711010110
Bakalova S., Nikolova A., Wedera D. // J. Plant Physiol. 2004. V. 30. P. 64–77. https://doi.org/10.1556/AAgr.56.2008.2.1
Luna C.M., Pastori G.M., Driscoll S., Groten K., Bernard S., Foyer C.H. // J. Experimental Botany. 2005. V. 56. № 411. P. 417–423. https://doi.org/10.1093/jxb/eri039
Rakhmankulova Z.F., Fedyaev V.V., Rakhmatulina S.R., Ivanov C.P., Gilvanova I.R., Usmanov I.Y. // Russ. J. Plant Physiol. 2010. V. 57. № 6. P. 778–783.
Guan L.M., Scandalios J.G. // Free Radic Biol Med. 2000. V. 28. № 8. P. 1182–1190.
Maksimov I.V., Abizgildina P.P., Sorokan A.V., Burkhanova G.F. // Applied Biochemistry and Microbiology. 2014. V. 50. № 2. P. 173–178. https://doi.org/10.1134/S0003683814020136
Sathyamurthy B., Dama G., Balasubramanian A., Vvs S. // World J. Pharmaceutical Research. 2015. V. 4. № 2. P. 927–939.
Pireivatloum J., Qasimov N., Maralian H. // Afr. J. Biotech. 2010. V. 9. P. 36–40.
Fabro G., Kovács I., Pavet V., Szabodos L., Alvarez M.E. // Mol. Plant Microb. Intrract. 2004. V. 17. № 4. P. 343–350.
Lastochkina O., Seifikalhor M., Aliniaeifard S., Bay-miev A., Pusenkova L., Garipova S., Kulabuhova D., Maksimov I. // Plants (Basel). 2019. V. 8. № 4. Article 97. https://doi.org/10.3390/plants8040097
Kuluev B., Mikhaylova E., Ermoshin A., Veselova S., Tugbaeva A., Gumerova G., Gainullina K., Zaikina E. // J. Plant Physiol. 2019. V. 242. Article 153033. https://doi.org/10.1016/j.jplph.2019.153033
Gimenez-Ibanez S., Solano R. // Front. Plant Sci.. 2013. V. 4. № 72. https://doi.org/10.3389/fpls.2013.00072
Durrant W.E., Dong X. // Annu. Rev. Phytopathol. 2004. V. 42. P. 185–209. https://doi.org/10.1146/annurev.phyto.42.040803
Koornneef A., Pieterse C.M.J. // Plant Physiol. 2008. V. 146. P. 839–844. https://doi.org/10.1104/pp.107.112029
Glazebrook J. // Annu. Rev. Phytopathol. 2005. V. 43. P. 205–227.https://doi.org/10.1146/annurev.phyto.43.040204.135923
Belhaj K., Lin B., Mauch F. // The Plant J. 2009. V. 58. № 2. P. 278–298. https://doi.org/10.1111/j.1365-313X.2008.03779.x
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


