Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 583-593
Активность метаногенных архей при компостировании органических отходов
В. В. Миронов 1, *, В. В. Потокина 1, Е. А. Бочкова 1, А. В. Вантеева 1, Н. А. Загустина 2, С. Н. Паршина 1
1 Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: 7390530@gmail.com
Поступила в редакцию 02.06.2021
После доработки 30.06.2021
Принята к публикации 02.07.2021
Аннотация
Выделены активные мезофильные и термофильные метаногенные консорциумы из компостированной при экстремально высокой температуре (75–82°С) смеси избыточного ила биологических очистных сооружений сточных вод молочного производства, овощных и древесных отходов в соотношении 3 : 3 : 4 (об./об.) с высоким содержанием сухого вещества (27.5 ± 1.3%). Ускоренный метаногенез и наибольший выход метана (31.7 ± 2.9 ммоль л–1) наблюдались при температуре культивирования 55°С. Исследование состава полученных консорциумов методом секвенирования гена 16S рРНК показало наличие метаногенных архей Methanosarcina thermophila, Methanothermobacter thermoautotrophicus, Candidatus ‘Methanogranum caenicola’, Methanofollis ethanolicus, а также Candidatus ‘Methanoplasma termitum’ и Methanomassiliicoccus luminyensis. Четыре последние были впервые обнаружены в компостируемых органических отходах. Полученные метаногенные консорциумы были способны осуществлять активный метаногенез и могут быть использованы в биотехнологии метанового сбраживания.
В связи с постоянным увеличением количества бытовых отходов, требующих переработки и утилизации, создающих серьезные экологические проблемы, все большее внимание привлекают исследования по применению методов их биодеградации, направленных на интенсификацию процесса разложения, повышение безопасности процесса для окружающей среды, а также на получение удобрений [1]. Несмотря на это, по-прежнему преобладает захоронение отходов на полигонах. По различным оценкам, коэффициент извлечения свалочного газа (смесь преимущественно метана, углекислого газа и азота), образующегося на традиционных полигонах, составляет менее 20% [2]. Альтернативным и реализуемым решением для сокращения количества захораниваемых биоразлагаемых отходов является механико-биологическая обработка [3], которая уменьшает реакционную способность, а также массу отходов перед дальнейшей утилизацией.
Компостирование является одним из лучших способов биологической переработки органических отходов с точки зрения минимального воздействия конечного продукта – компоста, на окружающую среду [4]. Такая технология полностью отвечает принятому на сегодняшний день в национальных и зарубежных разработках курсу на устойчивое развитие [4, 5]. В настоящее время наибольший интерес представляют исследования по переработке твердых коммунальных отходов (ТКО) методами ускорения и оптимизации процесса компостирования. В связи с этим одним из наиболее перспективных способов является применение аэробно-анаэробной технологии твердофазной биодеградации органических отходов, позволяющей производить не только компост, но и биогаз.
Компостирование является экзотермическим процессом микробного окисления, в котором органический субстрат подвергается биодеградации популяцией микроорганизмов в условиях оптимальной влажности и наличия кислорода. На разных стадиях процесса компостирования (мезофильной, термофильной, остывания и созревания) участвует множество микроорганизмов. Идентифицировано более 2000 известных видов бактерий, не менее 100 видов грибов, а также археи [1]. В процессе компостирования аэробные микроорганизмы преобразуют биоразлагаемые органические вещества в CO2, NH3, H2O и стабильное органическое вещество – компост.
Метан является вторым по значимости парниковым газом после углекислоты, при этом до 70% метана в атмосфере образуется за счёт жизнедеятельности микроорганизмов: аэробных и анаэробных бактерий, метаногенных архей, в том числе при деградации различных отходов [6]. Метаногенез осуществляется археями, представителями филума Euryarchaeota, среди которых метаногены, использующие водород, представляют самую большую группу. К ацетокластическим метаногенам, использующим в качестве субстрата ацетат, относятся представители двух родов порядка Methanosarcinales: Methanothrix (сем. Methanosaetaceae) и Methanosarcina (сем. Methanosarcinaceae). Представители рода Methanothrix являются строго ацетокластическими, а представители рода Methanosarcina способны использовать в качестве субстратов для образования метана не только ацетат и Н2/СО2, но и метанол, а также и другие метилированные соединения. Метилированные соединения используют также метилредуцирующие метаногены, не способные диспропорционировать эти субстраты и облигатно зависящие от Н2 и/или формиата, являющихся донорами электронов для восстановления метильных групп до метана. К ним относятся представители порядков Methanobacteriales, Methanosarcinales, Methanomassiliicoccales [7].
Несмотря на то, что при компостировании твердых отходов вначале субстрат полностью аэрируется кислородом воздуха, в его частицах всё же присутствуют анаэробные зоны, которые формируются из-за дефицита кислорода при интенсивном разложении органических веществ [8], в которых активны облигатно анаэробные метаногенные археи. Наружные слои компостных частиц заселяют аэробные метанотрофные бактерии. Деятельность метанотрофных микроорганизмов может способствовать снижению выбросов метана, а создание при компостировании условий, благоприятных для данной группы, по мнению некоторых авторов, может стать одной из стратегий борьбы с образованием метана [9]. Концентрация образованного метана также снижается при перемешивании компоста, так как при этом разрушаются анаэробные зоны и увеличивается содержание кислорода.
При этом показано, что активность метаногенов при компостировании всё же может оставаться более высокой, чем метанотрофов [10]. Следует отметить, что метаногенные археи более чувствительны, по сравнению с бактериями, к различным ингибиторам, таким как летучие жирные кислоты (ЛЖК) или аммиак. При этом разные виды метаногенов имеют различную степень устойчивости к ингибиторам [11].
Состав метаногенного сообщества компоста разнообразен и меняется на разных стадиях процесса компостирования в зависимости от температуры [9, 12]. В микробном сообществе компоста может иметь место дифференциация метаногенов по экологическим нишам, как это наблюдается в природных сообществах [9]. Было показано, что в микробном сообществе, осуществляющем анаэробную обработку ТКО, в нестрессовых условиях доминируют Methanosaeta – ацетокластические метаногены с более высоким сродством к субстрату. При возникновении неблагоприятных условий преимущество получают археи с миксотрофным типом метаболизма (Methanosarcina), которые более устойчивы к действию ингибиторов [11]. Кроме того, предполагается, что при разложении твердых отходов гидрогенотрофные метаногены обладают более высокой стрессоустойчивостью, чем ацетокластические [13].
В работе [14] обнаружены метаногенные археи в навозном компосте не только в термофильной фазе (50–60°С), но и в мезофильной и в стадии созревания (28–35°С). Представители порядка Methanosarcinales являются одними из наиболее часто обнаруживаемых метаногенов при компостировании [14]. Возможно, что в хорошо аэрируемых компостных субстратах даже при экстремально высоких температурах (75–82°С), сохраняющихся в течение продолжительного времени (от нескольких суток до нескольких недель), создаются анаэробные микрозоны, в которых сохраняют свою жизнедеятельность метаногенные археи, причём не только термофильные, но и мезофильные, и происходит образование метана.
Цель работы – оценка активности метаногенных архей при компостировании органических отходов с высоким содержанием сухого вещества и получение активных метаногенных консорциумов (накопительных культур) при средних и умеренно высоких температурах культивирования на различных субстратах.
МЕТОДИКА
За основу для формирования консорциумов была использована методика получения накопительных культур окисляющего ЛЖК психротолерантного микробного сообщества анаэробного биореактора [15]. Для получения накопительных культур метаногенных архей из компостируемых органических отходов применили предварительное твердофазное сбраживание. Эксперимент состоял из трех этапов: (1) твердофазное сбраживание исследуемого субстрата для компостирования, (2) жидкофазное сбраживание с добавлением питательной среды и метаногенных субстратов для роста различных метаногенных архей, (3) получения накопительных культур метаногенных архей и их исследование.
Твердофазное сбраживание. Субстрат для сбраживания отбирали из установки для промышленного компостирования “Климатическая камера” (“Грунт Эко”, Московская область, Россия). Субстрат имел следующий состав: смесь избыточного ила биологических очистных сооружений сточных вод молочного производства, овощных и древесных отходов в соотношении 3 : 3 : 4 (по объему). Содержание сухого вещества в субстрате 27.5 ± 1.3% (по массе). Пробы субстрата были отобраны из бурта объемом 950 м3 с мембранным светонепроницаемым покрытием и активной аэрацией. До момента отбора пробы субстрат саморазогревался, в течение не менее 7 сут наблюдалась температура 75–82°С. На момент отбора пробы срок компостирования составил 12 сут. Температура субстрата при отборе проб на глубине 200 мм от поверхности бурта была 76.5°С.
Время отбора проб было выбрано исходя из предварительных наблюдений за протеканием активной фазы компостирования. Низкая концентрация кислорода, высокая температура и интенсивное образование летучих дурнопахнущих органических соединений свидетельствовали о возможности одновременного протекания аэробных и анаэробных процессов внутри частиц компостируемого материала. Свободное пространство между буртом и мембранным покрытием было постоянно заполнено газом, выделяющимся при компостировании субстрата. Перед отбором субстрата газоанализатором МАГ-6 П-Т (“Эксис”, Россия) было измерено содержание метана в газе (2.2 ± 0.1 об. %), а также диоксида углерода (10.4 ± 0.1 об. %) и аммиака (1.0 ± 0.4 мг м–3).
В лабораторных условиях отобранный субстрат ~100 г быстро переносили в сывороточные бутыли объемом 500 мл под током азота, герметично закрывали резиновыми пробками, сверху алюминиевыми колпачками и обжимали их на приборе ПОК-1. Флаконы выдерживали в термостате при температуре 28 и 55°С.
Жидкофазное сбраживание. После достижения в пробах концентрации метана более 20.0 об. % (измеренного на хроматографе) проводили следующий этап эксперимента, добавляя во флаконы со сбраживаемой компостной смесью питательные среды и субстраты для роста метаногенных архей по методу [15].
Эксперименты по жидкофазному сбраживанию проводили на модифицированной среде Пфеннига [16] следующего состава (мг/л): NH4Cl – 330, MgCl2⋅6H2O – 250, CaCl2 – 168, KСl – 330, KH2PO4 – 330. В среду добавляли также 500 мг л–1 дрожжевого экстракта, 2500 мг л–1 NaHCO3, микроэлементы по Липперту [17] и витамины по Волину [18]. В качестве редуцирующего агента использовали сульфид натрия (0.5 г л–1) и цистеин (0.5 г л–1), рН 6.8–7.0. В качестве метаногенных субстратов использовали стерильные 1.0 М растворы ацетата, метанола или триметиламина (ТМА). Субстраты вносили непосредственно перед засевом по 4 мл на 200 мл среды во флаконы. После добавления среды и субстратов пробы снова ставили на 28 и 55°С соответственно.
Получение накопительных культур. Накопительные культуры получали методом серийных разведений. После накопления метана в газовой фазе бутылей более 25 об. % из флаконов жидкофазного сбраживания отбирали по 2 мл культуры и переносили во флаконы емкостью 120 мл с 18 мл среды того же состава, в которую добавляли по 0.4 мл 1.0 М растворов ацетата, метанола или ТМА (20 ммоль л–1) и последовательно пересевали во флаконы с соответствующим субстратом до 5–7 разведения, перенося каждый раз по 2 мл (10%) культуральной жидкости.
Для культивирования на H2/CO2 при приготовлении среды флаконы продували смесью газов H2/CO2 (80 : 20).
При достижении концентрации метана в газовой фазе флаконов более 10% проводили второй пересев на те же субстраты и при тех же условиях культивирования (28 и 55°С), но для подавления роста бактерий добавляли раствор антибиотика ванкомицина (100 мг/л–1) в 5–7 разведения.
Анализ концентрации метана. Метан в газовой фазе флаконов определяли методом газоадсорбционной хроматографии на хроматографе Хроматэк-Кристалл 5000.2 (“Хроматэк”, Россия) с 3 м колонкой, заполненной фазой Carbosieve G (“Sigma-Aldrich”, США). Температура колонки, испарителя и детектора – 140, 100 и 150°С соответственно. Расход водорода и воздуха – 15 и 250 мл мин–1 соответственно. Расход газа-носителя (аргона) – 15 мл мин–1.
Анализ содержания ЛЖК (ацетат, пропионат, бутират, валерат) и спиртов (этанол). ЛЖК в культуральной жидкости при жидкофазном сбраживании определяли методом газожидкостной хроматографии на хроматографе Хроматэк-Кристалл 5000.2 с пламенно-ионизационным детектором, оснащенным автосамплером ДАЖ-2М (“Хроматэк”, Россия), с колонкой Zebron ZB-WAXplus (“Phenomenex”, США). Длина колонки 30 м, внутренний диаметр 0.25 мм. Температура колонки, испарителя и детектора – 110, 180 и 200°С соответственно. Расходы водорода и воздуха составляли 40 и 400 мл мин–1 соответственно. Расход газа-носителя (азота) – 40 мл мин–1.
Микроскопическое исследование накопительных культур. Микроскопические исследования проводили на флуоресцентном микроскопе Axio Lab.A1 FL-LED (“Carl Zeiss”, Германия) с использованием фазово-контрастного объектива при увеличении в 100 раз.
Молекулярно-генетические исследования. Выделение ДНК из биомассы полученных метаногенных консорциумов проводили согласно ранее описанному методу [19]. Для проведения полимеразной цепной реакции фрагментов генов 16S рРНК архей использовалась система праймеров 8fa-a1492r [20]. Секвенирование полученных ПЦР-фрагментов проводили по методу [21] с помощью набора реактивов BigDyeTerminatorv.3.1 (“Applied Biosystems”, США) на анализаторе ABIPRIZM 3730 (“Applied Biosystems”, США) согласно инструкциям производителя. Для секвенирования были использованы следующие праймеры архей:
8fa (5'-TCCGGTTGATCCTGCCGG-3'),
A517R (5'-GGTRTTACCGCGGCGGCTGAC-3'),
A680F (5'-CSRGGGTAGGGGYGAAATCC-3'),
A1041F (5'-GAGAGGWGGTGCATGGCC-3'),
Arch915R (5'-GTGCTCCCCCGCCAATTCCT-3'),
530F (5'-GTGCCAGCMGCCGCGG-3'),
1492R (5'-TACGGYTACCTTGTTACGACTT-3').
Первичный анализ сходства нуклеотидных последовательностей изучаемых штаммов проводили с помощью программного пакета BLAST [22] и RDP Classifier [23].
Состав сформированного сообщества также анализировали по количеству копий последовательности гена 16S рРНК. Выделение ДНК из образцов осуществлялось с использованием коммерческого набора для выделения ДНК FastDNA SpinKit (“MPBio”, США) в соответствии с инструкцией производителя. Библиотеки V4 участка гена 16S рРНК для высокопроизводительного секвенирования на системе Illumina MiSeq были приготовлены по схеме, описанной в статье [24]. Для получения ампликонов использовалась следующая система праймеров: прямой праймер (5'-CAAGCAGAAGACGGCATACGAGATGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT XXXXXX ZZZZ GTGBCAGCMGCCGCGGTAA-3'), состоящий, соответственно, из “5' Illumina Linker Sequence”, “Index 1”, “Heterogeneity Spacer” [25] и 515F праймерной последовательности [26]; обратный праймер (5'-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT XXXXXX ZZZZ GACTACNVGGGTMTCTAATCC-3'), состоящий из “3' Illumina Linker Sequence”, “Index 2”, “Heterogeneity Spacer” и Pro-mod-805R праймерной последовательности [27], соответственно. Для каждого образца ДНК было приготовлено две библиотеки, которые секвенировались параллельно с использованием набора реагентов MiSeq Reagent Micro Kit v2 (300-cycles) MS-103-1002 (“Illumina”, США) на секвенаторе MiSeq (“Illumina”, США) в соответствии с инструкцией производителя.
Статистическая обработка результатов. Эксперименты по твердофазному и жидкофазному сбраживанию проводили в двукратной повторности. Результаты параллельных экспериментов по динамике образования метана и ЛЖК при жидкофазном сбраживании были статистически обработаны. Для определения статистической значимости различий параллельных экспериментов использовали t-критерий Стьюдента. Доверительный интервал был выбран с надежностью 90% (p = 0.1) [28].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Твердофазное сбраживание. При твердофазном сбраживании компостной смеси в сывороточных бутылях концентрация метана достигала в термофильных пробах 24.1–36.8 (об. %) на 11 сут эксперимента, в мезофильных пробах – 21.5–26.3 об. % на 14 сут. Это указывало на присутствие в компостной смеси активных метаногенных архей. Так как образование метана было зафиксировано при двух температурах культивирования, можно сделать вывод, что в компостной смеси присутствовали как термофильные, так и мезофильные метаногены, причем последние были способны сохранять свою активность и после термофильной стадии компостирования, что также было показано ранее [14].
Жидкофазное сбраживание. При проведении этапа жидкофазного сбраживания при 28°С концентрация метана постепенно возрастала на протяжении всего времени эксперимента в пробах со всеми типами метаногенных субстратов (рис. 1а), достигая максимума к концу культивирования на 25–32 сут. Контролем служили флаконы, куда метаногенные субстраты не добавляли. Из всех исследованных субстратов (добавленных по 20 ммоль л–1), максимальная концентрация метана в мезофильных условиях была на ТМА – 31.5 ± 3.9 ммоль л–1, что на 51% выше по сравнению с контролем (20.9 ± 1.9 ммоль л–1). На метаноле максимальная концентрация метана составила 26.7 ± 4.8 ммоль л–1 (на 28% выше контроля), на ацетате – 29.8 ± 3.8 ммоль л–1 (на 43% выше контроля). В работе [29] при обработке смеси пищевых отходов и избыточного активного ила (50 : 50) концентрация метана после 5–7-суточной лаг-фазы постепенно возрастала на протяжении 30 cут эксперимента, при этом стационарная фаза наблюдалась с 20 сут эксперимента. В настоящей работе в мезофильном режиме лаг-фазы не наблюдали ни на одном метаногенном субстрате: концентрации метана возрастали монотонно. Самая высокая скорость роста во время экспоненциальной фазы была на ТМА (4.7 ммоль л–1 сут–1), в контроле она составляла 1.5 ммоль л–1 сут–1, на метаноле 2.6 и ацетате 3.0 ммоль л–1 сут–1 (рис. 1а).
Рис. 1.
Динамика образования метана в пробах при температуре 28°С (а), 55°С (б): 1 – контроль; 2 – метанол; 3 – ацетат; 4 – ТМА. Результаты представлены как среднее значение ± общая погрешность по результатам двух повторностей.
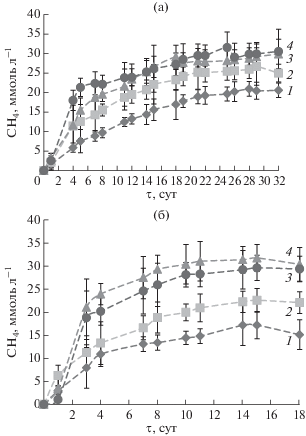
При жидкофазном сбраживании при 55°С на ацетате и ТМА наблюдали короткую лаг-фазу в первые сутки, а затем экспоненциальную фазу роста на протяжении следующих 3 сут, когда скорость образования метана составляла 6.8 ммоль л–1 сут–1 на ацетате и 6.4 ммоль л–1 сут–1 на ТМА. Скорость образования метана в контроле и на метаноле составила 2.6 и 2.4 ммоль л–1 cут–1 соответственно (рис. 1б).
В контрольном варианте и опыте с метанолом рост концентрации метана был постепенным, а лаг-фаза отсутствовала так же, как при температуре 28°С. Максимальная концентрация метана в контрольном эксперименте – 17.2 ± 2.9 ммоль л–1, при внесении метанола – 22.6 ± 2.6 ммоль л–1 (на 31% выше контроля), ТМА – 29.6 ± 2.7 ммоль л–1 (на 72% выше контроля) и ацетата – 31.7 ± ± 2.9 ммоль л–1 (на 84% выше контроля).
Таким образом, в термофильных условиях образование метана достигало максимума за более короткие сроки, чем в мезофильных. По результатам работ [30, 31] повышенная температура способствовала увеличению скорости гидролиза органических веществ и, соответственно, более быстрому образованию метана и его более высокому выходу.
Самые высокие концентрации метана были зафиксированы как при 28, так и при 55°С в экспериментах, в которых в качестве субстратов для роста метаногенных архей были добавлены ацетат и ТМА (рис. 1а и 1б). Можно предположить, что в исследуемой компостной смеси активны как мезофильные, так и термофильные метаногены семейства Methanosarcinaceae [32].
Некоторые метаногены способны использовать в качестве субстратов для образования метана не только ацетат и метилированные соединения, но и смесь газов Н2/СО2, поэтому из флаконов с ацетатом в качестве субстрата были сделаны пересевы также на Н2/СО2 (см. ниже).
Динамика образования ЛЖК при жидкофазном сбраживании. Известно, что ЛЖК являются важнейшими промежуточными продуктами при сбраживании органических веществ. Их низкая концентрация считается показателем стабильности процесса сбраживания, а избыточное накопление с последующим снижением рН является одной из наиболее частых причин дестабилизации анаэробных реакторов. В работе [33] было показано, что при концентрациях ацетата, пропионата и бутирата, равных 4125 (70), 2856 (40) и 3456 (40) мг л–1 (ммоль л–1) соответственно, наблюдалась полная дестабилизация процесса сбраживания. По данным [34] добавление 13 000 (220.2), 15 000 (172.2) и 3500 (47.9) мг л–1 (ммоль л–1) ацетата, бутирата и пропионата соответственно приводило к двукратному снижению выхода метана. В работе [35] наблюдалось снижение роста метаногенных архей при внесении 951 мг л–1 (13 ммоль л–1) пропионата.
В настоящей работе наблюдали незначительное образование ЛЖК и спиртов при жидкофазном сбраживании. При температуре 28°С концентрация этанола достигала 0.7–8.5, ацетата 4.0–9.5 и пропионата 4.9–7.5 ммоль л–1, при 55°С – этанола 1.8–4.9, ацетата 1.9–5.6, пропионата 0.5–1.6 ммоль л–1. Очевидно, столь низкие концентрации не оказывали ингибирующего действия на процесс метаногенеза.
Результаты работы [30] показали, что при совместном сбраживании ТКО с активным илом муниципальных очистных сооружений, в первую очередь, в мезофильных условиях наблюдали образование уксусной кислоты, а в термофильных условиях основной ЛЖК была масляная кислота. В настоящей работе образование бутирата не было обнаружено что, по-видимому, связано с различиями сбраживаемых субстратов.
К концу эксперимента концентрации ЛЖК на всех субстратах при двух температурах культивирования достигали следовых значений, что свидетельствовало не только об активном метаногенезе, но и о протекании процессов синтрофного метаболизма, при котором промежуточные продукты разложились до более простых субстратов вследствие их потребления синтрофными бактериями совместно с метаногенами [32].
Известно также, что соотношение C/N является одним из важных факторов, который влияет на выход и характер распределения ЛЖК в процессе сбраживания исследуемого субстрата. Ацетат, пропионат и бутират образуются из углеводов, а валерат и капронат – при дезаминировании аминокислот, образующихся во время разложения белков [36]. Анализ ЛЖК и спиртов при жидкофазном сбраживании показал, что в основном образовывались только этанол, ацетат и пропионат. По-видимому, исследуемая компостная смесь, содержала большее количество углеводов, чем белков в соотношении C/N.
Получение и исследование накопительных культур метаногенных архей. В результате первого пересева сброженной культуры при жидкофазном сбраживании на всех субстратах к 28 суткам культивирования концентрация метана во флаконах достигала 10–33 об. % при температуре 28°С и 18–33 об. % при 55°С. Как было описано выше, также был сделан второй пересев накопительных культур с добавлением ванкомицина. Для идентификации архейного состава накопительных культур были проведены молекулярно-генетические исследования, для чего были отобраны пробы из последних разведений второго пересева, в которых наблюдался активный рост, наибольшая концентрация метана и наименьшее морфологическое разнообразие. Результаты секвенирования гена 16S рРНК приведены в табл. 1.
Таблица 1.
Результаты секвенирования гена 16S рРНК в накопительных культурах метаногенных архей
| Субстрат | Температура культивирования, °С | Наиболее близкий вид | Степень сходства, % |
|---|---|---|---|
| ТМА (+ванкомицин) | 28 | Candidatus ‘Methanoplasma termitum’ | 96 |
| Candidatus ‘Methanogranum caenicola’ | 100 | ||
| Н2/СО2 (+ванкомицин) | 28 | Methanofollis ethanolicus | 98.8 |
| ТМА (+ванкомицин) | 55 | Methanosarcina thermophila | 100 |
| Ацетат | 55 | Methanomassiliicoccus luminyensis | 96 |
| Н2/СО2 (+ванкомицин) | 55 | Methanothermobacer thermoautotrophicus | 99 |
Максимальная концентрация метана в газовой фазе флаконов при 28°С, в которые был внесен ТМА, была достигнута через 49 сут культивирования в седьмом разведении – 29.7 об. %. В этой накопительной культуре в результате секвенирования гена 16S рРНК были обнаружены представители двух видов архей. Первый филотип принадлежал виду Candidatus ‘Methanogranum caenicola’, второй филотип имел 96% сходства с Candidatus ‘Methanoplasma termitum’ и, по-видимому, относится к новому виду этого рода-кандидата.
Ca. ‘Methanogranum caenicola’ был выделен ранее из осадка анаэробного метаногенного реактора [37], перерабатывающего ТКО при температуре 55°C, что еще раз подтвердило способность мезофильных метаногенов выживать при высоких температурах. Обнаружение этой культуры в сообществе находит логическое объяснение, так как исследуемая компостная смесь содержала избыточный ил биологических очистных сооружений сточных вод, прошедших как аэробную, так и анаэробную обработку. Тем не менее, Ca. ‘Methanogranum caenicola’ был впервые обнаружен в компостируемых органических отходах.
При микроскопировании проб из этой накопительной культуры были найдены крупные коккоидные клетки, которые могли принадлежать как одному, так и другому виду, так как для обоих характерна подобная морфология (рис. 2а). Ca. ‘Methanoplasma termitum’ является компонентом кишечной микробиоты термитов, но он был обнаружен также и в образцах почв и осадков приливно-отливной зоны [38]. Известно, что этот вид образует метан в присутствии водорода путем восстановления метанола или монометиламина, но не использует ди- и триметиламин [39]. Образование метана Ca. ‘Methanogranum caenicola’ также зависит от присутствия водорода и метанола [37]. Возможно, что обнаруженные микроорганизмы обладают более гибким метаболизмом, чем считалось ранее, и способны использовать для роста и другие метилированные соединения.
Рис. 2.
Морфология клеток накопительных культур, полученных на разных субстратах и при разных температурах: а – ТМА + ванкомицин, 28°С; б, в – Н2/СО2 + ванкомицин, 28°С; г – ТМА + ванкомицин, 55°С; д – ацетат, 55°С; е – Н2/СО2 + ванкомицин, 55°С. Масштаб 10 мкм.
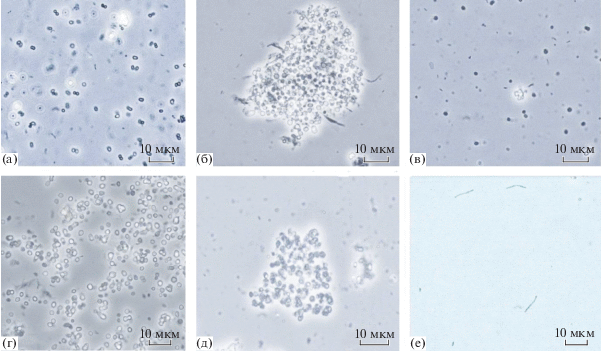
В газовой фазе пробы с субстратом Н2/СО2 при 28°С максимальная концентрация метана составляла 18.3 об. % на 85 сут культивирования. Результаты секвенирования показали, что в этой пробе присутствует археон Methanofollis ethanolicus (99% сходства). Этот вид метаногенных архей изначально был выделен из ила лотосовых полей [40], но обнаружен также и в сообществах анаэробных биореакторов, где может быть одним из самых значимых продуцентов метана [41]. Этот метаноген использует в качестве субстрата для роста и образования метана этанол, пропанол, бутанол, формиат и Н2/СО2. Клетки M. ethanolicus имеют форму неправильных (нерегулярных) кокков и встречаются в культуре поодиночке, что соответствовало морфологии клеток, выделенных в настоящей работе (рис. 2б). Обнаруженные в том же образце агрегаты клеток (рис. 2б), вероятно, относились к другому виду метаногенных архей, который не удалось детектировать в результате секвенирования.
При культивировании при 55°С максимальная концентрация метана была зафиксирована на ТМА на 71 день культивирования и составила 44.8 об. %. В этой пробе присутствовала морфологически однородная культура коккоидных клеток (рис. 2г) – представители вида Methanosarcina thermophila. При компостировании органических отходов представители порядка Methanosarcinales являются одними из наиболее часто обнаруживаемых метаногенов, активных в том числе на термофильной стадии процесса [12, 42]. Представители рода Methanosarcina успешно адаптируются к повышающейся температуре и обнаруживаются в составе микробного сообщества в течение всего процесса компостирования [42]. Способность использовать разные субстраты для метаногенеза и более высокая устойчивость к ингибиторам, чем у других метаногенных архей, делают их ключевым компонентом метаногенного сообщества, участвующего в обработке органических отходов. Считается, что при анаэробной обработке субстрата с получением биогаза большая часть метана образуется именно благодаря представителям этого рода [11, 43].
Секвенирование накопительной культуры на ацетате при 55°C (максимальная концентрация метана была 30.5 об. %) позволило обнаружить филотип, который имел 96% сходство с Methanomassiliicoccus luminyensis. Этот вид ассоциирован, главным образом, с кишечной микробиотой человека [44]. Известно, что этот метаноген является мезофильным, для образования метана использует смесь метанола и водорода в качестве субстрата и не растет на остальных типичных для других метаногенов субстратах. Учитывая отдаленную степень родства с ранее описанным видом, можно предположить, что обнаруженный метаноген может быть новым таксоном с иным типом метаболизма. При микроскопировании образца были обнаружены агрегаты коккоидных клеток (рис. 2д).
При культивировании на Н2/СО2 при 55°C (максимальная концентрация метана 22.8 об. %) при микроскопировании пробы были обнаружены кокки, реже палочки средней длины (рис. 2е). По данным секвенирования, в этой культуре присутствовал Methanothermobacter thermoautotrophicus (табл. 1) (ранее Methanothermobacter thermoformicicum) [45]. Представители этого вида были найдены в компостируемых органических отходах [12]. Известно, что M. thermoautotrophicus использует в качестве субстрата смесь водорода и углекислого газа, что соответствовало условиям культивирования в настоящей работе. Кроме того, ранее отмечалось, что представители этого вида более устойчивы к повышенным концентрациям ЛЖК, по сравнению с другими метаногенами, а накопление ЛЖК в процессе обработки органических отходов стимулирует сукцессию метаногенного сообщества, в результате которой доминирующим видом метаногенов становится M. thermoautotrophicus [46]. Несмотря на то, что этот вид метаногенов ассоциируется прежде всего с условиями обитания при повышенных температурах, было показано, что температурный диапазон, в котором M. thermoautotrophicus сохраняет активность, достаточно широкий (40–75°C) [47].
Состав некоторых активных консорциумов был также проанализирован с помощью высокопроизводительного секвенирования прокариотического сообщества и были рассчитаны показатели биоразнообразия микроорганизмов для этих консорциумов. Результаты приведены на рис. 3 и в табл. 2.
Рис. 3.
Состав архейного сообщества консорциумов (относительное множество копий гена 16S рРНК, %) на уровне рода: 1 – метанол + ванкомицин, 28°С; 2 – ацетат + ванкомицин, 28°С; 3 – ацетат, 55°С.
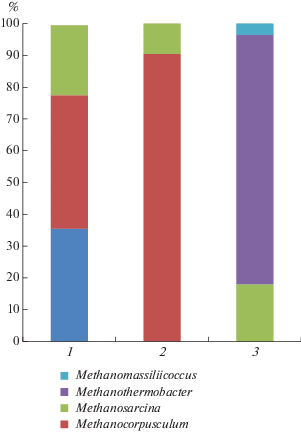
Таблица 2.
Разнообразие метаногенных архей в консорциумах
| Проба | Температура культивирования, °С | Число ОТЕ* | Индекс Chao1** | Индекс Симпсона*** | Индекс Шеннона*** |
|---|---|---|---|---|---|
| Метанол + ванкомицин | 28 | 89 | 188 | 0.51 | 1.07 |
| Ацетат + ванкомицин | 28 | 197 | 370 | 0.31 | 2.03 |
| Ацетат | 55 | 431 | 945 | 0.20 | 2.81 |
Согласно числу ОТЕ, значениям индексов Chao1, Симпсона и Шеннона, анаэробное сообщество, полученное в условиях роста на ацетате при 55°С, характеризовалось видовым разнообразием, было представлено значительным числом микроорганизмов, так как ацетат является легкоусвояемым источником углерода и энергии для многих прокариот, в том числе не метаногенных бактерий. Метанол, по-видимому, являлся субстратом для более узкого круга микроорганизмов, поэтому консорциум, полученный на этом субстрате с добавлением ванкомицина при 28°С, имел самые низкие показатели разнообразия относительно других изученных сообществ. Из полученных результатов также очевидно, что ванкомицин оказывал негативное влияние на биоразнообразие сообществ накопительных культур, так как, по-видимому, подавлял рост многих грамположительных бактерий.
В пробе с метанолом с добавлением ванкомицина при температуре культивирования 28°С (максимальная концентрация метана 12.0 об. %) бактериальное сообщество, в основном, было представлено родами Macellibacteroides (68%) и Aminobacterium (24%). Метаногенные археи в этой пробе составили 0.4% от всего сообщества накопительной культуры и были представлены родами Methanocorpusculum (42% архейного сообщества), Methanosarcina (22%) и Candidatus Methanogranum (35%). Последний метаноген был также обнаружен в мезофильной пробе на ТМА (сходство 100% с Candidatus ‘Methanogranum caenicola’), что подтвердило присутствие метаногенных архей этого рода в исследуемой компостной смеси.
На ацетате с добавлением ванкомицина при температуре культивирования 28°С (максимальная концентрация метана 35 об. %) бактериальное сообщество, в основном, представлено родами Macellibacteroides (53%), Desulfovibrio (15–16%), Aminobacterium (9%) и Succinispira (7–8%). Археи составили 2–3% от всего сообщества накопительной культуры и представлены двумя родами: Methanocorpusculum (90.5% архейного сообщества) и Methanosarcina (9.5%).
На данный момент род Methanocorpusculum включает в себя четыре вида метаногенных архей: Methanocorpusculum parvum, Methanocorpusculum sinense, Methanocorpusculum havaricum [48] и Methanocorpusculum labreanurn [49]. Основными субстратами для роста и образования метана этими археями являются H2/CО2 и формиат. В нашем исследовании представители этого рода были обнаружены на метаноле и ацетате. Возможно, эти субстраты не только потреблялись метаногенами, но и окислялись синтрофными бактериями с образованием водорода и углекислого газа, которые и были субстратом для метаногенов рода Methanocorpusculum.
Как было описано выше, в пробе при температуре культивирования 55°С, где субстратом был ацетат, был детектирован Methanomassiliicoccus luminyensis со сходством 96%. Эта проба была также дополнительно проанализирована с помощью высокопроизводительного секвенирования 16S рРНК прокариотического сообщества накопительной культуры. Бактериальное сообщество этой пробы, в основном, представлено родами Coprothermobacter (45%), Acetomicrobium (21%) и Anaerolinea (10–11%). Археи составили 5% от всего сообщества накопительной культуры, они представлены родами Methanothermobacter (на 78.5% архейного сообщества), Methanosarcina (18%) и Methanomassiliicoccus (3.5%). Известно также, что метаногенные археи рода Methanothermobacter используют в качестве субстрата H2/CО2, что подтверждает наше предположение о протекании синтрофных процессов окисления ацетата. Как было сказано выше, присутствие в данной накопительной культуре рода метаногенных архей Methanomassiliicoccus подтвердили результаты секвенирования гена 16S рРНК, поэтому мы предполагаем, что обнаруженный в данном исследовании метаноген является новым таксоном с иным типом метаболизма. Применение высокопроизводительного секвенирования позволило уточнить и дополнить данные о составе метаногенного сообщества в накопительных культурах.
Археям-метаногенам в исследованных образцах сопутствовали различные виды бактерий. Некоторые из них важны для роста и активности метаногенов, так как связаны с ними симбиотическими или синтрофными взаимосвязями. О присутствии представителей сульфатредуцирующих бактерий в сообществе компостируемых отходов различного происхождения сообщалось ранее. Активность этих микроорганизмов и детектированных нами Aminobacteria и Anaerolinea также связана с анаэробными микрозонами, подобными тем, что обнаружены в метаногенных гранулах из анаэробных биореакторов [50, 51]. Что касается рода Coprothermobacter, в значительных количествах присутствовавшего в одной из проб, то эти термофильные гидролитики связаны с метаногенами синтрофными взаимосвязями [52]. То же самое касается и Acetomicrobium, чья ацетогенная активность стимулирует рост ацетокластических метаногенов. Несомненный интерес представляет факт обнаружения в двух пробах значительных количеств гидролитических бактерий Macellibacteroides, которые нередко соседствуют с метаногенами в сообществах биореакторов [53].
Таким образом, в результате проведенной работы установлено, что мезофильные метаногены сохраняли свою жизнеспособность после длительного компостирования органических отходов с высоким содержанием сухого вещества (27.5%) при высоких температурах (75–82°С) и были способны образовывать метан при последующем сбраживании. В компостируемой смеси обнаружена высокая активность как термофильных, так и мезофильных метаногенных архей семейства Methanosarcinaceae. Термофильные консорциумы, в которых были обнаружены Methanosarcina thermophila и Methanothermobacter thermoautotrophicus, были наиболее активны в образовании метана. В ходе работы были получены накопительные культуры метаногенных архей, содержащие Methanosarcina thermophila, Methanothermobacter thermoautotrophicus, Candidatus ‘Methanogranum caenicola’, Methanofollis ethanolicus. Также были получены накопительные культуры, в состав которых входили археи, филогенетически близкие к Candidatus ‘Methanoplasma termitum’ и Methanomassiliicoccus luminyensis, возможно, представляющие новые таксоны согласно результатам секвенирования. Из выше упомянутых культур четыре последние были впервые обнаружены в компостируемых органических отходах. Результаты высокопроизводительного секвенирования наиболее интересных проб позволили уточнить и дополнить данные о филогенетическом составе микробного сообщества. Полученные активные консорциумы (накопительные культуры) метаногенных архей будут исследованы в дальнейшем с целью их использования в биотехнологии метанового сбраживания органических отходов, в том числе компостируемых, для интенсификации и увеличения выхода биогаза.
Работа выполнена с использованием научного оборудования ЦКП “Биоинженерия” (ФИЦ Биотехнологии РАН).
Работа выполнена при частичной финансовой поддержке гранта РФФИ мк-18-29-25035.
Список литературы
Миронов В., Бочкова Е., Ганнесен А., Вантеева А., Русскова Ю., Ножевникова А. // Микробиология. 2020. Т. 89. № 4. С. 474–487.
Xu Q., Jin X., Ma Z., Tao H., Ko Jae Hac. // Biores. Technol. 2014. V. 168. P. 92–96.
Di Maria F., Micale C., Sisani L., Rotondi L. // Waste Manag. 2016. V. 55. P. 49–60.
Sagdeeva O., Krusir G., Tsykalo A., ShpyrкoT., Leuenberger H. // J. Food Science and Technology. 2018. V. 11. № 4. P. 43–49.
Onwosi C.O., Igbokwe V.C., Odimba J.N., Eke I.E., Nwankwoala M.O., Iroh I.N., Ezeogu L.I. // J. Environ. Manag. 2017. V. 190. P. 140–157.
Conrad R. // Pedosphere. 2020. V. 30. № 1. P. 25–39.
Ножевникова А., Миронов В., Бочкова Е., Литти Ю., Русскова Ю. // Прикл. биохимия и микробиология. 2019. Т. 55. № 3. С. 211–221.
Yang F., Li G., Shi H., Wang Y. // Waste Manag. 2015. V. 36. P. 70–76.
Chen R., Wang Y., Wei S., Wang W., Lin X. // FEMS Microbiol. Ecol. 2014. V. 90. № 3. P. 575–586.
Ge J., Huang G., Li J., Han L. // Waste Manag. 2018. V. 78. P. 135–143.
Capson-Tojo G., Trably E., Rouez M., Crest M., Bernet N., Steyer J.P., Delgenès J.P., Escudié R. // Waste Manag. 2018. V. 76. P. 423–430.
Thummes K., Kämpfer P., Jäckel U. // Systematic and Applied Microbiology. 2007. V. 30. № 5. P. 418–429.
Yang S., Li L., Peng X., Song L. // Biores. Technol. 2021. V. 320. Part A. P. 124359.
Safika S., Aditiawati P., Akhmaloka A. // J. Pure and Applied Microbiology. 2014. V. 8. № 4. P. 2837–2844.
Паршина С.Н., Ермакова А.В., Шатилова К.А. // Микробиология 2011. Т. 80. № 1. С. 53–62.
Pfennig N. // Zbl. Bakt. I. Abt. Orig. Suppl. 1965. V. 1. P. 179–189.
Pfenning N., Lippert K.D. // Arch. Microbiol. 1966. V. 55. P. 245–246.
Wolin E.A., Wolin M.J., Wolfe R.S. // J. Biol. Chem. 1963. V. 238. P. 2882–2886.
Булыгина Е.С., Кузнецов Б.Б., Марусина А.И., Кравченко И.К., Быкова С.А., Колганова Т.В., Гальченко В.Ф. // Микробиология 2002. Т. 71. № 4. С. 500–508.
Колганова Т.В., Кузнецов Б.Б., Турова Т.П. // Микробиология 2002. Т. 71. № 2. С. 283–286.
Sanger F., Nicklen S., Coulson A.R. // Proceedings of the National academy of sciences. 1977. V. 74. № 12. P. 5463–5467.
Camacho C., Coulouris G., Avagyan V., Ma N., Papadopoulos J., Bealer K., Madden T.L. // BMC Bioinformatics. 2009. V. 10. P. 421.
Chen M.L., Tsen H.Y. // J. Appl. Microbiol. 2002. V. 92. P. 912–919.
Gohl D., MacLean A., Hauge A., Becker A., Walek D., Beckman K. // Protocol Exchange 2016. https://doi.org/10.1038/protex.2016.030
Fadrosh D., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R., Ravel J. // Microbiome. 2014. V. 2. № 1. P. 6.
Hugerth L.W., Wefer H.A, Lundin S., Jakobsson H.E., Lindberg M., Rodin S., Engstrand L., Andersson A.F. // Appl. Environ. Microbiol. 2017. V. 80. P. 5116–5123.
Меркель А., Тарновецкий И., Подосокорская О., Тощаков С. // Микробиология 2019. Т. 88. № 6. С. 655–664.
Strode P., Brokaw A. Using biointeractive resources to teach Mathematics and Statistics in Biology. P Strode Brokaw. 2015. P. 39
Gu J., Liu R., Cheng Y., Stanisavljevic N., Li L., Djatkov D., Peng X., Wang X. // Biores. Technol. 2020. V. 301. Art. № 122765.
Arras W., Hussain A., Hausler R., Guiot S.R. // Waste Manag. 2019. V. 87. P. 279–287.
Basinas P., Rusín J., Chamrádová K. // Environ. Research. 2021. V. 192. Art. № 110202.
Ножевникова А., Русскова Ю., Литти Ю., Паршина С., Журавлева Е., Никитина А. // Микробиология. 2020. Т. 89. № 2. С. 131–151.
Wang Y., Zhang Y., Wang J., Meng L. // Biomass and Bioenergy. 2009. V. 33. № 5. P. 848–853.
Dogan T., Ince O., Oz N.A., Ince B.K. // J. Environmental Science and Health. 2005. V. 40. № 3. P. 633–644.
Demirel B., Yenigün O. // Environmental Technology. 2002. V. 23. № 10. P. 1179–1187.
Rughoonundun H., Mohee R., Holtzapple M.T. // Biores. Technol. 2012. V. 112. P. 91–97.
Iino T., Tamaki H., Tamazawa S., Ueno Y., Ohkuma M., Suzuki K., Igarashi Y., Haruta S. // Microbes Environ. 2013. V. 28. № 2. P. 244–250.
De La Cuesta-Zuluaga J., Spector T.D., Youngblut N.D., Ley R.E. // Msystems. 2021. V. 9. № 6(1). Art. № e00939-20. https://doi.org/10.1128/mSystems.00261-19
Lang K., Schuldes J., Klingl A., Poehlein A., Daniel R., Brunea A. // Appl. Environ. Microbiol. 2015. V. 81. P. 1338–1352.
Imachi H., Sakai S., Nagai H., Yamaguchi T., Takai K. // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 800–805.
Karabey B., Daglioglu S. T., Azbar N., Ozdemir G. // J. Environmental Science and Health. 2019. Part A. V. 54. № 13. P. 1348–1355.
Yamamoto N., Nakai Y. // Advances in Environmental Microbiology. 2019. V. 6. P. 151–172
Kurade M.B., Saha S., Salama E.S., Patil S.M., Govindwar S.P., Jeon B.H. // Biores. Technol. 2019. V. 272. P. 351–359.
Dridi B., Fardeau M.L., Ollivier B., Raoult D., Drancourt M. // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 1902–1907.
Touzel J.-P., Macario E., Nölling J., De Vos W., Zhilina T., Lysenko A. // International J. Systematic Bacteriology. 1992. V. 42. P. 408–411.
Lin L., Yu Z., Li Y. // Biores. Technol. 2017. V. 241. P. 1027–1035.
Liu C., Mao L., Zheng X., Yuan J., Hu B., Cai Y., Xie H., Peng X., Ding X. // Microbiology Open. 2019. V. 8. № 5. P. Art. № e00715.
Zellner G., Stackebrandt E., Messner P., Tindall B., Macario E., Kneifel H., Sleytr U., Winter J. // Arch. Microbiol. 1989. V. 151. P. 381–390.
Zhao Y., Boone D., Mah R., Boone J., Xun L. // Int. J. Syst. Bacteriol. 1989. V. 39. P. 10–13.
Zhao Y., Jiang B., Tang X., Liu S. // Science of the Total Environment. 2019. V. 687. P. 50–60.
Trego A. C., Galvin E., Sweeney C., Dunning S., Murphy C., Mills S., Nzeteu C., Quince C., Colleny S., Ijaz U., Collins G. // Front. Microbiol. 2020. V. 11. P. 1126.
Sasaki K., Morita M., Sasaki D., Nagaoka J., Matsumoto N., Ohmura N., Shinozaki H. // J. Biosci. Bioeng. 2011. V. 112. № 5. P. 469–472.
Xu Q., Liu X., Wang D., Liu Y., Wang Q., Ni B. J., Li H. // Biores. Technol. 2019. V. 284. P. 456–465.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


