Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 605-612
АФК-зависимое стресс-протекторное действие 24-эпикастастерона и его моносалицилата на проростки пшеницы при гипертермии
Р. П. Литвиновская 1, М. А. Шкляревский 2, Ю. Е. Колупаев 2, *, А. И. Кокорев 2, В. А. Хрипач 1
1 Институт биоорганической химии Национальной академии наук Беларуси
220141 Минск, Республика Беларусь
2 Харьковский национальный аграрный университет им. В.В. Докучаева
62483 Харьков, Украина
* E-mail: plant.biology.knau@gmail.com
Поступила в редакцию 28.04.2021
После доработки 28.06.2021
Принята к публикации 02.07.2021
Аннотация
Проведено сравнение влияния 24-эпикастастерона (ЭК) и его конъюгата с остатком салициловой кислоты (2-моносалицилата ЭК – МСЭК) на теплоустойчивость проростков пшеницы. Обработка проростков МСЭК в концентрациях 20 и 50 нМ вызывала более существенное повышение их теплоустойчивости по сравнению с действием ЭК, салициловой кислоты (СК), а также смеси ЭК и СК в указанных концентрациях. Под влиянием ЭК и МСЭК отмечалось транзиторное повышение содержания пероксида водорода в корнях проростков, при этом эффект МСЭК был более существенным. Обработка проростков МСЭК вызывала более заметное повышение в корнях активности антиоксидантных ферментов (каталазы и гваяколпероксидазы) по сравнению с действием ЭК. Влияние ЭК и его салицилата на показатели про-/антиоксидантного равновесия в клетках корней и теплоустойчивость проростков устранялось их обработкой антиоксидантом диметилтиомочевиной и ингибитором НАДФH-оксидазы имидазолом. Сделано заключение об АФК-опосредованном действии исследуемых соединений на стресс-протекторные системы корней проростков. Более существенное защитное действие МСЭК по сравнению с ЭК могло быть связано с постепенным высвобождением из конъюгата СК и ЭК и функциональным взаимодействием сигнальных путей брассиностероидов и СК.
Брассиностероиды (БС) играют значительную роль в регуляции функций растительного организма как в оптимальных, так и в неблагоприятных условиях [1]. В настоящее время накоплены экспериментальные данные, которые свидетельствуют в пользу представлений о том, что модификация сигнальных путей БС экзогенными воздействиями может быть одним из стратегических направлений решения проблемы адаптации культурных растений [2–4].
БС находятся в тесных функциональных связях практически со всеми компонентами гормональной системы растений [3]. Так, показано, что стимуляция БС ростовых процессов включает в себя их синергическое взаимодействие с гиббереллинами и ауксинами [5]. Не менее важное значение имеет взаимодействие БС со стрессовыми фитогормонами, в частности с абсцизовой (АБК) и салициловой (СК) кислотами. Установлено, например, что индуцирование 24-эпибрассинолидом (ЭБ) устойчивости проростков пшеницы к действию кадмия, которое сопровождалось значительным усилением синтеза дегидрина с молекулярной массой (ММ) 28 кДа, было опосредовано образованием АБК [6].
Достаточно давно были получены данные, указывающие на возможное участие СК в реализации влияния БС на соле- и теплоустойчивость растений арабидопсиса. Так, экзогенный ЭБ почти не оказывал влияния на резистентность растений генотипа npr1-1 – мутантов по ключевому гену салицилатного сигналинга [7]. Также установлена более высокая чувствительность к гипертермии мутантов npr1-1 по сравнению с растениями арабидопсиса дикого типа. В то же время обнаружено подавление синтеза СК при усиленной в присутствии БС экспрессии гена NPR1 [8]. Имеющиеся сведения указывают на наличие как положительного, так и отрицательного перекрестного взаимодействия между БС и СК. Например, при заражении корней риса Pythium graminicola БС действовали как факторы вирулентности за счет отрицательного взаимодействия с СК [9]. С другой стороны, при действии абиотических стрессоров зарегистрированы эффекты усиления защитного действия БС и СК при совместном использовании двух фитогормонов. В частности, комбинация ЭБ и СК оказывала более заметное защитное действие на растения рапса при их обработке токсическими дозами свинца, что выражалось в усиленном накоплении антиоксидантов липидной фазы и хелаторов металлов [10]. Усиление защитного влияния обработки ЭБ при ее комбинировании с обработкой СК показано и в условиях солевого стресса [11]. При одновременном действии двух фитогормонов у растений рапса, подвергнутых солевому стрессу, отмечались более высокие показатели содержания пролина, активности нитратредуктазы и карбоангидразы, фиксации CO2 по сравнению с растениями, обработанными одним из фитогормонов.
Ранее сообщалось о синтезе конъюгатов БС с СК с помощью реакций ЭБ и 24-эпикастастерона (ЭК) с ангидридом 2-O-бензилсалициловой кислоты с последующим гидрогенолизом O-бензильных групп [12]. Полученные таким образом конъюгаты ЭБ и ЭК с СК оказывали более заметное влияние на выживание проростков проса после потенциально летального прогрева и в условиях солевого стресса не только по сравнению с исходными БС, но и по сравнению со смесью БС с СК, взятых в оптимальных концентрациях [12]. Под влиянием конъюгатов БС с СК отмечалось более заметное смягчение проявления окислительного стресса, определяемого по содержанию продуктов пероксидного окисления липидов (ПОЛ), после повреждающего действия гипертермии и засоления.
Известно, что АФК, образующиеся с участием НАДФH-оксидазы при действии БС на растения, участвуют в реализации их сигнальных и защитных эффектов [13–15]. С другой стороны, АФК, которые генерируются с помощью пероксидазы и НАДФН-оксидазы, задействованы в сигналинге СК [16]. Однако влияние конъюгатов БС с СК на редокс-гомеостаз растительных клеток и значение его изменений для реализации стресс-протекторного действия таких производных БС до сих пор не исследовано.
В последнее время появились сведения о различиях в физиологической активности лактон(ЭБ) и кетон-(ЭК) содержащих БС [17]. В частности, показано, что обработка стареющих листьев ячменя ЭК более эффективно по сравнению с действием ЭБ предотвращала развитие окислительного стресса [18]. Обработка растений рапса ЭК способствовала повышению в них активности пероксидазы, в то время как при действии ЭБ такой эффект почти не проявлялся [17]. В целом физиологические (стресс-протекторные) эффекты кетонсодержащих БС изучены значительно слабее, чем лактонсодержащих БС.
Цель работы – сравнительное изучение влияния ЭК и его 2-моносалицилата (МСЭК) на теплоустойчивость проростков пшеницы, образование в них АФК и состояние их антиоксидантной системы.
МЕТОДИКА
Зерновки пшеницы (Triticum aestivum L.) сорта Досконала обеззараживали 6%-ным пероксидом водорода в течение 30 мин и проращивали в темноте в течение 4 сут при температуре около 20°С на водопроводной воде, очищенной с использованием системы водоподготовки, включающей в себя фильтр механической очистки, угольный фильтр и полупроницаемую обратноосмотическую мембрану с размером ячеек 1 нм. Затем в среду инкубации корней добавляли ЭК или МСЭК в концентрациях диапазона 5–200 нМ, время воздействия 24 ч. В отдельных вариантах опытов проростки в течение 24 ч инкубировали на растворах СК (20 или 50 нМ) либо смеси ЭК с СК в соответствующих концентрациях. Время инкубации проростков на растворах физиологически активных соединений, вызывающее наиболее заметное повышение их выживания после повреждающего нагрева, было выбрано на основании предварительных опытов (результаты не приводятся).
При изучении влияния скавенджера пероксида водорода диметилтиомочевины (ДМТМ) [19] и ингибитора НАДФH-оксидазы имидазола [20] на теплоустойчивость проростков и биохимические показатели проростки икубировали на растворах 26 ч. При оценке совместного действия ДМТМ и имидазола с ЭК или МСЭК указанные соединения добавляли в среду инкубации корней за 2 ч до начала обработки БС. Концентрации ДМТМ и имидазола и время экспозиции, вызывающие наиболее существенные модификации физиологических эффектов, выбраны на основании предварительных опытов.
Биохимические показатели определяли в корнях проростков, поскольку они более чувствительны к воздействиям экзогенных соединений и теплового стресса [21]. Во время инкубации проростков на исследуемых растворах определяли содержание в корнях пероксида водорода и активность антиоксидантных ферментов – супероксиддисмутазы (СОД), каталазы и гваяколпероксидазы.
По окончании инкубации на растворах ЭК, МСЭК и исследуемых ингибиторов проростки подвергали повреждающему прогреву в водяном ультратермостате при температуре 45°С в течение 10 мин [21]. Затем их переносили на 24 ч на очищенную водопроводную воду и определяли содержание продуктов пероксидного окисления липидов (ПОЛ). Часть проростков после прогрева выдерживали в течение трех суток при температуре около 20°С и освещении 6000 лк для оценки выживания.
Для определения содержания H2O2 корни на холоде гомогенизировали в 5% трихлоруксусной кислоте, центрифугировали при 8000 g в течение 10 мин при температуре не выше 4°С на центрифуге MPW 350R (MPW MedInstruments, Польша) и в супернатанте определяли концентрацию H2O2 с помощью ферротиоцианатного метода [22].
Для определения активности антиоксидантных ферментов навески свежесрезанных корней гомогенизировали на подносах со льдом в 0.15 М K,Na-фосфатном буфере (pH 7.6), содержавшем ЭДТА (0.1 мМ) и дитиотрейтол (1 мМ) [23]. Для анализа использовали супернатант после центрифугирования гомогената при 8000 g в течение 10 мин при 4°С. Активность цитозольной супероксиддисмутазы (СОД, КФ 1.15.1.1) определяли при pH 7.6, используя метод, основанный на способности фермента конкурировать с нитросиним тетразолием за супероксидные анионы, образующиеся вследствие аэробного взаимодействия НАДH и феназинметосульфата. Активность каталазы (КФ 1.11.1.6) анализировали при рН 7.0 по количеству пероксида водорода, разложившегося за единицу времени. Активность гваяколпероксидазы определяли при pH 6.2, используя в качестве донора водорода гваякол, в качестве субстрата – пероксид водорода. Активность СОД выражали в усл. ед./г сырой массы ⋅ мин, каталазы – в мкмоль H2O2/г сырой массы ⋅ мин, пероксидазы – в усл. ед./г сырой массы ⋅ мин.
Для определения содержания продуктов ПОЛ растительный материал гомогенизировали в реакционной среде, содержащей 0.25%-ную 2-тиобарбитуровую кислоту в 10%-ной трихлоруксусной кислоте [24]. После этого пробы кипятили в течение 30 мин, охлаждали и центрифугировали 15 мин при 10 000 g. В супернатанте определяли продукты ПОЛ, реагирующие с 2-тиобарбитуровой кислотой (преимущественно малоновый диальдегид – МДА), измеряя оптическую плотность при длинах волн 532 нм (максимум светопоглощения МДА) и 600 нм (для поправки на неспецифическое поглощение).
Опыты проводили в 4 кратной биологической повторности и каждый опыт воспроизводили независимо 3 раза. На рисунках приведены средние величины и их стандартные ошибки. Достоверность различий при P ≤ 0.05 определяли с использованием дисперсионного анализа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
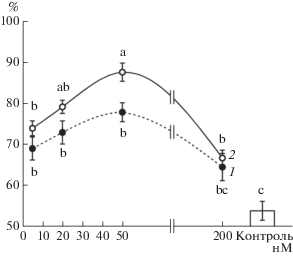
Обработка проростков ЭК в концентрациях диапазона 5–200 нМ вызывала повышение их теплоустойчивости (рис. 1). При этом наиболее заметный защитный эффект наблюдали под влиянием ЭК в концентрации 20 и, особенно, 50 нМ. Влияние МСЭК на выживание проростков пшеницы после теплового стресса было более существенным по сравнению с ЭК, по крайней мере, при использовании концентрации, вызывающей наибольший защитный эффект – 50 нМ.
Рис. 1.
Зависимость влияния концентрации ЭК и его конъюгата с салициловой кислотой (МСЭК) на выживание проростков пшеницы (%) после повреждающего прогрева. 1 – ЭК; 2 – МСЭК. Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
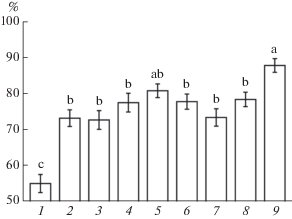
В отдельных сериях экспериментов сравнивали влияние МСЭК с действием СК и смеси ЭК и СК в соответствующих концентрациях. Обработка проростков СК, также как и ЭК, повышала их выживание после повреждающего прогрева (рис. 2). Защитный эффект смесей СК и ЭК в концентрациях 20 и 50 нМ был немного выше, чем действие каждого соединения в отдельности, однако это различие не было достоверным при P ≤ 0.05. В то же время протекторное действие МСЭК в концентрации 50 нМ существенно превышало эффект смеси СК и ЭК в такой же концентрации.
Рис. 2.
Сравнение влияния ЭК, МСЭК и смеси ЭК с СК на выживание проростков пшеницы (%) после повреждающего прогрева: 1 – контроль; 2 – ЭК (20 нМ); 3 – СК (20 нМ); 4 – ЭК (20 нМ) + СК (20 нМ); 5 – МСЭК (20 нМ); 6 – ЭК (50 нМ); 7 – СК (50 нМ); 8 – ЭК 50 (нМ) + СК (50 нМ); 9 – МСЭК (50 нМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
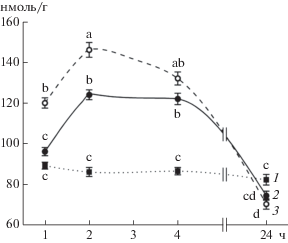
Как уже отмечалось, сигнальные и стресс-протекторные эффекты БС могут быть опосредованы образованием АФК, зависимым от НАДФH-оксидазы [14]. Значение АФК в реализации протекторного действия МСЭК до сих пор не исследовалось. В настоящей работе эффект повышения содержания пероксида водорода в корнях проростков пшеницы под влиянием как ЭК, так и МСЭК был транзиторным с максимумом через 2 ч после начала обработки. При этом обработка МСЭК вызывала более заметное повышение содержания H2O2 по сравнению с действием ЭК (рис. 3). В то же время через 24 ч экспозиции содержание пероксида водорода в корнях в вариантах с ЭК и особенно с МСЭК становилось ниже, чем в контроле, что указывает на более сбалансированную работу системы генерации и обезвреживания АФК в органах растений, обработанных БС.
Рис. 3.
Динамика содержания пероксида водорода (нмоль/г сырой массы) в корнях проростков пшеницы при действии ЭК и МСЭК: 1 – контроль; 2 – ЭК (50 нМ); 3 – МСЭК (50 нМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
Обработка корней проростков скавенджером пероксида водорода ДМТМ и ингибитором НАДФH-оксидазы имидазолом вызывала снижение в них содержания H2O2 (рис. 4). При этом как ДМТМ, так и имидазол, почти полностью устраняли эффекты повышения содержания H2O2 в корнях проростков, обработанных ЭК и МСЭК (рис. 4). Можно полагать, что усиление образования АФК под влиянием как ЭК, так и МСЭК, связано с повышением активности НАДФH-оксидазы.
Рис. 4.
Модификация влияния ЭК и МСЭК на содержание пероксида водорода в корнях проростков пшеницы обработкой ДМТМ и имидазолом: 1 – контроль; 2 – ДМТМ (150 мкМ); 3 – имидазол (10 мкМ); 4 – ЭК (50 нМ); 5 – МСЭК (50 нМ); 6 – ЭК (50 нМ) + + ДМТМ (150 мкМ); 7 – МСЭК (50 нМ) + ДМТМ (150 мкМ); 8 –ЭК (50 нМ) + имидазол (10 мкМ); 9 – МСЭК (50 нМ) + имидазол (10 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
Для выяснения значения АФК как сигнальных посредников в повышении теплоустойчивости проростков под действием ЭК и МСЭК изучали влияние ДМТМ и ингибитора НАДФH-оксидазы имидазола на проявление стресс-протекторных эффектов БС. Через сутки после прогрева в корнях проростков увеличивалось содержание продукта ПОЛ МДА (рис. 5а). Обработка ЭК и МСЭК уменьшала проявление эффекта окислительного стресса. ДМТМ не влияла на проявление процесса ПОЛ, но заметно уменьшала протекторные эффекты ЭК и МСЭК. При обработке имидазолом содержание МДА в корнях проростков почти не изменялось, но при этом ингибитор НАДФH-оксидазы устранял вызываемое действием ЭК и МСЭК уменьшение накопления продуктов ПОЛ.
Рис. 5.
Содержание МДА (%, к контролю без прогрева) в корнях (а) и выживание (%) проростков пшеницы (б) после повреждающего прогрева: 1 – контроль; 2 – ДМТМ (150 мкМ); 3 – имидазол (10 мкМ); 4 – ЭК (50 нМ); 5 – МСЭК (50 нМ); 6 – ЭК (50 нМ) + ДМТМ (150 мкМ); 7 – МСЭК (50 нМ) + ДМТМ (150 мкМ); 8 – ЭК (50 нМ) + имидазол (10 мкМ); 9 – МСЭК (50 нМ) + имидазол (10 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
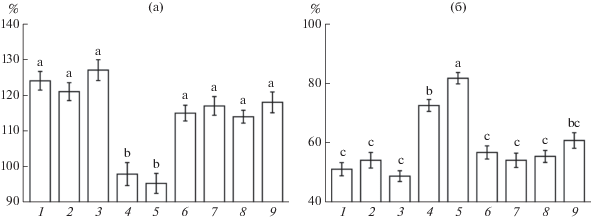
Данные по влиянию БС и антагонистов АФК на показатель окислительного стресса согласуются с изменением выживания проростков после теплового стресса. Обработка ДМТМ и имидазолом сама по себе существенно не влияла на теплоустойчивость проростков (рис. 5б). При этом защитные эффекты как ЭК, так и МСЭК, не проявлялись в присутствии ДМТМ. Ингибитор НАДФH-оксидазы имидазол также устранял стресс-протекторное действие ЭК и МСЭК.
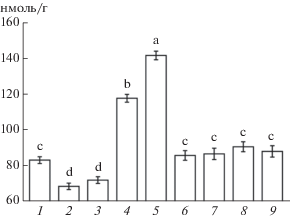
Смягчение проявления вызываемого прогревом эффекта окислительного стресса при обработке проростков ЭК и его салицилатом указывает на возможность активации антиоксидантной системы под влиянием как ЭК, так и его производного с СК. В связи с этим сравнили влияние ЭК и МСЭК на динамику активности антиоксидантных ферментов в корнях проростков пшеницы при их инкубации на среде с этими соединениями. Активность СОД в корнях в условиях наших экспериментов повышалась через 4 ч после начала воздействия обоих БС (рис. 6а). Однако через 24 ч значения активности СОД в этих вариантах приближались к величине контроля.
Рис. 6.
Динамика активности СОД (а, усл. ед./г сырой массы мин), каталазы (б, мкмоль H2O2/ г сырой массы мин) и гваяколпероксидазы (в, усл. ед./г сырой массы мин) в корнях проростков пшеницы при действии ЭК и МСЭК: 1 – контроль; 2 – ЭК (50 нМ); 3 – МСЭК (50 нМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
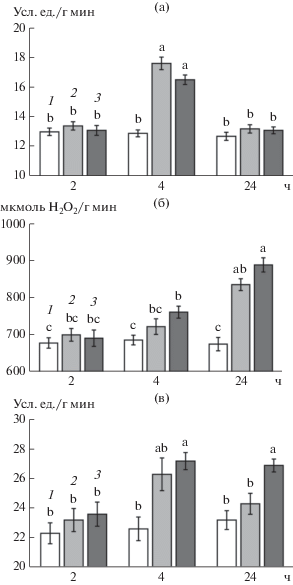
Активность каталазы через 4 ч инкубации достоверно (при P ≤ 0.05) превышала значения в контроле только в варианте с МСЭК. Через 24 ч от начала инкубации в вариантах с обоими БС отмечались более высокие значения активности фермента. При этом эффект МСЭК оказался более заметным (рис. 6б).
Активность гваяколпероксидазы превышала соответствующие значения в контроле в вариантах с обоими БС через 4 ч инкубации (рис. 6в). Через 24 ч величина активности фермента в варианте с МСЭК также превышала соответствующие значения контроля, а в варианте с ЭК активность гваколпероксидазы достоверно от него не отличалась.
В целом, полученные результаты указывают на более существенные изменения редокс-гомеостаза (содержания пероксида водорода и активности антиоксидантных ферментов) в корнях проростков пшеницы, обработанных МСЭК, по сравнению с эффектами природного ЭК.
Для выяснения возможного значения пероксида водорода как сигнального посредника в изменениях активности антиоксидантных ферментов исследовали влияние ЭК и МСЭК в присутствии ДМТМ и имидазола на активность в корнях каталазы и гваяколпероксидазы – ферментов, активность которых более заметно изменялась в присутствии БС (рис. 6).
Установлено, что ДМТМ и имидазол не оказывали влияния на активность каталазы (рис. 7а). При этом указанные ингибиторы почти полностью устраняли вызываемое ЭК и МСЭК увеличение активности фермента.
Рис. 7.
Влияние ЭК, МСЭК, ДМТМ и имидазола на активность каталазы (а, мкмоль H2O2/г сырой массы мин ) и гваяколпероксидазы (б, усл. ед./г сырой массы мин) в корнях проростков пшеницы: 1 – контроль; 2 – ДМТМ (150 мкМ); 3 – имидазол (10 мкМ); 4 – ЭК (50 нМ); 5 – МСЭК (50 нМ); 6 – ЭК (50 нМ) + ДМТМ (150 мкМ); 7 – МСЭК (50 нМ) + + ДМТМ (150 мкМ); 8 – ЭК (50 нМ) + имидазол (10 мкМ); 9 – МСЭК (50 нМ) + имидазол (10 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
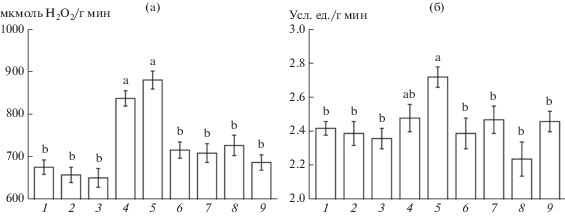
Также обработка ДМТМ и имидазолом не влияла на активность гваяколпероксидазы (рис. 7б). В то же время указанные ингибиторы нивелировали увеличение активности фермента, вызываемое МСЭК. В случае с ЭК ввиду слабых отличий активности гваяколпероксидазы от величин контроля, зафиксировать достоверные изменения его действия при обработке проростков ДМТМ и имидазолом не представлялось возможным.
Как уже отмечалось, к настоящему времени известно, что многие физиологические эффекты как БС, так и СК могут реализоваться с участием АФК. В экспериментах с отрезками колеоптилей пшеницы показано устранение стресс-протекторного действия экзогенных БС (ЭБ и ЭК) и СК в присутствии антиоксидантов и ингибиторов НАДФH-оксидазы [14, 16]. Идентичные эффекты получены в настоящей работе на примере интактных проростков пшеницы при изучении действия на них ЭК и его салицилата. Таким образом, можно полагать, что, по крайней мере, одной из причин повышения теплоустойчивости проростков под влиянием ЭК и МСЭК является активация антиоксидантной системы, благодаря чему проростки оказываются “праймированными” – подготовленными к действию стрессора.
Примечательно, что смесь ЭК и СК в оптимальных концентрациях оказывала заметное положительное влияние на теплоустойчивость проростков пшеницы (рис. 2). Однако ее влияние уступало эффекту МСЭК. Можно предположить, что в случае с МСЭК происходило “мягкое” постепенное высвобождение СК из конъюгата за счет гидролиза эфирной связи. При этом СК в низких концентрациях, возможно, выступает в роли посредника в реализации эффекта ЭК. Как отмечалось, имеются данные, свидетельствующие о роли основного транскрипционного регулятора передачи сигналов СК белка NPR1 (non expressor of pathogenesis related) в реализации эффектов БС [7]. Также есть сведения об усилении под влиянием БС экспрессии гена белка транскрипционного фактора WRKY70, который в сигнальных путях находится ниже NPR1 и, в свою очередь, участвует в салицилат-индуцированной экспрессии генов некоторых PR-белков [25]. С другой стороны, сообщается, что БС могут и подавлять синтез СК [8]. Возможно, что поступление свободной СК из МСЭК способствует проявлению влияния БС на экспрессию генов, причастных к формированию устойчивости к тепловому стрессу. Естественно, что для подтверждения этого предположения необходимы специальные исследования. Примечательно, что в ряде работ обнаружено сходство влияния БС и СК на теплоустойчивость растений и экспрессию генов антиоксидантных ферментов [26, 27].
Переход белка NPR1 в активное (мономерное) состояние, вероятно, происходит с участием тиоредоксинов и требует изменений редокс-гоместаза – накопления определенного пула восстановителей [28]. Не исключено, что эти процессы могут усиливаться в присутствии БС. С другой стороны, имеются сведения, что в сети сигналинга СК помимо NPR1 принимают участие транскрипционные факторы WRKY и ряд MAP-киназ (mitogen-activated protein kinase), в том числе MPK3, MPK4 и MPK6 [29, 30], экспрессия которых считается важной для устойчивости растений к абиотическим стрессорам различной природы.
Таким образом, по крайней мере, в умеренных концентрациях возможно синергическое влияние БС и СК на функционирование стресс-протекторных систем, обеспечивающих устойчивость растений к действию абиотических стрессоров. При этом, как показывают наши экспериментальные данные, реализация эффектов МСЭК включает в себя изменения редокс-гомеостаза, в частности, транзиторное усиление зависимого от НАДФН-оксидазы синтеза АФК с последующим повышением активности антиоксидантных ферментов. Однако вопрос о том, как связаны между собой изменения окислительно-восстановительного баланса и сигнальной сети БС и СК, включающей в себя упомянутые выше регуляторные белки, пока остается открытым.
* * *
Итак, полученные результаты показали значительное индуцирование теплоустойчивости проростков пшеницы обработкой ЭК и МСЭК. Следует отметить, что стресс-протекторное действие ЭК, который является кетонсодержащим БС, по силе не уступает эффектам, обнаруженным ранее в идентичных экспериментальных условиях для ЭБ – лактонсодержащего БС [31]. Оба БС уменьшали интенсивность вызываемого нагревом процесса ПОЛ и в целом способствовали активации ферментативной антиоксидантной системы. При этом ЭБ [31] вызывал более существенное по сравнению ЭК (рис. 6а) повышение активности СОД в корнях проростков пшеницы. В то же время при обработке ЭК наблюдали повышение активности каталазы и гваяколпероксидазы (рис. 6), а после воздействия ЭБ активность каталазы не изменялась, а гваяколпероксидазы, наоборот, снижалась [31]. Похожие различия влияния ЭБ и ЭК на активность антиоксидантных ферментов показаны и у растений рапса [17]. В связи с этим есть основания констатировать наличие некоторых специфических особенностей влияния лактон- и кетонсодержащих БС на ферментативную антиоксидантную систему растений.
Проведенные исследования показали и различия физиологических эффектов природного БС (ЭК) и его салицилата БС (МСЭК). При обработке МСЭК отмечалось более существенное повышение выживания проростков пшеницы после повреждающего нагрева, чем при обработке обычным ЭК (рис. 1). Более того, обработка оказалась более эффективной по сравнению с действием смеси СК и ЭК (рис. 2). Под влиянием МСЭК происходило более существенное по сравнению с эффектом ЭК транзиторное увеличение содержания пероксида водорода в корнях проростков и последующее повышение активности каталазы и гваяколпероксидазы (рис. 3, 6). При этом скавенджер пероксида водорода ДМТМ и ингибитор НАДФH-оксидазы имидазол, устраняющие индуцированный ЭК и МСЭК эффект повышения содержания пероксида водорода в корнях проростков, снимали и стресс-протекторное действие БС (рис. 4, 5). Таким образом, пероксид водорода, по-видимому, является сигнальным посредником в реализации действия обычных БС и их конъюгатов с СК. Необходимо отметить, что для СК, как и для БС, в экспериментах с растениями разных видов показано, что в физиологических концентрациях эти фитогормоны способствуют повышению активности антиоксидантных ферментов и снижению интенсивности ПОЛ [16, 32]. Более существенное стресс-протекторное действие МСЭК по сравнению с ЭК, а также смесью ЭК и СК, может быть связано с участием СК в качестве посредника при передаче в генетический аппарат сигнала, индуцируемого действием ЭК. Можно предположить, что эффект синергизма в действии ЭК и СК реализуется в результате постепенного высвобождения СК из конъюгата и ее присутствия в клетках в низких концентрациях. Однако это предположение требует в дальнейшем непосредственной экспериментальной проверки.
Список литературы
Ahanger M.A., Ashraf M., Bajguz A., Ahmad P. // J. Plant Growth Regul. 2018. V. 37. P. 1007–1024.
Anwar A., Liu Y., Dong R., Bai L., Yu X., Li Y. // Biol. Res. 2018. V. 51. Art. 46. doi.org/https://doi.org/10.1186/s40659-018-0195-2
Gruszka D. // Int. J. Mol. Sci. 2013. V. 14. № 5. P. 8740–8774.
Безрукова М.В., Кудоярова Г.Р., Лубянова А.Р., Масленникова Д.Р., Шакирова Ф.М. // Физиология растений. 2021. Т. 68. № 2. С. 161–169.
Bajguz A., Hayat S. // Plant Physiol. Biochem. 2009. V. 47. P. 1–8.
Аллагулова Ч.Р., Масленникова Д.Р., Авальбаев А.М., Фёдорова К.А., Юлдашев Р.А., Шакирова Ф.М. // Физиология растений. 2015. Т. 62. № 4. С. 499–505.
Divi U.K., Rahman T., Krishna P. // BMC Plant Biology. 2010. V. 10. P. 151–164.
Banerjee A., Roychoudhury A. // J. Plant Growth Regul. 2018. V. 37. P. 1025–1032.
Vleesschauwer D.D., Buyten E.V., Satoh K., Balidion J., Mauleon R., Choi I.-R., Vera-Cruz C., Kikuchi S., Hofte M. // Plant Physiol. 2012. V. 158. № 4. P. 1833–1846.
Kohli S.K., Handa N., Sharma A., Gautam V., Arora S., Bhardwaj R., Alyemeni M.N., Wijaya L., Ahmad P. // Protoplasma. 2018. V. 255. P. 11–24.
Hayat S., Maheshwari P., Wani A.S., Irfan M., Alyemeni M.N., Ahmad A. // Plant Physiol. Biochem. 2012. V. 53. P. 61–68.
Litvinovskaya R.P., Vayner A.A., Zhylitskaya H.A., Kolupaev Yu.E., Savachka A.P., Khripach V.A. // Chem. Nat. Compd. 2016. V. 52. № 3. P. 452–457.
Nie W.F. Wang M.-M., Xia X.-J., Zhou Y.-H., Shi K., Chen Z., Yu J.Q. // Plant Cell Environ. 2013. V. 36. № 4. P. 789–803.
Колупаев Ю.Е., Вайнер А.А., Ястреб Т.О., Обозный А.И., Хрипач В.А. // Прикл. биохимия и микробиология. 2014. Т. 50. № 6. С. 593–598.
Zhou J., Wang J., Li X., Xia X.-J., Zhou Y.-H., Shi K., Chen Z., Yu J.-Q. // J. Exp. Bot. 2014. V. 65. № 15. P. 4371–4383.
Колупаев Ю.Е., Ястреб Т.О., Швиденко Н.В., Карпец Ю.В. // Прикл. биохимия и микробиология. 2012. Т. 48. № 5. С. 550–556.
Коломейчук Л.В., Данилова Е.Д., Хрипач В.А., Жабинский В.Н., Кузнецов Вл.В., Ефимова М.В. // Физиология растений. 2021. Т. 68. № 3. С. 297–307.
Ковтун И.С., Кухаренко Н.Е., Кузнецов В.В., Хрипач В.А., Ефимова М.В. // Физиология растений. 2021. Т. 68. № 3. С. 268–278.
Sung M., Hsu Y., Hsu Y. // Mar. Biotechnol. 2009. V. 11. № 2. P. 199–209.
Hung K.T., Hsu Y.T., Kao C.H. // Physiol. Plant. 2006. V. 127. № 2. P. 293–303.
Колупаев Ю.Е., Обозный А.И., Швиденко Н.В. // Физиология растений. 2013. Т. 60. № 2. С. 221–229.
Sagisaka S. // Plant Physiol. 1976. V. 57. №. 2. P. 308–309.
Колупаев Ю.Е., Ястреб Т.О., Обозный А.И., Рябчун Н.И., Кириченко В.В. // Физиология растений. 2016. Т. 63. № 3. С. 346–358.
Фазлиева Э.Р., Киселева И.С., Жуйкова Т.В. // Физиология растений. 2012. Т. 59. № 3. С. 369–375.
Bali S., Poonam, Gautam V., Kaur P., Khanna K., Kaur R., Vig A.P., Ohri P., Bhardwaj R. // Salicylic Acid: A Multifaceted Hormone / Eds. R. Nazar, N. Iqbal, N.A. Khan. Singapore: Springer Nature Pte, 2017. P. 201–219.
Nawaz F., Naeem M., Zulfiqar B., Akram A., Ashraf M.Y., Raheel M., Shabbir R.N., Hussain R.A., Anwar I., Aurangzaib M. // Environ. Sci. Pollut. Res. 2017. V. 24. № 19. P. 15959–15975.
Vardhini B.V. // Protective Chemical Agents in the Amelioration of Plant Abiotic Stress: Biochemical and Molecular Perspectives. / Eds. A. Roychoudhury, D.K. Tripathi. John Wiley & Sons Inc., 2020. P. 389–412.
Tada Y., Spoel S.H., Pajerowska-Mukhtar K., Mou Z., Song J., Wang C., Zuo J., Dong X. // Science. 2008. V. 321. № 5891. P. 952–956.
Тарчевский И.А. // Прикл. биохимия и микробиология. 2014. Т. 50. № 4. С. 374–382.
Pedranzani H., Vigliocco A. // Mechanisms Behind Phytohormonal Signalling and Crop Abiotic Stress Tolerance. / Eds. V.P. Singh, S. Singh, S.M. Prasad S.M. N.Y.: Nova Science Publishers, 2017. P. 329–370.
Karpets Yu.V., Shkliarevskyi M.A., Khripach V.A., Kolupaev Yu.E. // Cereal Res. Commun. 2021. V. 49. № 2. P. 207–216.https://doi.org/10.1007/s42976-020-00090-5
Нечаева Т.Л., Николаева Т.Н., Загоскина Н.В. // Известия РАН. Серия биологическая. 2020. № 4. С. 385–392.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


