Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 549-555
Идентификация стрессового белка Hli в пигмент-белковых комплексах Arthrospira platensis
Л. С. Шарапова 1, Н. П. Юрина 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: nyurina@inbi.ras.ru
Поступила в редакцию 08.06.2021
После доработки 28.06.2021
Принята к публикации 02.07.2021
Аннотация
Изучена ассоциация стрессовых белков Hli (high light inducible proteins) c пигмент-белковыми комплексами многоклеточной цианобактерии Arthrospira platensis. Согласно базе данных NCBI в геноме A. platensis обнаружено три гена Hli, которые кодируют белки длиной 47, 64 и 69 аминокислотных остатка (а.о.). Клетки A. platensis инкубировали в условиях светового стресса (500 мкмоль фотонов/м2 · с, 1 ч). Затем с помощью двумерного электрофореза и последующей масс-спектрометрией изучали ассоциацию белков Hli с пигмент-белковыми комплексами тилакоидных мембран. С помощью MALDI-TOF масс-спектрометрии в составе пигмент-белковых комплексов был идентифицирован Hli 47 а.о. Показано, что белок Hli47 ассоциирован с фотосистемой II и является гомологом белка HliC Synechocystis sp. 6803. С помощью биоинформатического анализа установлено, что аминокислотная последовательность идентифицированного белка обнаруживала более высокую степень гомологии с белками многоклеточных цианобактерий и меньшую с аминокислотной последовательностью Hli белков одноклеточных цианобактерий.
В последнее время цианобактериям уделяется большое внимание в связи с возможностью их широкого применения в производстве биотоплива и биоремедиации [1]. Они хорошо адаптируются к разнообразным условиям, включая экстремальные, синтезируя мало изученные стрессовые белки и вторичные метаболиты [2]. Идентификация и характеристика таких белков необходима как для изучения адаптации клеток к стрессам, так и для повышения их устойчивости к стрессам при практическом применении цианобактерий. Особый интерес представляют белки светового стресса, так как одним из основных стрессовых воздействий на клетку является избыточный свет. Свет необходим для фотосинтеза, однако избыток световой энергии может нарушать работу фотосинтетического аппарата в результате процессов фотоингибирования и фотодеструкции [3]. Когда абсорбированная энергия не может полностью использоваться, в реакциях электронного транспорта происходит увеличение образования синглетного кислорода и других АФК. Для диссипации избыточно поглощенной энергии в фотосинтезирующих организмах образовались различные защитные механизмы [4]. Cреди защитных механизмов фотосинтеза отдельного рассмотрения заслуживают стрессовые белки, индуцированные интенсивным светом. К ним относятся стрессовые белки Hlips (high light inducible proteins) цианобактерий с одной трансмембранной спиралью. Четыре белка Hli (HliA, HliB, HliC и HliD) обнаружено у модельной цианобактерии Synechocystis. Белки Hlips необходимы для поддержания нормальной жизнедеятельности клетки. Предполагают, что белки Hli принимают участие в таких важных процессах, как: регуляция биосинтеза хлорофилла; транспорт и связывание молекул хлорофилла; тушение синглетного кислорода; сборка и репарация фотосистемы 2; нефотохимическая диссипация абсорбированной световой энергии [5]. Белки Hli ассоциированы с фотосистемой II и по-видимому с фотосистемой I [6, 7]. Однако основная функция этих белков пока не ясна, а данные о белках Hli других видов цианобактерий практически отсутствуют в литературе.
Большой интерес вызывают цианобактерии, имеющие длинноволновые формы хлорофилла. Это обусловлено предположением об их участии в защите фотосинтетического аппарата от фотодеструкции [8]. В работе использовали нитчатую многоклеточную экстремофильную цианобактерию Arthrospira platensis, содержащую данные формы хлорофилла [8]. Длинноволновый хлорофилл с полосой флуоресценции при 760 нм был обнаружен также у других нитчатых цианобактерий – Pseudoanabaena sp., Phormidium uncinatum и Nostoc muscorum, но не у одноклеточных цианобактерий Synechocystis sp. и Synechococcus elongatus, часто используемых для исследований по физиологии и биохимии фотосинтеза [8]. В этой связи нами была выдвинута гипотеза, что отличие фотозащиты фотосинтетического аппарата одноклеточных и многоклеточных цианобактерий, различающихся по наличию длинноволновых хлорофиллов, отразилось и на составе стрессовых белков Hli.
Цель работы – идентификация и изучение локализации белков Hli в пигмент-белковых комплексах тилакоидов многоклеточной экстремофильной цианобактерии A. platensis и определение их структурных и функциональных особенностей с помощью биоинформатических программ.
МЕТОДИКА
Объект исследования. Объектами исследования служили многоклеточная цианобактерия Arthrospira platensis (Nordst.) Geitl. IPPAS B-256 и одноклеточная цианобактерия Synechocystis sp. PCC 6803 (далее по тексту Synechocystis). Клетки цианобактерий выращивали при интенсивности освещения 50 мкмоль фотонов/м2 ⋅ с, температуре 30°С и аэрацией воздухом до середины логарифмической фазы роста [6, 7]. Часть клеток подвергалась воздействию светового стресса (500 мкмоль фотонов ⁄ м2 ⋅ с, в течение 1 ч).
Выделение тилакоидных мембран и фракционирование хлорофилл-белковых комплексов. Выделение тилакоидных мембран из клеток цианобактерий проводили методом, описанным ранее [6, 7]. Для экстракции нативных комплексов фотосистем из тилакоидных мембран использовали мягкий неионный детергент n-додецил-β-D-мальтозид (β-DM). Детергент добавляли к тилакоидным мембранам в соотношении детергент–хлорофилл 15 : 1 и инкубировали при 4°С в течение 30 мин. Лизат мембран центрифугировали при 18 000 g в течение 10 мин. Осадок тилакоидных мембран использовали для дальнейшего анализа.
Содержание хлорофилла а в образцах определяли в этаноловом экстракте по формуле: [Chla] (мг/мл) = 1.21А664 – 0.17 × А625 [9], где А664 – поглощение при длине волны 664 нм, А625 – поглощение при длине волны 625 нм.
Фракционирование пигмент-белковых и белковых комплексов тилакоидных мембран. Фракционирование проводили с помощью электрофореза в нативном неокрашенном полиакриламидном геле (ПААГ) [10]. К лизату тилакоидных мембран A. platensis добавляли десятикратный буфер (200 мМ BisTris рН 7.0; 75% сахароза, 1.0 М 6‑аминокапроновая кислота) в соотношении 10 : 1. Для электрофореза в первом направлении использовали градиентный ПААГ (4–12%). Электрофорез в первом направлении проводили на приборе фирмы “Hoefer” (США) при напряжении 100 В, в течение 2.5 ч. После окончания электрофореза гелевую пластину фотографировали, а затем одну полосу использовали для электрофореза во втором направлении в денатурирующих условиях в присутствии додецилсульфата Na (ДДС-Na). Электрофорез белков проводился в трис-глициновом буфере (25 мМ трис, 250 мМ глицин, 0.1%-ный ДДС-Na, pH 7.5) при постоянной силе тока 120 мА в течение 2 ч в 12.5%-ном ПААГ. Затем гель окрашивали Кумасси R-250 в течение ночи.
Идентификация белков с помощью масс-спектрометрии MALDI-TOF. Триптический гидролиз белка в полиакриламидном геле, окрашенном Coomassie Brilliant Blue, проводили следующим образом: кусочек геля размером 3–4 мм3 дважды промывали для удаления красителя в 100 мкл 40%-ного раствора ацетонитрила в 0.1 М NH4HCO3 в течение 20 мин при 37°С. После удаления раствора для дегидратации геля добавляли 100 мкл ацетонитрила. Затем удаляли ацетонитрил, высушивали кусочек геля и добавляли к нему 3.5 мкл раствора модифицированного трипсина (“Promega”, США) в 0.05 М NH4HCO3 с концентрацией 15 мкг/мл. Гидролиз проводили в течение 3 ч при 37°С, затем к раствору добавляли 5.25 мкл 0.5%-ной трифторуксусной кислоты (ТФУ) в 50%-ном растворе водного ацетонитрила и тщательно перемешивали. Гидролизат использовали для получения MALDI-масс-спектров. Подготовка образцов для масс-спектрометрии проводилась следующим образом: на мишени смешивали по 1.5 мкл раствора образца и 0.5 мкл раствора 2,5-диоксибензойной кислоты (“Aldrich”, США, 10 мг/мл в 20% водном ацетонитриле, 0.5% ТФУ), полученную смесь высушивали на воздухе. Идентификацию белков осуществляли при помощи программы Mascot (www.matrixscience.com). Масс-спектры были обработаны с помощью программного пакета FlexAnalysis 3.3 (“Bruker Daltonics”, Германия). Оборудование и программное обеспечение для масс-спектрометрии использовали на базе Центра коллективного пользования “Промышленные биотехнологии” ФИЦ Биотехнологии РАН.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
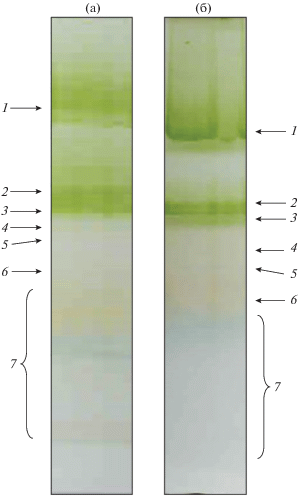
Фракционирование хлорофилл-белковых комплексов тилакоидных мембран цианобактерий. Хлорофилл-белковые комплексы цианобактерий Synechocystis и A. рlatensis фракционировали с помощью нативного электрофореза в ПААГ (рис. 1). При фракционировании пигмент-белковых комплексов в нативном геле обнаружены следующие компоненты тилакоидных мембран: тримеры и мономеры фотосистемы I, димеры и мономеры комплекса фотосистемы II, НАДФ-оксидоредуктаза, цитохромный комплекс b6-f и белки, не включенные в комплексы (зона свободных белков). Показано сходство состава пигмент-белковых комплексов одноклеточной цианобактерии Synechocystis и многоклеточной A. platensis.
Рис. 1.
Электрофореграмма пигмент-белковых комплексов тилакоидных мембран Synechocystis (а) и A. platensis (б) в ПААГ в нативных условиях: 1 – тримеры ФСI; 2 – мономеры ФСI; 3 – димеры ФСII; 4 – мономеры ФСII; 5 – НАД(Ф)Н-оксидоредуктаза; 6 – цитохром b6/f, 7 – зона свободных белков.
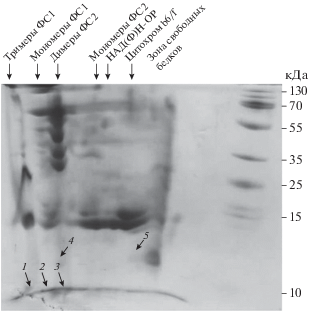
Локализация белков Hli в хлорофилл-белковых комплексах тилакоидных мембран A. platensis. Гели с фракционированными комплексами подвергали электрофорезу во втором направлении, в денатурирующих условиях. Фракционирование белков хлорофилл-белковых комплексов A. platensis в денатурирующих условиях представлено на рис. 2. Для определения локализации белков в хлорофилл-белковых комплексах на геле второго направления были выбраны окрашенные кумасси участки геля, в которых могли быть обнаружены белки Hli. Выбор производился с учeтом окрашивания белков Кумасси, молекулярной массы белка Hli и его наиболее вероятной локализации в хлорофилл-белковых комплексах цианобактерии. Выбранные образцы геля были проанализированы с помощью масс-спектрометрического анализа МАЛДИ-ТОФ. В образцах 1, 2 и 3 был идентифицирован белок Hli длиной 47 аминокислотных остатков (а.о.). В этих образцах кроме белка Hli47 были обнаружены белки фотосистемы II. Из полученных данных следует, что идентифицированный белок Hli47 A. platensis, ассоциирован с фотосистемой II.
Рис. 2.
Электрофореграмма белков тилакоидных мембран A. platensis в ПААГ c Na-ДДС (1-5 – порядковые номера белков, идентифицированных с помощью масс-спектрометрии): 1–3 – белок Hli47; 4 – белок Psb27 фотосистемы II; 5 – α-субъединица фикоцианина.
Белок Hli A. platensis, идентифицированный с помощью масс-спектрометрии, был найден в базе данных NCBI (https://www.ncbi.nlm.nih.gov/protein/ WP_00661948923.02.19. 23.02.19. г.) [11]. С помощью биоинформатического анализа проведено описание некоторых структурных и функциональных особенностей идентифицированного белка Hli47.
Используя программу Smart Blast [https://blast. ncbi.nlm.nih.gov/blast/smartblast/], была проведена оценка степени филогенетического родства идентифицированного белка с белками Hli других организмов. Показано, что аминокислотная последовательность идентифицированного белка Hli A. platensis имеет высокую степень идентичности с белками Hli других многоклеточных цианобактерий (Hlip 47 а.о., Leptolyngbya sp. – 89%; Hlip 47 а.о., Geitlerinema sp. – 87%). В то же время с аминокислотная последовательность белка Hli одноклеточной Synechocystis sp. идентифицированный белок имеет значительно меньшее сходство, всего – 55% (приведено ниже на рис. 4).
Филогенетически наиболее родственными Hlip 47 а.о. A. platensis, являются белки Hli других многоклеточных (нитчатых) цианобактерий. Ближайшие соседи – Limnospira indica, Planktothrix agardhii содержат белки Hli, имеющие аминокислотную последовательность, практически аналогичную Hlip 47 а.о. A. platensis. Полученный результат согласуется как с данными, полученными с помощью программы Smart Blast, так и с литературными данными [12]. Род Limnospira был совсем недавно выделен в отдельную группу от рода Arthrospira, а Planktothrix является близкородственным для Arthrospira [12]. Белки Hli одноклеточной цианобактерии Synechocystis филогенетически менее сходны с Hli 47 а.о. A. platensis. При поиске аминокислотных последовательностей, идентичных Hlip 47 а.о. A.platensis, программа Smart Blast практически не находит таковых у одноклеточных цианобактерий.
Для определения сходства белков Hli Synechocystis sp. и A. platensis с помощью программы UniProt (https://www.uniprot.org/) было проведено выравнивание их аминокислотных последовательностей. Показано, что их общая идентичность составляет всего 15.5% (рис. 3). Парное сравнение каждой из последовательностей белков Hli Synechocystis sp. с последовательностью идентифицированного белка Hli 47 а.о. A. Platensis показало, что аминокислотная последовательность белка HliC Synechocystis sp. наиболее гомологична последовательности идентифицированного белка Hli A. platensis 47 a.о. Их общая идентичность составляет 55% (рис. 4а).
Рис. 3.
Выравнивание аминокислотных последовательностей белков Hli Synechocystis и A. platensis с помощью программы UniProt. Выделено темно-серым (*) – полное совпадение а.о., серым (:) – близкие по свойствам а.о., светло-серым (.) – сходные по свойствам а.о.

Ранее белок HliC был выделен из цианобактерии Synechocystis sp. и охарактеризованы некоторые его структурные и физико-химические свойства [13]. Полученные структурные данные позволили предположить, что с белком HliC связывается по меньшей мере четыре молекулы хлорофилла и две молекулы β-каротина. Это указывало на участие этих белков в фотозащите и на их способность связывать вредоносные молекулы свободного хлорофилла, вызывающие фотодеструкцию.
Рис. 4.
Выравнивание аминокислотных последовательностей белков Synechocystis. и A. platensis: а – HliC Synechocystis и идентифицированного белка Hli 47 a.о. A. platensis; б – белка HliD Synechocystis и белка Hli 64 а.о. A. platensis; в ‒ белка HliА Synechocystis и белка Hli 69 а.о. A. platensis. Выделено темно-серым (*) – полное совпадение а.о., серым (:) – близкие по свойствам а.о., светло-серым (.) – сходные по свойствам а.о.

Чтобы составить более полное представление о степени гомологии первичной структуры белков Hli Synechocystis sp. и A. platensis, было проведено парное сравнение каждой из последовательностей белков Hli Synechocystis sp. с последовательностями белков Hli 64 и 69 а.о. A. platensis. В результате такого сравнения было показано, что Hli 64 а.о. A. platensis имел наиболее высокий процент сходства с последовательностью белка HliD Synechocystis sp. – 55% (рис. 4б). Аминокислотная последовательность Hlip 69 а.о. A. platensis имела наибольшее сходство с HliA Synechocystis sp. – 56% (рис. 4в). Гомология между представленными парами белков напрямую зависит от длины их аминокислотной последовательности. Также следует отметить, что даже самый большой процент сходства аминокислотных последовательностей между белками Hli Synechocystis sp. и A. platensis, не превышал 56%. Таким образом, в составе белков Hli A. platensis обнаружены гомологи охарактеризованных ранее белков Synechocystis: Hli64 – гомолог HliD; Hli69 – гомолог HliA и Hli47 гомолог HliC. Гомолог HliB отсутствовал в геноме A. platensis.
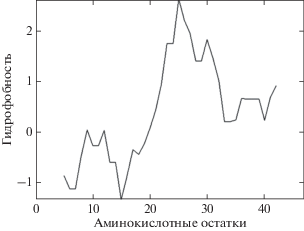
С помощью программы EMBOSS Pepwindow (https://www.ebi.ac.uk/Tools/seqstats/emboss_pepwindow/, 28.10.19. г.) был построен график гидрофобности белка Hli 47 а.о. A. platensis (рис. 5). Из полученного графика следует, что идентифицированный белок Hli 47 а.о. содержал достаточно протяжённый гидрофобный участок, характерный для трансмембранных доменов и являлся мембранным белком.
Рис. 5.
График гидрофобности белка Hli 47 а.о. A. platensis. На оси х – номера аминокислотных остатков (а.о.), на оси у – гидрофобность аминокислот, входящих в состав белковой последовательности.
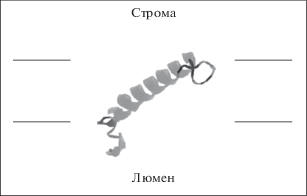
Для выяснения функций идентифицированного белка Hli 47 а.о. A. platensis, а также понимания пространственного расположения молекулы и ее локализации в клетке, с помощью программы I-TASSER (http://zhanglab.ccmb.med.umich.edu/I-TASSER, 29.10.19. г.) была построена трёхмерная модель белка (рис. 6). Моделирование I-TASSER [14–16] начинается с поиска шаблонов структур в библиотеке PDB (Protein Data Bank). В качестве наиболее удачного шаблона для построения модели белка Hli 47 а.о. A. platensis программа выбрала модель кристаллической структуры фотозащитного белка PsbS шпината (Spinacia oleracea). Это хлоропластный мембранный белок, локализован в фотосистеме II шпината, мол. масса 22 кДa и содержит четыре трансмембранных спирали. Этот белок PsbS фотосистемы II играет важную роль в нефотохимическом тушении [17], которое защищает растения от фотоповреждений в условиях избыточного освещения [18].
Рис. 6.
Структурная модель низкомолекулярного светоиндуцируемого белка Hli 47 а.о. A. platensis. Модель рассчитана на основании кристаллической структуры фотозащитного белка PsbS шпината (Spinacia oleracea, http://www.rcsb.org/) Приведено пространственное расположение молекулы белка в тилакоидной мембране относительно стромы клетки и люмена тилакоида.
Таким образом, полученные с помощью биоинформатических методов данные свидетельствуют, что Hlip 47 а.о. A. platensis – трансмембранный односпиральный белок, компонент клеточной мембраны цианобактерий. Анализ структуры белка подтвердил наличие сайтов связывания лигандов, среди которых хлорофилл a является наиболее значимым. Возможно, что белок участвует в нефотохимическом тушении избыточно поглощённой световой энергии.
Метаболизм азотистых соединений входит в число биологических процессов, в которых предположительно участвует идентифицированный белок. В исследованиях, проведенных ранее на Synechocystis, было обнаружено, что содержание белка HliC в клетке значительно повышается в условиях дефицита азота. При этом содержание остальных белков Hli остается на низком уровне [19]. Первичная структура HliC, как было отмечено, имеет значительное сходство с Hli 47 а.о. A. platensis.
На основании сходства аминокислотных последовательностей белка Hli 47 а.о. A. platensis и белка HliC Synechocystis sp., можно предположить, что в цианобактериальных клетках они выполняют сходную фотозащитную функцию, связывая фототоксичные свободные молекулы хлорофилла. Белки Hli, связывая свободный хлорофилл, препятствуют образованию активных форм кислорода [20].
Семейство стрессовых светоиндуцируемых белков Hli цианобактерий рассматривается как эволюционные предшественники хлорофилл a/b связывающих белков светособирающего комплекса LHC растений и водорослей [4]. Большинство исследований этих важных белков выполнено на клетках цианобактерии Synechocystis. В настоящей работе впервые изучены Hli белки многоклеточной цианобактерии A. platensis. Согласно базе данных NCBI в геноме A. platensis обнаружено три гена Hli, которые кодируют белки длиной 47, 64 и 69 а.о. В то время как в полностью секвенированном геноме цианобактерии Synechocystis были идентифицированы четыре гена, кодирующих белки Hli: HliB, HliC, HliD. Кроме того, Hli-домен был обнаружен на С-конце фермента феррохелатазы [21, 22]. В геноме A. platensis не содержится гена белка, гомологичного белку HliB Synechocystis sp.
В ассоциации с пигмент-белковыми комплексами у А. platensis участвует Hli47 – гомолог белка HliC. Доказательство связывания других белков Hli А. platensis c пигмент-белковыми комплексами ФСI и ФСII требует дальнейших исследований. С помощью биоинформатического анализа установлено, что аминокислотная последовательность белка Hli47 обнаруживает более высокую гомологию с белками многоклеточных цианобактерий и меньшую степень гомологии с аминокислотной последовательностью Hli белков одноклеточных цианобактерий.
Проведенное сравнение состава белков Hli у одноклеточной цианобактерии Synechocystis и многоклеточной экстремофильной цианобактерии A. platensis, содержащей длинноволновые формы хлорофилла [8], показало различия в содержании белков Hli в составе пигмент-белковых комплексов фотосистем. Не исключено, что различия в составе белков Hli одноклеточной и многоклеточной цианобактерий отражают особенности механизма фотозащиты этих цианобактерий.
Изучение механизмов фотопротекции у разных видов цианобактерий позволяет расширить знания о фотозащитных функциях односпиральных светоиндуцируемых белков Hli. Эти исследования открывают новые возможности селекции устойчивых к избыточному освещению и высокоурожайных сортов и гибридов, фотосинтетический аппарат которых позволит эффективнее использовать абсорбированную световую энергию. Механизм функционирования стрессовых белков может быть использован также при создании систем искусственного фотосинтеза.
Работа частично поддержана Российским фондом фундаментальных исследований (грант № 190400798).
Список литературы
Khetkorn W., Rastogi R.P., Incharoensakdi A., Lindblad P., Madamwar D., Pandey A. // Bioresour. Technol. 2017. V. 243. P. 1194–1206.
Babele P.K., Kumar J., Chaturvedi V. // Frontiers in Microbiology. 2019. V. 10. Art. 1315. https://doi.org/10.3389/fmicb.2019.01315
Jensen P.E., Leister D. // F1000Prime Rep. 2014. V. 6. Art. 40. https://doi.org/10.12703/P6-40
Tibiletti T., Rehman A.U., Vass I. // Photosynth. Res. 2018. V. 135. P. 103–114.
Komenda J., Sobotka R. // Biochim. Biophys. Acta. 2016. V. 1857. P. 288–295.
Акулинкина Д.В., Болычевцева Ю.В., Еланская И.В., Карапетян Н.В., Юрина Н.П. // Биохимия. 2015. Т. 80. № 10. С. 1522–1531.
Шарапова Л.С., Акулинкина Д.В., Болычевцева Ю.В., Еланская И.В., Юрина Н.П. // Прикл. биохимия и микробиология. 2019. Т. 55. № 1. С. 69–76.
Карапетян Н.В., Болычевцева Ю.В., Юрина Н.П., Терехова И.В., Шубин В.В. // Биохимия. 2014. Т. 79. № 3. С. 283–292.
Lichtenthaler H.K. // Methods in Enzymology. 1987. V. 148. P. 350–382.
Schagger H., von Jagow G. // Anal. Biochem. 1991. V. 199. P. 223–231.
Fujisawa T., Narikawa R., Okamoto S., Ehira S., Yoshimura H., Suzuki I. et al. // DNA Res. 2010. V. 17. P. 85–103.
Nowicka-Krawczyk P., Mühlsteinová R., Hauer T. // Scientific Reports. 2019. V. 9. Art. 694. https://doi.org/10.1038/s41598-018-36831-0
Shukla M.K., Llansola-Portoles M.J., Tichy M., Pascal A.A., Bruno R., Sobotka R. // Photosynthesis Research. 2017. V. 137. P. 29–39.
Yang J., Yan R., Roy A., Xu D., Poisson J., Zhang Y. // Nature Methods. 2015. V. 12. P. 7–8.
Roy A., Kucukural A., Zhang Y. // Nature Protocols. 2010. V. 5. P. 725–738.
Zhang Y. // BMC Bioinformatics. 2008. V. 9. P. 40. https://doi.org/10.1186/1471-2105-9-40
Ruban A.V. // Plant Physiology. 2016. V. 170. P. 1903–1916.
Fan M., Li M., Liu Z., Cao P., Pan X., Zhang H., Zhao X., Zhang J., Chang W. // Nat. Struct. Mol. Biol. 2015. V. 22. P. 729–735.
Kopf M., Klahn S., Scholz I., Matthiessen J.K., Hess W.R., Voss B. // DNA Res. 2014. V. 21. P. 527–539.
Staleva H., Komenda J., Shukla M.K., Šlouf V., Kaňa R., Polívka T., Sobotka R. // Nat. Chem. Biol. 2015. V. 11. P. 287–291.
Kaneko T., Sato S., Kotani H., Tanaka A., Asamizu E., Nakamura Y. et al. // DNA Res. 1996. V. 3. P. 109–136.
Funk C., Vermaas W. // Biochemistry. 1999. V. 38. P. 9397–9404.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


