Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 536-548
Оксид азота в метаболизме грибов (обзор)
С. Ю. Филиппович 1, *, Г. П. Бачурина 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: syf55@yandex.ru
Поступила в редакцию 01.06.2021
После доработки 21.06.2021
Принята к публикации 02.07.2021
Аннотация
В обзоре суммированы последние данные об идентификации и синтезе оксида азота у грибов, а также механизмах действия NO у этих организмов, которые включают S-нитрозилирование и нитрование остатков аминокислот, инициирование разрывов ДНК, транскрипционную активацию генов и цГМФ-зависимый сигнальный путь. Особое внимание уделено NO-зависимой регуляции таких процессов как апоптоз и различные стрессовые ответы, прорастание спор, рост мицелия и дифференцировка грибов.
Оксид азота – соединение, которое легко диффундирует через клеточные мембраны и обладает высокой реакционной способностью. Время полужизни молекулы внутри клеток составляет от 3 до 30 с в зависимости от начальной концентрации, а затем в присутствии воды и кислорода она превращается в нитрат и нитрит. Регулирующий эффект NO реализуется, прежде всего, в непосредственной близости от места его происхождения. Действие NO может изменяться в зависимости от концентрации – при низких концентрациях (несколько микромолей/кг ткани) соединение функционирует как сигнальная молекула, в более высоких концентрациях действует как защитный агент или токсический продукт окислительного метаболизма.
NO является медиатором, регулирующим целый ряд физиологических процессов у организмов, принадлежащих к разным таксономическим группам. У человека и животных NO участвует в функционировании и образовании кровеносных сосудов, гормональной регуляции, работе иммунной системы и нейротрансмиссии [1, 2]. У высших растений NO влияет на прорастание семян, созревание плодов, работу устьиц, развитие корневой системы, цветение, защиту от патогенов и апоптоз [3]. У бактерий NO участвует в регуляции денитрификации, вирулентности, подвижности, а также в образовании биопленок, восстановлении повреждений, вызванных УФ-радиацией, поглощении железа и адаптации к окислительному стрессу [4, 5]. Гораздо меньше изучена роль NO в метаболизме грибов, но в последнее время число публикаций, посвященных этой теме, возросло [6–8].
ИДЕНТИФИКАЦИЯ NO У ГРИБОВ
Образование NO в митохондриях [9] или клетках [10] дрожжей можно исследовать методами амперометрии, с использованием NO-чувствительного электрода Кларка, однако этот метод не получил широкого распространения для других грибов.
Для идентификации и функциональной оценки эндогенного оксида азота в клетках грибов применяют методы с использованием различных флуоресцентных индикаторов – 4-амино-5-метиламино-2',7'-дифлуоресцеин диацетата (DAF-FM DA) [11–16] и диаминородамина (DAR-4M) [17]. Флуоресцентный краситель DAF-FM очень чувствителен к NO (предел обнаружения – 3 нМ), а DAF-FM DA способен пассивно диффундировать через клеточные мембраны и, проникнув в клетку, превращается эстеразами в DAF-FM [18].
Эффект, наблюдаемый после добавления доноров оксида азота, а также ингибиторов NO-синтазы млекопитающих и скавенджеров NO, является показателем синтеза оксида азота в клетках грибов [11–13, 19–22]. В качестве соединений, генерирующих оксид азота в растворах (доноров NO), используют молсидомин [23], нитропруссид натрия (SNP) [12, 20, 21, 24–26], S-нитрозо-N-ацетилпенициламин (SNAP) [25], S-нитрозоцистеин (SNC) [27], S-нитрозо-N-ацетилцистеин (SNAC) [27], S-нитрозоглутатион (GSNO) [27–29], диэтилентриамин (DETA) [30], 2,2-(гидроксинитрозогидразино)-бисэтанамин [31] и диэтилентриамин-NO-ат [32]. При низких значениях рН донором NO может служить нитрит натрия, при этом нитрозирующим агентом является протонированная азотистая кислота (pKa 3.4) [27]:
NO доноры – гетерогенная группа молекул, способная выделять NO или его производные, такие как нитроксильный анион или катион нитрозония. Учитывая тот факт, что многие NO доноры в определенных концентрациях нетоксичны для клеток млекопитающих, в последнее время для борьбы с микотоксинами и токсикогенными грибами внимание исследователей привлекли наноматериалы, выделяющие это соединение [33]. Применение оксида азота в комбинации с наночастицами повышает стабильность, улучшает адресную доставку и контролируемое и долгосрочное высвобождение NO [34].
Для ингибирования NO-синтазной активности, ответственной за реакцию взаимодействия кислорода и L-аргинина с образованием оксида азота и L-цитруллина, у грибов применяют нитро-L-аргинин [11, 21, 29], метил-L-аргинин ацетат (L-NMMA) [11], аминогуанидин [20, 36], метиловый эфир N-нитро-L-аргинина (L-NAME) [10, 12, 20, 35], L-N6-(1-иминоэтил)-лизин (L-NIL) [35], 1-[2-(трифтор-метил)фенил]имидазол (TRIM) [13]. Скавенджерами NO могут служить оксигемоглобин Fe(II) [27] и 2-(4-карбоксифенил)-4,4,5,5-тетраметилимидазолин-1-оксил-3-оксид (cPTIO) [16, 36, 37].
УЧАСТИЕ NO В ФИЗИОЛОГИЧЕСКИХ И БИОХИМИЧЕСКИХ ПРОЦЕССАХ У ГРИБОВ
Апоптоз и стресс. Избыточное количество оксида азота может привести к повреждению клеток и вызвать апоптоз. Получены свидетельства об участии NO в апоптозе, индуцированном пероксидом водорода, у дрожжей Saccharomyces cerevisiae [10, 38]. Для этого же гриба показано, что NO в низких концентрациях оказывает цитопротекторный эффект при стрессе, вызванным повышением температуры или гидростатического давления [39]. В условиях гипоксии митохондрии S. cerevisiae способны к NO2-зависимому синтезу NO при участии флавогемоглобина YHb и цитохром-с-оксидазы [9], причем изоформы последнего фермента по-разному влияют на продукцию NO в зависимости от концентрации кислорода [40]. Получены также данные, свидетельствующие о синтезе NO из Arg в клетках этих дрожжей в ответ на тепловой стресс [41].
NO способен защитить клетки шампиньона двуспорового Agaricus bisporus от окислительного стресса [31]. Обработка донором NO, 2,2-(гидроксинитрозогидразино)-бисэтанамином, уменьшала окислительное повреждение в собранных плодовых телах. При этом NO снижает содержание супероксид-радикала и H2O2, ингибирует полифенолоксидазу и активирует такие антиокислительные ферменты как каталаза, супероксиддисмутаза и аскорбатпероксидаза.
При тепловом стрессе оксид азота эффективно уменьшает окислительное повреждение в мицелии вешенки степной Pleurotus eryngii var. tuoliensis [14] и Trichoderma harzianum LTR-2 [37]. Обнаружено также при данном виде стресса увеличение экспрессии генов, кодирующих белки теплового шока, у Ganoderma oregonense [42].
Таблица 1.
Участие оксида азота в физиологических процессах у грибов
| Гриб | Процесс, чувствительный к NO | Ссылка |
|---|---|---|
| Saccharomyces cerevisiae | H2O2-индуцированный апоптоз, гипоксия в митохондриях, стресс | [10], [9], [40], [39], [28] |
| Agaricus bisporus | Окислительный, тепловой, нитрозативный стресс | [31] |
| Pleurotus eryngii var. tuoliensis | [14] | |
| Botrytis cinerea | [30] | |
| Trichoderma harzianum LTR-2 | [37] | |
| Ganoderma oregonense | [42] | |
| Pleurotus eryngii | Толерантность к кадмию | [44] |
| Ganoderma lucidum | [45] | |
| S. cerevisiae | Толерантность к меди | [43] |
| Candida tropicales | Образование псевдомицелия | [23] |
| Взаимодействие между различными видами грибов | Генерация NO клетками базидиомицета в ответ на обработку элиситором из аскомицета | [36] |
| NO-индукция биосинтеза стирилпирона | [81] | |
| Aspergillus nidulans | Выживание и прорастание спор, рост мицелия | [22] |
| Candida albicans | [25] | |
| Aspergillus fumigates | [27] | |
| Colletotrichum coccoides | [11] | |
| Aspergillus niger, Monilinia fructicola, Penicillium italicum | [46] | |
| Penicillium expansum | [26], [74] | |
| Magnaporthe oryzae | [17] | |
| Puccinia striiformis | [47] | |
| Westend f. sp. tritici | ||
| Phycomyces blakesleanus | Дифференцировка | [19] |
| Flammulina velutipes | [20] | |
| Coniothyrium minitans | [12], [21] | |
| Botrytis cinerea | [30] | |
| Aspergillus nidulans | [22], [32], [51], [53] | |
| Blastocladiella emersonii | [13] | |
| Neurospora crassa | [24], [52], [29], [35], [16] | |
| Schizosaccharomyces pombe | [75] |
NO может служить регулятором метаболизма металлов у грибов, причем его действие зависит от концентрации соединения. NO в низких концентрациях защищает клетки S. cerevisiae от токсичности ионов Cu2+, однако при обработке высокими концентрациями NO наблюдали противоположный эффект [43]. При этом происходило изменение активности Cu-зависимого фактора транскрипции Ace1, что может свидетельствовать об участии оксида азота в метаболизме Cu у этого гриба. При добавлении NO к мицелию P. eryngii, обработанному высокими концентрациями Cd2+, отмечено увеличение биомассы [44]. На основании анализа секвенирования РНК установлено, что увеличение толерантности к кадмию обусловлено активацией ряда оксидоредуктаз, дегидрогеназ, трансфераз и транскрипционных факторов в присутствии экзогенного NO. Защитный эффект оксида азота от токсичного Cd2+ выявлен также у трутовика лакированного Ganoderma lucidum [45]. В мицелии этого гриба под действием кадмия образуются H2O2 и ${\text{O}}_{2}^{ - },$ а также запускается перекисное окисление липидов. Однако обработка 100 мM SNP (донор NO) предотвращает эти процессы и активирует пероксидазу и каталазу.
Показано, что в условиях нитрозативного стресса, вызванного присутствием NO, выделяющегося при обработке клеток DETA паразита-некротрофа Botrytis cinerea, основной системой детоксикации NO служит флавогемоглобин BCFHG1 [30]. Флавогемоглобины являются NO-оксидоредуктазами, известными также как NO-диоксигеназы (КФ 1.14.12.17). Эти ферменты катализируют превращение NO в ${\text{NO}}_{3}^{ - }$ в присутствии НАДФH, ФАД и O2.
Взаимодействие грибов. Оксид азота может быть вовлечен в механизм взаимодействия различных видов грибов. Показано, что в ответ на обработку элиситором, выделенного из аскомицета Alternaria alternate, в клетках базидиомицета Inonotus obliquus происходит генерация NO [36]. Очевидно, оксид азота является медиатором элиситора, приводящего к активации фенилаланин-аммиак-лиазы и увеличению биосинтеза антиоксидантных полифенолов у чаги скошенной I. obliquus. Авторы предположили, что при взаимодействии этих грибов NO участвует в сигнальном пути, независимом от действия оксилипинов.
Прорастание спор и рост мицелия. NO подавляет образование псевдомицелия у дрожжей Candida tropicalis [23].
В диплоидных клетках аспергилла гнездового Aspergillus nidulans NO, образованный донором SNP, способен ингибировать рост мицелия при концентрациях SNP от 40 до 320 μM. Процесс сопровождался индукцией митотического кроссинговера [22].
При рН 4.5 обработка 2 мМ нитритом в течение 24 ч уменьшает прорастание спор патогенного гриба Aspergillus fumigatus на 23%, а при увеличении концентрации до 5 мМ через 16 ч наблюдается гибель 100% спор [27]. Нитрозо-производные глутатиона, SNC, SNAP и SNAC также губительны для этих спор, но в меньшей степени. В противоположность этому GSNO не обладал фунгицидным действием, а наоборот, стимулировал прорастание спор.
Фунгицидную активность газообразного NO сравнили в опытах in vitro с патогенными грибами, развивающимися на растениях после сбора урожая. Обработке подвергали такие грибы как Aspergillus niger, Monilinia fructicola (возбудитель бурой гнили косточковых плодов) и Penicillium italicum (поражает плоды цитрусовых) [46]. Кратковременная обработка оксидом азота (50–500 мкл/л) ингибировала прорастание спор и рост мицелия, что позволило предложить NO в качестве природного фунгицида при хранении фруктов и овощей. Сходные результаты получены для Penicillium expansum, другого патогенного гриба, также поражающего фруктовые плоды [26]. Оксид азота, выделяющийся при действии 6 мМ SNP, ингибировал рост мицелия. Авторы обнаружили, что экзогенный NO в высоких концентрациях индуцирует образование активных форм кислорода (АФК), которые способны вызвать окислительное повреждение белков, необходимых для прорастания спор этих грибов. Вместе с тем, при индукции внутриклеточного синтеза NO у S. cerevisiae, вызванного добавлением синтетического фунгицидного гесапептида PAF26, аккумуляции АФК не наблюдалось [15]. В присутствии ингибитора NO-синтазы, L-NAME, происходило частичное восстановление роста дрожжей, обработанных PAF26.
В опытах in vitro NO, образованный донорами SNP и SNAP, активировал прорастание, но уменьшал жизнеспособность бластоконидий у Candida albicans [25], причем действие NO на споры было более заметным при кислых, чем при щелочных рН. Примечательно, что бластоконидии оказались более чувствительными к действию NO, чем гифы мицелия.
АФК и NO координированно регулируют прорастание спор и последующий рост зародышевых трубок ржавчинного гриба, Puccinia striiformis Westend f. sp. tritici [47]. По-видимому, в контроле прорастания трубок NO действует только совместно с АФК, так как повышение или снижение уровня одного из компонентов оказывает негативное влияние на процесс, тогда как накопление высокого уровня и NO, и АФК обеспечивало нормальный рост гриба. Очевидно, что для регулирования прорастания необходим определенный баланс NO и АФК. При достижении этого баланса как NO, так и АФК предпочтительно локализуются в порах и апексе растущих зародышевых трубок и влияют на их полярный рост.
Обработка аскомицета Trichophyton rubrum интенсивным импульсным светом с длиной волны 420 нм приводила к увеличению уровня NO в клетках и ингибированию их роста по сравнению с контролем in vitro [48].
Аккумуляция NO выявлена на всех стадиях прорастания конидий Colletotrichum coccoides, вызывающего антракноз у томатов [11]. Вместе с тем, добавление экзогенного NO ингибировало прорастание спор этого гриба, а обработка ингибиторами нитро-L-аргинином и L-NMMA в разной степени ускоряла процесс, указывая на регуляторную роль NO в прорастании спор.
Применение флуоресцентного красителя DAR-4M и NO-скавенджеров позволило выявить синтез NO при прорастании и на ранних стадиях развития Magnaporthe oryzae, аскомицета, вызывающего гниль риса [17]. Вместе с тем, делеция ряда генов, кодирующих ферменты, потенциально ответственные за синтез этого соединения, не сказывается на генерации NO. Флуоресцентные сигналы, обнаруженные после действия DAF-FM DA, также свидетельствовали о возможности вовлечения NO в процесс прорастания спор и созревания аппрессориев у этого гриба [49].
Обработка Fusarium oxysporum f. sp. fragariae донором NO SNP приводила к дозо-зависимому уменьшению прорастания конидий и увеличению скорости роста мицелия [50]. Регуляция роста мицелия оксидом азота сопровождалась изменением образования супероксид аниона.
Дифференцировка грибов. В литературе приводятся данные о действии NO как сигнальной молекулы, контролирующей дифференцировку грибов, принадлежащих к различным таксономическим группам.
NO при участии L-Arg и cGMP влияет на конидиогенез митоспорового гриба Coniothyrium minitans [12, 21], паразитирующего на склероциях грибов – нитроаргинин ингибирует образование пикнидий, а добавление SNP приводит к образованию спор у дефицитного по конидиогенезу мутанта. Наибольшая концентрация NO выявлена в мицелии на стадии инициации пикнидий (72 ч постинокуляции).
Майер с соавт. [19] изучили действие SNP – донора NO, и L-NAME – ингибитора NO-синтазной активности, на образование спорангиофоров у зигомицета Phycomyces blakesleeanus. Указанные соединения действовали противоположным образом на формирование микро- и макроспорангиофоров: под действием SNP отмечено увеличение числа макроструктур и уменьшение числа микроструктур, а в присутствии L-NAME выявлена обратная зависимость, причем процесс был гораздо сильнее выражен при макроспорангиогенезе.
Корейские исследователи обнаружили стимуляцию образования плодовых тел в присутствии SNP у базидиомицета Flammulina velutipes и подавление процесса при добавлении L-NAME и аминогуанидина [20].
Виера с соавт. [13], используя флуоресцентный индикатор DAF-FM DA, выявили образование ∙NO при споруляции водного хитридиомицета Blastocladiella emersonii. Если обработку клеток флуоресцентным детектором проводили в присутствии NO-синтазного ингибитора L-NAME, то интенсивность зеленого флуоресцентного сигнала резко снижалась. Применение количественного хемилюминесцентного анализа подтвердило, что при индукции образования подвижных зооспор происходило увеличение внутриклеточных продуктов, являющихся производными NO, почти в 3 раза.
В работе Пенгкита с соавт. [16] для идентификации и функциональной оценки эндогенного NO у аскомицета Neurospora crassa также был использован метод с этим же флуоресцентным индикатором. Степень флуоресценции, показывающая уровень внутриклеточного содержания оксида азота, сильно возрастала в гифах мицелия при росте в погруженной культуре, а также в конидиофорах при конидиогенезе в поверхностной культуре. Авторы также показали, что обработка мицелия NO-скавенджером, сPTIO, приводила к резкому уменьшению уровня транскрипции генов con-10 и con-13, экспрессия которых возрастает при конидиогенезе. Авторы предположили, что оксид азота образуется внутри молодых растущих гиф и участвует в формировании конидий.
Под действием NO, генерированного донором SNP, происходило уменьшение образования конидий у аскомицета A. nidulans [22]. Позднее было показано, что у этого гриба синтез эндогенного NO возрастал на ранних стадиях дифференцировки, при переходе от вегетативного роста к конидиогенезу и добавление экзогенного NO служило индуктором этого перехода [51]. Уровень NO определял баланс между бесполым и половым циклами A. nidulans – искусственное повышение концентрации NO приводило к уменьшению конидиогенеза и индукции образования плодовых тел, клейстотециев, содержащих аскоспоры [32, 51].
Грибы могут обладать разной чувствительностью к NO в зависимости от стадии дифференцировки. Так, обработка клеток Bacillus cinerea [30] экзогенным NO, образованным донором DETA, приводит к изменению экспрессии гена, ответственного за синтез флавогемоглобина в мицелии и спорах. Установлено, что данный белок участвует в детоксикации NO, превращая активный NO радикал в нитрат. При обработке NO максимальная экспрессия гена, кодирующего этот белок, отмечена в прорастающих конидиях B. cinerea, но отсутствовала в растущем и активно ветвящемся мицелии.
В связи с тем, что свет является важным регуляторным фактором целого ряда жизненных циклов грибов, особый интерес представляет изучение роли оксида азота в трансдукции фотосигнала у P. blakesleeanus [19], F. velutipes [20], N. crassa [16, 24, 52] и A. nidulans [53].
Синий свет ингибирует образование микроспорангиофоров, но стимулирует формирование макроспорангиофоров у P. blakesleeanus [19]. Донор NO SNP способен замещать эффект активирующего действия света при макроспорангиогенезе, а ингибиторы NO-синтазной реакции подавлять его. Вместе с тем, свет индуцирует образование цитруллина из аргинина в наиболее важных для развития фазах роста – логарифмической фазе роста мицелия и при созревании макроспорангиофоров. Ингибирование биосинтеза тетрагидробиоптерина BH4, кофактора NO-синтазы (NOS), приводило к ингибированию фотоморфогенеза. При дифференцировке поверхностной культуры P. blakesleeanus значения удельной активности фермента в экстрактах мицелия и скорость образования NO в клетках гриба, измеренная хемилюминесцентной детекторной системой, были сходны и составляли от 1 до 10 пмоль ∙ мин–1 ∙ мг белка–1. Характерно, что образование цитруллина и эмиссия NO стимулировались светом и ингибировались при росте гриба на среде с 2,4-диамино-6-гидроксипиримидином, ингибитором биосинтеза BH4. Авторы предположили, что NOS участвует в передаче светового сигнала при формировании спорангиев.
Перед образованием плодовых тел в освещенном мицелии опенка зимнего F. velutipes NO-синтазная активность возрастала в 72 раза [20], тем не менее оценить вклад действия света в этот процесс сложно, так как авторы не исследовали темновые контроли и, кроме того, одновременно с освещением культур изменили температурный режим с 18 до 10°С.
Результаты, полученные при действии SNP, экзогенного донора NO и специфических ингибиторов NOS, позволили предположить, что NO ингибирует светостимулируемое образование конидий у аскомицета N. сrassa [24]. Наряду с этим, авторы, измерив превращение 3H-L-аргинина в 3H-L-цитруллин, выявили наличие NO-синтазной активности в клетках гриба. Следует отметить, что роль оксида азота в фотопроцессах N. сrassa можно оценить по присутствию конечных продуктов распада NO, нитрата и нитрита, в мицелии и среде культивирования, используя определенные мутанты гриба [29, 52]. Клетки дикого типа N. сrassa и других высших грибов обладают высокой активностью нитратредуктаз (НР) и нитритредуктаз (НиР), что позволяет им утилизировать нитрат и нитрит. В связи с этим измерение выхода этих ионов из клеток дикого типа невозможно, однако трудности можно избежать, используя мутанты, лишенные данных ферментов. Так, при использовании nit-6 штамма N. сrassa, в котором отсутствует НиР, но осуществляется каталитическое превращение нитрата в нитрит, выход ${\text{NO}}_{2}^{ - }$ можно рассматривать как показатель суммарного содержания ${\text{NO}}_{3}^{ - }$ и ${\text{NO}}_{2}^{ - }$ вне клетки. Анализ динамики выхода ионов нитрита из мицелия в ходе фотоиндуцированного каротиногенеза [52] и фотостимулируемого конидиогенеза [29] nit-6 штамма N. сrassa свидетельствовал о возможном участии NO-генерирующего механизма в трансдукции фотосигнала гриба. Введение в среду культивирования донора оксида азота, GSNO, ингибировало, а ингибитора NOS, нитро-L-аргинина, стимулировало фотоконидиогенез N. сrassa, что указывает на участие NO в данном процессе. Вместе с тем, отсутствие выхода ${\text{NO}}_{2}^{ - }$ из мицелия этого же штамма в ходе светозависимого развития протоперитециев, предшественников женских половых структур, свидетельствует о малой вероятности вовлечения NO в половой процесс гриба. Таким образом, в зависимости от природы трех светорегулируемых процессов (индукция каротиногенеза, стимуляция бесполого или полового циклов) роль NO-генерирующего механизма в трансдукции фотосигнала N. crassa может отличаться. Вместе с тем, светозависимые изменения удельной активности NOS, определенные измерением превращения 3H-L-аргинина в 3H-L-цитруллин, в фотокаротиногенезе и фотоконидиогенезе N. сrassa выявлены не были [35].
Действие света на A. nidulans в присутствии кислорода инициирует образование бесполых спор, а темновые условия и гипоксия приводят к образованию половых структур. Недавно у данного гриба выявлена светорегулируемая индукция образования NO [53]. Уровень NO возрастал при освещении мицелия, культивируемого на нитрате или Arg, и уменьшался в темноте. Свет активирует 2 гена, связанных с регуляцией уровня NO, – fhbB, кодирующий флавогемоглобин, и agaA, кодирующий аргиназу, контролирующую уровень внутриклеточного аргинина. Флавогемоглобин превращает NO в безопасный нитрат, а Arg может служить субстратом для NOS. Для светозависимой индукции указанных генов необходимо функционирование гена фитохрома fphA, а ген lreA действует как репрессор в присутствии Arg в среде. При дифференцировке гриба концентрация внутриклеточного Arg возрастает, причем более заметно при индукции полового развития, чем бесполого. Аргининовый метаболизм и свет контролируют уровень конидиогенеза. Делеция fhbB приводит к частичной потере световой регуляции конидиогенеза на среде с Arg или нитратом, в то время как делеция fhbA влияет на световую регуляцию только на среде с нитратом. Авторы предположили, что нитрат-регулируемый fhbA и свето-регулируемый fhbB необходимы для корректной световой регуляции конидиогенеза A. nidulans.
СИНТЕЗ NO В КЛЕТКАХ ГРИБОВ
Вопрос о природе генерации NO у грибов в значительной степени остается открытым. Синтез NO может осуществляться неэнзиматически и энзиматически. Неэнзиматически образование NO происходит из ${\text{NO}}_{2}^{ - }$ при низких значениях рН.
Известно, что у млекопитающих основным ферментом синтеза NO является NO-синтаза (КФ 1.14.13.396), представленная 3 формами, нейрональной (nNOS), индуцибельной (iNOS) и эндотелиальной (eNOS), кодируемыми разными генами [54]. Естественно, что по аналогии с млекопитающими наиболее вероятным претендентом на роль фермента, ответственного за синтез оксида азота у грибов, считался именно этот фермент. Однако вопрос о существовании NO-синтазной активности в клетках грибов до сих пор является дискуссионным. Оказалось, что типичные полноценные гены, кодирующие NOS млекопитающих, в геноме большинства грибов, как и у высших растений, отсутствуют. В связи с этим для обозначения энзима, осуществляющего функции NOS у этих организмов, иногда даже используется термин NO-синтазоподобная (NOS-like) активность. Вместе с тем, у некоторых из них активность фермента определяется изотопным методом, по превращению 3H- или 14C-L-аргинина в 3H- или 14C-L-цитруллин. Среди таких грибов – N. crassa [24, 35], F. velutipes [20], P. blakesleeanus [19], S. cerevisiae [10, 39], B. emersonii [13] и C. minitans [21].
Показано, что подобно ферменту млекопитающих, NOS F. velutipes использует в качестве кофакторов НАДФН, ФАД, ФМН и BH4, но в отличие от него, не нуждается в ионах Ca2+ и кальмодулине [20]. KM и Vmax для данного фермента составляют 3.3 × 10–5 M и 2.4 × 10–4 μмоль/мин/мг белка соответственно, энзим ингибируется нитро-L-аргинином и аминогуанидином с величинами Ki 2.9 × 10–4 и 3.3 × 10–4 M соответственно. Авторы предполагают, что при действии этих ингибиторов, благодаря их низкому сродству к ферменту, происходит лишь задержка образования плодовых тел, но не полное ингибирование процесса. NOS F. velutipes представлена димером с молекулярной массой 100 кДа и имеет активность >500 пмоль/мин/мг белка (плодовые тела).
Активность NOS возрастает после обработки клеток дрожжей S. cerevisiae пероксидом водорода [10]. Кроме того, при этом наблюдается 2-кратное увеличение внутриклеточной концентрации L-Arg, что может быть определяющим фактором для синтеза NO при Н2О2-индуцированном апоптозе.
NO-синтазная активность выявляется в ходе споруляции хитридиомицета B. emersonii [13], достигая максимума через 150 мин после начала процесса и снижаясь при добавлении ингибиторов фермента, L-NAME и TRIM. Фермент является Ca2+-зависимым, обнаруживая в этом сходство с nNOS формой фермента млекопитающих.
Активность NOS гриба-паразита C. minitans достигала максимального уровня 20 пмоль/мин/мг белка на ранней стадии формирования пикнидий (72 ч постинокуляции) [21]. Это время совпадало с максимумом образования NO в клетках.
Данные о существовании различных форм NOS грибов, аналогичных формам, обнаруженным для фермента животных, немногочисленны. NO-синтазная активность аскомицета N. crassa по ряду свойств (чувствительность к ионам кальция, действие специфических ингибиторов фермента, Вестерн-блот анализ) сходна с iNOS формой фермента млекопитающих [35]. В работе использовали поликлональные антитела против iNOS изоформы фермента млекопитающих, иммуногеном для которых был С-концевой пептид, содержащий 14 аминокислот iNOS, полученный из макрофагов мыши. Молекулярная масса фермента составляет около 130 кДа, что близко к таковой для iNOS животных [55]. Использование моноклональных антител против nNOS позволило обнаружить конститутивную форму фермента с молекулярной массой 60 кДа у дрожжей S. cerevisiae [56, 57]. Домитрович с соавт. [39] выявили в экспоненциальной фазе роста этого же организма экспрессию nNOS, iNOS, и eNOS с молекулярными массами 160, 130 и 132 кДа, соответственно. Индуцированная NOS у этого гриба обладает изоформной специфичностью и зависит от метаболического состояния клеток и ответа на стресс. Молекулярная масса NOS I. obliquus, определенная изоферментным методом, составила 85 кДа для конститутивной и 110 кДа для индуцибельной форм фермента [58]. Совместное культивирование базидиомицета I. obliquus и трутового гриба Phellinus morii приводило к 5-кратному увеличению активности iNOS у первого гриба с последующим резким возрастанием образования NO [58]. По мнению авторов эта форма фермента может действовать как важный регулятор, влияющий на продукцию метаболитов фенилпропаноидов во время межвидовых взаимодействий между грибами.
Как указано выше, у грибов не удалось найти полноценный ген NOS животного типа. Вместе с тем, в грибных геномах P. blakesleeanus и Magnaporthe grisea обнаружен по крайней мере один фрагмент последовательности ДНК, сходный с таковым для NOS млекопитающих [13]. Сходные участки аминокислотных NO-синтазо-подобных последовательностей обнаружены в ходе анализа in silico у грибов Aspergillus oryzae, Glomerella graminicola и Colletotricum gloeosporioides [59]. Используя этот же метод, авторы выявили консервативные аминокислотные NO-синтазо-подобные последовательности у Macrophomina phaseolina. При помощи биоинформационного анализа в геноме базидиомицета I. obliquus были выявлены гены, имеющие определенное сходство с аналогичными генами, кодирующими конститутивную и индуцибельную формы NOS млекопитающих [58]. Недавно [16] в геноме N. crassa обнаружен ряд генов, имеющих высокую степень гомологии с генами NOS у других грибов и человека. Основываясь на их свойствах, авторы предположили возможность наличия различных путей синтеза NO (зависимого и независимого от NOS) у данного гриба.
У M. oryzae делеции ряда генов биосинтеза Arg, субстрата для NOS [49], а также генов NO-синтазо-подобной активности [17] не влияли на синтез NO, что также подтверждило возможность генерации NO у грибов независимым от NOS способом.
У дрожжей S. cerevisiae Arg-зависимое образование NO опосредовано флавопротеином Tah18 [41]. При этом в ответ на действие таких стрессоров как высокая температура, высушивание и замораживание/оттаивание происходит активация генов N-ацетилтрансферазы MPR1 и пролиноксидазы PUT1, что ведет к значительному увеличению содержания Arg, являющегося субстратом NOS [41, 60]. Предполагают, что Tah18 белок гомологичен редуктазному домену NOS [61]. Установлено, что Tah18 переносит электроны от НАДФН на Fe-S кластеры Dre2 белка через ФАД и ФМН [62]. В условиях окислительного стресса Tah18-Dre2-комплекс распадается, что приводит к функциональному изменению Tah18 и электроны от НАДФН используются для синтеза NO. По-видимому, в условиях окислительного стресса Tah18-Dre2-комплекс может использоваться в качестве молекулярного переключателя для контроля синтеза NO, индуцируя апоптоз или защищая клетку дрожжей [61].
Корпас и Баррозо [63] в 2017 г. предложили для высших растений гипотезу, согласно которой L-Arg-зависимая NO-синтазо-подобная активность может быть результатом кооперативного действия нескольких различных ферментов, собранных в сложный комплекс. Предложенный механизм синтеза NO может существовать и у грибов.
Синтез NO может осуществляться не только NOS. Маркос с соавт. [51] обнаружили, что при дифференцировке A. nidulans синтез NO регулируется НР, причем ген niaD, кодирующий НР, активируется при индукции конидиогенеза даже в условиях репрессии азотом в присутствии аммония. Вместе с тем это не универсальный механизм, так как с использованием мутантов, дефицитных по НР и НиР, показано, что эти ферменты не участвуют в синтезе NO у аскомицета M. oryzae [17]. Установлено также, что НиР внутренней мембраны митохондрий грибов при участии НАДН способна восстанавливать NO2– в NO [31]. Предполагают, что митохондриальные цитохром-с-оксидаза и НиР обеспечивают образование NO в условиях гипоксии или аноксии [9, 40].
Другими возможными кандидатами, ответственными за образование оксида азота у грибов, могут быть также ксантиноксидоредуктаза [64], p450:НАДФН-P450-редуктаза [17], некоторые мембраносвязанные ферменты [64, 65] или это может быть неэнзиматический синтез [66].
ПУТИ ДЕЙСТВИЯ NO У ГРИБОВ
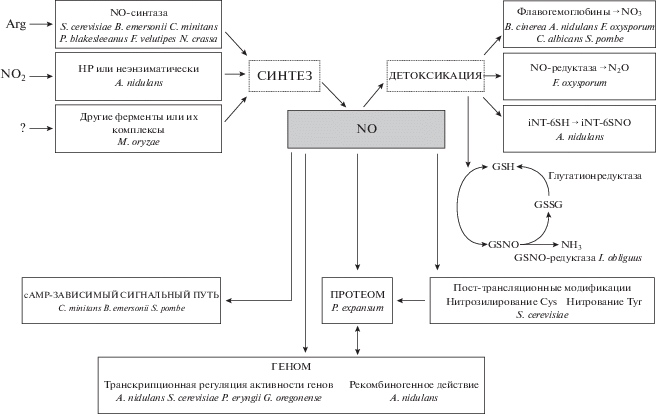
Мишени для действия NO в клетках грибов разнообразны (рис. 1).
Геном. Образующийся из оксида азота в клетке пероксинитрит представляет собой сильный окислитель, который способен повреждать ДНК. Рекомбиногенный потенциал NO на клетки A. nidulans оценивали по действию SNP, экзогенного донора NO [22]. Это соединение стимулировало возникновение разрывов ДНК в G2 периоде деления. Авторы предполагают, что изменения интенсивности конидиогенеза A. nidulans, вызванные SNP, могут быть связаны с нарушением оксидом азота транскрипционной активации структурных, специфичных для споруляции генов.
У дрожжей Kluyveromyces lactis после действия газообразного NO наблюдалось ингибирование ДНК-связывающей активности транскрипционного фактора LAC9, содержащего “цинковый палец” [67]. Поскольку NO способен вызывать S-нитрозилирование тиолов цинк-серных кластеров, что приводит к обратимому разрушению структур “цинковых пальцев”, это обеспечивает молекулярный механизм для регулирования транскрипции генов.
Обработка дрожжей S. cerevisiae GSNO, донором NO, вызывала мягкий окислительный стресс и увеличение активности антиоксидантных ферментов – супероксиддисмутазы и каталазы [28]. Предполагают, что в транскрипционной активации синтеза этих ферментов участвует Yap1p, ключевой регулятор ответа дрожжей на окислительный стресс.
Для выявления механизма действия NO, связанного с повышением толерантности P. eryngii к тяжелым металлам, Ли с соавт. [21] использовали транскрипционный анализ. Авторы обнаружили значительное увеличение экспрессии 45 генов, кодирующих оксидоредуктазы, дегидрогеназы, редуктазы, трансферазы и факторы транскрипции, в образцах, обработанных экзогенным NO, что способствовало повышению устойчивости гриба к чрезвычайно высокому уровню кадмия. Наиболее многочисленными оказались гены, кодирующие ферменты, участвующие в окислительно-восстановительных процессах, включая предположительно пиридиннуклеотид-дисульфид-оксидоредуктазы, ацил-КоА-редуктазы, альдегиддегидрогеназу, сульфитредуктазу, оксалатдекарбоксилазу и формиатдегидрогеназу.
Насуно с соавт. [68] наблюдали у дрожжей S. cerevisiae под действием экзогенного NO индукцию экспрессии Cu-регулируемых генов, находящихся под контролем транскрипционного фактора Mac1, включая ген CTR1, кодирующий высокоаффинный транспортер меди. Оказалось, что NO усиливает связывание Mac1 с промоторами генов-мишеней. Обработка оксидом азота в условиях высокотемпературного стресса приводила к возрастанию ряда параметров – транскрипции гена CTR1, внутриклеточной концентрации меди, активности Cu,Zn-супероксиддисмутазы и жизнеспособности клеток. Наряду с этим, NO не влиял на экспрессию гена MAC1, что, по мнению авторов, свидетельствует об активации Mac1 за счет NO-зависимой посттрансляционной модификации путем S-нитрозилирования и/или фосфорилирования. Вместе с тем у этих же дрожжей NO ингибировал активность Cu-регулируемого транскрипционного фактора Асе1, что приводило к ингибированию Cu-зависимой индукции гена CUP1 [69]. Предполагают, что под действием оксида азота происходит модификация связывающих металлы тиолов Ace1, уменьшающая способность фактора связывать медь.
Чен с соавт. [42] сравнили транскриптом мицелия Ganoderma oregonense, подвергнутого тепловому стрессу (32°C) и воздействию экзогенного NO, с таковым, полученным в условиях регуляции NO при нормальной температуре культивирования. В дополнение к усилению регуляции генов, кодирующих белки теплового шока (HSP), в условиях теплового стресса по сравнению с контролем, после обработки NО был выявлен ряд новых HSP – HSP 78, HSP 70, HSP 104, HSP 30 и HSP C4. Предполагают, что NO активирует HSP для защиты G. oregonense от абиотического стресса. Кроме того, тепловой стресс приводит к увеличению экспрессии генов, регулирующих активность оксидазы D-аминокислот и оксидоредуктазы.
S-Нитрозилирование и нитрование остатков аминокислот. NO-зависимые пост-трансляционные модификации могут изменять функциональную активность белков, участвующих в сигнальной трансдукции при разных физиологических и стрессовых условиях. Взаимодействие NO с белками способно приводить к S-нитрозилированию Cys остатков или нитрованию остатков Tyr. Выше уже упоминалось о том, что NO может быть использован в ответах клеток грибов на разные типы стресса. Так, на основании активации синтеза NO и S-нитрозилирования глицеральдегид-3-фосфат-дегидрогеназы, а также корреляции между уровнем внутриклеточной концентрации супероксидных анионов и образованием NO, Альмейда с соавт. [10] предположили участие NO в передаче сигнала при Н2О2-индуцированном апоптозе S. cerevisiae. Ингибирование синтеза NO при помощи L-NAME привело к уменьшению S-нитрозилирования фермента, увеличению уровня АФК и выживаемости клеток. Оксид азота, синтезированный в митохондриях этих дрожжей, участвует в передаче сигнала в других стрессовых условиях – при гипоксии, вызывая увеличение уровня экспрессии гена гипоксии CYC7, которое сопровождается возрастанием нитрования Tyr в белке [9]. Авторы обнаружили, что митохондрии дрожжей продуцируют NO при концентрации растворенного кислорода ниже 20 µМ. Процесс катализируется цитохром-с-оксидазой и является рН-зависимым. Предполагают существование механизма положительной обратной связи, при котором NO, образованный в митохондриях, индуцирует экспрессию гена COX5b, кодирующего 5b-субъединицу цитохром-с-оксидазы, увеличивающую продукцию оксида азота в условиях гипоксии [40].
Известно, что в противоположность S-нитрозилированию нитрование Tyr осуществляется не оксидом азота, а продуктом его взаимодействия с супероксидом $\left( {{\text{О}}_{{\text{2}}}^{{ \bullet - }}} \right)$ – пероксинитритом (ONOO–) [70]. Предполагают, что нитрование Tyr изменяет такие свойства аминокислоты как редокс-потенциал, объем, гидрофобность и pK(a) фенольной группы, что в свою очередь, может привести к глубоким изменениям структурных и функциональных свойств белка [71], определяя участие NO в широком спектре сигнальных и регуляторных процессов.
Использование двумерного гель-электрофореза с последующим Вестерн-блот-анализом позволило выявить нитрование цитозольных и митохондриальных белков S. cerevisiae [72]. Среди 8 белков митохондрий, подвергшихся нитрованию, 2 были идентифицированы как аконитаза и изоцитратдегидрогеназа. Позднее Канг с соавт. [73] изучили нитропротеомный профиль у этих же дрожжей и нашли изменения в состояниях нитрования 14 белков, участвующих в передаче сигнала спаривания – α-фактора. Показано, что вокруг нитрованных остатков Tyr группировались остатки таких аминокислот как Asp, Glu и His. Предполагают, что остатки Tyr нитрируются легче, когда остатки кислых аминокислот находятся в непосредственной близости, а также что конформационные изменения при нитровании приводят к тому, что остатки нитротирозина оказываются спрятанными внутри молекулы белка.
Таблица 2.
NOS грибов, выявленная изотопным методом
| Гриб | Факторы, влияющие на активность NO синтазы | Стадии развития, чувствительные к соединениям, влияющим на NO-синтазу | Ссылка |
|---|---|---|---|
| Saccharomyces cerevisiae (аскомицет) |
Концентрация H2O2 | H2O2-индуцированный апоптоз | [10] |
| Blastocladiella emersonii (хитридиомицет) | Концентрация кальция | Образование зооспор | [13] |
| Coniothurium minitans (митоспоровый гриб) | Время роста | Развитие пикнидий | [21] |
| Phycomyces blakesleeanus (зигомицет) | Синий свет (стимуляция NO синтазной активности in vivo и in vitro) | Светостимулируемое образование макроспорангиофоров (SNP заменяет свет; L-NAME ингибирует) | [19] |
| Flammulina velutipes (базидиомицет) | Свет, понижение температуры | Формирование плодовых тел (SNP стимулирует; L-NAME и аминогуанидин ингибируют) | [20] |
| Neurospora crassa (аскомицет) | Синий свет | Бесполое развитие – светостимулируемое образование конидий (SNP ингибирует; L-NAME и нитроаргинин стимулируют) | [24], [35] |
Протеом. Лай с соавт. [74] использовали протеомный подход для оценки механизма действия экзогенного NO при прорастании спор P. expansum. Методами двумерного электрофореза и масс-спектрометрии было показано, что после обработки спор NO происходило увеличение активности глутаминсинтетазы, амидогидролазы, нитрилаз, диоксигеназы оксида азота и HSP 70, а также уменьшение активности тетратрикопептидного структурного повтора, УДФ-N-ацетилглюкозамин пирофосфорилазы, энолазы, HSP 60 и K-гомологичного РНК-связывающего домена.
cGMP-зависимый сигнальный путь. NO способен изменять физиологический ответ клеток через cGMP-зависимый сигнальный путь за счет активации растворимой гуанилатциклазы [75]. Реализация данного пути обнаружена при конидиогенезе C. minitans [21] и биогенезе зооспор в водной культуре B. emersonii [13]. При дифференцировке C. minitans динамика изменения активности NOS была сходна с таковой для уровня cGMP, причем самая высокая активация наблюдалась на стадии пикнидиальной инициации [21].
При споруляции B. emersonii наряду с возрастанием уровня NO наблюдается стимуляция образования cGMP. При этом происходит активация транскрипционного профиля генов, кодирующих гуанилатциклазу и cGMP-фосфодиэстеразу [13]. У дрожжей Schizosaccharomyces pombe эффект действия потенциальных ингибиторов гуанилатциклазы и NOS свидетельствует о NO-регулируемом спорообразовании через cGMP-зависимый путь [76]. Очевидно, что cGMP действует в качестве важного внутриклеточного вторичного мессенджера в NO-опосредованном процессе образования спор у столь разных по таксономической принадлежности грибов.
Флавогемоглобины, нитрозотионеин (iNT), S-нитрозоглутатионредуктаза (GSNO-редуктаза) и NO-редуктаза. При индукции конидиогенеза у A. nidulans NO-метаболизирующие флавогемоглобины FhbA и FhbB участвуют в координированной регуляции переключения от вегетативного роста к размножению [51]. Экспрессия цитоплазматического fhbA гена и гена НР niaD возрастала в течение первых часов конидиогенеза (до 10 ч) и затем снижалась, а увеличение экспрессии fhbВ гена митохондрий наблюдалась в более поздний период развития (в интервале от 24 до 120 ч). Важно, что регуляция экспрессии первых 2 генов определяется глобальным регулятором азотного метаболизма AreA и специфичным регулятором нитратного пути NirA. Считают, что у данного гриба гомеостаз NO достигается за счет баланса его синтеза, осуществляемого НР, и распада в результате действия флавогемоглобинов. Установлено также, что индуцибельный FhbA защищает НР и НиР от повреждения высокими концентрациями NO [77].
Флавогемоглобины различных видов дрожжей: S. cerevisiae (ScYhb1), C. albicans (CaYhb1) и S. pombe (SPAC869.02c), содержат 3 консервативных фрагмента – N-концевой гемовый, ФАД-связывающий и С-концевой НАД(Ф)-связывающий домены [78]. У S. cerevisiae и S. pombe флавогемоглобины кодируются одним геном – ScYHB1 и SPAC869.02c соответственно, а у C. albicans – тремя (CaYHB1, CaYHB4 и CaYHB5), причем сходство последовательностей для первого и трех последних составляет от 31 до 25%. Предполагают, что флавогемоглобины способны защитить дрожжевые клетки как от внешних, так и внутренних источников NO и активных форм азота (АФА). Очевидно, что обнаруженные различия в составе и функционировании соединений могут быть обусловлены адаптацией к разным нишам обитания указанных видов дрожжей.
Баланс синтеза и распада NO важен для регуляции физиологических функций, так как избыток NO может вызвать нитрозативный стресс благодаря высокой реактивности NO и АФА. У A. nidulans в условиях нитрозативного стресса NO-индуцируемый 23-аминокислотный пептид нитрозотионеин (iNT) способен обезвреживать NO посредством S-нитрозилирования Cys остатков [79]. Тиоредоксин и его редуктаза денитрозировали S‑нитрозилированный пептид, снижали клеточный S-нитрозотиол и обеспечивали толерантность гриба к NO, что указывает на опосредованное пептидами каталитическое удаление NO.
GSNO рассматривают как одну из физиологических форм хранения и транспорта оксида азота в высших растениях [80]. Очевидно, такой способ депонирования и детоксикации NO существует и в грибах. При совместном культивировании I. obliquus и P. morii наблюдается аккумуляция оксида азота, который используется для обратимого S-нитрозилирования фенилаланин-аммиак-лиазы, 4-кумарат-КоА-лигазы и стирилпирон-синтазы, ферментов, участвующих в биосинтезе стирилпирона [81]. При этом в регуляции как специфичности, так и обратимости S-нитрозилирования белка у I. obliquus принимает участие GSNO-редуктаза и тиоредоксин-подобные белки.
Удаление избыточно-токсичного NO из клеток грибов также может осуществлять NO-редуктаза – фермент, катализирующий образование N2O из оксида азота [82]. Известно, что у грибов для этого используется цитохром Р-450nor, который передает электроны от НАДН без участия электрон-транспортной цепи. При нитратной диссимиляции у мутанта F. oxysporum, неспособного синтезировать NO-редуктазу и флавогемоглобин, отмечено нарушение работы дыхательной системы и ингибирование роста [83].
* * *
Основной метод, применяемый для идентификации и действия эндогенного оксида азота в клетках грибов – использование флуоресцентных индикаторов. В последнее время для оценки участия NO в различных физиологических процессах этих организмов получило широкое применение доноров и скавенджеров NO, а также ингибиторов NO-синтазы млекопитающих. Достигнуты значительные успехи в исследовании роли оксида азота в регуляции у грибов апоптоза, различных видов стресса, метаболизма металлов, мицелиального роста, прорастания спор и дифференцировки. Уровень NO способен определять баланс между бесполым и половым циклами этих организмов, причем в регуляции жизненных циклов особое значение может приобретать участие оксида азота в трансдукции фотосигнала. Это может быть важно при разработке подходов к управлению жизненными циклами промышленно-значимых грибов. Разнообразие NO-зависимых сигнальных путей, задействованных в различных биологических процессах грибов, свидетельствует о сложности механизмов, регулируемых NO. Это расширяет наши знания о проблеме регуляции оксида азота у эукариот. Среди них – участие оксида азота в S-нитрозилировании и нитровании остатков аминокислот, инициировании разрывов ДНК, транскрипционной активации определенных генов и синтезе cGMP. Несмотря на отсутствие в геноме типичных полноценных генов, кодирующих NOS млекопитающих, у ряда грибов методом, основанным на превращении 3H- или 14C-L-аргинина в 3H- или 14C-L-цитруллин, выявлен данный фермент. Представляется важным дальнейшее подробное изучение ферментов, определяющих синтез NO, у этих организмов, а также NO-метаболизирующих флавогемоглобинов и NO-редуктазы.
Работа выполнена в рамках госзадания 0104-2019-0024 для ФИЦ биотехнологии РАН.
Список литературы
Ignarro L.J., Buga G.M., Wood K.S., Byrns R.E., Chaudhuri G. // Proc. Natl. Acad. Sci. USA. 1987. V. 84. № 24. P. 9265–9269.
Tsoukias M. // Microcirculation. 2008. V. 15. № 8. P. 813–834.
Verma N., Tiwari S., Singh V.P., Prasad S.M. // Plant Growth Regul. 2020. V. 90. № 1. P. 1–13.
Филиппович С.Ю. // Биохимия. 2010. V. 75. № 10. P. 1367–1376.
Williams D.E., Boon E.M. // J. Innate Immun. 2019. V. 11. № 3. P. 205–215.
Cánovas D., Marcos J.F., Ana T., Marcos A.T., Strauss J. // Curr. Genet. 2016. V. 62. № 3. P. 513–518.
Arasimowicz-Jelonek M., Floryszak-Wieczorek J. // Front. Plant Sci. 2016. V. 4. P. 252.
Zhao Y., Lim J., Xu J., Yu J-H., Zheng W. // Mol. Microbiol. 2020. V. 113. № 5. P. 872–882.
Castello P.R., David P.S., McClure T., Crook Z., Poyton R.O. // Cell Metab. 2006. V. 87. № 4. P. 277–287.
Almeida B., Buttner S., Ohlmeier S., Silva A., Mesquita A., Sampaio-Marque, B. et al. // J. Cell Sci. 2007. V. 120. № 18. P. 3279–3288.
Wang J., Higgins V.J. // Fungal Genet. Biol. 2005. V. 42. № 4. P. 284–292.
Gong X., Fu Y., Jiang D., Li G., Yi X., Peng Y. // Fungal Genet. Biol. 2007. V. 44. № 12. P. 1368–1379.
Vieira A.L., Linares E., Augusto, O., Gomes S.L. // Fungal Genet. Biol. 2009. V. 46. № 8. P. 575–584.
Kong W.W., Huang C.Y., Chen Q., Zou Y.J., Zhang J.X. // Fungal Genet. Biol. 2012. V. 49. № 1. P. 15–20.
Carmona L., Gandía M., López-García B., Marcos J.F. // Biochem. Biophys. Res. Comm. 2012. V. 417. № 1. P. 56–61.
Pengkit A., Jeon S.S., Son S.J., Shin J.H., Baik K.Y., Choi E.H., Park G. // Sci. Rep. 2016. V. 6. article №30037. https://doi.org/10.1038/srep30037
Samalova M., Johnson J., Illes M., Kelly S., Fricker M., Gurr S. // New Phytol. 2013. V. 197. P. 207–222.
Kojima H., Urano Y., Kikuchi K., Higuchi T., Hirata Y., Nagano T. // Angew. Chem. Int. Ed. 1999. V. 38. № 21. P. 3209–3212.
Maier J., Hecker R., Rockel P., Ninnemann H. // Plant Physiol. 2001. V. 126. № 3. P. 1323–1330.
Song N.K., Jeong C.S., Choi I.S. // Mycologia. 2000. V. 92. № 6. P. 1027–1032.
Li B., Fu Y., Jiang D., Xie J., Cheng J., Li G. et al. // Appl. Environ. Microbiol. 2010. V. 76. № 9. P. 2830–2836.
Chiuchetta S.J.R., Castro-Prado M.A.A. // Genet. Mol. Biol. 2005. V. 28. № 4. P. 798–803.
Wilken M., Huchzermeyer B. // Eur. J. Cell Biol. 1999. V. 78. № 3. P. 209–213.
Ninnemann H., Maier J. // Photochem. Photobiol. 1996. V. 64. № 2. P. 393–398.
Abaitua F., Rementeria A., Millan R.S., Eguzkiza A., Rodriguez J.A., Ponton J., Sevilla M.S. // Microbiology. 1999. V. 145. № 7. P. 1641–1647.
Lai T., Li B., Qin G., Tian S. // Curr. Microbiol. 2011. V. 62. № 1. P. 229–234.
Kunert J. // Folia Microbiol. 1995. V. 40. № 3. P. 238–244.
Lushchak O.V., Lushchak V.I. // Redox Rep. 2008. V. 13. № 6. P. 283–291.
Филиппович С.Ю., Онуфриев М.В., Бачурина Г.П., Крицкий М.С. // Прикл. биохимия и микробиология. 2019. Т. 55. № 4. С. 403–409.
Turrion-Gomez J.L., Eslava A.P., Benito E.P. // Fungal Genet. Biol. 2010. V. 47. № 5. P. 484–496.
Rőszer T. // The Biology of Subcellular Nitric Oxide. New York, N.Y.: Springer & Business Media, 2012. 200 p.
Baidya S., Cary J.W., Grayburn W.S., Calvo A.M. // Appl. Environ. Microbiol. 2011. V. 77. № 15. P. 5524–5528.
Nanomycotoxicology. Treating Mycotoxins in the Nano Way. / Eds. M. Rai and K.A. Abd-Elsalam. N.Y.: Acad. Press, 2020. P. 481–501.
Hetrick E.M., Shin J.H., Paul H.S., Schoenfisch M.H. // Biomaterials. 2009. V. 30. № 14. P. 2782–2789.
Филиппович С.Ю., Онуфриев М.В., Перегуд Д.И., Бачурина Г.П., Крицкий М.С. // Прикл. биохимия и микробиология. 2020. Т. 56. № 4. С. 358–365.
Zheng W., Miao K., Zhang Y., Pan S., Zhang M., Jiang H. // Microbiology. 2009. V. 155. № 10. P. 3440–3448.
Yu Y., Yang Z., Guo K., Li Z., Zhou H., Wei Y. et al. // Curr. Microbiol. 2015. V. 70. № 4. P. 618–622.
Liu W.C., Yuan H.M., Li Y.H., Lu Y.T. // FEMS Yeast Res. 2015. V. 15. fov051. https://doi.org/10.1093/femsyr/fov051
Domitrovic T., Palhano F.L., Barja-Fidalgo C., DeFreitas M., Orlando M.T., Fernandes P.M. // FEMS Yeast Res., 2003. V. 3. № 4. P. 341–346.
Castello P.R., Woo D.K., Ball K., Wojcik J., Liu L., Poyton R.O. // Proc. Natl. Acad. Sci. USA. 2008. V. 105. № 24. P. 8203–8208.
Nishimura A., Kawahara N., Takagi H. // Biochem. Biophys. Res. Comm. 2013. V. 430. № 1. P. 137–143.
Chen C., Li Q., Wang Q., Lu D., Zhang H., Wang J., Fu R. // Sci. Rep. 2017. V. 7. article 15694. https://doi.org/10.1038/s41598-017-15340-6
Chiang K.T., Shinyashiki M., Switzer C.H., Valentine J.S., Gralla E.B., Thiele D.J., Fukuto J.M. // Archiv. Biochem. Biophys. 2000. V. 377. № 2. P. 296–303.
Li Q., Huang W., Xiong C., Zhao J. // Chemosphere. 2018. V. 201. № 6. P. 294–302.
Guo S., Yao Y., Zuo L., Shi W., Gao N., Xu H. // J. Basic Microbiol. 2016. V. 56. № 1. P. 36–43.
Lazar E.E., Wills R.B., Ho B.T., Harris A.M., Spohr L.J. // Lett. Appl. Microbiol. 2008. V. 46. № 6. P. 688–692.
Yin S., Gao Z., Wang C., Huang L., Kang Z., Zhang H. // Front. Microbiol. 2016. V. 7. P. 178.
Huang H., Huang M., Lv W., Hu Y., Wang R., Zheng X. et al. // Front. Pharmacol. 2019. V. 10. P. 1143.
Zhang Y., Shi H., Liang S., Ning G., Xu N., Lu J. et al. // Microbial Res. 2015. V. 180. P. 11–22.
Do Y.J., Kim D.H., Jo M.S., Kang D.G., Lee S.W., Kim J.-W., Hong J.K. // Korean J. Mycol. 2019. V. 47. № 3. P. 219–232.
Marcos A.T., Ramos M.S., Marcos J.F., Carmona L., Strauss J., Canovas D. // Mol. Microbiol. 2016. V. 99. № 1. P. 15–33.
Филиппович С.Ю., Бачурина Г.П., Крицкий М.С. // Прикл. биохимия и микробиология. 2007. Т. 43. № 3. С. 331–337.
Marcos A.T., Ramos M.S., Schinko T., Strauss J., Canovas D. // Fungal Genet. Biol. 2020. V. 137. Article 10337. https://doi.org/10.1016/j.fgb.2020.103337
Alderton W.K., Cooper C.E., Knowles R.G. // Biochem. J. 2001. V. 357. № 3. P. 593–615.
Hevel J.M., White K.A., Marletta M.A. // J. Biol. Chem. 1991. V. 266. № 34. P. 22789–22791.
Kuo W.N., Jn-Baptiste J.B., Kanadia R.N., McNabb L.D., Zhai L., Weeks K. et al. // Cytobios. 1996. V. 87. P. 251–263.
Kanadia R.N., Kuo W.N., Mcnabb M., Botchway A. // Biochem. Mol. Biol. Int. 1998. V. 45. № 6. P. 1081–1087.
Zhao Y., Xi Q., Xu Q., He M., Ding J., Dai Y. et al. // Appl. Microbiol. Biotechnol. 2015. V. 99. № 10. P. 4361–4372.
Sarkar T.S., Biswas P., Ghosh S.K., Ghosh S. // PloS ONE. 2014. V. 9. e107348. https://doi.org/10.1371/journal.pone.0107348
Sasano Y., Haitani Y., Hashida K., Ohtsu I., Shima J., Takagi H. // Microb. Cell Fact. 2012. V. 11. P. 11–40.
Astuti R.I., Nasuno R., Takagi H. // Appl. Microbiol. Biotechnol. 2016. V. 100. № 22. P. 9483–9497.
Netz D.J., Stümpfig M., Doré C., Mühlenhoff U., Pierik A.J., Lill R. // Nat. Chem. Biol. 2010. V. 6. № 10. P. 758–765.
Corpas F.G., Barroso J.B. // Nitric Oxide. 2017. V. 68. P. 5–6.
Gupta K.J., Fernie A.R., Kaiser W.M., van Dongen J.T. // Trends Plant Sci. 2011. V. 16. № 3. P. 160–168.
Baudouin E. // Plant Biol. 2011. V. 13. № 2. P. 233–242.
Zweier J.L., Samouilov A., Kuppusamy P. // Biochim. Biophys. Acta. 1999. V. 1411. № 2–3. P. 250–262.
Kröncke K.D., Fehsel K., Schmidt T., Zenke F.T., Dasting I., Wesener J.R. et al. // Biochem. Biophys. Res. Comm. 1994. V. 200. P. 1105–1110.
Nasuno R., Aitoku M., Manago Y., Nishimura A., Sasano Y., Takagi H. // PLoS ONE. 2014. V. 9. e113788. https://doi.org/10.1371/journal.pone.0113788
Shinyashiki M., Chiang K., Switzer C., Gralla E., Valentine J., Thiele D.J. et al. // Proc. Natl. Acad. Sci. USA. 2000. V. 97. № 6. P. 2491–2496.
Gunaydin H., Houk K.N. // Chem. Res. Toxicol. 2009. V. 22. P. 894–898.
Radi R. // Acc. Chem. Res. 2013. V. 46. № 2. P. 550–559.
Bhattacharjee A., Majumdar U., Maity D., Sarkar T.S., Goswami A.M., Sahoo R., Ghosh S. // Biochem. Biophys. Res. Comm. 2009. V. 388. № 3. P. 612–617.
Kang J.W., Lee N.Y., Cho K.C., Lee M.Y., Choi D.Y., Park S.H., Kim K.P. // Proteomics. 2015. V. 15. № 2–3. P. 580–590.
Lai T., Chen Y., Li B., Qin G., Tian S. // J. Proteom. 2014. V. 103. P. 47–56.
Friebe A., Koesling D. // Circ. Res. 2003. V. 93. № 2. P. 96–105.
Kig C., Temizkan G. // Protoplasma. 2009. V. 238. № 1–4. P. 59–66.
Schinko T., Berger H., Lee W., Gallmetzer A., Pirker K., Pachlinger R. et al. // Mol. Microbiol. 2010. V. 78. № 3. P. 720–738.
Tillmann A., Gow N.A.R., Brown A.J.P. // Biochem. Soc. Trans. 2011. V. 39. P. 219–223.
Zhou S., Narukami T., Masuo S., Shimizu M., Fujita T., Doi Y. et al. // Nat. Chem. Biol. 2013. V. 9. № 1. P. 657–663.
Shumaev K.B., Kosmachevskaya O.V., Chumikina L.V., Topunov A.F. // Nat. Prod. Commun. 2016. V. 11. P. 1189–1192.
Zhao Y., He M., Ding J., Xi Q., Loake G.J., Zheng W. // Sci. Rep. V. 6. Article 37601. https://doi.org/10.1038/srep37601
Морозкина Е.В., Кураков А.В. Прикл. биохим. и микробиология. 2007. Т. 43. № 5. С. 607–613.
Takaya N. // J. Biosci. Bioeng. 2002. V. 94. № 6. P. 506–510.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология