Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 571-582
Моделирование структуры α-субъединицы бифенил диоксигеназы штаммов рода Rhodococcus и особенности деструкции хлорированных- и гидроксилированных бифенилов при различных температурах
Д. О. Егорова 1, *, Т. И. Горбунова 2, Т. Д. Кирьянова 2, М. Г. Первова 2, Е. Г. Плотникова 1
1 Институт экологии и генетики микроорганизмов Уральского отделения Российской академии наук – филиал Пермского федерального исследовательского центра Уральского отделения Российской академии наук
614081 Пермь, Россия
2 Институт органического синтеза им. И.Я. Постовского Уральского отделения Российской академии наук
620108 Екатеринбург, Россия
* E-mail: daryao@rambler.ru
Поступила в редакцию 07.06.2021
После доработки 21.06.2021
Принята к публикации 02.07.2021
Аннотация
На основе моделирования белковой структуры α-субъединицы бифенил 2,3-диоксигеназы (BphA1) (КФ 1.14.12.18), ключевого фермента деструкции бифенила и полихлорбифенилов (ПХБ), установлено, что BphA1 Rhodococcus wratislaviensis КТ112-7(=ВКМ Ас-2623D) имела наибольший уровень сходства с классическими бифенилдиоксигеназами (БДО) штаммов-деструкторов ПХБ рода Rhodococcus, структура BphA1 Rhodococcus wratislaviensis CH628 – с нафталин диоксигеназой штаммов рода Rhodococcus. Структура BphA1 Rhodococcus ruber P25(=ИЭГМ 896) была уникальной, так как не было выявлено белковых молекул с высоким уровнем сходства. Показано, что все исследуемые штаммы, несмотря на различия в строении BphA1, осуществляли диоксигенирование незамещенного цикла в молекулах 3,4-дихлорбифенила (ПХБ 12) монохлорированных и моногидрокси-монохлорированных бифенилов (смесь Р). Уровень деструкции ПХБ 12 и смеси Р составил 95.4–100% при 30°С за 10 сут при начальной концентрации 0.1 г/л. Установлено, что изменение температуры (10–50°С) оказывало наибольшее влияние на активность штамма R. ruber P25 (снижение в 3.1–3.9 раза). Штаммы R. wratislaviensis CH628 и R. wratislaviensis КТ112-7 эффективно разлагали ПХБ 12 в пределах 20–40 и 10–30°С соответственно, при уровне деструкции 93.2–100%.
Ремедиация объектов окружающей среды (грунтов, воды и воздуха) с помощью бактериальных штаммов, обладающих способностью к деградации токсикантов, является актуальной задачей современных биотехнологий. Из-за высокой сорбционной способности наиболее проблемным объектом для микробиологической очистки (восстановления) является почва [1]. В то же время, именно почвогрунт является благоприятной средой обитания бактериальных сообществ, среди которых имеются потенциальные штаммы-деструкторы, адаптированные к определенным классам загрязняющих почву веществ и материалов. Особо пристальное внимание разработчиков новых биотехнологий приковано к проблемам ремедиации природных объектов после их загрязнения стойкими органическими загрязнителями (СОЗ), основную часть которых составляют соединения хлорароматической природы (http://www.pops.int). Наибольший вклад в эту группу хлораренов вносят полихлорбифенилы (ПХБ), значительная доля которых (около 40% от всех произведенных ПХБ) аккумулирована в окружающей среде из-за неправильного обращения с этими материалами [2]. Установленная высокая токсичность ПХБ и их опасность для сложившихся биот подкрепляется длительными периодами полураспада этих хлоаренов, достигающих в случае высокохлорированных соединений нескольких десятков лет [3].
Находясь в природных объектах, ПХБ в зависимости от климатических условий могут подвергаться различным окислительным процессам, трансформируясь в первичные продукты окисления – гидроксипроизводные (ПХБ-ОН) [4]. Соединения ПХБ-ОН, обладая более высокой гидрофильностью по сравнению с исходными ПХБ, являются и более доступными для микробов: бактерий, грибов. Но даже самые развитые биотехнологические методы и подходы не могут дать однозначных схем превращений всех ПХБ, попавших в природу, и предположить четкие направления бактериальной деструкции ПХБ и ПХБ-ОН по причине сложного состава технических ПХБ. Таким образом, для более глубокого понимания процессов трансформации ПХБ в окружающей среде, необходимы комплексные исследования, сочетающие методы химической модификации ПХБ в ПХБ-ОН и микробной деструкции данных соединений.
Первичная атака молекулы ПХБ и ПХБ-ОН путем внедрения в молекулу двух гидроксильных групп осуществляется ферментом бифенил-2,3-диоксигеназой (BphA, БДО, КФ 1.14.12.18) [5]. BphA входит в семейство гидроксилирующих диоксигеназ и состоит из трех α- больших (BphA1) и трех β- малых (BphA2) субъединиц, ферредоксина (BphA3) и ферредоксин-оксидо-редуктазы (BphA4). За распознавание конгенеров ПХБ и связывание с ними отвечает α-субъединица бифенил 2,3-диоксигеназы [6]. В связи с этим особый интерес при изучении возможности разложения ПХБ и ПХБ-ОН аэробными бактериями представляет структура α-субъединицы данного фермента у активных штаммов-деструкторов.
Восстановление территорий, загрязненных ПХБ, осложняется нестабильными температурными условиями в течение вегетационного сезона. Известно, что выход температуры окружающей среды за рамки оптимального диапазона культивирования бактериальных штаммов негативно сказывается на их биодеградативном потенциале [8]. Разложение ПХБ осуществляется психрофильными, мезофильными и термофильными штаммами [8–12]. Температура, при которых описанные штаммы проявляли окислительную активность по отношению ПХБ, составляет 4–60°С. Однако, наиболее высокие показатели отмечены при температурах близких к 30°С [8–11]. Сведения о разложении ПХБ в неоптимальных условиях ограничены.
Цель работы – моделирование первичной, вторичной и третичной структуры α-субъединицы бифенил диоксигеназы штаммов Rhodococcus ruber P25, Rhodococcus wratislaviensis CH628 и Rhodococcus wratislaviensis КТ112-7, а также анализ их способности к деструкции 3,4-дихлорбифенила и его химически модифицированных производных при различных температурах.
МЕТОДИКА
Бактериальные штаммы и условия культивирования. Штаммы рода Rhodococcus, использованные в настоящем исследовании, выделены ранее из почв на территории России, загрязненных хлорароматическими соединениями. Штамм Rhodococcus ruber P25 выделен из почв в г. Пермь (Россия), депонирован в Коллекции алканотрофных микроорганизмов ИЭГМ УрО РАН (=ИЭГМ 896) [13, 14], Rhodococcus wratislaviensis CH628 – из почв г. Чапаевска (Россия) [15, 16], Rhodococcus wratislaviensis КТ112-7 – из почв г. Березники (Россия), депонирован во Всероссийской коллекции микроорганизмов (=ВКМ Ас-2623D) [17, 18]. Культивирование штаммов проводили в минеральной среде К1 [19] с внесением бифенила в качестве источника углерода (конечная концентрация 0.5 г/л). Оптимальную температуру и пределы сохранения жизнеспособности штаммов определяли при культивировании в диапазоне температур 4–60°С [13].
Ресурсы для моделирования структуры BphA1. Нуклеотидную последовательность α-субъединицы бифенил 2,3-диоксигеназы штаммов R. wratislaviensis KT112-7 и R. wratislaviensis CH628 получили при анализе результатов полногеномного секвенирования и депонировали в международную базу данных GenBank под номерами MW070531 и MW070532, соответственно. Для штамма R. ruber P25 использована нуклеотидная последовательность гена bphA1, депонированная ранее в GenBank под номером КР985699.1 [20]. Первичную, вторичную и третичную структуру α-субъединицы БДО моделировали на основе нуклеотидной последовательности гена bphA1 с применением известных моделей ферментов класса диоксигеназ с использованием программ MEGA X (https://www.megasoftware.net), SwissDock (https://www.swissdock.ch), SwissModel (https://www.swissmodel.expasy.org), UCSF CHIMERA (https://www.cgl.ucsf.edu/chimera/ download.html).
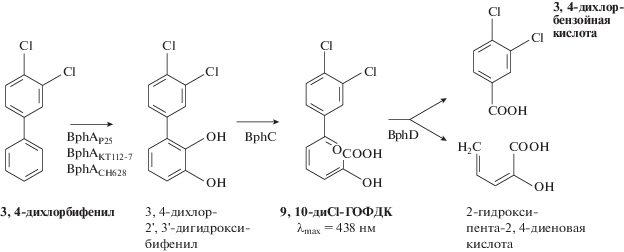
Синтез ПХБ 12. Для исследования использовали 3,4-дихлорбифенил (ПХБ 12). Синтез осуществляли по реакции Гомберга–Бахмана–Хея в присутствии изо-амилнитрита [21] из бензола и 3,4-дихлоранилина. Все реагенты квалификации х. ч. (ЗАО “НПО Экрос”, АО “Вектон”, Россия). Для применения в микробиологических экспериментах полученный 3,4-дихлорбифенил очищали от остальных компонентов реакционной смеси путем перегонки в вакууме.
Синтез производных ПХБ 12 (смесь Р). В колбу, снабженную магнитной мешалкой, обратным холодильником и капельной воронкой, вносили 3.36 г (0.06 моль) KOH и 25 мл (25.55 г, 0.42 моль) 2-аминоэтанола. Содержимое колбы нагревали при интенсивном перемешивании до образования мелкодисперсной суспензии. Затем вносили 0.22 г (0.01 моль) ПХБ 12 и кипятили реакционную массу при перемешивании (~170°C) в течение 17 ч. По окончания массу охлаждали до комнатной температуры, вносили разбавленную соляную кислоту до рН 1–2 и экстрагировали толуолом (2 × 10 мл). Толуольный экстракт сушили CaCl2 и анализировали методом ГХ-МС. Каждое взаимодействие проводили 3 раза. Для микробиологических исследований толуольный экстракт упаривали на воздухе, остаток высушивали под вакуумом (5 мм рт. ст., tкомн) до постоянной массы [22]. Получали смесь Р – смесь двух изомеров моногидрокси-монохлорбифенилов (98.42%), остальное – 3- и 4‑монохлорбифенилы с суммарным содержанием (1.68%). Все реагенты были квалификации х. ч.
Идентификация и анализ ПХБ 12 и компонентов смеси Р. Анализ и идентификацию осуществляли на газовом хромато-масс-спектрометре “Agilent GC 7890A MS 5975C Inert XLEI/CI” (“Agilent Technologies”, США) с кварцевой капиллярной колонкой HP-5MS (полидиметилсилоксан, 5 мас. % фенильных групп) длиной 30 м, диаметром 0.25 мм, толщиной пленки 0.25 мкм и квадрупольным масс-спектрометрическим детектором. Температура колонки: начальная – 40°С (выдержка 3 мин), программирование со скоростью 10 град./мин до 290°С (выдержка 30 мин), температура испарителя – 250°С, температура источника – 230°С, квадруполя – 150°С, переходной камеры – 280°С, газ-носитель – гелий, 1.0 мл/мин. Сканирование в режиме электронной ионизации (70 эВ) по полному ионному току в диапазоне масс 20–1000 Да.
Биодеструкция ПХБ 12 и смеси Р. Для изучения биодеградации ПХБ 12 и смеси Р бактериальные культуры (ОП600 = 1.5, 1 мл), предварительно выращенные в минеральной среде К1 с добавлением 1 г/л бифенила в качестве источника углерода до середины экспоненциальной фазы, были помещены в стеклянные флаконы (“Sigma-Aldrich”, Германия) объемом 4 мл, закрытые тефлоновыми крышками. В каждый флакон вносили 0.1 г/л ПХБ 12 или смеси Р и инкубировали на круговом шейкере Environmental Shaker-Incubator ES-20/60 (“BioSan”, Латвия) при 120 об./мин в течение 14 сут. Температура культивирования 10, 20, 30, 40 и 50°С. Образцы для анализа отбирали на 0, 1, 3, 7, 10 и 14 сут инкубации. Процесс деструкции останавливали замораживанием. Бактериальный рост контролировали в незамороженных образцах по изменению оптической плотности культуры при 600 нм на спектрофотометре UV-Visible BioSpec-mini (“Shimadzu”, Япония).
Определение содержания ПХБ 12 и смеси Р при биодеструкции. Во флаконы, содержащие 1 мл бактериальной культуры и ПХБ 12 или смесь Р после биодеструкции, добавляли 0.1 мл 35%-ной соляной кислоты и 0.5 мл гексана. Для лучшего разделения органической и водной фаз флаконы помещали в центрифугу Sigma 3-16P (“Sigma”, Германия) и центрифугировали содержимое флакона в течение 5 мин при скорости 9168 g. Далее проводили анализ органического слоя в условиях ГХ-ПИД.
Количественную оценку ПХБ и/или ПХБ-ОН проводили на газовом хроматографе “Shimadzu GC 2010” (“Shimadzu”, Япония) с пламенно-ионизационным детектором и кварцевой капиллярной колонкой ZB-5 (длина 30 м, диаметр 0.25 мм), толщина пленки неподвижной фазы составляла 0.25 мкм. Начальная температура колонки составляла 40°С (3 мин) с последующим повышением температуры 10°/мин до конечной температуры 280°С (изотерма 15 мин). Температура испарителя 250°С, детектора – 300°С.
Расчет содержания оставшихся после биодеструкции ПХБ или ПХБ-ОН в каждом исследуемом образце проводили методом внутренней нормализации, рассчитывая вклад отдельных соединений в суммарную площадь пиков. На основании полученных расчетных площадей пиков оценивали содержание исходных ПХБ или ПХБ-ОН после процесса биодеградации.
Каждый образец был проанализирован не менее четырех раз на газовом хроматографе, среднеквадратическое отклонение составило не более 3%.
Анализ метаболитов. Метаболиты изучали в образцах, отобранных на 0, 1, 3, 7, 10 и 14 сут эксперимента по биодеградации. Содержимое каждого стеклянного флакона центрифугировали на миницентрифуге MiniSpin (“Eppendorf”, Германия) 10 мин при 13201 g. Для анализа использовали надосадочную жидкость. В качестве стандартов применяли бензойную кислоту (БК), моно- (3-, 4-) и ди- (3,4-) хлорбензойные кислоты (ХБК), 2‑гидрокси-3-хлор- и 2-гидрокси-4-хлорбензойные кислоты (“Sigma-Aldrich”, Германия).
Присутствие метаболитов в среде культивирования регистрировали методом ВЭЖХ при использовании хроматографа “LC-20AD Prominance” (“Shimadzu”, Япония) с колонкой С-18 150 × 4.6 мм (“Sigma-Aldrich”, США) и УФ-детектором “SPD-20A” (“Shimadzu”, Япония) в системе ацетонитрил – 0.1%-ная Н3РО4 (60 : 40 об./об.). Идентификацию продуктов метаболизма проводили методом сравнения времени удерживания на колонке образовавшихся и стандартных соединений [23].
Установлено, что БК регистрируется при длине волны λ = 205 нм с временем удерживания τ – 4.8 мин, 3-ХБК, 4-ХБК и 3,4-диХБК – при длине волны λ = 232 нм в диапазоне времен удерживания 5–8 мин, а моно(хлоргидрокси)бензойные кислоты – при λ = 205 нм и τ = 10–15 мин.
Образование (хлор/гидрокси)-2-гидроксо-6-оксо-(хлорфенил)гекса-2,4-диеновых кислот (ГОФДК) определяли на спектрофотометре UV‑Visible BioSpec-mini (“Shimadzu”, Япония) при λmax от 390 до 450 нм [23].
Анализ эффективности биодеструкции. Эффективность деструкции оценивали, определяя уровень деструкции субстрата (%, 1), удельную скорость (сут–1, 2), а также кинетические параметры деструкции путем вычисления уравнения первого приближения зависимости концентрации ПХБ 12 и смеси Р от времени инкубации (3) с учетом коэффициента достоверности аппроксимации (R2):
(1)
${\text{Д }}\left( \% \right) = 100--({{({{С}_{{\text{t}}}} \times {\text{ }}100)} \mathord{\left/ {\vphantom {{({{С}_{{\text{t}}}} \times {\text{ }}100)} {{{C}_{0}}}}} \right. \kern-0em} {{{C}_{0}}}}),$(2)
$\mu = {{({\text{Ln}}{{{\text{С}}}_{0}}--{\text{Ln}}{{{\text{C}}}_{{\text{i}}}})} \mathord{\left/ {\vphantom {{({\text{Ln}}{{{\text{С}}}_{0}}--{\text{Ln}}{{{\text{C}}}_{{\text{i}}}})} {\Delta t}}} \right. \kern-0em} {\Delta t}},$Статистический анализ данных. Все эксперименты проводили не менее чем в трехкратной повторности. Анализ количественных показателей проводили с использованием пакетов программ MS Office и CAKE (https://www.tessella.com/showcase/computer-assisted-kinetic-evaluation).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
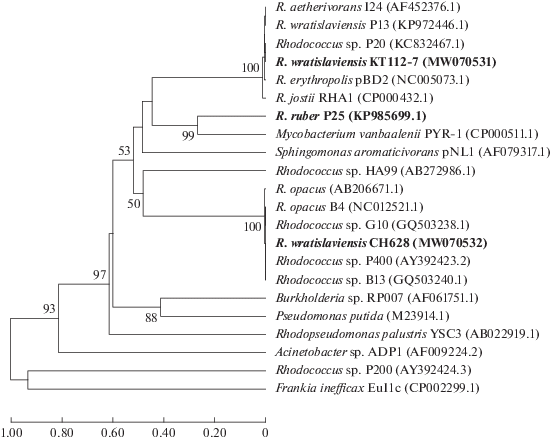
Характеристика α-субъединицы бифенил 2,3-диоксигеназы. Для моделирования структуры α-субъединицы БДО штаммов-деструкторов ПХБ R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 были использованы нуклеотидные последовательности генов bphA1КТ112-7 (GenBank MW070531), bphA1СН628 (GenBank MW070532) и bphA1Р25 (GenBank KP985699.1). Филогенетический анализ генов bphA1КТ112-7, bphA1СН628 и bphA1Р25 показал, что они принадлежат различным семействам диоксигеназ (рис. 1). В результате дедуктивной трансляции и сравнения с гомологичными аминокислотными последовательностями, представленными в базе данных GenBank, установлено, что BphA1КТ112-7 на 99.64% идентична таковой фермента семейства бифенил-диоксигеназ (КФ 1.14.12.18) штамма-деструктора ПХБ Rhodococcus aetherivorans I24 (GenBank AAL61663.2) и находится в группе классических БДО. Дедуктивная аминокислотная последовательность BphA1СН628 на 100% сходна с первичной структурой α-субъединицы нафталиндиоксигеназы (КФ 1.14.12.12) штамма-деструктора Rhodococcus opacus B4 (GenBank BAH47212.1) и располагается в “ветви” нафталиновых диоксигеназ. Как было показано ранее, BphA1Р25 показывает наибольший уровень сходства с ферментами группы фенил-пропионат диоксигеназ (КФ 1.14.12.– ) [20].
Рис. 1.
Дерево сходства генов α-субъединиц гидроксилирующих диоксигеназ ароматических соединений, построенное с использованием метода UPGMA. Достоверность ветвления оценивали на основании “bootstrap”-анализа 1000 альтернативных деревьев. Дерево построено на основании выравнивания последовательностей исследуемых генов и ранее опубликованных в GenBank. На дереве представлены названия штаммов и номера нуклеотидных последовательностей в GenBank (исследуемые в настоящей работе выделены полужирным шрифтом).
Анализ вторичной структуры показал, что соотношение α-спиралей и β-тяжей в α-субъединицах БДО штаммов R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 составило 1 : 0.89, 1 : 1.06 и 1 : 1.38 соответственно (табл. 1). Таким образом, у штаммов СН628 и Р25 большая часть аминокислотной последовательности BphA1 формирует β-тяжи.
Таблица 1.
Вторичная структура α-субъединицы бифенил диоксигеназы
| α-спирали | № аминокислотного остатка в первичной структуре | β-тяжи | № аминокислотного остатка в первичной структуре | ||||
|---|---|---|---|---|---|---|---|
| КТ112-7 | СН628 | Р25 | КТ112-7 | СН628 | Р25 | ||
| α 1 | 3–9 | 4–16 | 61–64 | β 1 | 41–45 | 47–51 | 5–9 |
| α 2 | 19–22 | 25–27 | 100–115 | β 2 | 54–60 | 60–66 | 15–19 |
| α 3 | 25–36 | 31–40 | 137–141 | β 3 | 63–69 | 69–75 | 81–85 |
| α 4 | 46–48 | 52–54 | 146–150 | β 4 | 75–79 | 81–85 | 88–92 |
| α 5 | 121–124 | 127–140 | 153–159 | β 5 | 94–96 | 100–102 | 129–133 |
| α 6 | 130–132 | 166–180 | 197–201 | β 6 | 139–143 | 105–107 | 177–179 |
| α 7 | 158–173 | 203–212 | 205–210 | β 7 | 146–150 | 114–116 | 186–190 |
| α 8 | 195–204 | 215–220 | 215–220 | β 8 | 180–182 | 147–151 | 231–234 |
| α 9 | 215–221 | 222–227 | β 9 | 187–192 | 154–158 | 238–241 | |
| α 10 | 228–230 | 236–238 | β 10 | 237–241 | 187–189 | 246–252 | |
| α 11 | 257–272 | 246–248 | β 11 | 248–252 | 185–199 | 258–263 | |
| α 12 | 274–284 | 265–267 | β 12 | 297–300 | 240–244 | ||
| α 13 | 287–291 | 270–279 | β 13 | 304–307 | 250–254 | ||
| α 14 | 338–351 | 282–288 | β 14 | 312–318 | 293–298 | ||
| α 15 | 359–374 | 348–359 | β 15 | 324–333 | 302–309 | ||
| α 16 | 377–379 | 368–375 | β 16 | 402–405 | 318–330 | ||
| α 17 | 410–423 | β 17 | 333–343 | ||||
| α 18 | 428–434 | ||||||
В результате 3D-моделирования установлены третичные структуры BphA1КТ112-7, BphA1СН628 и BphA1Р25 (рис. 2). Анализ параметров показал, что наиболее достоверная модель (93–99%) α-субъединицы БДО получена для BphA1 штамма R. wratislaviensis KT112-7 (табл. 2). При этом наиболее близкой моделью третичной структуры BphA1КТ112-7 является таковая БДО штамма Rhodococcus jostii RHA1 [24]. Для BphA1СН628 также удалось получить модель третичной структуры с высокими показателями достоверности (91–92%). Наиболее близкой является модель α-субъединицы нафталиндиоксигеназы штамма Rhodococcus sp. NCIMB12038 (табл. 2) [25]. В то же время создание модели третичной структуры BphA1Р25 было сопряжено с проблемой поиска наиболее близкой третичной структуры фермента семейства диоксигеназ. Анализ баз данных показал, что из описанных моделей максимальный уровень сходства выявляется при сравнении BphA1Р25 с α-субъединицей толуол-2,3-диоксигеназы штамма Pseudomonas putida F1 (табл. 2) [26]. Уровень достоверности полученной третичной структуры BphA1Р25 составил 35–77% при анализе различных параметров. Полученные результаты подтверждают уникальность строения α-субъединицы бифенил-2,3-диоксигеназы штамма R. ruber P25.
Рис. 2.
Третичная структура α-субъединицы бифенил 2,3-диоксигеназы штаммов R. wratislaviensis CH628 (a), R. ruber P25 (б) и R. wratislaviensis KT112-7 (в). Модели построены на основании анализа дедуктивных аминокислотных последовательностей исследуемых ферментов, имеющихся в базах данных с использованием алгоритма программы UCSF CHIMERA. При окрашивании моделей использован режим “rainbow”, при котором окрашивание модели происходит от N-конца цепи до С-конца от синего через радужный спектр до красного с выделением цветом каждого элемента вторичной структуры.
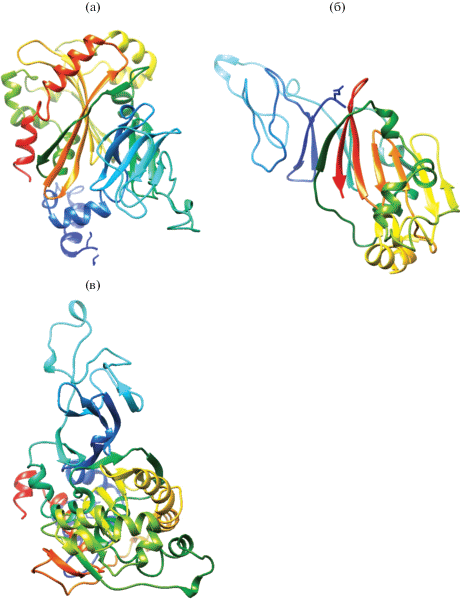
Таблица 2.
Параметры модели третичной структуры α-субъединицы бифенил 2,3-диоксигеназы
| Параметр | R. wratislaviensis КТ112-7 | R. wratislaviensis СН628 | R. ruber Р25 |
|---|---|---|---|
| Площадь поверхности субъединицы, Å2 | 17.84 × 103 | 17.39 × 103 | 15.20 × 103 |
| Объем субъединицы, Å3 | 55.63 × 103 | 48.20 × 103 | 32.40 × 103 |
| Наиболее близкий по третичной структуре фермент | BphA1, бифенил 2,3-диоксигеназа (КФ 1.14.12.18) |
NDO-R_A, нафталин 1,2-диоксигеназа (КФ 1.14.12.12) | TDO-F, толуол 2,3-диоксигеназа (КФ 1.14.12.11) |
| Бактериальный штамм с близким ферментом | Rhodococcus jostii RHA1 [25] | Rhodococcus sp. NCIMB12038 [26] | Pseudomonas putida F1 [27] |
| Уровень сходства, % | 98.65 | 93.72 | 44.79 |
| Точность третичной структуры | 0.93 | 0.91 | 0.77 |
| Оценка качества третичной структуры | –0.06 | –0.35 | –2.63 |
| Оценка качества четвертичной структуры | 0.76 | 0.82 | 0.75 |
Анализ деструкции ПХБ 12 штаммами R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25. Для изучения особенностей деструкции хлорированных бифенилов штаммами R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25, БДО которых существенно различались, была исследована их активность по отношению к ПХБ 12, в молекуле которого атомы хлора находятся у 3 и 4 атомов углерода в одном ароматическом кольце. Синтез ПХБ 12 был осуществлен по стандартной методике путем конденсации 3,4-дихлоранилина с бензолом в присутствии изо-амилнитрита (рис. 3) [21]. Выход целевого продукта ПХБ 12 достигал 10%. Для дальнейших микробиологических исследований ПХБ 12 был очищен от компонентов реакционной смеси до концентрации 98.03%.
Анализ данных, полученных по биотрансформации ПХБ 12, показал, что штаммы КТ112-7 и СН628 осуществляли его полное разложение за 7 сут, а штамм Р25 – за 10 сут культивирования при 30°С. При этом основным метаболитом является 3,4-диХБК (рис. 4). Известно, что термофильный штамм Bacillus sp. JF8 разлагал ПХБ 12 также через стадию образования 3,4-диХБК [12]. Помимо хлорбензойной кислоты в среде культивирования всех исследуемых штаммов идентифицирована ГОФДК с длиной волны максимального поглощения 438 нм (ОП = 0.120–0.264 о.е.), что свидетельствовало о расположении атомов хлора в фенольной части молекулы, при этом один из заместителей находится у 9 углеродного атома [27]. Известно, что низкохлорированные конгенеры ПХБ (количество атомов хлора ≤3) в присутствии аэробных микроорганизмов преимущественно подвергаются окислительной деградации под действием ферментов класса диоксигеназ с образованием катехолподобных соединений [5]. Очевидно, что для БДО исследуемых штаммов наиболее удобным структурным фрагментом молекулы ПХБ 12 для атаки двух атомов кислорода из активированной под действием диоксигеназы молекулы кислорода является стерически свободный, незамещенный ароматический цикл (рис. 5). Окисление ПХБ 12 протекало через стадию дигидроксилирования с образованием 3,4-дихлор-2',3'-дигидроксибифенила. Далее следует стандартный для аэробных бактерий мета-распад нехлорированного цикла, и образуется замещенная пентадиеновая кислота (9,10-диCl-ГОФДК). В результате последующего ферментативного расщепления 9,10-диCl-ГОФДК образуются пентадиеновая и 3,4-дихлорбензойная кислоты (рис. 5) [28].
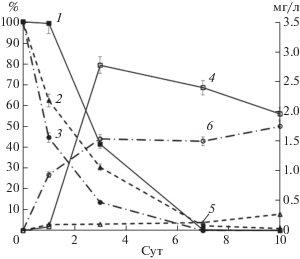
Рис. 4.
Деструкция 3,4-дихлорбифенила (%) и образование основного метаболита – 3,4-дихлорбензойной кислоты (мг/л) при 30°С: 1, 4 – R. wratislaviensis KT112-7, 2, 5 – R. ruber P25, 3, 6 – R. wratislaviensis CH628.
Возможный альтернативный вариант – взаимодействие атомов кислорода под действием БДО по хлорированному циклу – является менее выгодным из-за стерических препятствий. В результате окисления хлорированного кольца ПХБ 12 образовавшиеся аналоги дихлор-дигидроксибифенила будут характеризоваться расположением всех заместителей в одном ароматическом кольце, а при мета-распаде – все заместители будут располагаться в диеноатной части ГОФДК. Последующее гидролитическое расщепление такой молекулы приведет к образованию дихлорпентадиеновой кислоты и БК. Однако в настоящем исследовании БК не была выявлена среди метаболитов, образующихся при разложении ПХБ 12 штаммами R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25.
Таким образом, накопление в среде 3,4-диХБК (рис. 4), но не БК, подтверждает высказанное предположение, что БДО исследуемых штаммов осуществляют окисление незамещенного кольца ПХБ 12.
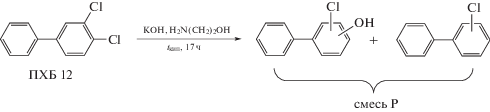
Биодеструкция смеси Р, полученной при гидроксилировании ПХБ 12. Синтез ПХБ-ОН на основе ПХБ 12 проводили путем взаимодействия конгенера ПХБ со щелочью в среде 2-аминоэтанола (рис. 6) по методике, описанной ранее [22].
По результатам ГХ-МС анализа установлено, что в условиях реакции протекало образование смеси продуктов (смесь Р). В составе смеси Р преобладали целевые продукты – моногидрокси-монохлорированные бифенилы. Наиболее вероятно, что ПХБ-ОН были представлены 3-гидрокси-4-хлорбифенилом и 4-гидрокси-3-хлорбифенилом при условии ипсо-атаки гидрокси-группы по связи CAr–Cl конгенера ПХБ 12. На долю целевых продуктов (ПХБ-ОН) приходилось 98.42% от всех компонентов смеси Р. Характерной особенностью результатов химического синтеза было образование в условиях реакции более низкохлорированных конгенеров ПХБ наряду с формированием изомерных ПХБ-ОН. Полученные результаты свидетельствовали о том, что в составе смеси Р присутствовали 3‑хлорбифенил и 4-хлорбифенил (1.68% от всех компонентов смеси). Как было показано, образование более низкохлорированных ПХБ связано с протеканием in situ конкурирующей реакции гидродехлорирования, как результата межмолекулярных взаимодействий всех участвующих реагентов [22].
Время трансформации смеси Р штаммами R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 при условиях, аналогичных биодеструкции ПХБ 12, увеличивалось (рис. 7). Штаммы R. wratislaviensis KT112-7 и R. wratislaviensis CH628 осуществляли 100%-ное разложение смеси за 10 сут, тогда как уровень деструкции смеси Р штаммом R. ruber P25 за аналогичный период составлял 95.4%. Снижение биодеградативной активности может быть обусловлено токсическим эффектом, который оказывают на бактериальные клетки гидроксилированные монохлорбифенилы. Согласно данным [29] концентрация 4‑гидрокси-3-хлорбифенила, при которой наблюдалось 50%‑ное падение бактериальной люминесценции составляло 1.15 мг/л, а для 3-гидрокси-4-хлорбифенила данный показатель составлял 6.34 мг/л, что в 7–39 раз меньше, чем аналогичный показатель для негидроксилированных хлорбифенилов. Уровень цитотоксичности 100 мг/л 4-гидрокси-3-хлорбифенила, исследованный на специально подготовленных бактериальных клетках, составлял 33.1 ± 5.5% [30].
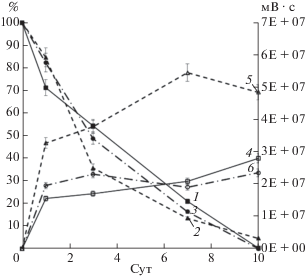
Рис. 7.
Деструкция (%) смеси Р и образование замещенных бензойных кислот (мВ · с) при 30°С: 1, 4 – R. wratislaviensis KT112-7, 2, 5 – R. ruber P25, 3, 6 – R. wratislaviensis CH628.
Следует отметить, что удельная скорость деструкции смеси Р, по сравнению с аналогичным показателем для штаммов R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 ПХБ12, снизилась в 1.2–1.4 раза (табл. 3, 4 ). Так как основную часть смеси Р составляют гидроксихлорбифенилы, то снижение скорости деструкции исследуемой смеси по сравнению с аналогичным показателем при разложении ПХБ 12, вероятно, обусловлено токсичностью компонентов смеси.
Методом ВЭЖХ при биодеструкции смеси Р в культуральной среде всех трех штаммов были зафиксированы 3-ХБК, 4-ХБК и моногидрокси-монохлорбензойные кислоты, но не обнаруживалась БК (рис. 7). Известно, что основным метаболитом при разложении 4-гидрокси-3-хлорбифенила штаммом Sphingomonas sp. N-9 является 4-гидрокси-3-хлорбензойная кислота [30]. Спектрофотометрические исследования показали, что при разложении смеси Р отмечалось присутствие нескольких ГОФДК с максимальной длиной волны поглощения при 436 и 418 нм (ОП436 = 0.112–0.134 о.е., ОП418 = 0.254–0.351 о.е. соответственно). Известно, что λмакс = 436 нм характерна для 9Cl-ГОФДК, образующейся при окислении и последующем расщеплении незамещенного цикла молекулы 3-хлорбифенила [27]. Полученные данные позволяют предположить, что БДО штаммов R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 осуществляли окисление компонентов смеси Р (т.е. монохлорбифенилов и моногидрокси-монохлорбифенилов) аналогично ПХБ 12 по незамещенному циклу молекулы (рис. 5, 6).
Таким образом, различия в строении BphA1КТ112-7, BphA1СН628 и BphA1Р25 не оказывали влияния на механизм разложения моно- и дихлорбифенилов, а также моногидрокси-монохлорбифенилов, содержащих заместители в одном кольце молекулы.
Биодеструкция ПХБ 12 и смеси Р при различных температурах. В естественных условиях бактериальные штаммы испытывают существенные перепады температуры окружающей среды. Эффективность биодеструкции зависит от активности штаммов по отношению к ПХБ и их производным в зависимости от температуры. Установлено, что штаммы R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 являются мезофилами, растут в диапазоне температур 7–45°C, с оптимумом для роста при 20–37°C [13]. Деструктивную активность по отношению к ПХБ 12 и смеси Р штаммы проявляли при 10–50°C (табл. 3, 4 ). Максимальные показатели деструкции отмечены при 30°C. Отклонение температуры в меньшую или большую стороны снижало способности у штамма R. ruber P25 к деструкции как ПХБ 12, так и смеси Р. В то же время, снижение температуры до 10°C не приводило к потере активности штамма R. wratislaviensis KT112-7 в отношении ПХБ 12 (табл. 3 ), тогда как уровень деструкции смеси Р снижался в 1.7–2.4 раза (табл. 4 ). Повышение температуры культивирования штамма R. wratislaviensis KT112-7 ингибировало процесс разложения как ПХБ 12, так и смеси Р: снижение показателей в 1.5–1.6 раза при 40°С, в 1.9–2.2 раза при 50°С. Штамм R. wratislaviensis CH628 эффективно разлагал ПХБ 12 при 20–40°С (табл. 3 ). Если субстратом являлась смесь Р, отклонение температуры культивирования от 30°С как в большую, так и в меньшую стороны приводило к существенному снижению биодеградативной активности штамма CH628 (табл. 4 ). В литературе присутствует ограниченное количество сведений о разложении ПХБ и ПХБ-ОН при высоких и низких температурах. Известно, что мезофильный штамм-деструктор ПХБ Burkholderia cepacia LB400 наиболее активно разлагал смесь ПХБ Арохлор 1242 при 37°С, снижение температуры до 7°С приводило к ингибированию процесса деструкции в 3.1 раза, а повышение температуры до 50°С – к снижению эффективности деструкции в 1.1 раза [9]. Для психрофильных штаммов Pseudomonas sp. Cam-1 и Hydrogenophaga sp. IA3-A снижение температуры культивирования с 30–37°С до 5–7°С также вызывало снижение эффективности разложения смесей ПХБ (Арохлор 1221 и Арохлор 1242) в целом, и ПХБ 12, входящего в состав Арохлор 1221, в частности [8, 9]. Микрофлора арктических почв более эффективно разлагает ПХБ 12 в составе Арохлора 1221 при 30°С (100% за 6 недель), чем при 7°С (0–50% за 8 недель) [11]. Аналогичная закономерность описана для психротолерантных антарктических штаммов Arthrobacter sp. 74, Pseudoalteromonas sp. 19 и Psychrobacter sp. 15 [10].
Таблица 3.
Кинетические параметры разложения ПХБ 12
| Штамм | Темпе-ратура, °C | Деструкция, % | Удельная скорость деструкции, сут–1 | Уравнение деструкции | R2 |
|---|---|---|---|---|---|
| КТ112-7 | 10 | 98.2 | 0.444 | y = 1.3524x2 – 21.996x + 89.36 | 0.948 |
| 20 | 99.6 | 0.543 | y = 2.411x2 – 33.301x + 104.02 | 0.897 | |
| 30 | 100 | 0.866 | y = 1.4384x 2– 25.398x + 109.11 | 0.969 | |
| 40 | 65.8 | 0.107 | y = –0.1321x2 – 4.9961x + 98.593 | 0.992 | |
| 50 | 45.7 | 0.061 | y = 0.0593x2 – 4.5872x + 97.084 | 0.883 | |
| Р25 | 10 | 27.6 | 0.023 | y = –0.2447x2 + 0.2605x + 95.723 | 0.864 |
| 20 | 60.2 | 0.088 | y = –0.1915x2 – 3.5901x + 102.12 | 0.993 | |
| 30 | 98.9 | 0.536 | y = 1.6013x2 – 24.992x + 93.244 | 0.979 | |
| 40 | 50.7 | 0.071 | y = –0.0491x2 – 5.0386x + 104.97 | 0.935 | |
| 50 | 25.4 | 0.029 | y = 0.0913x2 – 3.3287x + 99.791 | 0.955 | |
| СН628 | 10 | 83.3 | 0.172 | y = –0.7691x2 + 0.2328x + 95.089 | 0.952 |
| 20 | 99.8 | 0.597 | y = 1.387x2 – 19.13x + 75.651 | 0.615 | |
| 30 | 100 | 0.765 | y = 2.0062x2 – 28.101x + 85.845 | 0.908 | |
| 40 | 93.2 | 0.269 | y = –0.5051x2 – 3.2536x + 93.078 | 0.964 | |
| 50 | 75.9 | 0.143 | y = –0.3675x2 – 4.2201x + 101.66 | 0.994 |
Таблица 4.
Кинетические параметры разложения смеси P, полученной при гидроксилировании ПХБ 12
| Штамм | Температура, °C | Деструкция, % | Удельная скорость деструкции, сут–1 | Уравнение деструкции | R2 |
|---|---|---|---|---|---|
| КТ112-7 | 10 | 59.4 | 0.091 | y = 0.8622x2 – 14.116x + 97.83 | 0.969 |
| 20 | 41.4 | 0.053 | y = 2.411x 2– 33.901 + 104.02 | 0.897 | |
| 30 | 99.6 | 0.552 | y = 0.5647x2 – 14.823x + 93.715 | 0.981 | |
| 40 | 61.2 | 0.095 | y = –0.2598x2 – 3.5541x + 101.73 | 0.968 | |
| 50 | 52.1 | 0.074 | y = 0.039x2 – 5.8553x + 100.82 | 0.976 | |
| Р25 | 10 | 47.8 | 0.065 | y = –0.9218x2 + 5.104x + 96.347 | 0.922 |
| 20 | 52.2 | 0.074 | y = –0.4391x2 – 1.5687x + 99.368 | 0.999 | |
| 30 | 95.4 | 0.308 | y = 1.3376x2 – 22.74x + 100.68 | 0.979 | |
| 40 | 35.3 | 0.044 | y = 0.3753x2 – 7.1846x + 99.995 | 0.976 | |
| 50 | 31.4 | 0.038 | y = 0.5504x2 – 8.2418x + 98.04 | 0.915 | |
| СН628 | 10 | 8.2 | 0.009 | y = 1.5772x2 – 20.967x + 76.694 | 0.651 |
| 20 | 84.3 | 0.185 | y = 1.6625x2 – 26.437x + 99.956 | 0.993 | |
| 30 | 100 | 0.691 | y = 0.833x2 – 18.107x + 99.023 | 0.996 | |
| 40 | 63.4 | 0.101 | y = 0.2574x2 – 8.0068x + 94.368 | 0.925 | |
| 50 | 45.8 | 0.061 | y = –0.5727x2 – 0.404x + 115.04 | 0.732 |
Таким образом в результате проведенных исследований установлено, что α-субъединицы бифенил 2,3-диоксигеназы штаммов R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 имеют существенные различия в нуклеотидных и аминокислотных последовательностях. Впервые для BphA1КТ112-7, BphA1СН628 и BphA1Р25 созданы модели третичной структуры белковой молекулы, подтвердившие принадлежность данных ферментов к различным подсемействам диоксигеназ и указавшим на уникальность строения BphA1Р25. Установлено, что штаммы R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 эффективно разлагают ПХБ 12 и смесь монохлорбифенилов и моногидрокси-монохлорбифенилов (смесь Р), полученную при химической модификации ПХБ 12. Бифенил диоксигеназы всех трех штаммов осуществляют окисление незамещенного цикла в молекулах ПХБ 12 и компонентах смеси Р. Впервые показано, что штаммы рода Rhodococcus осуществляют биодеструкцию хлорированных и гидроксилированных бифенилов в диапазоне температур 10–50°С. При этом у штамма R. wratislaviensis KT112-7 наиболее эффективно процесс деструкции ПХБ 12 протекал при 10–30°С, а смеси Р – при 30°С. Штамм R. wratislaviensis CH628 разлагал ПХБ 12 на 93–100% при 20–40°С, тогда как уровень деструкции смеси Р в том же температурном диапазоне составлял 63–100%. Отклонение температуры культивирования от 30°С приводит к снижению, но не потере активности штамма R. ruber P25 к исследуемым субстратам. Полученные данные позволили предположить, что штаммы R. wratislaviensis KT112-7, R. wratislaviensis CH628 и R. ruber P25 могут быть перспективными для использования в технологиях биоремедиации территорий, загрязненных ПХБ, с различными климатическими условиями.
В работе использовали оборудование молекулярно-генетической лаборатории кафедры ботаники и генетики растений Пермского государственного национального исследовательского университета, Центра коллективного пользования “Спектроскопия и анализ органических соединений” (ЦКП “САОС”), а также ЦКП “Исследования материалов и вещества” ПФИЦ УрО РАН.
Работы по химическому синтезу ПХБ 12 и его производных, а также исследования биодеструкции данных соединений штаммами рода Rhodococcus при различных температурах выполнены при финансовой поддержке РФФИ (грант 18-29-05016мк).
Моделирование структуры α-субъединицы БДО выполнено в рамках НИОКР АААА-А19-119112290009-1 “Молекулярные механизмы адаптации микроорганизмов к факторам среды”.
Список литературы
Коршунова Т.Ю., Четвериков С.П., Бакаева М.Д., Кузина Е.В., Рафикова Г.Ф., Четверикова Д.В., Логинов О.Н. // Прикл. биохимия микробиология. 2019. Т. 55. № 4. С. 338–349.
Занавескин Л.Н., Аверьянов В.А. // Успехи химии. 1998. Т. 67. № 8. С. 788–800.
Sinkkonen S., Paasivirta J. // Chemosphere. 2000. V. 40. P. 943–949.
Tehrani R., Van Aken B. // Environ. Sci. Poll. Res. 2014. V. 21. P. 6334–6345. https://doi.org/10.1007/s11356-013-1742-6
Furukawa K., Fuijhara H.J. // Biosci. Bioeng. 2008. V. 105. P. 433–449. https://doi.org/10.1263/jbb.105.433
Agulló L., Pieper D.H., Seeger M. // In: Rojo F. (eds) Aerobic Utilization of Hydrocarbons, Oils, and Lipids. Handbook of Hydrocarbon and Lipid Microbiology. Springer, Cham, 2019. P. 595–622. https://doi.org/10.1007/978-3-319-50418-6_30
Bajaj S., Singh D.K. // Int. Biodeterior. Biodegrad. 2015. V. 100. P. 98–105https://doi.org/10.1016/j.ibiod.2015.02.023
Lambo A.J., Patel T.R. // Curr. Microbiol. 2006. V. 53. P. 48–52. https://doi.org/10.1007/s00284-005-0194-8
Master E.R., Mohn W.W. // Appl. Environ. Microbiol. 1998. V. 64. № 12. P. 4823–4829.
Michaud L., Di Marco G., Bruni V., Lo Giudice A. // Marine Pollut. Bull. 2007. V. 54. P. 1754–1761. https://doi.org/10.1016/j.marpolbul/2007/07/011
Mohn W.W., Westerberg K., Cullen W.R., Reimer K.J. // Appl. Environ. Microbiol. 1997. V. 63. № 9. P. 3378–3384.
Shimura M., Mukerjee-Dhar G., Kimbara K., Nagato H., Kiyohara H., Hatta T. // FEMS Microbiol. Lett. 1999. V. 178. P. 89–93.
Plotnikova E.G., Rybkina D.O., Anan’ina L.N., Yastrebova O.V., Demakov V.A. // Russ. J. Ecol. 2006. V. 37. P. 233–240. https://doi.org/10.1134/S1067413606040035
Plotnikova E.G., Egorova D.O., Shumkova E.S., Solyanikova I.P., Golovleva L.A. // Microbiology (Mikrobiologiya). 2012. V. 81. P. 143–153. https://doi.org/10.1134/S0026261712020117
Egorova D.O., Buzmakov S.A., Nazarova E.A., Andreev D.N., Demakov V.A., Plotnikova E.G. // Water Air Soil Pollut. 2017. V. 228. P. 183–199. https://doi.org/10.1007/s11270-017-3344-2
Egorova D.O., Farafonova V.V., Shestakova E.A., Andreev D.N., Maksimov A.S., Vasyanin A.N., Buzmakov C.A., Plotnikova E.G. // Eurasian. Soil. Sci. 2017. V. 50. P. 1217–1224. https://doi.org/10.1134/S1064229317100015
Egorova D.O., Korsakova E.S., Demakov V.A., Plotnikova E.G. // Appl. Biochem. Microbiol. 2013. V. 49. P. 244–255. https://doi.org/10.1134/S0003683813030071
Egorova D.O., Pervova M.G., Demakov V.A., Plotnikova E.G. // Appl. Biochem. Microbiol. 2018. V. 54. P. 252–261. https://doi.org/10.1134/S000368381803002X
Зайцев Г.М., Карасевич Ю.Н. // Микробиология. 1981. Т. 50. № 2. С. 423–428.
Шумкова Е.С., Егорова Д.О., Боронникова С.В., Плотникова Е.Г. // Молекулярная биология. 2015. Т. 49. № 4. С. 638–648.
Mullin M.D., Pochini C.M., McGrindle M.R., Romkes M., Safe S.H., Safe L.M. // Environ. Sci. Technol. 1984. V. 18. P. 468–476.
Горбунова Т.И., Первова М.Г., Салоутин В.И., Чупахин О.Н. // Журнал органической химии. 2019. Т. 55. № 7. С. 1089–1092. https://doi.org/10.1134/S0514749219070127
Maltseva O.V., Tsoi T.V., Quensen III J.F., Fukuda M., Tiedje J.M. // Biodegradation. 1999. V. 10. P. 363–371.
Furusawa Y., Nagarajan V., Tanokura M., Masai E., Fukuda M., Senda T. // J. Mol. Biol. 2004. V. 342. P. 1041–1052. https://doi.org/10.1016/j/jmb/2004.07.062
Gakhar L., Malik Z.A., Allen Ch.C.R., Liqscomb D.A., Larkin M.J., Ramaswamy S. // J. Bacteriol. 2005. V. 187. № 21. P. 7222–7231. https://doi.org/10.1128/JB/187.21.7222-7231.2005
Friemann R., Lee K., Brown E.N., Gibson D.T., Eklund H., Ramaswamy S. // Acta Crystallographica sect D. 2009. V. 65. P. 24–33. https://doi.org/10.1107/s0907444908036524
Fortin P.D., Lo A. T.-F., Haro M.-A., Kaschabek S., Reineke W., Eltis L.D. // J. Bacteriol. 2005. V. 187. № 2. P. 415–421.
Passatore L., Rossetti S., Juwarkar A.A., Massacci A. // J. Hazard. Mater. 2014. V. 278. P. 189–202. https://doi.org/10.1016/j.jhazmat.2014.05.051
Bhalla R., Tehrani R., Van Aken B. // Microtox. Ecotoxicol. 2016. V. 25. P. 1438–1444. https://doi.org/10.1007/s10646-016-1693-z
Mizukami-Murata S., Sakakibara F., Fujita K., Fukuda M., Kuramata M., Takagi K. // Chemosphere. 2016. V. 165. P. 173–182. https://doi.org/10.1016/j.chemosphere.2016.08.127
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология