Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 563-570
Внеклеточные высокостабильные щелочные пептидазы алкалофильных бактерий Alkalicaulis satelles и Aliidiomarina sp., перспектива их применения в составе детергентов
Е. В. Лаврентьева 1, 2, *, Е. Б. Эрдынеева 1, Я. Е. Дунаевский 3, Ю. В. Болтянская 4, В. В. Кевбрин 4
1 Институт общей и экспериментальной биологии CО РАН
670047 Улан-Удэ, Россия
2 Бурятский государственный университет им. Д. Банзарова
670000 Улан-Удэ, Россия
3 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
4 Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
117312 Москва, Россия
* E-mail: lena_l@mail.ru
Поступила в редакцию 30.04.2021
После доработки 30.06.2021
Принята к публикации 02.07.2021
Аннотация
Изучена пептидазная активность в культуральной среде алкалофильных протеолитических бактерий Alkalicaulis satelles G-192T и Aliidiomarina sp. P-156, выделенных из системы гиперсоленых щелочных озер Танатар (Алтайский край, Россия). Обнаружено, что секретируемые пептидазы штаммов G-192 и P-156 способны гидролизовать п-нитроанилидные субстраты, проявляя максимальную активность при гидролизе аминопептидазного субстрата LpNa. Анализ частично очищенных препаратов пептидаз из штаммов G-192 и P-156 показал, что исследуемые ферменты отличались наибольшей активностью и стабильностью при рН от 8.4 до 11. Ферменты штаммов G-192 и P-156 были высокостабильными по отношению к NaCl, сохраняя активность при 220 и 70 г/л NaCl соответственно. Данные ингибиторного анализа и субстратной специфичности внеклеточных ферментов указывают на их принадлежность к классу металлопептидаз аминопептидазного типа. Щелочные пептидазы показали значительную устойчивость к поверхностно-активным веществам тритон X-100, ДДС-Na и окислителю H2O2 и могут быть использованы при разработке новых моющих средств.
Пептидазы (EC 3.4.21) обнаружены у всех групп живых организмов и представляют собой отдельную подгруппу гидролитических ферментов, способных к гидролизу пептидных связей в белках и пептидах. Эти ферменты разнообразны по структуре и свойствам, выполняют множество сложных биологических функций и участвуют в биогеохимическом цикле углерода и азота [1]. В коммерческом отношении пептидазы бактерий являются наиболее ценной группой ферментов, на долю которых приходится 60% общемировых продаж промышленных ферментов [2]. Щелочные пептидазы уникальны по стабильности в широком диапазоне температур, pH и концентраций NaCl и широко используются в пищевой и кормовой промышленности, в медицине, а также при переработке органических отходов [3, 4]. Одним из основных применений этих пептидаз является производство моющих средств, поскольку pH стиральных порошков находится в диапазоне рН 7–11. Щелочные пептидазы используются в различных составах моющих средств вместе с другими гидролитическими ферментами в качестве добавок для облегчения расщепления и высвобождения белковых загрязнений [5].
Важным источником щелочных ферментов являются алкалофильные бактерии из местообитаний с высоким значением рН. К таким, в частности, принадлежат содовые озера, представляющие естественную среду обитания алкалофилов, относящихся к экстремальным микроорганизмам. Исследование секреции внеклеточных пептидаз у новых представителей экстремофильных бактерий дает возможность выявлять природные штаммы с различным спектром секретируемых пептидаз, обладающих высокой ферментативной активностью. Потенциал пептидаз бактерий из содовых озер рассмотрен в работах [6, 7]. Показано, что щелочные пептидазы бактерий рода Bacillus, – благодаря высокому уровню их стабильности и способности к разложению широкого спектра субстратов, доминируют на коммерческом рынке. Секвенирование и аннотирование геномов позволило выявить высокий потенциал секретируемых щелочных пептидаз у этой группы бактерий для практического применения [8].
Однако в связи с непрерывным развитием технологий и ужесточением экологических норм поиск новых видов алкалофильных бактерий из природных местообитаний, способных продуцировать стабильные щелочные ферменты, остается актуальным направлением в современной микробиологии. В последние годы внимание исследователей привлечено к таксономическим группам бактерий, выделенным из содовых озер и способным активно секретировать щелочные пептидазы: Microbacterium, Arthrobacter, Geomicrobium, Salipaludibacillus, Brachybacterium, Bacillus, Brevibacterium, Halomonas и Alkalibacillus [9–13].
Цель работы – поиск и характеристика внеклеточных щелочных пептидаз у двух штаммов новых алкалофильных бактерий родов Alkalicaulis и Aliidiomarina, оценка возможности их применения в составе синтетических моющих средств (детергентов).
МЕТОДИКА
Культивирование штаммов-продуцентов. Штамм G-192 культивировали на среде следующего состава (г/л): NaHCO3-13, Na2CO3 – 46, KH2PO4 – 0.3, MgSO4⋅7H2O – 0.12, CaCl2⋅2H2O – 0.015, дрожжевой экстракт – 0.1 и 1.0 мл раствора микроэлементов [15]. Рост штамма Р-156 поддерживали на среде следующего состава (г/л): NaCl – 30, NaHCO3 – 7, NaHCO3 – 23, KH2PO4 – 0.3, MgSO4⋅7H2O – 0.12, CaCl2⋅2H2O – 0.015, дрожжевой экстракт – 0.1 и 1.0 мл раствора микроэлементов [15]. В качестве индуктора пептидаз в среды добавляли казеинат натрия – 2.0 г/л. Штаммы выращивали в 250 мл среды в конических колбах без перемешивания при рН 9. Инкубацию проводили в течение 48–72 ч при температуре 35°С. После окончания роста клетки отделяли от среды центрифугированием 10 000 g в течение 5 мин при 4°С и отбрасывали. Собранную бесклеточную культуральную жидкость хранили в холодильнике при 4°C для дальнейшей работы.
Определение протеолитической активности. Внеклеточную протеолитическую активность ферментов, содержащихся в полученных супернатантах определяли согласно методу Эрлангера [16]. В работе использованы следующие п-нитроанилидные субстраты, специфичные для эндопептидаз определенного типа или класса): GlpAALpNA (пироглутамил-аланил-аланил-лейцин-n-нитроанилид) – для субтилизин-подобных пептидаз; BzRpNA (N-бензоил-L-аргинил-n-нитроанилид) – для трипсин-подобных пептидаз; GlpFpNA (пироглутамил-фенилаланил-n-нитроанилид) – для химотрипсин-подобных пептидаз; GlpFApNA (пироглютамил-фенилаланил-аланил-n-нитроанилид) – для цистеиновых пептидаз. Субстраты для аминопептидаз: LpNA (L-лейцил-п-нитроанилид); FpNA (L-фенилаланил-п-нитроанилид).
Эти субстраты содержат аналог пептидной связи, которая расщепляется под действием протеолитических ферментов. В результате расщепления выделяется п-нитроанилин, окрашивающий раствор в желтый цвет. Все субстраты вносили в концентрации 5 мМ.
Для измерения активности пептидаз в ячейку микропланшета вносили 160 мкл 0.1 М фосфатного буфера, рН 7.0, добавляли 10–20 мкл культуральной жидкости, 5 мкл соответствующего субстрата и измеряли оптическое поглощение раствора в начальный момент времени. Затем поглощение измеряли через 12 ч инкубации при 37°С. Количество образовавшегося п-нитроанилина определяли спектрофотометрически при 405 нм на микропланшетном фотометре StatFax 2100 (“Awareness Technology”, США), используя дифференциальный фильтр 405 нм. За 1 единицу активности (U) принимали изменение оптической плотности (ОП) опытных растворов относительно контрольных на 0.01 за 12 ч при 405 нм и 37°С. В качестве контроля использовали ОП реакционной смеси, измеренную сразу после добавления субстрата. Концентрацию белка определяли спектрофотометрически при 280 нм. При определении активности цистеиновых пептидаз к реакционной смеси дополнительно добавляли 5 мкл свежеприготовленного раствора дитиотреитола с концентрацией 10 мг/мл.
Очистка пептидаз. Щелочные пептидазы штаммов G-192 и Р-156 очищали, используя осаждение сульфатом аммония с последующей ионообменной хроматографией и гель-фильтрацией. На первом этапе белок из супернатанта культуральной жидкости осаждали сульфатом аммония, внесенного до насыщения 60%. Растворы оставляли при 4°С на ночь, чтобы обеспечить более полное осаждение белка. После этого осадок отделяли центрифугированием при 10 000 g в течение 15 мин, затем растворяли в небольшом объеме 0.1 М фосфатного буфера рН 7.0. Полученный раствор обессоливали диализом против 0.1 М фосфатного буфера при 4°С в течение 24 ч, определяли содержание белка и анализировали наличие активности пептидаз.
Ионообменную хроматографию осуществляли на колонке Mono Q (FPLC), уравновешенной 0.01 М фосфатным буфером, рН 7.0. Белок, сорбировавшийся на колонке, элюировали градиентом NaCl (0–1 М) со скоростью 1 мл/мин. Фракции (1 мл) собирали, анализировали на содержание белка и протеолитическую активность. Активность измеряли по выбранным субстратам при 405 нм. Фракции, проявляющие протеолитическую активность, объединяли. Объединенные фракции подвергали гель-фильтрации с использованием колонки, заполненной Superdex 75, 60 × 1 см (“Pharmacia”, Швеция). Элюирование проводили 0.01 М фосфатным буфером, рН 7, со скоростью 1 мл/мин. Все фракции были проанализированы на протеолитическую активность и содержание белка.
Определение оптимума pH-активности и рН-стабильности фермента. При определении pH оптимума секретируемой пептидазы по отношению к синтетическим субстратам был использован универсальный буфер в диапазоне рН 2–11 с шагом 1. В состав буфера входили: 0.02 М H3PO4, 0.02 M CH3COOH, 0.02 M H3BO3. Необходимое значение рН получали, добавляя к смеси кислот 0.02 М NaOH. После инкубации 10 мкл препарата фермента с 20 мкл буфера определенного рН и 5 мкл субстрата при 37°С к каждой пробе добавляли 160 мкл 0.1 М фосфатного буфера рН 7.5 и измеряли поглощение как описано выше.
Для определения рН стабильности ферментный препарат инкубировали 4 ч при 37°С в универсальном буферном растворе с рН от 2 до 11, затем образцы доводили до рН 7.5 с помощью 0.1 М фосфатного буфера, рН 7.5 при рН от 8.0, либо 0.1 М NaOH в при рН до 8.0. Активность ферментов определяли по методу, описанному выше.
Определение температурного оптимума и стабильности фермента. Определение температурного оптимума фермента проводили в диапазоне температур от 5 до 65°С. Для изучения температурной стабильности раствор фермента инкубировали при тех же температурах в течение 4 ч, затем приводили к комнатной температуре и определяли активность при 37°С, как указано выше.
Определение оптимума концентрации хлорида натрия для исследуемого фермента. При определении оптимума концентрации хлорида натрия для проявления активности секретируемой пептидазы были подготовлены солевые растворы с концентрацией от 0 до 300 г/л (0, 10, 30, 50, 80, 100, 150, 200, 250, 300 г/л). Фермент инкубировали в растворах хлорида натрия и определяли активность, как указано выше. Для определения стабильности пептидазы выдерживали в течение 4 ч при 37°С при различных концентрациях хлорида натрия, а затем добавляли специфичный п-нитроанилидный субстрат и определяли активность.
Определение влияния специфических ингибиторов на ферментативную активность. Ингибиторный анализ проводили с очищенными ферментными препаратами и с культуральной жидкостью. В работе использовали специфические ингибиторы: – ФМСФ (фенилметилсульфонилфторид) для сериновых пептидаз; ЭДТА (этилендиаминтетраацетат натрия) для металлопептидаз; ЙАА (2-йодацетамид) для цистеиновых пептидаз.
К 50 мкл раствора фермента добавляли 5 мкл раствора ингибитора определенной концентрации (0.01 и 0.1 М) и выдерживали смесь 50–60 мин при комнатной температуре. Затем добавляли 700 мкл фосфатного буфера (0.1 М, рН 8) и 10 мкл раствора соответствующего п-нитроанилидного субстрата и определяли остаточную активность пептидазы. Ферментативную активность в отсутствие ингибиторов использовали в качестве контроля.
Для приготовления растворов ингибиторов ЭДТА и ЙАА растворяли в фосфатном буфере (0.1 М, рН 8), а ФМСФ в этаноле; в тех случаях, когда используемый ингибитор был растворен в спирте, в качестве контроля к раствору фермента добавляли 5 мкл спирта.
Влияние поверхностно-активных веществ и окислителя на стабильность пептидаз. Влияние некоторых поверхностно-активных веществ (ПАВ), таких как тритон X-100 (неионное ПАВ), ДДС-Na (анионное ПАВ) и окислителя (пероксид водорода) на стабильность фермента изучали путем инкубации ферментов в течение 4 ч при 37°С с указанными добавками. После инкубационного периода измеряли остаточную активность пептидазы в стандартных условиях анализа. Активность фермента без добавок принимали за 100%.
Концентрации тритон X-100 и ДДС-Na составляли 0.5, 1.0, 2.0, 4.0, 6.0% и 0.1, 0.2, 0.4, 0.6, 0.8% соответственно. Пероксид водорода добавляли в концентрациях 0.5, 1.0 и 3.0%.
Статистический анализ. Эксперименты проводили в трех повторностях, результаты обрабатывали с использованием программного пакета Microsoft Excel 2013. Для полученных результатов рассчитывали среднее значение и стандартное отклонение.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Штаммы – продуценты. Штаммы новых аэробных алкалофильных бактерий, использованных в работе, были выделены из разных щелочных биоценозов. Штамм G-192 был выделен из лабораторного консорциума галоалкалофильной цианобактерии Geitlerinema sp. Z-T0701 с ее естественными хемоорганотрофными спутниками [15]. Синтез протеолитических ферментов у этого штамма, вероятно, связан с обитанием в природном микробном консорциуме за счет утилизации отмирающих клеток или прижизненных белковых выделений цианобактерии, являясь деструктором (или редуцентом, в современной терминологии) биомассы первичного продуцента. Учитывая место штамма G-192 в трофической цепи, представляло интерес выяснить, какими пептидазами располагает деструктор для выполнения своей роли в алкалофильном микробном сообществе. По таксономическому положению штамм G-192 образовал новый род и вид – Alkalicaulis satelles G-192T gen. nov., sp. nov. в составе нового семейства Maricaulaceae fam. nov. (ВКМ B-3306T, ККТК 72746T) [15]. Штамм Р-156 был выделен из прибрежных осадков озера Петуховское (Алтайский край, Россия), из мест, где наблюдалось спонтанное разложение альго-цианобактериальной биомассы. Так же, как и штамм G-192, штамм Р-156 был выделен как протеолитик для выяснения его роли в алкалофильном микробном сообществе. На основании филогенетического анализа штамм Р-156 оказался в кластере Aliidiomarina (семейство Idiomarinaceae), где он, по-видимому, образует новый вид.
Субстратная специфичность внеклеточных пептидаз. Использование п-нитроанилидных субстратов для определения класса секретируемых пептидаз штаммов G-192 и Р-156 выявило присутствие субтилизин-подобной пептидазы (по субстрату GlpAALpNa) и аминопептидазы (по субстрату LpNa) (рис. 1). Оба штамма проявили наибольшую активность в отношении субстрата, специфичного для аминопептидаз – LpNa. Высокая активность по этому субстрату приходилась на экспоненциальную фазу роста бактерий (48–96 ч) и к 192 ч роста активность заметно снижалась.
Рис. 1.
Активность пептидаз (удельная активность, U/мг белка) на разных субстратах: 1 – пептидаза штамма G-192 на субстрате LpNa, 2 – пептидаза штамма G-192 на субстрате GlpAALpNa, 3 – пептидаза штамма Р-156 на субстрате LpNa, 4 – пептидаза штамма Р-156 на субстрате GlpAALpNa.
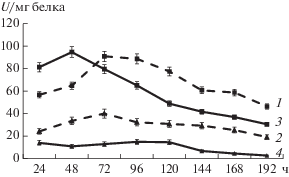
Из рис. 1 видно, что максимальная активность пептидазы штамма G-192, наблюдалась на 72 ч культивирования и составляла 91 U/мл при определении с субстратом LpNa. У пептидаз штамма P-156 уровень активности по тому же субстрату был максимальным на вторые сутки и составил 94.8 U/мл. При использовании в качестве субстрата GlpAALpNa для субтилизин-подобных пептидаз определяемые активности были значительно ниже. Изученные штаммы не гидролизовали субстраты, специфичные для химотрипсин-подобных, трипсин-подобных и цистеиновых пептидаз.
Способность изученных бактерий секретировать пептидазы, активные на синтетических субстратах LpNa и GlpAALpNa, возможно, указывает на способность в выработке определенных типов внеклеточных протеолитических ферментов в ответ на конкретные условия окружающей среды. Причиной, вероятно, может быть специфическая ниша обитания.
Очистка аминопептидаз. Поскольку аминопептидазы обоих штаммов показали более высокую активность по сравнению с субтилизин-подобными ферментами, они были частично очищены с целью дальнейшего описания их свойств (табл. 1). В процессе очистки были получены аминопептидазы со степенью очистки 4.7, выходом 2.3% и удельной активностью 96.4 U/мг для штамма G-192 и со степенью очистки 9.7, выходом 1.8% и удельной активностью 109.7 U/мг для штамма Р-156. Аналогичная хроматографическая процедура была применена для пептидаз из Bacillus subtilis AU-2 [17], алкалофильного штамма Salipaludibacillus agaradhaerens AK-R [18], Staphylococcus sciuri [19], штамма Aeribacillus pallidus C10 [20], галотолерантного штамма Salinicoccus sp. UN-12 [21].
Таблица 1.
Очистка щелочных аминопептидаз штаммов G-192 (1) и Р-156 (2)*
| Стадия очистки | V, мл | Активность, U/мл | Белок, мг/мл | Удельная активность, U/мг белка | Выход, % | Степень очистки | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | |
| Культуральная жидкость | 50 | 50 | 40.7 | 19.9 | 2.0 | 1.8 | 20.7 | 11.3 | 100 | 100 | 1 | 1 |
| Осаждение сульфатом аммония (60%) | 5 | 4 | 96.2 | 28.5 | 3.1 | 2.2 | 30.9 | 13.2 | 23.6 | 11.5 | 1.5 | 1.17 |
| Ионообменная хроматогра- фия (Mono Q) |
4 | – | 9.8 | – | 0.2 | – | 46.7 | – | 1.9 | – | 2.3 | – |
| Гель-хроматография (Superdex75) | 3 | 5 | 16.0 | 3.62 | 0.2 | 0.03 | 96.4 | 109.7 | 2.3 | 1.8 | 4.7 | 9.7 |
Физико-химические свойства выделенных пептидаз. Изучение физико-химических свойств ферментов было проведено с использованием синтетического субстрата для пептидаз LpNa на очищенных препаратах штаммов G-192 и Р-156.
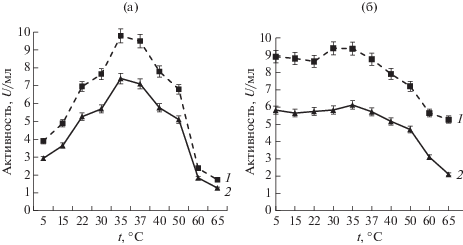
Определение температурного оптимума и термостабильности пептидаз у изученных штаммов проводили в диапазоне температур 5–65°С (рис. 2). Показано, что температурный оптимум активности пептидаз находился в пределах 30–50°С, с максимумом при температуре 35–37°С. Изученные ферменты были стабильны до температуры 50°С, повышение температуры до 65°С приводит к снижению активности у штамма G-192 до 56% и у штамма Р-156 до 34% от исходной активности.
Полученные нами результаты сопоставимы с активностью и стабильностью внеклеточной металлопептидазы морской бактерии Vibrio sp. LA-05 [5], которая, как показано, была активна и стабильна при 25–40°C.
Известно, что температурный оптимум и термостабильность пептидаз варьируют в зависимости от вида бактерий. В ранее проведенных исследованиях сообщалось, что щелочные сериновые пептидазы бактерий Salipaludibacillus agaradhaerens AK-R и Bacillus caseinilyticus SPT, выделенных из щелочных озер Индии и Египта, имеют более высокий температурный оптимум – 60°C [18, 22]. Термостабильность пептидазы у штамма Salipaludibacillus agaradhaerens AK-R сохранялась при более низких температурах 40–45°C.
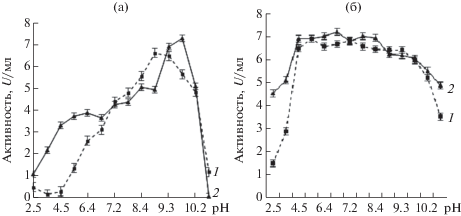
Исследования рН оптимума ферментов были проведены в диапазоне рН 2.5–11.5. Установлено, что пептидазы активны в широком диапазоне значений рН, при этом наибольшая активность наблюдалась при рН от 8.4 до 11.0 (рис. 3) и следовательно, они могли быть отнесены к классу щелочных пептидаз. Пептидаза штамма G-192 проявляла максимальную активность при рН 9.0, тогда как пептидаза штамма Р-156 при 10.1. Обычно коммерческие микробные пептидазы имеют оптимумы при pH от 7 до 11, хотя оптимумы могут различаться в зависимости от использованных субстратов [23].
Анализ рН-стабильности пептидаз показал, что обе исследуемые аминопептидазы стабильны в широком диапазоне рН от 4.5 до 11.5. При щелочном рН (11.5) пептидаза штамма G-192 сохраняла более 51% от исходной активности, а пептидаза штамма Р-156 – 67.5% активности.
Следует отметить, что изученные нами пептидазы имели более широкий диапазон рН-стабильности от 4.5 до 11.5, чем ранее изученные пептидазы бактерий [20].
Влияние хлорида натрия на активность аминопептидаз представлено на рис. 4. Для фермента штамма G-192 установлено, что аминопептидаза была высокостабильной в широком диапазоне концентраций NaCl от 10 до 220 г/л. При этом при концентрации NaCl 270 г/л фермент сохранял 45% от максимальной активности. Аминопептидаза штамма Р-156 была стабильной при концентрации NaCl от 10 до 70 г/л, тогда как при 90 г/л активность фермента снижалась в два раза.
Рис. 4.
Активность внеклеточных пептидаз штаммов G-192 (1) и Р-156 (2) при различных концентрациях NaCl.
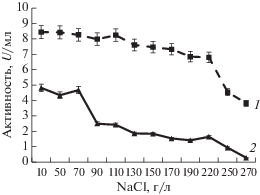
Галотолерантность пептидаз является важной характеристикой, поскольку NaCl входит в состав ядра, используемого в процессе грануляции пептидазы перед ее включением в качестве добавки в состав моющего средства [24]. Способность сохранять активность в условиях высоких концентраций солей очищенных пептидаз делает их многообещающими для использования в качестве экологичной, биологически активной и стабильной добавки в составе детергентов.
Таким образом, определение физико-химических свойств ферментов из штаммов G-192 и Р-156 показало, что исследуемые аминопептидазы имели высокую активность и стабильность в широком диапазоне pH (от 4.5 до 11.5) и температуры (5–60°С), а также демонстрировали устойчивость в растворах с высоким содержанием соли (до 220 г/л).
Определение влияния ингибиторов на активность пептидаз. Ингибиторный анализ показал, что активности пептидаз штаммов G-192 и Р-156 по субстрату LpNa ингибируются ЭДТА – специфическим ингибитором металлопептидаз, тогда как специфические ингибиторы сериновых пептидаз (ФМСФ) и цистеиновых пептидаз (ЙАА) подавляли активность в заметно меньшей степени (табл. 2). Таким образом, по типу ингибирования выделенные пептидазы можно отнести к классу металлопептидаз.
Таблица 2.
Влияние ингибиторов на активность аминопептидаз
| Ингибиторы | Концентрация, М | Остаточная активность пептидаз штаммов, % | |
|---|---|---|---|
| G-192Т | Р-156 | ||
| Контроль | – | 100 | 100 |
| ЭДТА | 0.04 | 46.9 | 44.8 |
| ЙАА | 0.04 | 78.8 | 68.4 |
| ФМСФ | 0.04 | 84.8 | 73.5 |
Влияние поверхностно-активных веществ и окисляющего агента на стабильность щелочных пептидаз. Поверхностно-активные вещества, окислители и ферменты являются важными компонентами современных моющих средств. Существует широкий спектр анионных, неионных, катионных и амфотерных поверхностно-активных веществ и окислителей, которые используются в составе детергентов [25]. Обычно в их составе используются смесь от двух до четырех ПАВ. Преобладающим типом являются анионные ПАВ (например, ДДС-Na), за которыми следуют неионные (тритон Х-100). Комбинация анионных и неионных ПАВ позволяет в значительной степени преодолеть вредное воздействие анионных ПАВ на конформацию ферментов. На активность фермента также может влиять концентрация используемых ПАВ и этот эффект проявляется по разному для разных классов ферментов [26]. Для возможного применения щелочных пептидаз в составе моющих средств они должны функционировать и быть стабильными в различных химически агрессивных условиях.
Влияние некоторых ПАВ на стабильность пептидаз штаммов G-192 и Р-156 изучали путем предварительной инкубации фермента с химическими добавками различной концентрации. Показано, что в присутствии тритон X-100 в концентрации от 0.5 до 4.5% остаточная активность пептидаз была 30–45% (табл. 3). Щелочные пептидазы штамма G-192 сохраняли до 50% активности в присутствии сильного анионного ПАВ ДДС-Na при его концентрации от 0.1 до 0.6%. Пептидаза штамма Р-156 сохраняла активность на 47% при концентрации ДДС-Na 0.5%. В присутствии H2O2 (3.0%) используемого для отбеливания, пептидаза штамма G-192 сохраняла 50% активности, тогда как у пептидазы штамма Р-156 остаточная активность составила 20%. Ингибирование активности от 20 до 50% некоторых щелочных пептидаз у алкалофилов в присутствии 1–5% детергента тритон X-100 описано в работах [20, 21]. Следует отметить, что в некоторых работах показана стимуляция протеолитической активности фермента при инкубации его в тритон X-100 в концентрациях 0.1, 1.0 и 5.0% [18, 19, 27]. Подавление активности ферментов на 20–50% в присутствии малых концентраций ДДС-Na описано также и в работах [18, 19]. Полученные результаты свидетельствуют о влиянии отдельных ПАВ на стабильность пептидазы, что в дальнейшем должно быть учтено при разработке моющих средств с оптимальными характеристиками.
Таблица 3.
Влияние поверхностно-активных веществ и окислителя на активность аминопептидаз из штаммов G-192 и Р-156
| Реагент | Остаточная активность, % (вес/об.)* | |
|---|---|---|
| G-192 | Р-156 | |
| Тритон X-100, % | ||
| 0.5 | 39.4 ± 1.5 | 41.5 ± 1.7 |
| 1 | 43.2 ± 1.3 | 43.5 ± 1.5 |
| 1.5 | 43.1 ± 1.7 | 45.7 ± 1.9 |
| 2 | 34.9 ± 0.9 | 40.2 ± 2.1 |
| 2.5 | 33 ± 2.0 | 41.2 ± 0.6 |
| 3 | 30 ± 1.9 | 40.7 ± 1.5 |
| 3.5 | 29.4 ± 1.3 | 42.7 ± 0.7 |
| 4 | 15.2 ± 0.7 | 42.5 ± 1.3 |
| 4.5 | 6.5 ± 1.8 | 38.4 ± 0.9 |
| 5 | 5 ± 1.5 | 12.8 ± 1.7 |
| 5.5 | 6.4 ± 0.9 | 14.1 ± 2.0 |
| 6 | 4.8 ± 1.7 | 8.5 ± 1.3 |
| ДДС, % | ||
| 0.1 | 74.5 ± 0.6 | 88.1 ± 1.1 |
| 0.2 | 62.2 ± 0.8 | 90.1 ± 1.6 |
| 0.3 | 58.4 ± 1.1 | 78.7 ± 2.1 |
| 0.4 | 55.7 ± 1.6 | 78.1 ± 0.6 |
| 0.5 | 52.6 ± 2.2 | 46.6 ± 0.4 |
| 0.6 | 50.8 ± 0.8 | 38.2 ± 0.7 |
| 0.7 | 22.9 ± 1.6 | 38.5 ± 1.1 |
| 0.8 | 23.5 ± 0.6 | 36.5 ± 0.8 |
| H2O2, % | ||
| 0.5 | 69.8 ± 0.9 | 80.4 ± 0.4 |
| 1.0 | 54.5 ± 1.4 | 57.6 ± 1.7 |
| 2.0 | 52.8 ± 1.3 | 32.2 ± 0.9 |
| 3.0 | 51.8 ± 0.7 | 19.8 ± 1.3 |
Таким образом, было подтверждено, что одним из потенциальных источников щелочных пептидаз могут быть новые алкалофильные бактерии, способные расти в щелочных условиях. Секретируемые пептидазы новых видов алкалофильных бактерий были частично очищены и охарактеризованы. Пептидазы продемонстрировали такие свойства, как высокую стабильность при щелочных pH, устойчивость к ПАВ и солености среды, что указывало на возможность их использования в качестве добавок при разработке моющих средств.
Работа выполнена при финансовой поддержке гранта РФФИ № 18-04-00236, частично в рамках госзадания АААА-А19-119020590109-3 для ФИЦ Биотехнологии РАН и частично в рамках госзадания 0271-2021-0003 (FWSM-2021-0003) для ФГБУН ИОЭБ CО РАН.
Список литературы
Luo L., Meng H, Gu J-D. // J. Environ. Manage. 2017. V. 197. P. 539–549.
Ibrahim A.S.S., Al-Salamah A.A., El-Badawi Y.B., El-Tayeb M.A., Antranikian G // Extremophiles. 2015. V. 19. № 5. P. 961–971.
Garg S.K., Singh K.S. // Enz. Eng. 2015. V. 4. № 2. Art. 129. https://doi.org/10.4172/2329-6674.1000129
Sharma M., Gat Y., Arya S., Kumar V., Panghal A., Kumar A.A // Ind. Biotechnol. 2019. V. 15. № 2. P. 69–78.
Zhang H., Li H., Lang D.A., Xu H., Zhu H. // J. Chem. Technol. Biotechnol. 2018. V. 93. P. 3627–3637.
Zhou, C., Qin, H., Chen X., ZhangY., Xue Y., Ma Y. // Sci Rep. 2018. V. 8. Art. 16467. https://doi.org/10.1038/s41598-018-34416-5
Uma G., Babu M.M., Prakash V.S.G., Nisha S.J., Citarasu T. // World J. Microbiol. Biotechnol. 2020. V. 36 № 5. Art. 66. https://doi.org/10.1007/s11274-020-02841-2
Danilova I., Sharipova M. // Front Microbiol. 2020. V. 11. P. 1782. https://doi.org/10.3389/fmicb.2020.01782
Gessesse A., Gashe B.A. // Biotechnol. Lett. 1997. V. 19. P. 479–481.
Nilegaonkar S., Kanekar P., Sarnaik S., Kelkar A.S. // World J. Microbiol. Biotechnol. 2002. V. 18. P. 785–789.
Karan R., Singh S.P., Kapoor S., Khare S.K. // N Biotechnol. 2011. V. 28. № 2. P. 136–145.
Ibrahim A.S., Al-Salamah A.A., El-Badawi Y.B., El-Tayeb Mohamed A., Ibrahim S.S. // Biosci. J. 2016. V. 32. № 6. P. 1604–1618.
Rathod M.G., Pathak A.P. //Data in Brief. 2016. V. 8. P. 863–866.
Abdel-Hamed A.R., Abo-Elmatty D.M., Wiegel J., Mesbah N.M. // Extremophiles. 2016. V. 20. P. 885–894.
Kevbrin V., Boltyanskaya Y., Koziaeva V., Uzun M., Grouzdev D. // Int. J. Syst. Evol. Microbiol. 2021. V. 71. № 1. https://doi.org/10.1099/ijsem.0.004614
Erlanger B.F., Kokowsky N., Cohen W. //Arch. Biochem. Biophys. 1961. V. 95. № 2. P. 271–278.
Patel A.R., Mokashe N.U., Chaudhari D.S., Jadhav A.G., Patil U.K. // Biocatal. Agric. Biotechnol. 2019. V. 19. P. 101–122.
Ibrahim A.S.S., Elbadawi Y.B., Tayeb M.A.E., Maa-ry K.S.A., Maany D.A.F., Ibrahim S.S.S., Elagib A.A. // 3 Biotech. 2019. V. 9. № 11. P. 391.
Abu-Khudir R., Salem M.M., Allam N.G., Ali E.M.M. // Appl. Biochem. Biotechnol. 2019. V. 189. № 1. P. 87–102.
Yildirim V., Baltaci M.O., Ozgencli I., Sisecioglu M., Adiguzel A., Adiguzel G. // J. Enzyme Inhib. Med. Chem. 2017. V. 32. № 1. P. 468–477.
Mokashe N., Chaudhari B., Patil U. // J. Surfactants Deterg. 2017. V. 20. № 6. P. 1377–1393.
Mothe T., Sultanpuram V. // 3 Biotech. 2016. V. 6. № 53. https://doi.org/10.1007/s13205-016-0377-y
Gupta R., Beg Q., Lorenz P. // Appl. Microbiol. Biotechnol. 2002. V. 59. P. 15–32.
Jaouadi N.Z., Jaouadi B., Aghajari N., Bejar S. // Process Biochem. 2012. V. 105. P. 142–151.
Hellmuth H., Dreja M. // Tenside Surfactants Deterg. 2016. V. 53. P. 502–508.
Holmberg K. // Colloids Surf. B Biointerfaces. 2018. V. 168. P. 169–177.
Shaikh I.K., Dixit P.P., Shaikh T.M. // J. Genet. Eng. Biotechnol. 2018. V. 16. № 2. P. 273–279.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология