Прикладная биохимия и микробиология, 2021, T. 57, № 6, стр. 523-535
Сходство и различия в механизме антибактериального действия ионов и наночастиц серебра
А. Г. Хина 1, Ю. А. Крутяков 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова, химический факультет
199991 Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
123182 Москва, Россия
* E-mail: yurii@petrol.chem.msu.ru
Поступила в редакцию 21.04.2021
После доработки 02.07.2021
Принята к публикации 02.07.2021
Аннотация
Рост числа клинических случаев обнаружения новых штаммов бактерий, резистентных к антибиотикам, делает необходимым поиск альтернативных путей решения проблемы множественной лекарственной устойчивости. Одним из таких путей, по крайней мере при местном применении в терапии инфекционно-осложненных поражений слизистых оболочек и кожных покровов, может стать коллоидное серебро, стабилизированное различными соединениями, в том числе проявляющими собственную биологическую активность. В представленном обзоре обобщены результаты экспериментальных исследований механизмов антибактериального действия серебра в ионной и нанодисперсной формах. При этом особое внимание уделено работам последнего десятилетия, целью которых являлось сопоставление различий в действии ионного и коллоидного серебра на молекулярном уровне. В результате проведенного анализа литературы показано, что наночастицы серебра достоверно обладают дополнительным фактором бактерицидности за счет эффективного связывания с мембраной бактерии и нарушением ее структуры, что приводит к существенному увеличению внутриклеточной концентрации ионов Ag+.
Известно, что серебряные сосуды использовались для хранения и обеззараживания питьевой воды еще в античные времена [1]. В средневековье люди стали применять соединения серебра в медицине, например, кристаллический нитрат серебра (называемый тогда “лунный каустик” или “адский камень”) был очень популярен в терапии ожоговых и раневых поражений кожи, при хирургических вмешательствах, удалении кожных новообразований и др. [2]. В XIX веке области медицинского применения серебра существенно расширились – помимо хирургии, 1–2%-ные водные растворы нитрата серебра стали использовать в качестве антисептика для предотвращения гонорейной офтальмии у новорожденных [3]. Этот протокол лечения, предложенный выдающимся немецким акушером французского происхождения К. Креде, был разрешен в клиниках Германии вплоть до 1992 г. В 1897 г. его сын Б. Креде впервые предложил использовать водный раствор стабилизированного желатином коллоидного серебра (Collargol) в качестве антимикробного агента в терапии инфицированных ран вместо растворов нитрата серебра, обладающих нежелательными побочными эффектами [4]. Максимальное распространение применение серебра и его соединения в медицинских целях, особенно в офтальмологии, урологии, гинекологии и дерматологии, получили в первые десятилетия ХХ века [5]. С внедрением в широкую медицинскую практику сульфонамидов в 1930 гг. и наступлением эры антибиотиков, когда в 1942 г. в США были запущены первые производственные мощности по наработке пенициллина, применение соединений на основе серебра в медицинской практике сошло на нет [2], за исключением ожоговой медицины. Действительно, сульфадиазин серебра, вошедший в медицинскую практику в 1960 гг., и по сей день считается одним из наиболее эффективных лекарственных средств в терапии ожоговых инфицированных ран. Однако, повсеместное использование антибиотиков в последней четверти ХХ и начале XXI в. привело к появлению больничных штаммов бактерий с лекарственной устойчивостью, в том числе к антибиотикам последнего поколения [6–10], и научный интерес к серебру вспыхнул с новой силой [11]. В результате современных исследований с помощью молекулярных методов было обнаружено, что катионы серебра обладают сильным антибактериальным эффектом за счет одновременного действия на большое количество молекулярных мишеней в бактериальной клетке, а выработка бактериями устойчивости к их действию затруднена [12, 13]. Развитие резистентности бактерий к ионному серебру хорошо задокументировано [14, 15], однако в сравнении с антибиотиками существенно затруднено в связи с одновременным действием серебра на большое число молекулярных мишеней. Катионы серебра (Ag+) воздействуют на мембранные белки и ферменты дыхательной цепи, что приводит к образованию избыточного количества активных форм кислорода (АФК) вблизи мембраны и внутри бактериальной клетки, непосредственно связываются с ДНК, ингибируют процессы трансляции и инициируют развитие других патологических для клетки механизмов.
В свою очередь, развитие науки в области синтеза, стабилизации, химического поверхностного модифицирования и инструментальных методов исследования наноматериалов в последние 20 лет стимулировало взрывной рост числа научных работ, посвященных изучению биологической активности нанодисперсного серебра и композитных материалов на его основе [16–21]. Оказалось, что наночастицы (НЧ) серебра обладают набором новых уникальных свойств по сравнению с ионной или макроскопической формой металла [22–24]. НЧ серебра демонстрируют высокую антибактериальную [25–31], умеренную фунгицидную [32, 33] и противовирусную [34–37] активности in vitro в отношении широкого спектра патогенов [38], в том числе обладающих множественной лекарственной устойчивостью [39–41]. Кроме того, в умеренных дозах НЧ серебра не проявляют выраженной острой и хронической токсичности при различных путях поступления, не обладают мутагенным, канцерогенным, нейротоксическим и эмбриотоксическим действием [42–45]. Серебро, будучи тяжелым металлом с высоким сродством к сере, не является кумулятивным ядом для теплокровных, в отличие от кадмия, ртути, свинца и других металлов. Этот факт находит объяснение в химическом сродстве серебра и меди, и наличии у эукариотических клеток теплокровных животных эффективных механизмов связывания и эффлюкса серебра с помощью специальных низкомолекулярных белков с высоким содержанием цистеина – металлотионеинов [46]. Подробно описанным в медицинской научной литературе побочным эффектом от действия на организм высоких доз серебра является аргирия – изменение цвета кожи на синий или голубовато-серый, обусловленное отложением сульфида и селенида серебра [47]. Ярко выраженные антибактериальные свойства содержащих НЧ серебра материалов позволили им стать альтернативой антибиотикам в терапии инфицированных бактериями ран [48, 49], ожогов [50], язв и воспалений [51, 52], а также других заболеваний слизистых оболочек и кожных покровов бактериальной этиологии. Кроме того, НЧ серебра активно используют в качестве материала для покрытия медицинских изделий, например катетеров [53], в стоматологических амальгамах [54], в составе лекарственных препаратов для ветеринарного применения [55]. Помимо этого НЧ серебра на сегодняшний день являются одним из самых коммерчески успешных продуктов среди всех наноматериалов [56, 57] и используются в изготовлении широкого ассортимента товаров [58, 59], таких как косметические, дезинфицирующие и моющие средства, одежда [60], пестициды, агрохимикаты и регуляторы роста растений [61–63], упаковочные материалы для пищевой продукции [64, 65], фильтры для очистки воды [66–68], компоненты микроэлектронных схем и даже детских игрушек [69].
Несмотря на массовое использование НЧ серебра, до сих пор продолжаются дискуссии о механизме их антибактериального действия [70, 71]. В частности, ведутся споры о наличии или отсутствии у НЧ серебра уникальных, не связанных с генерацией Ag+, механизмов действия на бактерии [23]. Целью настоящего обзора стало сравнение молекулярных механизмов, лежащих в основе воздействия Ag+ и НЧ серебра на бактерии. Выводы о таких механизмах во многом стали возможны, в том числе, благодаря широкому использованию транскриптомных и протеомных методов исследования последних лет.
МЕХАНИЗМ АНТИБАКТЕРИАЛЬНОГО ДЕЙСТВИЯ Ag+
Катионы серебра, являясь кислотой Льюиса, обладают химическим сродством к основаниям Льюиса – молекулам и группам, способным выступать донорами электронных пар. По этой причине азот-, фосфор- и серосодержащие группы, присутствующие в структурных элементах клеточной мембраны бактерий – белков, ферментов, фосфолипидов и др., могут стать центрами электрофильной атаки ионами Ag+. Так, было показано, что ионы серебра способны практически необратимо связываться с тиол-содержащими цистеином [72] и глутатионом [73, 74], а также флавиновыми группами [75], являющимися компонентами мембранных белков. Воздействуя на мембранные белки электронно-транспортной цепи (ЭТЦ) [76], катионы серебра нарушают их уникальную трехмерную структуру, выводят из строя активные центры, препятствуя протеканию мембранного фосфорилирования – важной составляющей метаболизма бактериальной клетки, в том числе процесса синтеза АТФ. Другим следствием воздействия ионов серебра на белки цитоплазматической мембраны (ЦПМ), является увеличение ее проницаемости, в результате чего происходит значительный приток протонов из внешней среды в цитоплазматическое пространство, что приводит к коллапсу протонной движущей силы [77], необходимой для осуществления трансмембранного транспорта. Помимо этого, падение градиента концентрации протонов приводит бактериальную клетку к необходимости выводить большее число протонов через дыхательную цепь, что вызывает стимуляцию дыхания и разобщение дыхательной цепи (независимость дыхания от синтеза АТФ) [78].
Описанные нарушения в транспортной и метаболической функциях бактериальных клеток, препятствующие протеканию анаболических процессов, а также изменения в структуре белков ЦПМ, приводят к невозможности поддержания бактериальной клеткой целостности структуры своей оболочки. С помощью просвечивающей электронной микроскопии (ПЭМ) показано, что воздействие ионов серебра на грамположительные и грамотрицательные бактерии приводит к нарушениям целостности мембраны [79], повреждениям в клеточной стенке, ее отслоению от цитоплазматической мембраны. Помимо этого, наблюдаются снижение и гетерогенность электронной плотности в цитоплазме, а также лизис.
Антибактериальная активность ионов серебра обусловлена не только действием на мембранные белки и ферменты, но и внутриклеточным воздействием. В исследовании [12] методом ПЭМ совместно с энергодисперсионной рентгеновской спектроскопией среза клетки бактерии показано, что ионы серебра способны проникать внутрь клетки без повреждения клеточной мембраны. В случае действия на грамотрицательные бактерии, имеющие две клеточные мембраны – внешнюю (ВМ) и цитоплазматическую, это происходит в две стадии. Показано, что ионы серебра проникают через ВМ, проходя через расположенные в ней порины, являющиеся структурными элементами каналов пассивного транспорта, не обладающие высокой селективностью. Например, Escherichia coli K12 (грамотрицательная бактерия с устойчивостью к серебру, являющаяся по этой причине модельным объектом во многих микробиологических экспериментах с ним) обладает поринами, как минимум, двух типов (OmpC и OmpF) с диаметром пор, превышающим размер ионов серебра [80]. Это позволяет Ag+ проникать в периплазматическое пространство бактериальной клетки. Механизм переноса ионов серебра через ЦПМ исследован мало, однако, есть основания полагать, что это происходит через активные транспортеры ионов Cu+, изоэлектронных Ag+. Медь – жизненно важный микроэлемент, являющийся кофактором многих ферментов, необходимых для протекания процессов электронного транспорта, дыхания, а также участвующий в реакциях восстановления [81]. В то же время, окислительный потенциал меди может являться причиной серьезных повреждений бактериальной клетки за счет образования избыточного количества АФК при нарушениях регуляции концентрации этого элемента. В связи с этим, концентрация меди в цитоплазме тщательно регулируется бактериальными клетками [82]. На схожесть путей поступления ионов серебра и меди внутрь бактериальной клетки указывают результаты работы [83], в которой описываются механизмы эффлюкса ионов серебра и меди у грамотрицательных бактерий, а также способность эукариотических клеток поглощать Ag+ через медный CTR1 транспортер [84]. Потенциальными кандидатами на роль импортера меди в бактериальных клетках могут быть белки, кодируемые генами сcoA и hmtA. Ген сcoA кодирует транспортный белок из суперсемейства MFS (major facilitator superfamily), содержащий несколько мотивов, аналогичных присутствующим в медных импортерах CTR-типа у эукариот [85, 86]. HmtA является АТФ-азой Р-типа, обеспечивающей транспорт тяжелых металлов, в частности меди и цинка, что подтверждается увеличением устойчивости бактерий к действию этих металлов при делеции соответствующего гена [87].
Попадая внутрь бактериальной клетки, серебро потенциально может взаимодействовать с огромным количеством биологических мишеней – белков [72], ферментов [76], нуклеозидов и нуклеотидов [88], РНК и ДНК [89], что, в свою очередь, может влиять на протекание многих жизненно важных для клетки процессов. Например, в исследовании [12] с помощью двумерного электрофореза и масс-спектрометрии МАЛДИ было показано, что при действии на E. coli ионов серебра, происходит снижение экспрессии S2 белка 30S субъединицы рибосом, играющей важнейшую роль в биосинтезе белков. Предполагается, что это вызвано денатурацией рибосом ионами серебра. В свою очередь, снижение экспрессии белка S2 вызывало снижение экспрессии других белков и ферментов, например, CoA сукцинил-синтазы, катализирующего внутриклеточное производство АТФ. В другой работе было обнаружено, что попавшие внутрь бактериальной клетки ионы серебра нарушают процессы образования дисульфидных S–S связей в белках [90]. Важным этапом в углублении понимания антимикробного внутриклеточного механизма действия ионов Ag стала работа [91]. В ней, с помощью изотермического калориметрического титрования было показано, что ионы серебра и ДНК взаимодействуют напрямую. Для изучения механизма взаимодействия ДНК и Ag+ авторы исследования использовали недавно разработанный метод изогнутых молекул ДНК [92]. В этом методе две отдельные нити ДНК разной длины (45 и 30 оснований) образуют кольцевую изогнутую молекулу, что создает несколько экспериментальных преимуществ. Во-первых, напряжения в полученной таким образом ДНК, вызванные изгибом одного из двух сегментов, делают молекулу более склонной к взаимодействию с другими веществами, что упрощает обнаружение этих взаимодействий. Во-вторых, так как гистоноподобные H-NS белки связываются с изогнутой ДНК, способствуя соединению ее цепей [93], изогнутая ДНК может моделировать естественную ДНК, с которой связываются H-NS белки в живых бактериях, более эффективно, чем линейная ДНК. При исследовании изогнутой молекулы ДНК методом гель-электрофореза, после ее обработки Ag+, наблюдалось уменьшение интенсивности полосы изогнутой ДНК и появление полосы, соответствующей одноцепочечной ДНК состоящей из 45 оснований, что позволяет утверждать что ионы Ag+ приводят к дегибридизации кольцевой изогнутой ДНК. Также, в этой работе с использованием метода фотоактивированной локализационной микроскопии с отслеживанием отдельных частиц (sptPALM) было обнаружено, что действие ионов серебра на живые бактерии приводит к увеличению подвижности гистоноподобного белка (H-NS protein). Данный белок является важнейшим для жизнедеятельности бактерии, так как регулирует экспрессию многих генов [94, 95], обеспечивает плотную упаковку ДНК [96, 97] и влияет на клеточную защиту от АФК [98]. С помощью анализа сдвига электрофоретической подвижности (EMSA) было показано, что увеличение скорости диффузии этого белка вызвано ослаблением его связывания с ДНК при действии на систему ионов серебра. Таким образом, было подтверждено, что ионы серебра способны воздействовать на процессы экспрессии генов за счет нарушения структуры ДНК, а также препятствуя ее связыванию с H-NS белками.
Другим механизмом внутриклеточного антибактериального действия ионов серебра является окислительный стресс, вызываемый увеличением концентрации АФК в цитоплазме, что приводит к клеточным повреждениям [99]. В частности, известно, что генерация АФК приводит к повреждениям белков, липидов и ДНК [100].
Установлено несколько механизмов генерации АФК в бактериях при действии на них Ag+. Во-первых, как было указано ранее, ионы серебра воздействуют на мембранные ферменты ЭТЦ, что препятствует нормальному переносу электронов к субстрату. В частности, известно, что ионы серебра нарушают работу тиоредоксиновой (Trx) и глутатионовой (GSH) редокс-систем [101, 102]. Вероятно, это происходит за счет действия Ag+ на тиоредоксинредуктазы (TrxR) [103] и глутатионредуктазы (GR) [104], осуществляющие перенос электронов от НАДФ к субстратам. Так как основной функцией этих тиол-содержащих антиокислительных систем является поглощение АФК для поддержания окислительно-восстановительного гомеостаза и защита клетки от окислительного стресса, а нарушения в них приводят к неспособности клетки своевременно обезвреживать вновь сгенерированные АФК и, следовательно, их накоплению [105]. Во-вторых, так как АФК являются естественным продуктом дыхания бактерий, его стимуляция, вызванная упомянутой выше потерей трансмембранного градиента концентрации протонов [106], также может приводить к увеличению их концентрации. В-третьих, установлено, что действие Ag+ вызывает протекание в цитоплазматическом пространстве реакции Фентона – катализируемого ионами железа(II) разложения пероксида водорода на гидроксильный и гидропироксильный радикалы (HO• и HOO•, соответственно). В работе [90] показано, что это происходит за счет прямого действия Ag+ на Fe–S кластеры, присутствующие в большом количестве в ферментах дыхательной цепи, и приводит к увеличению концентрации ионов Fe2+ в цитоплазме. Кроме того, существует еще непрямой механизм разрушения Fe–S кластеров за счет действия на них АФК, таких как супероксид-анион и пероксид водорода [76, 90], в результате чего, генерация АФК может приобрести автокаталитический характер.
Таким образом, ионы серебра способны оказывать комплексное, многоуровневое действие на бактерии. Однако, встает вопрос о величине вклада того или иного механизма в суммарный антибактериальный эффект. В работе [76] было показано, что антибактериальная активность Ag+ не снижалась при добавлении в систему эквимолярного количества ДНК или не содержащей серу аминокислоты (глутамата). Напротив, эквимолярные количества цистеина, содержащего тиольные группы, полностью лишают Ag+ бактерицидных свойств. Таким образом, по данным исследования, именно тиольные группы, являются основными мишенями бактерицидной активности. Это, в свою очередь, может указывать на то, что действие ионов серебра на мембранные ферменты ЭТЦ, содержащие данные группы в большом количестве, является основным фактором их токсического действия. С другой стороны, в работе [106] с помощью вольтамперометрического измерения скорости изменения концентрации ионов серебра в растворе при взаимодействии Ag+ с живыми и мертвыми бактериальным клетками, показано, что лишь 40% взаимодействующего с бактериями серебра остается связанным на клеточной мембране, 60% же проникает в цитоплазму, что может говорить о существенном вкладе внутриклеточных факторов токсичности Ag+ в их общую антибактериальную активность. Остается не до конца ясным и вклад в антибактериальное действие окислительного стресса. Несмотря на то, что механизм генерации АФК всесторонне изучен, так как именно их действием обусловлена антибактериальная активность многих антибиотиков [107], проведено сравнительно немного исследований, подтверждающих бактерицидные свойства АФК, сгенерированных внутри бактериальной клетки при действии на нее ионов серебра. Одним из них стало исследование [108], в котором с помощью измерения антибактериальной активности ионов серебра, а также измерения активности супероксид-сенсорного белка SoxR при действии Ag+ на бактерии в аэробных и анаэробных условиях, было показано, что бактерицидное действие ионов серебра на E. coli и Staphylococcus aureus практически наполовину обусловлено действием именно окислительного стресса. Таким образом, было установлено, что важнейшим фактором для проявления окислительного стресса является доступ кислорода к клеткам бактерий. Данный факт, а также несколько противоречивые результаты описанных экспериментов, могут говорить о том, что ключевая стадия антибактериального действия ионов серебра значительно зависит от условий эксперимента.
Подводя итог, можно сказать, что ионы серебра способны оказывать губительное действие на многие жизненно важные системы бактериальной клетки. За счет связывания с мембранными белками и ферментами они вызывают резкое падение мембранного потенциала, нарушают нормальную работу ЭТЦ. Помимо этого, ионы серебра проникают внутрь бактериальной клетки, где взаимодействуют с ДНК и белковыми субъединицами рибосом, что приводит к нарушениям в экспрессии генов. В свою очередь, описанные нарушения жизненно важных для бактериальной клетки процессов приводят к невозможности поддержания клеточной структуры и вызывают морфологические изменения: нарушение целостности мембраны, ее отслоение от клеточной стенки. Кроме того, стимуляция дыхания, вызванная воздействием ионов серебра, их взаимодействие с ферментами ЭТЦ и высвобождение ионов Fe2+ приводит к генерации АФК внутри бактериальной клетки, что вызывает окислительные повреждения. Представляется, что критическая стадия антибактериального действия ионов серебра определяется набором условий: видом бактерий, концентрацией ионов серебра, типом питательной среды, присутствием/отсутствием достаточного количества питательных веществ, наличием хелатирующих серебро соединений и др.
Механизм антибактериального действия НЧ серебра. Антибактериальное действие НЧ серебра тесно связано с описанным выше антибактериальным действием ионов серебра, выделяющимися в две стадии c поверхности НЧ [109–111]. На первой стадии металлическое серебро окисляется под действием растворенного в среде кислорода, а на второй происходит растворение образовавшегося основного оксида в кислой среде [112]. Данный процесс окислительного растворения можно представить следующими уравнениями химических реакций:
Выделяющиеся с поверхности НЧ серебра ионы аналогично ионам Ag+, образующимся в результате диссоциации в воде неорганических солей серебра, действуют на тиольные группы мембранных белков и ферментов [113], увеличивая проницаемость мембраны и нейтрализуя ее заряд [114], проникают внутрь бактериальной клетки [115, 116], вызывают окислительный стресс [113, 117–119], а также повреждения в ДНК [120], что приводит к морфологическим изменениям в бактериальной клетке – дезорганизации мембраны [121], отслоению клеточной стенки, лизису [122], и, в конечном итоге, ее гибели.
Необходимость окисления НЧ серебра с выделением ионов Ag+ для проявления ими антибактериальной активности была показана в работах [123, 124]. В этих работах синтезированные и испытанные в анаэробных условиях (и, потому, не способные к окислительному растворению) НЧ серебра, не проявляли антибактериальной активности. При этом, антибактериальные свойства проявлялись этими же НЧ при наличии доступа к кислороду воздуха.
Однако в ряде исследований [115, 116, 125] обнаружено, что равновесная концентрация ионов серебра, образующихся в результате высвобождения с поверхности НЧ при наличии у дисперсий ингибирующего действия на бактерии, много меньше ингибирующей концентрации ионов серебра при действии на бактерии AgNO3 (табл. 1). Это свидетельствует о существовании альтернативного, специфического для НЧ серебра механизма антибактериального действия. В попытках установить такие механизмы было обнаружено, что некоторые НЧ серебра способны связываться с бактериальной мембраной [30]. Это может происходить за счет сродства НЧ к серосодержащим белкам внешней мембраны и электростатического притяжения между положительно заряженными ионами Ag+, адсорбирующихся на поверхности НЧ [112], и отрицательно заряженной мембраной бактериальной клетки [126]. При этом, связанные с поверхностью НЧ серебра нарушают структуру мембраны [30]. Кроме того, можно полагать, что адгезия НЧ серебра к поверхности мембраны может увеличивать локальную концентрацию ионов Ag+, а также ускорять переход НЧ в ионную форму за счет кислой среды, обусловленной трансмембранным градиентом концентрации протонов и необходимой на стадии растворения Ag2O. Совокупность этих факторов приводит к повышенному притоку ионов Ag+ в цитоплазматическое пространство клетки, создавая дополнительный фактор токсичности НЧ серебра (рис. 1), что и было показано в работе [115] с помощью измерения концентрации ионов Ag+ внутри бактериальной клетки и в питательной среде (табл. 1).
Таблица 1.
Концентрация ионов Ag+ в питательной среде и внутри клетки при воздействии на бактерии AgNO3 и НЧ серебра в ингибирующих рост концентрациях
| Вид бактерии | Метод оценки антибактериальной активности | Форма серебра | Концентрация Ag+ в питательной среде, мг/л | Внутриклеточная концентрация Ag+, мг/л | Ссылка |
|---|---|---|---|---|---|
| Pseudomonas aeruginosa | EC20 | AgNO3 | 107.1 | – | [125] |
| Наночастицы(45 нм; стабилизатор – цитрат) | <0.20 | – | |||
| E. coli | Анализ кривых роста числа КОЕ | AgNO3 | 3–9 | – | [116] |
| Наночастицы (142 нм; без стабилизатора) | 0.440 | – | |||
| E. coli | IC50 | AgNO3 | 2 | 2 | [115] |
| Наночастицы (9.1 нм; стабилизатор – цитрат) | 0.49 | 1.52 | |||
| Наночастицы (17.9 нм; стабилизатор – поливинилпирролидон) | 0.242 | 2.1 | |||
| Наночастицы (23.3 нм; стабилизатор – полиэтиленимин) | 0.59 | 2.4 |
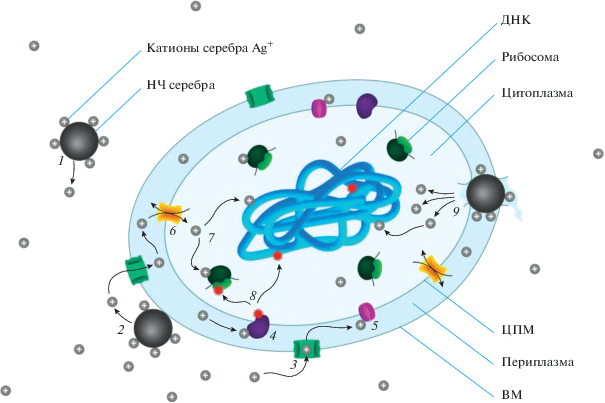
Рис. 1
Схематическое изображение антибактериального действия НЧ серебра на примере грамотрицательной бактерии: 1 – окислительное растворение НЧ серебра, приводящее к образованию ионов Ag+ в окружающем клетку пространстве; 2 – адгезия НЧ серебра к мембране; 3 – проникновение ионов Ag+ в периплазматическое пространство через порины; 4 – воздействие Ag+ на ферменты ЭТЦ, приводящее к нарушениям метаболизма и генерации АФК; 5 – воздействие Ag+ на белки ЦПМ, вызывающее нарушения транспортной функции клетки; 6 – проникновение Ag+ в цитоплазму через активные транспортеры Cu+; 7 – воздействие Ag+ на внутриклеточные компоненты, такие как рибосомы и ДНК, вызывающее нарушения в процессе экспрессии генов; 8 – окисление внутриклеточных компонентов бактерии образовавшимися АФК; 9 – нарушения в структуре мембраны бактерии, возникшие в результате адгезии к ней НЧ серебра и приводящие к увеличению внутриклеточной концентрации Ag+ и утечке внутриклеточных компонентов.
В некоторых работах заявлено о другом специфическом механизме действия НЧ серебра, связанном с их непосредственным проникновением внутрь живой бактериальной клетки. Данное явление описано при действии НЧ серебра как на грамположительные [127, 128], так и на и грамотрицательные [129] виды. Однако, в исследованиях наличие НЧ внутри клетки обнаруживалось с помощью двухмерных проекций ПЭМ, что оставляет возможность неправильной трактовки результатов. Кроме того, неверно интерпретировано как присутствие наноматериала внутри клетки [130] может быть и уранилацетатное окрашивание, наблюдаемое в виде электронно-плотного вещества [130]. Для решения этой проблемы, в работе [131] исследования ПЭМ проводились совместно с элементным анализом. В результате, было обнаружено, что НЧ серебра диаметром 10–50 нм не проникают в грамотрицательные E. coli. Напротив, в работе [132] с помощью тех же методов обнаружено, что НЧ диаметром 4–10 нм способны проникать в грамотрицательные Nitrosomonas europaea, хотя и в ограниченном количестве. Также наличие небольших (до 10 нм) НЧ было обнаружено внутри различных грамотрицательных бактерий с помощью анализа элементного картирования с использованием рентгеновской энергодисперсионной спектрометрии (EDS) в ПЭМ [30]. Кроме того, авторы последнего из приведенных исследований показали, что только связанные с поверхностью мембраны НЧ серебра способны проникать внутрь бактериальной клетки. В работах [115, 116] НЧ относительно больших размеров также не были обнаружены внутри бактериальных клеток. Исходя из представленных экспериментальных данных, был предложен возможный механизм проникновения НЧ серебра внутрь клетки: адгезия НЧ к поверхности мембраны вызывает изменения в ее морфологии, влияет на нормальную работу трансмембранного транспорта, увеличивает проницаемость, что, в свою очередь, может привести к поглощению НЧ. Однако, в таком случае встает вопрос о важности проникновения НЧ внутрь бактериальной клетки с точки зрения проявления ими антибактериальной активности. У прокариотических клеток отсутствуют механизмы поглощения больших НЧ, а если проникновение происходит за счет пассивной диффузии НЧ через разрушенную мембрану, то это говорит о том, что данная бактериальная клетка уже подверглась необратимым изменениями в структуре, лизису, и ее жизнеспособность представляется маловероятной. Таким образом, можно полагать, что проникновение НЧ серебра внутрь бактериальной клетки существенно затруднено, а если оно и возможно, то его вклад в антибактериальную активность представляется весьма спорным.
Механизмы антибактериального действия НЧ серебра были изучены и подтверждены с помощью протеомных и транскриптомных исследований в двух пионерских работах Маккуиллана с соавт. [116, 133]. В них методом ПЦР в реальном времени показано, что обе формы серебра воздействуют на системы гомеостаза меди, что объясняется схожестью путей метаболизма ионов меди и серебра. Кроме того, с помощью технологии ДНК-микрочипа, позволяющей оценивать экспрессию генов, был изучен полный транскриптомный ответ E. coli K12 на действие AgNO3 и НЧ серебра. Было подтверждено, что обе формы серебра воздействуют на E. coli K12 за счет нарушения трехмерной структуры белков, а также окислительного стресса. В частности, наибольший ответ был зарегистрирован в регуляции генов, ответственных за контроль денатурации белков, наблюдалось повышение регуляции генов системы soxRS (защита от окислительного стресса и поддержание окислительно-восстановительного гомеостаза), а также isc и suf (кодируют белки, участвующие в сборке железно-серных кластеров). В то же время наблюдалось снижение регуляции генов трансляции, что объясняется вызываемыми действием Ag+ нарушениями процессов экспрессии генов и необходимостью клетки выработать адаптивный ответ, прежде чем использовать ресурсы для биосинтеза новых белковых молекул. Схожие данные были получены при исследовании ответа на действие НЧ серебра других видов бактерий. Например, в работе [134] методом количественного протеомного анализа показано, что действие НЧ серебра на Pseudomonas aeruginosa также приводит к увеличению экспрессии генов, отвечающих за уменьшение окислительного стресса и снижению регуляции генов, кодирующих белки, необходимые для осуществления метаболических процессов и биосинтеза сложных макромолекул, а также структурных составляющих рибосом. В другой работе [135] механизмы действия НЧ серебра исследовались методами секвенирования РНК и количественного ПЦР с обратной транскрипцией. В нем в качестве объекта для изучения была выбрана грамотрицательная бактерия Klebsiella pneumoniae MGH78578, принадлежащая к семейству Enterobacteriaceae и обладающая множественной лекарственной устойчивостью. Как и в упомянутых ранее работах, наблюдалась активация систем, отвечающих за поддержание окислительно-восстановительного гомеостаза. В частности, наблюдалось увеличение экспрессии генов систем soxS и oxyR – двух главных транскрипционных факторов, отвечающих за окислительный стресс в Enterobacteriaceae. Кроме того, наблюдалось значительное увеличение экспрессии системы эффлюкса ионов серебра silCFBA, кодирующей трехкомпонентный SilCBA эффлюксный СВА транспортер и мембранную эффлюксную АТФ-азу P-типа SilP [14, 15], что объясняется попыткой бактерии вывести токсичные ионы серебра из цитоплазматического пространства.
Транскриптомные и протеомные исследования также позволили сопоставить между собой клеточные ответы бактерий на воздействие ионной и нанодисперсной форм серебра, что позволило обнаружить некоторые различия в механизмах их антибактериального действия. В работе [116] было показано, что ионы Ag+ в большей степени регулируют экспрессию генов, кодирующих биосинтез поринов, а НЧ – системы эффлюкса, что указывает на различные пути транспорта ионов Ag+ внутрь бактериальной клетки при действии этих двух форм. В работе [133] следствием специфического действия НЧ, но не ионов серебра, на E. coli K12 являлось снижение регуляции генов биосинтеза липидов и жирных кислот, являющихся компонентами мембраны, что может служить подтверждением факта специфического действия НЧ на мембрану, обусловленного их адгезией к ее поверхности. Кроме того, НЧ сильнее воздействовали на регуляцию белков, ответственных за внутриклеточные процессы трансляции, в то время как ионная форма серебра активнее влияла на регуляцию транспортных мембранных белков. Данный факт позволяет выдвинуть предположение, что нанодисперсная форма серебра сильнее влияет на внутриклеточные процессы в бактериальной клетке, в то время как действие ионной формы в основном обусловлено воздействием на мембранные белки и ферменты. Подтверждением данной гипотезы является работа [125], в которой был изучен протеомный ответ Pseudomonas sp. M1 на воздействие НЧ и ионов серебра. Как и в работе [133], было обнаружено, что НЧ сильнее влияют на внутриклеточный процесс трансляции, что отражается в увеличении количества белков, входящих в структуру рибосом и/или связывающихся с РНК. В свою очередь, ионы Ag+ активнее влияли на трансмембранный транспорт, что выражалось в увеличении количества белков ЦПМ, поринов и других белков внешней мембраны, а также на процессы денатурации белков. Кроме того, исследование активности антиокислительных ферментов, показало, что она возрастала сильнее под действием Ag+, чем НЧ, что также косвенно подтверждает ранее высказанное предположение о том, что Ag+ более активно воздействуют на мембранные белки, в том числе ферменты ЭТЦ.
В другой важной работе [115] для определения физиологических путей воздействия НЧ и ионов серебра на бактерии, была исследована полногеномная библиотека E. coli, состоящая примерно из 4000 мутантов, каждый с делецией одного определенного гена. Как и в работах Маккуиллана с соавт., среди генов, экспрессия которых играет существенную роль при воздействии обеих форм серебра, было большое количество генов, участвующих в регуляции гомеостаза меди. В частности, мутанты с делецией генов cueR (кодирует Cu+-зависимый транскриптомный регулятор) и cusS (являющийся частью двухкомпонентной регуляторной системы, ответственной за экспрессию cueR) оказывались более чувствительными ко всем формам серебра, что, вероятно, связано с их ограниченными возможностями эффлюкса токсичных ионов Ag+ из цитоплазмы. К увеличению восприимчивости к обеим формам серебра также приводила делеция генов katE (кодирует каталазу, индуцируемую при высоких уровнях концентрации пероксида) и recA (индуцируется повреждениями ДНК), что подтвердило ранее описанный механизм индуцирования ионами серебра окислительного стресса в бактериальной клетке, который приводит к повреждениям ДНК. Кроме того, среди генов, отсутствие которых приводит к увеличению чувствительности фенотипа к любой форме серебра, были обнаружены некоторые гены, кодирующие биосинтез белков, связанных с внутренней мембраной. Специфичным для НЧ было увеличение эффективности их действия на бактерии с делецией генов, ответственных за синтез липополисахаридов. Вероятно, это связано с упрощением адгезии НЧ к бактериям, неспособным создать защитный липополисахаридный слой на своей поверхности, что, в свою очередь, приводит к увеличению токсичности НЧ за счет повреждений мембраны и увеличения внутриклеточной концентрации ионов серебра. К тому же, авторы работы отмечают, что различные НЧ (с различающимися размерами частиц и зарядом поверхности) имели различную активность в отношении бактерий с делецией того или иного гена, что говорит о различиях в механизме антибактериального действия НЧ серебра с различными физико-химическими параметрами.
Перспективными с точки зрения изучения механизмов антибактериального действия различных соединений, в том числе серебра, представляются развивающиеся в последние годы хемометрические исследования, связанные с анализом большого количества экспериментальных данных [136]. В качестве примера можно привести работу [137], в которой изучение механизма действия НЧ серебра в отношении E. coli было выполнено комбинированием методов ИК-спектроскопии и хемометрических исследований. В частности, проводилось сравнение характерных областей ИК-спектра поглощения E. coli, подвергшихся воздействию НЧ серебра, и четырех классов антибиотиков с известным механизмом антибактериального действия методами математической обработки и классификации данных, такими как, разведочный и кластерный анализ [136]. По результатам исследования, наибольшее сходство со спектром поглощения E. coli, подвергшихся воздействию НЧ серебра имели спектры поглощения бактерий, подвергшихся воздействию сульфадиазина. Механизм действия сульфадиазина заключается в ингибировании фермента дигидроптероатсинтазы, отвечающего за каталитическое образование фолиевой кислоты – ключевого предшественника в синтезе ДНК у бактерий [138]. Полученные данные могут быть дополнительным косвенным подтверждением установленного ранее внутриклеточного механизма воздействия НЧ серебра на ДНК как ключевой мишени их антибактериального действия, хотя его пути, вероятно, отличаются от путей воздействия сульфадиазина. В другой упоминаемой ранее работе [135] сравнение механизмов НЧ серебра и различных антибиотиков было выполнено с помощью сопоставления паттернов транскриптомного ответа при их действии на K. pneumoniae MGH78578. По результатам исследования наибольшая схожесть в изменении регуляции генов проявляется при действии НЧ серебра и триклозана. Триклозан является антимикробным агентом широкого спектра действия, который воздействует на бактерии за счет подавления синтеза жирных кислот [139]. О наличии схожего механизма воздействия у НЧ серебра говорит и значительное снижение в регуляции генов fabA/H/D/G/F/B, ответственных за биосинтез жирных кислот, установленное в этой же работе. Примечательно, что аналогичные данные были получены в работе [133] при изучении транскриптомного ответа E. coli K12 на действие НЧ серебра, но не AgNO3, что косвенно подтвердило специфичность взаимодействия нанодисперсного серебра с мембраной бактерии, по сравнению с ионной формой этого металла. При этом, данный механизм вносит существенный вклад в общий антибактериальный эффект, что подтверждает выполненное в [135] исследование действия НЧ серебра на K. pneumoniae MGH785781soxS с ослабленной возможностью ответа на окислительный стресс. В нем было показано, что изменения в гене soxS, отвечающего за защиту от окислительного стресса, не приводят к значительному уменьшению минимальной ингибирующей концентрации НЧ серебра. Это, в свою очередь, указывает на то, что окислительный стресс не вносит решающего вклада в антибактериальный эффект. Последний, очевидно, обусловлен сочетанием как окислительного стресса, так и специфичного только для НЧ серебра ингибирования биосинтеза жирных кислот.
В обзоре после рассмотрения основных механизмов биологического действия ионов серебра на бактериальные клетки, проведен сравнительный анализ экспериментальных данных, полученных в результате транскриптомных и протеомных исследований последних лет, целью которых являлось установление различий в механизмах антибактериальной активности ионов и НЧ серебра. Действительно, НЧ оказывают свое ключевое воздействие за счет ионов Ag+, выделяющихся с их поверхности при окислении серебра как в окружающей среде, так и в непосредственной близости к клеточной мембране. Однако НЧ являются не только резервуаром ионного серебра, но и проявляют специфический механизм его доставки внутрь бактериальной клетки. Ассоциируясь с мембраной, вызывая нарушения ее структуры, а также увеличивая локальную концентрацию ионов Ag+, НЧ увеличивают внутриклеточную концентрацию Ag+, что делает именно ее, а не концентрацию Ag+ в окружающей клетку среде, основным фактором токсичности НЧ серебра. По этой причине, хотя основные мишени в бактериальной клетке для ионов и НЧ серебра совпадают, НЧ влияют, в первую очередь, на внутриклеточные процессы, такие как трансляция и синтез необходимых для поддержания жизнедеятельности биомолекул, например, жирных кислот. Ионная же форма серебра более активно воздействует на мембранные белки и ферменты, нарушая нормальную работу электронно-транспортной цепи, трансмембранного транспорта, вызывая окислительный стресс и препятствуя метаболизму бактерий.
Не до конца выясненными остаются вопросы, связанные с величиной вклада той или иной стадии механизма воздействия серебра в суммарный антибактериальный эффект и ее зависимости от внешних факторов, в частности типа используемого стабилизатора НЧ. В свете продолжающегося поиска новых антибактериальных агентов, эти вопросы представляются нам весьма актуальными и заслуживающими дальнейшего развития, поскольку гибкое регулирование коллоидно-химических свойств НЧ и связанное с этим изменение ключевой стадии их действия на бактерии потенциально может привести к созданию новых классов антимикробных препаратов, выработка лекарственной устойчивости бактериями к действию которых будет существенно затруднена.
Список литературы
Russell A.D., Hugo W.B. // Prog. Med. Chem. 1994. V. 31. № 1. P. 351–370.
Klasen H.J. // Burns. 2000. V. 26. № 2. P. 117–130.
Credé C. // Arch. Gynak. 1881. V. 17. № 1. P. 50–53.
Alexander J.W. // Surg. Infect. 2009. V. 10. № 3. P. 289–292.
Krutyakov Y.A., Kudrinskiy A.A., Kuzmin V.A., Pyee J., Gusev A.A., Vasyukova I.A., Zakharova O.V., Lisichkin G.V. // Nanomaterials. 2021. V. 11. № 2. P. 332–344.
Truszczyński M., Posyniak A., Pejsak Z. // Med. Wet. 2013. V. 69. № 3. P. 131–135.
Weese J.S. // Vet. Rec. 2001. V. 169. № 5. P. 122–123.
von Samson-Himmelstjerna G., Blackhall W. // Vet. Parasitol. 2005. V. 132. № 2. P. 223–239.
Morley P.S., Apley M.D., Besser T.E., Burney D.P., Fedorka-Cray P.J., Papich M.G., Traub-Dargatz J.L., Weese J.S. // J. Vet. Intern. Med. 2005. V. 19. № 4. P. 617–629.
Persoons D., Van Hoorebeke S., Hermans K., Butaye P., de Kruif A., Haesebrouck F., Dewulf J. // Emerg. Infect. Dis. 2009. V. 15. № 3. P. 452–453.
Klasen H.J. // Burns. 2000. V. 26. № 2. P. 131–138.
Yamanaka M., Hara K., Kudo J. // Appl. Environ. Microbiol. 2005. V. 71. № 11. P. 7589–7593.
Mijnendonckx K., Leys N., Mahillon J., Silver S., Van Houdt R. // Biometals. 2013. V. 26. № 4. P. 609–621.
Silver S. // FEMS Microbiol. Rev. 2003. V. 27. № 2. P. 341–353.
Silver S., Phung T., Silver G. // J. Ind. Microbiol. Biotechnol. 2006. V. 33. № 7. P. 627–34.
Sánchez-López E., Gomes D., Esteruelas G., Bonilla L., Lopez-Machado AL., Galindo R., Cano A., Espina M., Ettcheto M., Camins A., Silva A.M., Durazzo A., Santini A., Garcia M.L., Souto E.B. // Nanomaterials (Basel). 2020. V. 10. № 2. https://doi.org/10.3390/nano10020292
Makvandi P., Wang C., Zare E.N., Borzacchiello A., Niu L., Tay F.R. // Advanced Functional Materials. 2020. V. 30. № 22. Article № 1910021. https://doi.org/10.1002/adfm.201910021
Khan I., Saeed K., Khan I. // Arab. J. Chem. 2019. V. 12. № 7. P. 908–931.
Lee S.H., Jun B.H. // Int. J. Mol. Sci. 2019. V. 20. № 4. https://doi.org/10.3390/ijms20040865
Roy A., Bulut O., Some S., Mandal A., Yilmaz M.D. // RSC Advances. 2019. V. 9. P. 2673–2702.
Kudrinskiy A., Zherebin P., Gusev A., Shapoval O., Pyee J., Lisichkin G., Krutyakov Y. // Nanomaterials (Basel). 2020 V. 10. № 8. https://doi.org/10.3390/nano10081459
Chernousova S., Epple M. // Angew. Chem. Int. Ed. Engl. 2013. V. 52. № 6. P. 1636–1653.
Kędziora A., Speruda M., Krzyżewska E., Rybka J., Łukowiak A., Bugla-Płoskońska G. // Int. J. Mol. Sci. 2018. V. 19. № 2. https://doi.org/10.3390/ijms19020444
Rai M., Yadav A., Gade A. // Biotechnol. Adv. 2009. V. 27. № 1. P. 76–83.
Yousaf H., Mehmood A., Ahmad K.S., Raffi M. // Materials Science & Engineering C: Materials for Biological Applications. 2020. V. 112. Article № 110901.
Shu M., He F., Li Z., Zhu X., Ma Y., Zhou Z., Yang Z., Gao F., Zeng M. // Nanoscale Res. Lett. 2020. V. 15. № 1. https://doi.org/10.1186/s11671-019-3244-z
Crisan C.M., Mocan T., Manolea M., Lasca L.I., Tăbăran F-A., Mocan L. // Applied Sciences. 2021. V. 11. № 3. Article № 1120.
Agnihotri S., Mukherji S., Mukherji S. // Nanoscale. 2013. V. 5. № 16. P. 7328–7340.
Radzig M.A., Nadtochenko V.A., Koksharova O.A., Kiwi J., Lipasova V.A., Khmel I.A. // Colloids. Surf. B: Biointerfaces. 2013. V. 102. P. 300–306.
Morones J.R., Elechiguerra J.L., Camacho A., Holt K., Kouri J.B., Ramírez J.T., Yacaman M.J. // Nanotechnology. 2005. V. 16. № 10. P. 2346–2353.
Sondi I., Salopek-Sondi B. // J. Colloid. Interface. Sci. 2004. V. 275. № 1. P. 177–182.
Mondal A., Chowdhury S., Mondal N.K. et al. // Int. J. Environ. Sci. Technol. 2021. https://doi.org/10.1007/s13762-021-03181-w
Kora A.J., Mounika J., Jagadeeshwar R. // Fungal Biol. 2020. V. 124. № 7. P. 671–681.
Salleh A., Naomi R., Utami N.D., Mohammad A.W., Mahmoudi E., Mustafa N., Fauzi M.B. // Nanomaterials (Basel). 2020. V. 10. № 8. Article № 1566.
Teirumnieks E., Balchev I., Ghalot R.S., Lazov L. // Laser Physics. 2020. V. 31. № 1. Article № 013001.
Lu L., Sun R.W., Chen R., Hui C.K., Ho C.M., Luk J.M., Lau G.K., Che C.M. // Antivir. Ther. 2008. V. 13. № 2. P. 253–262.
Rogers J.V., Parkinson C.V., Choi Y.W., Speshock J.L., Hussain S.M. // Nanoscale Res. Lett. 2008. V. 3. № 4. P. 129–133.
Lara H.H., Garza-Treviño E.N., Ixtepan-Turrent L., Singh D.K. // J. Nanobiotechnology. 2011. V. 9. https://doi.org/10.1186/1477-3155-9-30
D’Lima L., Phadke M., Ashok V. // New J. Chemistry. 2020. V. 44. № 12. P. 4935–4941.
Shirzadi-Ahodashti M., Hashemi Z., Mortazavi Y., Khormali, K., Mortazavi-Derazkola S., Ebrahimzadeh M.A. // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2021. V. 617. Article № 126383.
Rai M.K., Deshmukh S.D., Ingle A.P., Gade A.K. // J. Appl. Microbiol. 2012. V. 112 № 5. P. 841–852.
Wang S.H., Chen C.C., Lee C.H., Chen X.A., Chang T.Y., Cheng Y.C., Young J.J., Lu J.J. // Int. J. Biol. Macromol. 2020 V. 143. P. 724–731.
Lansdown A.B. // Toxicol. 2007. V. 37. № 3. P. 237–50.
Lansdown A.B. // Adv. Pharmacol. Sci. 2010. V. 2010. https://doi.org/10.1155/2010/910686
Wijnhoven S.W.P., Peijnenburg W., Herberts C.A., Hagens W.I., Oomen A.G., Heugens E.H.W., Roszek B., Bisschops J., Gosens I., van De Meent D., Dekkers S., Dejong W.H., van Zijverden M., Sips A., Geertsma R.E. // J. Nanotoxicology. 2009. V. 3. № 2. P. 109–138.
Sácký J., Leonhardt T., Borovička J., Gryndler M., Briksí A., Kotrba P. // Fungal Genet. Biol. 2014. V. 67. P. 3–14.
Chang A.L., Khosravi V., Egbert B.A. // J. Cutan. Pathol. 2006. V. 33 № 12. P. 809–811.
Ahmed M.K., Zayed M.A., El-Dek S.I., Hady M.A., El Sherbiny D.H., Uskoković V. // Bioact. Mater. 2021. V. 6. № 7. P. 2070–2088.
Mishra M., Kumar H., Tripathi K. // Digest J. Nanomaterials and Biostructures. 2008. V. 3. № 2. P. 49–54.
Atiyeh B.S., Costagliola M., Hayek S.N., Dibo S.A. // Burns. 2007. V. 33. № 2. P. 139–148.
Nadworny P.L., Wang J.F., Tredget E.E., Burrell R.E. // J. Inflamm. 2010. V. 7. № 1. https://doi.org/10.1186/1476-9255-7-13
Boucher W., Stern J.M., Kotsinyan V., Kempuraj D., Papaliodis D., Cohen M.S., Theoharides T.C. // J. Urology. 2008. V. 179. № 4. P. 1598–1602.
Chen X., Schluesener H.J. // Toxicol. Lett. 2008. V. 176. № 1. P. 1–12.
Yin I.X., Zhang J., Zhao I.S., Mei M.L., Li Q., Chu C.H. // Int. J. Nanomedicine. 2020. V. 15. P. 2555–2562.
Krutyakov Yu., Klimov A., Violin B., Kuzmin V., Ryzhikh V., Gusev A., Zakharova O., Lisichkin G. // Europ. J. Nanomed. 2016. V. 8. № 4. P. 185–194.
Salata O. // J. Nanobiotechnology. 2004. V. 2. № 1. https://doi.org/10.1186/1477-3155-2-3
Nowack B., Krug H.F., Height M. // Environ. Sci. Technol. 2011. V. 45. № 4. P. 1177–1183.
Kudrinskiy A.A., Krutyakov Yu.A., Olenin A.Yu., Romanovskaya G.I., Vasilyeva S.Yu., Lisichkin G.V. // J. Fluorescence. 2009. V. 19. № 3. P. 473–478.
Крутяков Ю.А., Кудринский А.А., Оленин А.Ю., Лисичкин Г.В. // Успехи химии. 2008. Т. 77. № 3. С. 242–269
Quadros M.E., Marr L.C. // Environ. Sci. Technol. 2011. V. 45. № 24. P. 10713–10719.
Zhao L., Lu L., Wang A., Zhang H., Huang M., Wu H., Xing B., Wang Z., Ji R. // J. Agric. Food Chem. 2020. V. 68. № 7. P. 1935–1947.
Kutuzova I.A., Kokaeva L.Y., Pobendinskaya M.A., Krutyakov Y.A., Skolotneva E.S., Chudinova E.M., Elansky S.N. // J. Plant. Path. 2017. V. 99. № 3. P. 635–642.
Gusev A.A., Kudrinsky A.A., Zakharova O.V., Klimov A.I., Zherebin P.M., Lisichkin G.V., Vasyukova I.A., Denisov A.N., Krutyakov Y.A. // Mater. Sci. Eng. C: Mater. Biol. Appl. 2016. V. 62. P. 152–159.
He Y., Li H., Fei X., Peng L. // Carbohydr. Polym. 2021. V. 252. Article № 117156.
Edwards-Jones V. // Lett. Appl. Microbiol. 2009. V. 49. № 2. P. 147–152.
Qumar U., Hassan J., Naz S., Haider A., Raza A., Ul-Hamid A., Haider J., Shahzadi I., Ahmad I., Ikram M. // Nanotechnology. 2021. V. 32. № 25. Article № 255704.
Gangadharan D., Harshvardan K., Gnanasekar G., Dixit D., Popat K.M., Anand P.S. // Water Res. 2010. V. 44. № 18. P. 5481–5487.
Krutyakov Y.A., Zherebin P.M., Kudrinskiy A.A., Zubavichus Y.V., Presniakov M.Y., Yapryntsev A.D., Karabtseva A.V., Mikhaylov D.M., Lisichkin G.V. // J. Physics D – Applied Physics. 2016. V. 49. https://doi.org/10.1088/0022-3727/49/37/375501
Marambio-Jones C., Hoek E.M.V. // J. Nanopart. 2010. V. 12. P. 1531–1551.
Durán N., Durán M., de Jesus M.B., Seabra A.B., Fávaro W.J., Nakazato G. // Nanomedicine. 2016. V. 12. № 3. P. 789–799.
Krutyakov Yu.A., Kudrinskiy A.A., Zherebin P.M., Lisichkin G.V. // J. Nanoparticle Research. 2019. V. 21. № 4. Article № 69.
Liau S.Y., Read D.C., Pugh W.J., Furr J.R., Russell A.D. // Lett. Appl. Microbiol. 1997. V. 25. № 4. P. 279–283.
Masip L., Veeravalli K., Georgiou G. // Antioxid. Redox. Signal. 2006 V. 8. № 5. P. 753–762.
Fenoglio I., Corazzari I., Francia C., Bodoardo S., Fubini B. // Free Radic. Res. 2008. V. 42. № 8. P. 437–745.
Zeiri L., Bronk B.V., Shabtai Y., Eichler J., Efrima S. // Appl. Spectrosc. 2004. V. 58 № 1. P. 33–40.
Gordon O., Vig Slenters T., Brunetto P.S., Villaruz A.E., Sturdevant D.E., Otto M., Landmann R., Fromm K.M. // Antimicrob. Agents Chemother. 2010. V. 54. № 10. P. 4208–4218.
Dibrov P., Dzioba J., Gosink K.K., Häse C.C. // Antimicrob Agents Chemother. 2002. V. 46. № 8. P. 2668–2670.
Yudkin J. // Enzymologia. 1937. V. 2. P. 161–170.
Jung W.K., Koo H.C., Kim K.W., Shin S., Kim S.H., Park Y.H. // Appl. Environ. Microbiol. 2008. V. 74. P. 2171–2178.
Nikaido H. // J. Bacteriology. 1999. V. 181. № 1. P. 4–8.
Silva J.J.R.F.D., Williams R.J.P. The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. N.Y.: Oxford University Press, 1991. 561 p.
Argüello J.M., Raimunda D., Padilla-Benavides T. // Front. Cell Infect. Microbiol. 2013. V. 5. № 3. Article № 73.
Chacón K.N., Mealman T.D., McEvoy M.M., Blackburn N.J. // Proceedings of the National Academy of Sciences of the USA. 2014. V. 111. № 43. P. 15373–15378.
Bertinato J., Cheung L., Hoque R., Plouffe L.J. // J. Trace Elem. Med. Biol. 2010. V. 24. № 3. P. 178–84.
Puig S., Lee J., Lau M., Thiele D.J. // J. Biol. Chem. 2002. V. 277. № 29. P. 26021–26030.
Eisses J.F., Kaplan J.H. // J. Biol. Chem. 2005. V. 280. № 44. P. 37159–37168.
Lewinson O., Lee A.T., Rees D.C. // Proc. Natl. Acad. Sci. 2009. V. 106. № 12. P. 4677–4682.
Tu A.T., Reinosa J.A. // Biochemistry. 1966. V. 5. № 10. P. 3375–3383.
Arakawa H., Neault J.F., Tajmir-Riahi H.A. // Biophys J. 2001. V. 81. № 3. P. 1580–1587.
Morones-Ramirez J.R., Winkler J.A., Spina C.S., Collins J.J. // Sci. Transl. Med. 2013. V. 5. https://doi.org/10.1126/scitranslmed.3006276
Sadoon A.A., Khadka P., Freeland J., Gundampati R.K., Manso R.H., Ruiz M., Krishnamurthi V.R., Thallapuranam S.K., Chen J., Wang Y. // Appl. Environ. Microbiol. 2020. V. 86. № 6. https://doi.org/10.1128/AEM.02479-19
Freeland J., Khadka P., Wang Y. // Phys. Rev. E. 2018. V. 98. № 6. https://doi.org/10.1103/PhysRevE.98.062403
Sonnenfield J.M., Burns C.M., Higgins C.F., Hinton J.C. // Biochimie. 2001. V. 83. № 2. P. 243–249.
Dorman C.J. // Nat. Rev. Microbiol. 2004. V. 2. № 5. P. 391–400.
Gao Y., Foo Y.H., Winardhi R.S., Tang Q., Yan J., Kenney L.J. // Proc. Natl. Acad. Sci. 2017. V. 114. № 47. P. 12560–12565.
Dame R.T., Wyman C., Goosen N. // Nucleic Acids Res. 2000. V. 28. № 18. P. 3504–3510.
Winardhi R.S., Yan J., Kenney L.J. // Biophys. J. 2015. V. 109. № 7. P. 1321–1329.
Gérard F., Dri A.M., Moreau P.L. // Microbiology. 1999. V. 145. № 7. P. 1547–1562.
Sies H. // Exp. Physiol. 1997. V. 82. № 2. P. 291–295.
Cabiscol E., Tamarit J., Ros J. // Int. Microbiol. 2000 V. 3. № 1. P. 3–8.
Zou L., Lu J., Wang J., Ren X., Zhang L., Gao Y., Rottenberg M.E., Holmgren A. // EMBO Mol. Med. 2017 V. 9. № 8. P. 1165–1178.
Zou L., Wang J., Gao Y., Ren X., Rottenberg ME., Lu J., Holmgren A. // Sci. Rep. 2018. V. 8. № 1. https://doi.org/10.1038/s41598-018-29313-w
Holmgren A., Björnstedt M. // Methods Enzymol. 1995. V. 252. P. 199–208.
Lillig C.H., Holmgren A. // Antioxid. Redox. Signal. 2007. V. 9. № 1. P. 25–47.
Messner K.R., Imlay J.A. // J. Biol. Chem. 1999. V. 274. № 15. P. 10119–10128.
Holt K.B., Bard A.J. // Biochemistry. 2005. V. 44. № 39. P. 13214–13223.
Kohanski M.A., Dwyer D.J., Hayete B., Lawrence C.A., Collins J.J. // Cell. 2007. V. 130. № 5. P. 797–810.
Park H.J., Kim J.Y., Kim J., Lee J.H., Hahn J.S., Gu M.B., Yoon J. // Water Res. 2009. V. 43. № 4. P. 1027–1032.
Matai I., Sachdev A., Dubey P., Kumar S.U., Bhushan B., Gopinath P. // Colloids Surf. B: Biointerfaces. 2014. V. 115. P. 359–367.
Smetana A.B., Klabunde K.J., Marchin G.R., Sorensen C.M. // Langmuir. 2008. V. 24. № 14. P. 7457–7464.
Klimov A.I., Zherebin P.M., Gusev A.A., Kudrinskiy A.A., Krutyakov Y.A. // IOP Conf. Ser.: Materials Science and Engineering. 2015 V. 98. № 012034. P. 1–9.
Liu J., Hurt R.H. // Environ. Sci. Technol. 2010. V. 44. № 6. P. 2169–2175.
Hwang E.T., Lee J.H., Chae Y.J., Kim Y.S., Kim B.C., Sang B.I., Gu M.B. // Small. 2008. V. 6. P. 746–50.
Ramalingam B., Parandhaman T., Das S.K. // ACS Appl. Mater. Interfaces. 2016. V. 8. № 7. P. 4963–4976.
Ivask A., Elbadawy A., Kaweeteerawat C., Boren D., Fischer H., Ji Z., Chang C.H., Liu R., Tolaymat T., Telesca D., Zink J.I., Cohen Y., Holden P.A., Godwin H.A. // ACS Nano. 2014. V. 8. № 1. P. 374–386.
McQuillan J.S., Infante H.G., Stokes E., Shaw A.M. // Nanotoxicology. 2012. V. 6. № 8. P. 857–866.
Adeyemi O.S., Shittu E.O., Akpor O.B., Rotimi D., Batiha G.E. // EXCLI J. 2020. V. 19. P. 492–500.
Xu H., Qu F., Xu H., Lai W., Andrew Wang Y., Aguilar Z.P., Wei H. // Biometals. 2012. V. 25. № 1. P. 45–53.
Kim J.S., Kuk E., Yu K.N., Kim J.H., Park S.J., Lee H.J., Kim S.H., Park Y.K., Park Y.H., Hwang C.Y., Kim Y.K., Lee Y.S., Jeong D.H., Cho M.H. // Nanomedicine. 2007. V. 3. № 1. P. 95–101.
Vishnupriya S., Chaudhari K., Jagannathan R., Pradeep T. // Particle & Particle Systems Characterization. 2013. V. 30. № 12. P. 1056–1062.
Akter S., Huq M.A. // Artif. Cells Nanomed. Biotechnol. 2020. V. 48 № 1. P. 672–682.
Du J., Hu Z., Dong W., Wang Y., Wu S., Bai Y. // Microchemical J. 2019. V. 147. P. 333–338.
Xiu Z.M., Ma J., Alvarez P.J. // Environ. Sci. Technol. 2011. V. 45. № 20. P. 9003–9008.
Xiu Z.M., Zhang Q.B., Puppala H.L., Colvin V.L., Alvarez P.J. // Nano Lett. 2012. V. 12. № 8. P. 4271–4275.
Barros D., Pradhan A., Mendes V.M., Manadas B., Santos P.M., Pascoal C., Cassio F. // Env. Science-Nano. 2019. V. 6. № 4. P. 1207–1218.
Abbaszadegan A., Ghahramani Y., Gholami A., Hemmateenejad B., Dorostkar S., Nabavizadeh M. // J. Nanomaterials. 2015. V. 2015. Article № 720654.
Dror-Ehre A., Mamane H., Belenkova T., Markovich G., Adin A. // J. Colloid Interface Sci. 2009. V. 339. № 2. P. 521–526.
Habash M.B., Park A.J., Vis E.C., Harris R.J., Khursigara C.M. // Antimicrob. Agents Chemother. 2014. V. 58. № 10. P. 5818–5830.
Mirzajani F., Ghassempour A., Aliahmadi A., Esmaeili M.A. // Res. Microbiol. 2011. V. 162. № 5. P. 542–549.
Brandenberger C., Clift M.J., Vanhecke D., Mühlfeld C., Stone V., Gehr P., Rothen-Rutishauser B. // Part. Fibre Toxicol. 2010. V. 7. № 15. https://doi.org/10.1186/1743-8977-7-15
Chamakura K., Perez-Ballestero R., Luo Z., Bashir S., Liu J. // Colloids. Surf. B: Biointerfaces. 2011. V. 84. № 1. P. 88–96.
Yuan Z., Li J., Cui L., Xu B., Zhang H., Yu C.P. // Chemosphere. 2013. V. 90. № 4. P. 1404–1411.
McQuillan J.S., Shaw A.M. // Nanotoxicology. 2014. V. 1. P. 177–84.
Lia S.J., Zhang, Y.P., Pan X.H., Zhu F.Z., Jiang C.Y., Liu Q.Q., Cheng Z.Y., Dai G., Wu G.J., Wang L.Q., Chen L.Y. // International J. Nanomedicine. 2019. V. 14. P. 1469–1487.
Pareek V., Devineau S., Sivasankaran S.K., Bhargava A., Panwar J., Srikumar S., Fanning S. // Front. Microbiol. 2021. V. 12. Article № 638640.
Brereton R.G., Jansen J., Lopes J., Marini F., Pomerantsev A., Rodionova O., Roger J.M., Walczak B., Tauler R. // Anal. Bioanal. Chem. 2018. V. 410. P. 6691–6704.
Neves A.C.O., Viana A.D., Menezes F.G., Neto A.O.W., Melo M.C.N., Gasparotto L. // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2021. V. 253. Article № 119558.
Li P., Wu L., Li B., Zhao Y., Qu P. // Mater. Sci. Eng. 2016. V. 60. P. 54–59.
McMurry L.M., Oethinger M., Levy S.B. // Nature. 1998. V. 394. № 6693. P. 531–532.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


