Прикладная биохимия и микробиология, 2021, T. 57, № 4, стр. 342-352
Оптимизация анаэробной продукции пировиноградной кислоты из глюкозы рекомбинантными штаммами Escherichia coli С нарушенной способностью к брожению за счет форсированного гидролиза АТФ
А. Ю. Скороходова 1, *, А. Ю. Гулевич 1, В. Г. Дебабов 1
1 Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
117312 Москва, Россия
* E-mail: sasha.skorokhodova@gmail.com
Поступила в редакцию 10.12.2020
После доработки 25.01.2021
Принята к публикации 22.02.2021
Аннотация
Исследована анаэробная продукция пировиноградной кислоты из глюкозы рекомбинантными штаммами Escherichia coli с нарушенной способностью к брожению при дыхании с нитратом в качестве внешнего акцептора электронов. Базовый штамм E. coli MG1655 ∆ackA-pta, ∆poxB, ∆ldhA, ∆adhE, ∆ptsG, PLglk, PtacgalP, ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF при нитратном дыхании в минимальной солевой среде лишенной ионов аммония конвертировал глюкозу в пировиноградную кислоту с выходом 1.72 моль/моль, секретируя молочную кислоту в качестве единственной детектированной примеси. Делеция в штамме генов lldD и dld приводила к прекращению секреции данного побочного продукта. Соответствующий штамм, лишенный респираторных L- и D-лактатдегидрогеназ LldD и Dld, синтезировал пировиноградную кислоту из глюкозы с выходом 1.76 моль/моль, не полностью потребляя доступный углеводный субстрат. Форсированный гидролиз АТФ, за счет действия в клетке футильных циклов пировиноградная кислота – щавелевоуксусная кислота – яблочная кислота – пировиноградная кислота или пировиноградная кислота – фосфоенолпируват – пировиноградная кислота, обеспечивал выраженный рост потребления рекомбинантами глюкозы при сохранении уровней конверсии субстрата в целевой продукт. В результате, при анаэробном нитратном дыхании и форсированном гидролизе АТФ, достигнут выход пировиноградной кислоты из глюкозы составляющий 1.77–1.78 моль/моль, при практически исчерпывающем потреблении рекомбинантами субстрата и минимальном или же отсутствующем формировании побочных продуктов.
Пировиноградная кислота является не только одним из ключевых центральных метаболитов живой клетки, но и важным промышленно значимым соединением, способным служить удобным предшественником в последующем синтезе широкого спектра веществ с высокой добавленной стоимостью. С использованием в качестве стартового материала пировиноградной кислоты в ходе органического синтеза могут быть получены пищевые добавки, лекарственные препараты, различные растворители, такие как ацетальдегид [1, 2] и бутанол [3], D/L-аланин, ароматические L-аминокислоты [4], 4-дигидрокси-L-фенилаланин [5] и N-ацетил-D-нейраминовая кислота [6]. Кроме того, пировиноградная кислота может быть непосредственно использована в питании, как диетическая добавка, обладающая множеством полезных для здоровья свойств [7].
В настоящее время пировиноградную кислоту получают нефтехимическим синтезом. Однако современные стратегии устойчивого развития предполагают постепенную, но неуклонную замену продуктов химической промышленности соответствующими продуктами микробной биотехнологии. Таким образом, получение микробных продуцентов пировиноградной кислоты, способных к эффективному биосинтезу целевого соединения из дешевого и доступного возобновляемого сырья (т.е. сахаров растительной биомассы), является актуальной задачей. Необходимо отметить, что в клетке пировиноградная кислота выступает в качестве основного метаболита-предшественника для множества биохимических путей, ведущих к формированию различных классов органических молекул. Поэтому, высокоэффективные продуценты пировиноградной кислоты могут служить, кроме того, штаммами-платформами для дальнейшего создания специализированных продуцентов других полезных соединений. В последние годы был достигнут значительный прогресс в разработке процессов биологической конверсии углеводов в пировиноградную кислоту с использованием различных видов промышленно значимых микроорганизмов [8]. В качестве соответствующего продуцента, лучшие характеристики, при этом, демонстрировал направленно сконструированный штамм Escherichia coli, который был способен синтезировать пировиноградную кислоту из глюкозы с выходом 1.53 моль/моль, составляющим 77% от теоретического максимума [9].
Ключевым биохимическим путем, снабжающим клетку пировиноградной кислотой при утилизации соответствующих субстратов (в первую очередь глюкозы), служит гликолиз, консервативный метаболический путь множества микроорганизмов присущий, в том числе, традиционной для промышленной биотехнологии факультативно анаэробной бактерии E. coli. Известно, что гликолиз транскрипционно не лимитирован и контролируется, в основном, внутриклеточными соотношениями НАДН/НАД+ и АТФ/АДФ [10, 11]. В результате гликолитической утилизации глюкозы формируются две молекулы пировиноградной кислоты, две молекулы НАДН и две молекулы АТФ. При аэрации гликолитический НАДН реокисляется в дыхательной электрон-транспортной цепи с участием кислорода в качестве терминального акцептора электронов, тогда как пировиноградная кислота и АТФ вовлекаются в анаболические процессы формирования биомассы. В условиях анаэробиоза значительная доля гликолитически сформированной пировиноградной кислоты прямо или опосредованно участвует в реакциях брожения, с целью поддержания внутриклеточного окислительно-восстановительного баланса, выступая внутренним терминальным акцептором электронов для окисления НАДН.
В клетках E. coli ключевыми ферментами, ответственными за анаэробную диссимиляцию пировиноградной кислоты являются лактатдегидрогеназа LdhA (КФ 1.1.1.28), ацетаткиназа AckA (КФ 2.7.2.1), фосфотрансацетилаза Pta (КФ 2.3.1.8), бифункциональная алкоголь/альдегиддегидрогеназа AdhE (КФ 1.1.1.1/1.2.1.3), катализирующие формирование основных продуктов смешанно-кислотного брожения, то есть молочной, уксусной кислот и этанола, а также пируват-формиат-лиаза PflB (КФ 2.3.1.54), конвертирующая пировиноградную кислоту в муравьиную кислоту и ацетил-КоА. Инактивация этих ферментов является обязательным условием для обеспечения возможности эффективной анаэробной продукции пировиноградной кислоты рекомбинантными штаммами E. coli. Однако штаммы E. coli дефицитные по путям смешанно-кислотного брожения неспособны расти анаэробно [12]. Более того, остаточная способность к реокислению НАДН у соответствующих штаммов весьма незначительна, а их потребность в АТФ резко снижена. В результате, подобные мутанты практически не могут утилизировать глюкозу в бескислородных условиях [13]. Вместе с тем, именно анаэробные процессы являются более предпочтительными для биосинтеза ценных продуктов, нежели аэробные, в силу меньших капитальных затрат, операционных издержек и проблем, связанных с массообменом и контаминацией [14]. Благодаря тому, что E. coli является факультативно анаэробной бактерией, анаэробная продукция пировиноградной кислоты из глюкозы рекомбинантами, лишенными путей брожения, может быть достигнута в результате двухстадийной ферментации, включающей стадию аэробного накопления биомассы с последующей анаэробной продуктивной стадией. Регенерация НАД+ в бескислородных условиях может быть обеспечена в данном случае за счет анаэробного дыхания с внешним акцептором электронов, таким как ДМСО [15], нитрат [16], или даже электрод, функционирующий в режиме анода [17].
Действительно, ранее было показано, что направленно сконструированный штамм E. coli, обладающий модифицированной системой транспорта и фосфорилирования глюкозы, лишенный основных путей смешанно-кислотного брожения и возможности взаимопревращения фумарат-сукцинат, а также не способный формировать ацетил-КоА из соответствующего трехуглеродного предшественника в присутствии в среде нитрата натрия анаэробно конвертирует глюкозу в пировиноградную кислоту с довольно высоким молярным выходом [18]. Единственным побочным продуктом, секретированным штаммом помимо пировиноградной кислоты, была молочная кислота, сформированная, по всей вероятности, в результате вовлечения целевого продукта в реакции альтернативного анаэробного дыхания с внутренним акцептором электронов [19, 20]. При этом, несмотря на эффективное реокисление гликолитического НАДН за счет анаэробного дыхания, как с внешним, так и с внутренним акцептором электронов, штамм не потреблял доступную глюкозу полностью. Ключевым фактором, лимитирующим потребление глюкозы рекомбинантом в бескислородных условиях, являлись, по-видимому, избыточные внутриклеточные уровни АТФ.
Цель работы – оптимизация анаэробной продукции пировиноградной кислоты из глюкозы рекомбинантными штаммами Escherichia coli с нарушенной способностью к брожению за счет форсированного гидролиза АТФ.
МЕТОДИКА
Реактивы. В работе использовали рестриктазу BglII, Т4 ДНК лигазу, ДНК полимеразу Taq (“Thermo Scientific”, Литва), а также высокоточную ДНК полимеразу Kapa HiFi (“Roche”, Швейцария). ПЦР-продукты очищали электрофорезом в агарозном геле и выделяли с помощью QIAquick Gel Extraction Kit (“Qiagen”, США). Олигонуклеотиды (“Евроген”, Россия) представлены в табл. 1. Компоненты питательных сред, соли и другие реактивы были произведены фирмами “Panreac” (Испания) и “Sigma” (США).
Таблица 1.
Олигонуклеотидные праймеры, использованные в работе
| № | Последовательность |
|---|---|
| P1 | 5'-catgattatttccgcagccagcgattatcgcgccgc-cgctcaagttagtataaaaaagctgaac-3' |
| P2 | 5'-ctatgccgcattccctttcgccatgggagccagtgc-tgaagcctgcttttttatactaagttgg-3' |
| P3 | 5'-aatgtcttccatgacaacaactgataataaagcctt-cgctcaagttagtataaaaaagctgaac-3' |
| P4 | 5'-ttactccacttcctgccagtttttccgtttactggt-tgaagcctgcttttttatactaagttgg-3' |
| P5 | 5'-gattcgatgaagatcaggctcg-3' |
| P6 | 5'-cagagtgagggagtacatacag-3' |
| P7 | 5'-gccataagcatgatggagagag-3' |
| P8 | 5'-ccggtaaagtgatgcctgtgc-3' |
| P9 | 5'-tgcgac-agatct-ctcacctaccaaacaatgccc-3' |
| P10 | 5'-atgtatatctccttc-acggccaatgcttcgtttc-3' |
| P11 | 5'-ccaaagcaccagcggtgacgagccattgttggacat-atgtatatctccttc-acggccaatg-3' |
| P12 | 5'- ctagta-agatct-tgaagcctgcttttttatactaagttgg-3' |
| P13 | 5'-tctcaaaccgttcatttatcacaaaaggattgttcg-cgctcaagttagtataaaaaagctgaac-3' |
| P14 | 5'-gtcgaagagagcagatttgcgc-3' |
| P15 | 5'-cctgtctacatcattcatgccg-3' |
Бактериальные штаммы, плазмиды и среды. Использованные в работе бактериальные штаммы и плазмиды представлены в табл. 2. Штамм E. coli K-12 MG1655 (ВКПМ B-6195), ранее сконструированный штамм E. coli MG1655 ∆ackA-pta, ∆poxB, ∆ldhA, ∆adhE, ∆ptsG, PLglk, PtacgalP [21], обозначенный как PA4, обладающий модифицированной системой транспорта и фосфорилирования глюкозы, лишенный основных путей смешанно-кислотного брожения, а также его производный штамм PA4FPSA [18], с дополнительно блокированной возможностью взаимопревращения фумарат-сукцинат и не способный конвертировать пировиноградную кислоту в ацетил-КоА, были использованы в качестве исходных для конструирования всех полученных в работе рекомбинантов.
Таблица 2.
Штаммы и плазмиды
| Объект | Генотип | Ссылка |
|---|---|---|
| Штамм | ||
| MG1655 | Штамм E. coli дикого типа (ВКПМ B-6195) | ВКПМ |
| PA4 | E. coli MSG1.0 (MG1655 ∆ackA-pta, ∆poxB, ∆ldhA, ∆adhE, ∆ptsG, PLglk, PtacgalP) | [21] |
| PA4FPSA | E. coli MSG1.0 ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF | [18] |
| PA4FPSAL | E. coli MSG1.0 ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF, ∆lldD | Данная работа |
| PA4FPSAD | E. coli MSG1.0 ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF, ∆dld | » |
| PA4FPSALD | E. coli MSG1.0 ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF, ∆lldD, ∆dld | » |
| PA4FPSAPyc | E. coli MSG1.0 ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF, pPYC | » |
| PA4FPSAPps | E. coli MSG1.0 ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF, PL-SDφ10-ppsA | » |
| PA4FPSALDPyc | E. coli MSG1.0 ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF, ∆lldD, ∆dld, pPYC | » |
| PA4FPSALDPps | E. coli MSG1.0 ∆frdAB, ∆pflB, ∆sdhAB, ∆aceEF, ∆lldD, ∆dld, PL-SDφ10-ppsA | » |
| Плазмида | ||
| pMW118-(λattL-Cm-λattR) | pSC101, bla, cat, λattL-cat-λattR | [24] |
| pKD46 | pINT-ts, bla, ParaB-λgam-bet-exo | [23] |
| pMWts-Int/Xis | pSC101-ts, bla, PR-λxis-int, cIts857 | [25] |
| pPYC | pMW119 с клонированным геном пируваткарбоксилазы (pycA) из B. subtilis | [33] |
Бактерии культивировали в богатых средах LB, SOB, SOC и минимальной среде М9 [22], с добавлением, при необходимости, ампициллина (100 мкг/мл) или хлорамфеникола (30 мкг/мл). Для поддержания аэробного роста ∆aceEF штамма PA4FPSA и его производных среды дополнительно содержали 10 мМ ацетата натрия.
Конструирование штаммов. Все хромосомные модификации осуществляли по ранее описанному методу [23].
Линейные фрагменты ДНК для инактивации генов lldD и dld, содержащих маркер устойчивости к хлорамфениколу (ген cat), получали при помощи ПЦР с использованием пар праймеров P1 и P2, P3 и P4, и плазмиды pMW118-(λattL-Cm-λattR) [24] в качестве матрицы. Полученные фрагменты ДНК были индивидуально интегрированы в хромосому штамма E. coli MG1655, несущего плазмиду-помощник pKD46. Факт соответствия предполагаемых и полученных экспериментально структур хромосом отобранных штаммов, с индивидуально инактивированными генами lldD и dld, подтверждали ПЦР-анализом с помощью пар локус-специфичных праймеров P5 и P6, P7 и P8.
Конструирование фрагмента ДНК для замены нативной регуляторной области гена ppsA искусственным генетическим элементом PL-SDφ10, содержащим промотор PL фага лямбда и эффективный сайт связывания рибосом гена φ10 из фага Т7, проводили в несколько стадий. На первой стадии, с помощью ПЦР был получен фрагмент ДНК, содержащий участок узнавания BglII, промотор PL, последовательность SD гена φ10 из фага Т7 и 36 нуклеотидов, комплементарных 5'-концу кодирующей области гена ppsA.
Фрагмент получали в два этапа. На первом этапе, с использованием в качестве матрицы геномной ДНК фага лямбда и праймеров P9 и P10 был получен фрагмент ДНК, содержащий участок узнавания BglII, промотор PL и часть последовательности SD гена φ10 из фага Т7. Полученный ПЦР-продукт служил матрицей в следующем раунде ПЦР с использованием праймеров P9 и P11. Праймер Р11 содержал область комплементарную 3'-концу промотора PL, последовательность SD гена φ10 из фага Т7 и 36 первых нуклеотидов из рамки считывания гена ppsA. Параллельно осуществляли вторую стадию конструирования фрагмента ДНК. Фрагмент ДНК, содержащий участок узнавания BglII, маркер устойчивости к хлорамфениколу (ген cat) и 36 нуклеотидов, гомологичных участку ДНК, непосредственно предшествующему кодирующей области гена ppsA, был получен ПЦР с использованием праймеров P12 и P13 и плазмиды pMW118-(λattL-Cm-λattR) в качестве матрицы. Полученные фрагменты ДНК были обработаны эндонуклеазой рестрикции BglII и лигированы Т4 ДНК-лигазой. Продукт лигирования амплифицировали с использованием праймеров P11 и P13. Полученный ПЦР-продукт был интегрирован в хромосому штамма E. coli MG1655, несущего плазмиду-помощник pKD46. Соответствие запланированной и экспериментально полученной нуклеотидной последовательности нового регуляторного элемента, введенного перед кодирующей областью гена ppsA, было подтверждено секвенированием с помощью праймеров P14 и P15.
Соответствующие индивидуальные генетические модификации были, в последствии, введены в хромосомы целевых рекомбинантных штаммов с помощью P1-зависимых трансдукций [22]. Удаление маркера, фланкированного att-сайтами фага лямбда, из хромосом целевых штаммов, проводили с использованием плазмиды pMWts-Int/Xis, как описано ранее [25]. Трансформацию штаммов плазмидами осуществляли по стандартной методике.
Культивирование штаммов. Рекомбинантные штаммы выращивали в течение ночи в среде М9, содержащей 2 г/л глюкозы при 37°C. По 5 мл ночных культур разбавляли в 10 раз, добавляя 45 мл среды М9, содержавшей 10 г/л дрожжевого экстракта. Полученные культуры выращивали в колбах объемом 750 мл при 37°C на роторной качалке при 250 об./мин в течение 8 ч. Клеточные суспензии центрифугировали в течение 15 мин при 2000 g при 4°C. Осадки ресуспендировали в 15 мл модифицированной среды М9, лишенной ионов аммония, содержащей 10 г/л глюкозы и 50 мМ нитрата натрия до ОП600 ~ 10. В дальнейшем культуры инкубировали анаэробно в течение 24 ч в пробирках объемом 15 мл, закрытых завинчивающимися крышками, при 37°C на роторной качалке при 250 об./мин. В случае штаммов, несущих pMW-производные плазмиды, среды дополнительно содержали 100 мкг/мл ампициллина (ООО “Синтез”, Россия). Для обеспечения функциональной активности пируваткарбоксилазы в штаммах с геном pycA Bacillus subtilis в среды, используемые на последней стадии, вносили NaHCO3 до конечной концентрации 10 г/л.
Собранные для анализа клеточные суспензии центрифугировали при 10000 g в течение 10 мин. В полученных супернатантах определяли концентрации секретированных метаболитов и остаточной глюкозы. Все эксперименты повторялись не менее трех раз.
Аналитические методы. Концентрации органических кислот в культуральных жидкостях, освобожденных от биомассы центрифугированием, определяли методом ВЭЖХ с использованием системы “Waters” HPLC system (США). Применяли ион-эксклюзионную колонку Rezex ROA-Organic Acid H+ (8%) (300 × 7.8 мм, 8 мкм, “Phenomenex”, США) с детекцией при длине волны 210 нм. В качестве подвижной фазы использовали водный раствор серной кислоты (2.5 мМ) со скоростью потока 0.5 мл/мин. Для измерения концентрации глюкозы, система была укомплектована рефрактивным детектором “Waters” 2414 и колонкой Spherisorb-NH2 (4.6 × 250 мм, 5 μм, “Waters”, США). Подвижной фазой служила смесь ацетонитрил/вода (объемное соотношение 75/25) при скорости потока 1.0 мл/мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве базового продуцента пировиноградной кислоты был использован ранее сконструированный штамм E. coli PA4FPSA. В данном штамме основные пути смешанно-кислотного брожения, ответственные за анаэробную диссимиляцию пирувата и ведущие к формированию уксусной и молочной кислот, а также этанола, были инактивированы за счет делеции генов ack-A, pta, poxB, ldhA и adhE, кодирующих ферменты, катализирующие соответствующие реакции. Возможность анаэробного дыхания с фумаратом в качестве внутреннего акцептора электронов была исключена в штамме, в первую очередь, за счет делеции генов frdAB, кодирующих компоненты фумаратредуктазы (КФ 1.3.5.4). Известно, что в штаммах E. coli с инактивированными генами frdAB сукцинатдегидрогеназа (КФ 1.3.5.1) способна функционально замещать фумаратредуктазу [26]. Поэтому, гены sdhAB, кодирующие компоненты сукцинатдегидрогеназы были также делетированы в штамме. Вовлечение пировиноградной кислоты через промежуточное образование ацетил-КоА в реакции цикла трикарбоновых кислот (ЦТК), активирующиеся при дыхании, было предотвращено в штамме в результате делеций генов pflB и aceEF, кодирующих пируфат-формиат-лиазу и компоненты пируватдегидрогеназного ферментативного комплекса (КФ 1.2.4.1/2.3.1.12/1.8.1.4). Кроме того, система транспорта и фосфорилирования глюкозы была модифицирована в штамме таким образом, чтобы потреблять АТФ для фосфорилирования углеводного субстрата вместо фосфоенолпирувата (ФЕП) с целью потенциального снижения ингибирования начальной и терминальной стадий гликолиза АТФ, генерируемым на его промежуточных стадиях. Это было достигнуто за счет инактивации гена ptsG, кодирующего пермеазу глюкозы ФЕП-зависимой фосфотрансферазной системы, при оверэкспрессии генов galP и glk, кодирующих H+-симпортер галактозы и АТФ-зависимую глюкокиназу (КФ 2.7.1.2). В результате, после аэробного выращивания, штамм PA4FPSA был способен анаэробно конвертировать глюкозу в пировиноградную кислоту, при дыхании с нитратом в качестве внешнего акцептора электронов, с выходом ~1.7 моль/моль [18].
Основной детектированной примесью, формируемой штаммом, являлась молочная кислота. Результаты анализа энантиомерного состава секретированной штаммом молочной кислоты указывали на то, что за формирование этого соединения могли быть ответственны респираторные лактатдегидрогеназы LldD и Dld (КФ 1.1.5.12). В норме, соответствующие ферменты катализируют хинон-зависимую конверсию L-молочной кислоты и D-молочной кислоты в пировиноградную [19]. Однако, в условиях анаэробиоза их инвертированное хинол-зависимое действие, ведущее к образованию из пировиноградной кислоты соответствующего восстановленного продукта, могло дополнительно способствовать поддержанию внутриклеточного окислительно-восстановительного баланса в штамме с нарушенной способностью к брожению.
Помимо лактатдегидрогеназ LldD и Dld в альтернативном анаэробном дыхании с пировиноградной кислотой в качестве внутреннего акцептора электронов может принимать участие D-аланиндегидрогеназа DadA (КФ 1.4.5.-) [20]. Для исключения потенциального вклада соответствующего фермента в процессы поддержания внутриклеточного окислительно-восстановительного баланса, характеристику анаэробной утилизации глюкозы и биосинтеза пировиноградной кислоты штаммом PA4FPSA и его производными в ходе двухстадийной ферментации осуществляли в настоящей работе, используя на финальной стадии модифицированную минимальную среду М9, лишенную ионов аммония.
В присутствии в среде ионов нитрата и при отсутствии ионов аммония, штамм PA4FPSA демонстрировал характеристики, аналогичные полученным ранее, потребляя около 23.6 мМ глюкозы и синтезируя ~40.8 мМ (рис. 1) пировиноградной кислоты с выходом 1.72 моль/моль (табл. 3). Аланин ожидаемо не был обнаружен среди продуктов анаэробной утилизации глюкозы, секретированных штаммом, и единственным побочным продуктом, сформированным рекомбинантом, являлась молочная кислота (рис. 1). Наблюдаемый в присутствии нитрата натрия синтез штаммом молочной кислоты объяснялся, по-видимому, высоким потенциалом (~0.19 V) соответствующих респираторных реакций, использующих внутренний акцептор электронов, лишь в два раза уступающим соответствующему показателю (~0.42 V) для дыхания с участием нитратредуктаз Nar-системы и превосходящим показатель для дыхания с фумаратом (~0.03 V) и даже ДМСО (~0.16 V) в качестве внешних акцепторов электронов [19].
Рис. 1.
Концентрации метаболитов (мМ) пировиноградной (1) и молочной (2) кислот, секретированных штаммом PA4FPSA и его производными PA4FPSAL, PA4FPSAD, PA4FPSALD в ходе анаэробной утилизации глюкозы (3) при дыхании с нитратом натрия в качестве внешнего акцептора электронов.
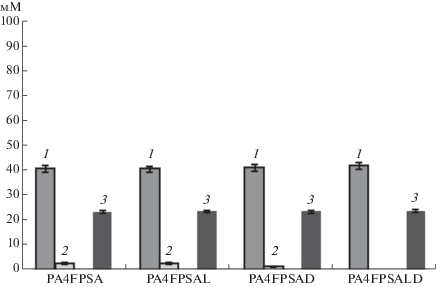
Таблица 3.
Характеристики потребления углеродного субстрата и продукции метаболитов штаммами PA4FPSA, PA4FPSAL, PA4FPSAD, PA4FPSALD в ходе анаэробной утилизации глюкозы при дыхании с нитратом натрия в качестве внешнего акцептора электронов*
| Штамм | Потребленная глюкоза, мМ |
Выход метаболитов, моль/моль | Углеродный баланс, % | |
|---|---|---|---|---|
| пировиноградная кислота | молочная кислота | |||
| PA4FPSA | 23.6 ± 0.5 | 1.72 ± 0.02 | 0.13 ± 0.01 | 93 |
| PA4FPSAL | 23.8 ± 0.5 | 1.71 ± 0.02 | 0.12 ± 0.01 | 92 |
| PA4FPSAD | 23.7 ± 0.6 | 1.74 ± 0.02 | 0.07 ± 0.01 | 91 |
| PA4FPSALD | 23.8 ± 0.6 | 1.76 ± 0.03 | н.д. | 89 |
Известно, что в условиях нитратного дыхания в клетках E. coli индуцируется экспрессия гена, по крайней мере одной из хинон-зависимых лактатдегидрогеназ, LldD [27]. Поэтому, для предотвращения побочной продукции молочной кислоты в штамме PA4FPSA первично был делетирован ген lldD. Соответствующий производный штамм PA4FPSAL синтезировал пировиноградную кислоту из глюкозы с эффективностью, практически идентичной эффективности родительского штамма (рис. 1, табл. 3), продолжая, тем не менее, секретировать значимые количества молочной кислоты (рис. 1). Более того, несмотря на инактивацию L-лактатдегидрогеназы LldD, выход молочной кислоты, сформированной штаммом при утилизации глюкозы, не снижался (табл. 3). Можно было предположить, что D-лактатдегидрогеназа Dld была основным ферментом, ответственным за формирование молочной кислоты штаммами PA4FPSA и PA4FPSAL. С целью проверки этой гипотезы, ген dld был делетирован в штамме PA4FPSA. При инактивации D-лактатдегидрогеназы анаэробная продукция пировиноградной кислоты из глюкозы соответствующим штаммом PA4FPSAD не изменялась по сравнению со штаммом PA4FPSA, тогда как секреция молочной кислоты заметно падала (рис. 1, табл. 3). Однако образование молочной кислоты dld– мутантом не прекращалось полностью. Таким образом, несмотря на предпочтительное формирование в штаммах PA4FPSA и PA4FPSAL молочной кислоты под действием D-лактатдегидрогеназы, L-лактатдегидрогеназа была способна частично компенсировать потерю активности альтернативного фермента в штамме PA4FPSAD. Соответственно, гены обеих лактатдегидрогеназ были, в дальнейшем, совместно делетированы в штамме PA4FPSA.
Штамм PA4FPSALD с инактивированными респираторными лактатдегидрогеназами LldD и Dld не секретировал заметных количеств молочной кислоты в ходе анаэробной утилизации глюкозы. При этом продукция штаммом пировиноградной кислоты (~42.1 мМ) несколько превосходила уровень синтеза целевого вещества, демонстрируемый исходным штаммом PA4FPSA (рис. 1) и выход соответствующего карбоксилата из глюкозы достигал 1.76 моль/моль (табл. 3). Отсутствие в среде восстановленных продуктов катаболизма глюкозы, в свою очередь, указывало на то, что дыхание с экзогенным нитратом в качестве единственного терминального акцептора электронов было способно обеспечить полноценное поддержание внутриклеточного окислительно-восстановительного баланса в штамме PA4FPSALD.
Вместе с тем, штамм PA4FPSALD, как и его предшественники, не потреблял всю доступную глюкозу (55.5 мМ) полностью (рис. 1, табл. 3), хотя Nar и Nrf системы нитратного и нитритного дыхания позволяют реокислить 250 мМ НАДН, используя 50 мМ добавленного в среду NaNO3 [19], что эквивалентно количеству восстановленных эквивалентов, формируемых при гликолитической утилизации 125 мМ глюкозы. Таким образом, при даже эффективном реокислении гликолитически сформированного НАДН посредством анаэробного дыхания с внешним акцептором электронов, избыточные внутриклеточные уровни АТФ оставались, как и в случае штамма PA4FPSA, ключевым фактором, лимитирующим потребление глюкозы в бескислородных условиях, его перспективным сконструированными производным PA4FPSALD.
На сегодняшний день описаны несколько подходов направленных на интенсификацию гликолитического потока углерода в рекомбинантных штаммах E. coli за счет снижения внутриклеточного уровня АТФ. Основной подход основывается на манипуляции компонентами (F1F0) H+-АТФ синтазного комплекса для предотвращения окислительного фосфорилирования и/или повышения гидролиза ATP. Оверэкспрессия генов, кодирующих компоненты цитоплазматической субъединицы F1, содержащей каталитический сайт, должна способствовать гидролизу АТФ. С другой стороны, инактивация генов мембранно-связанной субъединицы F0, которая формирует протонный канал, будет приводить к прекращению продукции АТФ посредством оксидативного фосфорилирования с одновременным повышением активности АТФазы. Каждая из этих стратегий была успешно применена для улучшения биосинтетических показателей рекомбинантных штаммов E. coli, сконструированных для продукции пировиноградной кислоты из глюкозы в аэробных условиях [9, 28]. Альтернативный и достаточно перспективный подход состоит в реализации в клетке принудительного гидролиза АТФ в результате действия футильных циклов [29].
Ранее было обнаружено, что экспрессия гетерологичной пируваткарбоксилазы (КФ 6.4.1.1) в штаммах E. coli дефицитных по основным путям смешанно-кислотного брожения провоцирует, в ходе анаэробной утилизации глюкозы, возникновение искусственного футильного цикла пировиноградная кислота – щавелевоуксусная кислота (ЩУК) – яблочная кислота – пировиноградная кислота [30]. В данном цикле ЩУК, сформированная из пировиноградной кислоты АТФ-зависимой пируваткарбоксилазой, конвертировалась в яблочную кислоту через потребляющую НАДН начальную реакцию восстановительной ветви ЦТК, катализируемую малатдегидрогеназой Mdh (КФ 1.1.1.37), и, затем, декарбоксилировалась в пировиноградную кислоту в результате действия конститутивно экспрессирующегося в E. coli НАД+-зависимого малатного фермента MaeA (КФ 1.1.1.39), обеспечивая, в итоге, гидролиз 1 молекулы АТФ при отсутствии суммарной генерации НАДН. Инактивация этого цикла способствовала анаэробной продукции соответствующими рекомбинантными штаммами четырехуглеродных дикарбоновых кислот [31], тогда как его активация улучшала продукцию пировиноградной кислоты [18, 30].
Альтернативой футильному циклу пировиноградная кислота – ЩУК – яблочная кислота – пировиноградная кислота, функционирующему исключительно при анаэробиозе, когда активна восстановительная ветвь ЦТК, может служить цикл пировиноградная кислота – ФЕП – пировиноградная кислота. В присутствии в среде глюкозы, футильный цикл пировиноградная кислота – ФЕП – пировиноградная кислота может быть активен как в аэробных, так и в анаэробных условиях. В этом цикле пируваткиназа (КФ 2.7.1.40) катализирует АДФ-зависимое дефосфорилирование ФЕП в пировиноградную кислоту с образованием молекулы АТФ, а фосфоенолпируватсинтаза (КФ 2.7.9.2) фосфорилирует пировиноградную кислоту, используя АТФ как кофактор, расщепляя его до АМФ и неорганического фосфата. Регенерация АМФ в АТФ, под действием аденилаткиназы (КФ 2.7.4.3), требует, при этом, расхода двух АТФ. Способность соответствующего цикла улучшать продукцию целевого соединения из глюкозы в бескислородных условиях, за счет снижения внутриклеточного пула АТФ, была недавно продемонстрирована с использованием в качестве примера штамма E. coli – продуцента молочной кислоты [32].
Способность футильных циклов пировиноградная кислота – ЩУК – яблочная кислота – пировиноградная кислота и пировиноградная кислота – ФЕП – пировиноградная кислота улучшать анаэробное потребление глюкозы сконструированными рекомбинантыми продуцентами пировиноградной кислоты была проверена при реализации их функциональности как в базовом штамме PA4FPSA, так и в его производном PA4FPSALD, лишенном респираторных лактатдегидрогеназ. С целью обеспечения в штаммах активности футильного цикла пировиноградная кислота – ЩУК – яблочная кислота – пировиноградная кислота, в клетки вводили плазмиду pPYC [33], экспрессирующую ген pycA B. subtilis, получая соответствующие производные PA4FPSAPyc и PA4FPSALDPyc. Функциональность футильного цикла пировиноградная кислота – ФЕП – пировиноградная кислота была обеспечена в штаммах PA4FPSAPps и PA4FPSALDPps за счет конститутивной экспрессии гена ppsA, кодирующего фосфоенолпируватсинтазу, под контролем промотора PL фага лямбда.
Анаэробное потребление глюкозы сконструированными штаммами PA4FPSAPyc, PA4FPSALDPyc, PA4FPSAPps и PA4FPSALDPps резко возрастало по сравнению со штаммами предшественниками (рис. 1, 2), при сохранении высоких значений выхода синтезированной рекомбинантами пировиноградной кислоты (табл. 4). Это свидетельствовало о позитивном влиянии в штаммах форсированного гидролиза АТФ, в результате действии каждого из футильных циклов, на интенсивность потока углерода через каскад гликолитических реакций, ведущих к целевому формированию пировиноградной кислоты в качестве основного продукта утилизации углеродного субстрата.
Рис. 2.
Концентрации метаболитов (мМ) пировиноградной (1), молочной (2) и яблочной (3) кислот, секретированных штаммами PA4FPSAPyc, PA4FPSAPps, PA4FPSALDPyc и PA4FPSALDPps в ходе анаэробной утилизации глюкозы (4) при дыхании с нитратом натрия в качестве внешнего акцептора электронов и форсированном гидролизе АТФ за счет функционирования футильных циклов пировиноградная кислота – ЩУК – яблочная кислота – пировиноградная кислота (штаммы PA4FPSAPyc и PA4FPSALDPyc) и пировиноградная кислота – ФЕП – пировиноградная кислота (штаммы PA4FPSAPps и PA4FPSALDPps).
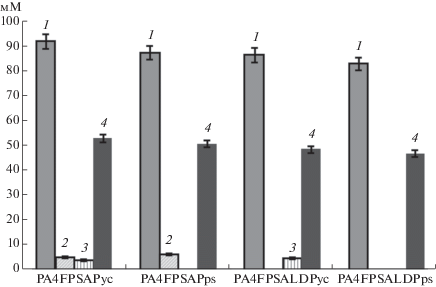
Таблица 4.
Характеристики потребления углеродного субстрата и продукции метаболитов штаммами PA4FPSAPyc, PA4FPSAPps, PA4FPSALDPyc и PA4FPSALDPps в ходе анаэробной утилизации глюкозы при дыхании с нитратом натрия в качестве внешнего акцептора электронов и форсированном гидролизе АТФ*
| Штамм | Потребленная глюкоза, мМ |
Выход метаболитов, моль/моль | Углеродный баланс, % | ||
|---|---|---|---|---|---|
| пировиноград-ная кислота | молочная кислота | яблочная кислота | |||
| PA4FPSAPyc | 53.1 ± 1.6 | 1.73 ± 0.02 | 0.10 ± 0.01 | 0.08 ± 0.01 | 97 |
| PA4FPSAPps | 51.0 ± 1.5 | 1.72 ± 0.02 | 0.13 ± 0.01 | н.д. | 92 |
| PA4FPSALDPyc | 48.8 ± 1.5 | 1.78 ± 0.03 | н.д. | 0.10 ± 0.01 | 96 |
| PA4FPSALDPps | 47.1 ± 1.4 | 1.77 ± 0.03 | н.д. | н.д. | 88 |
Тем не менее, эффект введения в штаммы соответствующих футильных циклов несколько различался. Так, штаммы PA4FPSAPyc, PA4FPSALDPyc с активным футильным циклом пировиноградная кислота – ЩУК – яблочная кислота – пировиноградная кислота секретировали, в качестве одного из продуктов утилизации глюкозы, яблочную кислоту (рис. 2). Это, с одной стороны, свидетельствовало о функциональности именно данного футильного цикла в клетках рекомбинантов, но, с другой стороны, указывало на недостаточную активность в клетках малатных ферментов. При этом значение углеродного баланса, характеризующее полноту конверсии субстрата в детектированные продукты, в случае штаммов PA4FPSAPyc и PA4FPSALDPyc возрастало в сравнении с родительскими штаммами, тогда как для штаммов PA4FPSAPps и PA4FPSALDPps оставалось практически неизменным (табл. 3, 4).
Поскольку функционирование футильного цикла пировиноградная кислота – ФЕП – пировиноградная кислота не приводило к формированию штаммами новых продуктов утилизации глюкозы, это указывало на то, что те или иные интермедиаты гликолиза вовлекались в соответствующих рекомбинантах в побочные реакции расхода субстрата, сопровождающиеся непродуктивной потерей углерода. С учетом отсутствия в штаммах пируватдегидрогеназы и, следовательно, невозможности протекания в условиях дыхания реакций оксидативной ветви ЦТК, за сниженное значение углеродного баланса могла быть ответственна частично активированная оксидативная ветвь пентозофосфатного пути (ПФП), обуславливающая потерю углерода за счет высвобождения СО2 на стадии реакции катализируемой 6-фосфоглюконатдегидрогеназой (КФ 1.1.1.44). Активность в клетках футильного цикла пировиноградная кислота – ЩУК – яблочная кислота – пировиноградная кислота снижала вклад оксидативной ветви ПФП в непродуктивную потерю рекомбинантами углерода, тогда как форсированное взаимопревращение пировиноградная кислота – ФЕП практически не влияло на интенсивность соответствующего процесса. Вместе с тем, штамм PA4FPSALDPps, гидролизующий избыточный АТФ за счет действия футильного цикла пировиноградная кислота – ФЕП – пировиноградная кислота, в отличие от штамма PA4FPSALDPyc, снижающего внутриклеточный пул соответствующего кофактора в результате функционирования футильного цикла пировиноградная кислота – ЩУК – яблочная кислота – пировиноградная кислота, синтезировал пировиноградную кислоту с повышенным выходом (1.77 моль/моль), не секретируя заметных количеств каких-либо побочных продуктов и потребляя доступную глюкозу практически полностью. С другой стороны, высокое значение углеродного баланса (96%, табл. 4), демонстрируемое штаммом PA4FPSALDPyc при анаэробной утилизации глюкозы в условиях нитратного дыхания, позволяло предположить, что достигнутый выход синтезированной штаммом пировиноградной кислоты (1.78 моль/моль, табл. 4) может быть и далее увеличен при повышении в клетках активности малатных ферментов. Однако, футильный цикл пировиноградная кислота – ЩУК – яблочная кислота – пировиноградная кислота, обеспечивающий в клетках штамма PA4FPSALDPyc форсированный гидролиз АТФ, не активен при отсутствии в среде доступного источника CO2. При этом снабжение среды бикарбонатом будет увеличивать общую стоимость продукции целевого соединения.
Таким образом, промышленная применимость каждого из подходов, основанных на форсированном гидролизе АТФ за счет действия в клетках рекомбинантов искусственно созданных футильных циклов, для эффективной анаэробной продукции пировиноградной кислоты из глюкозы рекомбинантными штаммами E. coli должна оцениваться с учетом как потенциальной выгоды, так и возможного роста операционных издержек.
Результаты исследования наглядно демонстрируют потенциал форсированного гидролиза АТФ, за счет применения расходующих данный кофактор футильных циклов, для улучшения биосинтетических характеристик рекомбинантных штаммов E. coli, направленно сконструированных для анаэробной продукции пировиноградной кислоты из глюкозы при анаэробном дыхании с внешним акцептором электронов.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-04-01222).
Список литературы
Ingram L.O., Conway T., Clark D.P., Sewell G.W., Preston, J.F. // Appl. Environ. Microbiol. 1987. V. 53. № 10. P. 2420–2425.
Eram M.S., Ma K. // Biomolecules. 2013. V. 3. № 3. P. 578–596.
Reiße S., Haack M., Garbe D., Sommer B., Steffler F., Carsten J., Bohnen F., Sieber V., Brück T. // Front. Bioeng. Biotechnol. 2016. V. 4. № 74. https://doi.org/10.3389/fbioe.2016.00074
Li Y., Chen J., Lun S.Y. // Appl. Microbiol. Biotechnol. 2001. V. 57. № 4. P. 451–459.
Park H.S., Lee J.Y., Kim H.S. // Biotechnol Bioeng. 1998. V. 58. № 2–3. P. 339–343.
Zhang Y., Tao F., Du M., Ma C., Qiu J., Gu L., He X., Xu P. // Appl. Microbiol. Biotechnol. 2010. V. 86. № 2. P. 481–489.
Saper R.B., Eisenberg D.M., Phillips R.S. // Am. Fam. Physician. 2004. V. 70. № 9. P. 1731–1738.
Maleki N., Eiteman M.A. // Fermentation. 2017. V. 3. № 8. https://doi.org/10.3390/fermentation3010008
Causey T.B., Shanmugam K.T., Yomano L.P., Ingram L.O. // Proc. Natl. Acad. Sci. USA. 2004. V. 101. № 8. P. 2235–2240.
Koebmann B.J., Westerhoff H.V., Snoep J.L., Nilsson D., Jensen P.R. // J. Bacteriol. 2002. V. 184. № 14. P. 3909–3916.
Vemuri G.N., Altman E., Sangurdekar D.P., Khodur-sky A.B., Eiteman M.A. // Appl. Environ. Microbiol. 2006. V. 72. № 5. P. 3653–3661.
Fischer C.R., Tseng H.C., Tai M., Prather K.L., Stephanopoulos G. // Appl. Microbiol. Biotechnol. 2010. V. 88. № 1. 265–275. https://doi.org/10.1007/s00253-010-2749-2
Скороходова А.Ю., Гулевич А.Ю., Дебабов В.Г. // Прикл. биохимия и микробиология. 2017. Т. 53. № 3. С. 278–284.
Chen G.Q. // Microb. Cell. Fact. 2012. V. 11. № 111. https://doi.org/10.1186/1475-2859-11-111
Carvalho M., Matos M., Roca C., Reis M.A. // N. Biotechnol. 2014. V. 31. № 1. P. 133–139.
Jung H.M., Kim Y.H., Oh M.K. // Biotechnol. J. 2017. V. 12. № 11. https://doi.org/10.1002/biot.201700121
Förster A.H., Beblawy S., Golitsch F., Gescher J. // Biotechnol. Biofuels. 2017. V. 10. № 65. https://doi.org/10.1186/s13068-017-0745-9
Skorokhodova A.Y., Gulevich A.Y., Debabov V.G. // J. Biotechnol. 2019. V. 293. P. 47–55.
Unden G., Bongaerts J. // Biochim. Biophys. Acta. 1997. V. 1320. № 3. P. 217–234.
Скороходова А.Ю., Сухоженко А.В., Гулевич А.Ю., Дебабов В.Г. // Биотехнология. 2019. Т. 35. № 2. С. 16–24.
Моржакова А.А., Скороходова А.Ю., Гулевич А.Ю., Дебабов В.Г. // Прикл. биохимия и микробиология. 2013. Т. 49. № 2. С. 136–143.
Sambrook J., Fritsch E., Maniatis T. // Molecular Cloning: a Laboratory Manual, 2nd Ed., N.Y.: Cold Spring Harbor Lab. Press, 1989. 1659 p.
Datsenko K.A., Wanner B.L. // Proc. Natl. Acad. Sci. USA. 2000. V. 97. № 12. P. 6640–6645.
Каташкина Ж.И., Скороходова А.Ю., Зименков Д.В., Гулевич А.Ю., Минаева Н.И., Дорошенко В.Г., Бирюкова И.В., Машко С.В. // Молекулярная биология. 2005. Т. 39. № 5. С. 823–831.
Гулевич А.Ю., Скороходова А.Ю., Ермишев В.Ю., Крылов А.А., Минаева Н.И., Полонская З.М., Зименков Д.В., Бирюкова И.В., Машко С.В. // Молекулярная биология. 2009. Т. 43. № 3. С. 547–557.
Maklashina E., Berthold D.A., Cecchini G. // J Bacteriol. 1998. V. 180. № 22. P. 5989–5996.
Nishimura Y., Tan I.K.P., Ohgami Y., Kohgami K., Kamihara T. // FEMS Microbiol. Lett. 1983. V. 17. № 1–3. P. 283–286.
Zhu Y., Eiteman M.A., Altman R., Altman E. // Appl. Environ. Microbiol. 2008. V. 74. № 21. P. 6649–6655.
Hädicke O., Klamt S. // Biochem. Soc. Trans. 2015. V. 43. № 6. P. 1140–1145.
Скороходова А.Ю., Стасенко А.А., Гулевич А.Ю., Дебабов В.Г. // Прикл. биохимия и микробиология. 2018. Т. 54. № 2. С. 149–157.
Скороходова А.Ю., Гулевич А.Ю., Дебабов В.Г. // Биотехнология. 2018. Т. 34. № 2. С. 18–25.
Hädicke O., Bettenbrock K., Klamt S. // Biotechnol. Bioeng. 2015. V. 112. № 10. P. 2195–2199.
Скороходова А.Ю., Гулевич А.Ю., Моржакова А.А., Шакулов Р.С., Дебабов В.Г. // Прикл. биохимия и микробиология. 2011. Т. 47. № 4. С. 415–423.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


