Прикладная биохимия и микробиология, 2021, T. 57, № 4, стр. 332-341
Участие липополисахарида и неспецифических поринов Yersinia pseudotuberculosis в рецепции псевдотуберкулезного диагностического бактериофага
Л. Г. Дудина 1, 2, О. Д. Новикова 3, *, О. Ю. Портнягина 3, В. А. Хоменко 3, И. В. Конышев 1, 2, А. А. Бывалов 1, 2, **
1 Вятский государственный университет
610000 Киров, Россия
2 Институт физиологии Коми НЦ УрО РАН
167982 Сыктывкар, Россия
3 Тихоокеанский институт биоорганической химии ДВО РАН им. Г.Б. Елякова
690022 Владивосток, Россия
* E-mail: novolga_05@mail.ru
** E-mail: byvalov@nextmail.ru
Поступила в редакцию 27.08.2020
После доработки 02.02.2021
Принята к публикации 22.02.2021
Аннотация
Роль компонентов наружной мембраны Yersinia pseudotuberculosis и Yersinia pestis в адсорбции псевдотуберкулезного диагностического бактериофага (ПДБ) оценивали с помощью двух модельных систем взаимодействия “бактериофаг-антиген”, в которых целевые антигены находились или в растворе, или на поверхности полистирольных микросфер. Показано, что неспецифические порины наружной мембраны OmpF и OmpC псевдотуберкулезного микроба участвовали в рецепции ПДБ наряду с липополисахидом. Выявлена существенная роль конформации молекулы поринов при взаимодействии с ПДБ. Обнаружено, что О-антиген Y. pseudotuberculosis не только не участвует в рецепции ПДБ, но и препятствует ей, экранируя рецепторный участок кора липополисахарида иерсиний, полностью доступный у клеток Y. pestis для контакта с бактериофагом.
Одной из наиболее острых проблем современной медицины является появление и широкое распространение резистентных к антибиотикам штаммов возбудителей многих инфекционных заболеваний, в том числе и патогенных представителей рода Yersinia, включая Yersinia pseudotuberculosis [1]. Альтернативным и/или дополнительным подходом к решению проблем диагностики, лечения и профилактики инфекций, вызываемых такими штаммами бактерий, признано использование специфических бактериофагов [2, 3]. Выяснение механизмов взаимодействия в системе “бактериальная клетка – фаговая частица” определяет перспективу применения тех или иных бактериофагов в качестве лекарственных и диагностических средств.
Известно, что взаимодействие белков адсорбционного аппарата бактериофага с рецепторными структурами на поверхности бактериальной клетки необходимо для “конформационного” запуска фаговой инфекции [4]. Ключевой характеристикой инфицирующей активности бактериофага является его способность к высокоаффинному взаимодействию с некоторыми консервативными молекулярными структурами, выраженными на поверхности бактериальной клетки [5]. Прикрепление фага к бактериальной поверхности может происходить с помощью как одного, так и двух рецепторов, первичного и вторичного [6, 7]. В последнем случае взаимодействие фага с соответствующим ему первичным рецептором приводит к образованию промежуточного комплекса, который может затем разрушиться. Отделение бактериофага от клетки сохраняет его способность вновь адсорбироваться на клеточной поверхности. Взаимодействие фага со вторичным рецептором приводит к необратимой адсорбции, в результате чего происходит конформационная перестройка белков капсида, создающая условия для эжекции ДНК в клетку.
Частицы многих фагов, специфичных в отношении энтеробактерий, прикрепляются к клеткам возбудителя, как правило, посредством рецептор-связывающих белков, расположенных на хвосте фага (или “белков хвоста”). Так, фаг Yersinia enterocolitica ϕYeO3-12 распознает специфичный рецептор на поверхности бактериальной клетки с помощью хвостовых фибрилл, образованных белком gp17 [8], а фаг Escherichia coli λcl26, равно как и все прочие штаммы фага λ, связывается с бактериальной клеткой за счет взаимодействия белка J, расположенного на конце хвоста [9].
Первичными рецепторами фагов грамотрицательных бактерий могут быть жгутики, пили и, чаще всего, вариабельная часть (О-антиген) липополисахарида (ЛПС) [4, 10]. Кроме того, в качестве фаговых рецепторов могут выступать различные белки наружной мембраны (НМ) бактерий, в том числе транспортеры и порины [11, 12]. Так, например белок E. сoli FhuA, транспортер ионов железа и некоторых антибиотиков, служит рецептором для фагов T1, T5 и φ80 [13]. Рецептором для фага λcl26 E. coli является мальтодекстрин-специфичный порин LamB. Эволюционные изменения в пределах гена J, кодирующего белок распознавания рецептора организма-хозяина, привели к тому, что в условиях снижения экспрессии LamB, у λcl26 фага сформировалась способность связываться с новым рецептором, неспецифическим порином OmpF [9]. Порин OmpA E. coli является рецептором для фагов K3, M1, Ox2, TuII, RB32, PST [14], а OmpF порин E. coli взаимодействует с фагами K20, RB69, SV76, RB51, T2 [15, 16]. Установлено, что фаг Yep-phi использует для рецепции, наряду с ЛПС, белки НМ Ail и OmpF Yersinia pestis [17]. Вирулентные для Salmonella enterica серовар Typhimurium фаги Gifsy-1 и Gifsy-2 используют в качестве рецептора OmpC порин НМ бактерии, в то же время, эти фаги не взаимодействуют с OmpC порином E. coli, несмотря на 83%-ную идентичность аминокислотной последовательности этих белков. Видимо, наиболее значимыми для рецепции фагов являются участки, соответствующие вариабельным наружным петлям поринов [18].
До сих пор недостаточно известно о структуре фаговых рецепторов псевдотуберкулезного микроба, и практически не исследованы механизмы взаимодействия фаговых частиц с этими бактериями. Лишь небольшое число бактериофагов, активных в отношении Y. pseudotuberculosis, охарактеризовано в той или иной мере и используется в исследовательской работе. Так, для фага YpsP-PST (семейство Myoviridae) показана способность лизировать клетки большинства штаммов Y. pseudotuberculosis наряду с клетками Y. pestis [19]. Рецептор этого фага расположен на участке HepII/HepIII кора ЛПС [20]. Похожий рецептор Hep (II)-Hep (I) (Glc)-Kdo (Ko)–LA идентифицирован для фага А1122, специфичного к Y. pestis, который инфицирует также клетки Y. pseudotuberculosis, выращенные при температуре 37°С [21]. Для бактериофага wR1-37, способного инфицировать штамм YeO3-R1 Y. enterocolitica, выявлен специфический рецептор на O-антигене Y. pseudotuberculosis O:9 [22].
В литературе, доступной в настоящее время, нет информации о применении идентифицированных псевдотуберкулезных бактериофагов для лечения этого заболевания у людей. Сфера применения псевдотуберкулезного диагностического бактериофага (ПДБ), производимого ФКУЗ РосНИПЧИ “Микроб” (Россия), ограничена диагностическими мероприятиями. О механизмах адсорбции этого бактериофага известно мало, показано лишь участие в его рецепции полисахаридной составляющей НМ бактерий [23]. Участие поверхностных белковых антигенов бактерий Y. pseudotuberculosis в рецепции ПДБ остается пока не изученным. Как правило, способы определения участия того или иного поверхностного антигена бактерий в рецепции фагов ограничены конструированием и использованием соответствующих штаммов-нокаутов или оценкой уровня инактивации литической активности фагов отдельными компонентами микробной клетки при их совместной инкубации в жидкой фазе. Вместе с тем известны и другие методические подходы, которые заключаются в определении адгезивных свойств различных биообъектов, в том числе бактериальных антигенов, по отношению к неорганическим субстратам [24, 25]. Появляются работы по идентификации и количественному определению целевых биомолекул, содержащих структуры, комплементарные модельным соединениям, иммобилизованным на поверхности субстратов различного химического состава, в частности, на основе полистирола [26, 27].
Цель работы – оценка значимости OmpF, OmpC- поринов и ЛПС Y. pseudotuberculosis в рецепции ПДБ с использованием двух методических подходов, один из которых основан на взаимодействии бактериофаг-антиген в жидкой реакционной среде, а другой, предложенный в работе, предполагает проведение реакции в гетерогенной системе с использованием антигенов, адсорбированных на полистирольных микросферах.
МЕТОДИКА
Штаммы бактерии. Y. pseudotuberculosis серотипа 1b (№ 474) и вакцинный штамм Y. pestis EV получены из коллекции Федерального казенного учреждения здравоохранения Российский научно-исследовательский противочумный институт “Микроб” (ФКУЗ РосНИПЧИ “Микроб”, Россия).
Бактериофаг. Псевдотуберкулезный диагностический бактериофаг ПДБ (производства ФКУЗ РосНИПЧИ “Микроб”), известен как бактериофаг d’Herelle-m или YpsP-G [28, 29]. Этот бактериофаг отнесен к семейству Podoviridea (порядок Caudovirales) [30], его геном секвенирован (GenBank accession no. JQ965703). Фаг не является высокоспецифичным и способен лизировать многие штаммы Y. pseudotuberculosis и Y. pestis [19, 31].
Использованные в работе препараты фага получали из глубинной культуры Y. pseudotuberculosis 1b, зараженной суспензией ПДБ, которую получали из отдельной бляшки при высеве коммерческого препарата. Совместную инкубацию микробных клеток (200 млн/мл) и частиц фага (0.4 млн/мл) проводили в течение 18–20 ч при 37°С. После низкоскоростного центрифугирования фаг выделяли из надосадочной жидкости c помощью полиэтиленгликоля ПЭГ-8000 [32]. Дополнительную очистку и последующее концентрирование суспензии фага проводили с помощью ультрафильтров “Amicon Ultra-15, 30 кДа” (“Merck”, Германия).
Определение титра бактериофага. Определение проводили методом Грациа [33]. В пробирке смешивали 100 мкл раствора, содержащего бактериофаг, и 100 мкл суспензии клеток Y. pseudotuberculosis (1 × 109/мл), выращенных при температуре 37°С в течение ночи на плотной питательной среде БТН-агаре (“Биотехновация”, Россия). Смесь инкубировали в течение 5 мин при комнатной температуре для адсорбции бактериофага на поверхности бактериальных клеток, после чего в пробирки приливали по 3 мл 1.5%-ного БТН-агара, предварительно расплавленного и охлажденного до температуры 47°С. Содержимое пробирок перемешивали интенсивным вращением в руках и выливали на чашку Петри с плотной питательной средой – предварительно подсушенным 3%-ным БТН-агаром. Чашки выдерживали в течение 18–24 ч при температуре 37°С, после чего осуществляли подсчет количества бляшек.
Антигенные препараты. В работе использовали следующие антигенные препараты.
1. ЛПС иерсиний. Препараты ЛПС выделяли по методу Вестфаля с помощью водно-фенольной экстракции [34] из бактериальных культур, выращенных в жидкой питательной среде на основе солянокислотного гидролизата казеина: Y. pseudotuberculosis 1b – при температуре 10 и 37°С, Y. pestis EV – при температуре 27°С. Далее они именуются как ЛПС 10, ЛПС 37 и ЛПС EV соответственно.
2. ЛПС E. сoli 055:В5. Коммерческий препарат (“Difco”, США). Иммунохимическую активность использованных в работе препаратов ЛПС, оценивали методом иммуноферментного анализа (ИФА), сенсибилизируя дно лунок планшета исследуемым антигеном в концентрации 10 мкг/мл [35]. Оптическая плотность продукта ферментативной реакции (ОП492), характеризующая взаимодействие “антиген–антитело”, для препаратов ЛПС 10, ЛПС 37, ЛПС EV, ЛПС E. coli при использовании моноклональных антител к О-антигену Y. рseudotuberculosis составила 1.85, 0.62, 0.18, 0.13, а при использовании моноклональных антител к белковому эпитопу НМ энтеробактерий – 0.19, 0.23, 0.27, 0.30 соответственно. Эти данные свидетельствуют о минимальном содержании белковых примесей во всех четырех препаратах ЛПС и о низком уровне (или отсутствии) перекрестных реакций между ЛПС EV и ЛПС E. coli и О-антигеном ЛПС Y. рseudotuberculosis
3. Порины энтеробактерий. Для получения поринов OmpF и OmpC биомассу клеток Y. pseudotuberculosis выращивали при температурах 6–8 и 37°С соответственно. Препараты названных поринов выделяли по методике, описанной в статье [36]. O-mpF порин E. coli получали по методу Гаравито [37]. Степень очистки полученных образцов порина анализировали с помощью электрофореза по методу Лэммли [38] в вертикальных пластинах (9 × 2 × 0.1 см) в 12–25%-ном ПААГ в присутствии 0.1%-ного ДДС-Na. В качестве маркеров использовали набор окрашенных белков фирмы “Fermentas” (Литва) с молекулярными массами от 11 до 130 кДа. Белки, разделенные в геле, окрашивали раствором Кумасси R-250 в 10%-ной уксусной кислоте и 45%-ном этаноле. По данным электрофореза, использованные в эксперименте образцы белков представляли собой гомогенные препараты. До начала использования в эксперименте образцы хранили при температуре 4–6°С в забуференном физиологическом растворе (ЗФР), рН 7.2–7.4, с 0.1%-ным ДДС-Na.
4. Рекомбинантный OmpF порин Y. pseudotuberculosis. Экспрессию рекомбинантного OmpF (OmpFрек) порина Y. pseudotuberculosis, экстракцию его из телец включения и рефолдинг тримера порина проводили в соответствии с процедурой, в деталях описанной в работе [39]. По данным электрофореза в ПААГ с ДДС-Na, полученный образец OmpFрек имел подвижность, совпадающую с подвижностью тримера OmpF порина, выделенного из наружной мембраны Y. pseudotuberculosis. По данным оптической спектроскопии (кругового дихроизма и собственной белковой флуоресценции) пространственная структура OmpFрек была подобна таковой изолированного тримера порина, но имела несколько меньшую компактность белковой молекулы [39]. Содержание ЛПС в образцах OmpFрек определяли с помощью набора для количественного определения эндотоксина Limulus Amebocyte Lysate (LAL) (“Thermo Scientific”, США) в соответствии с протоколом производителя.
Иммунохимическую активность использованных в работе препаратов поринов оценивали методом ИФА, как и для ЛПС [35]. Значения ОП492 для препаратов OmpF, OmpFрек, OmpF E. coli c поливалентной антисывороткой к OmpF Y. pseudotuberculosis оказались равными 1.85, 1.68, 0.87, для препарата OmpC с поливалентной антисывороткой к OmpC Y. pseudotuberculosis – 1.55. Кроме того, методом проточной цитофлуориметрии было показано, что поликлональная антисыворотка к поринам Y. pseudotuberculosis достаточно эффективно взаимодействуют и с интактными микробными клетками, что подтверждает поверхностную локализацию этих белков в бактериальной НМ.
Инактивация бактериофага антигенами в растворе. Предварительно препараты поринов переводили в ЗФР с 0.01%-ным ДДС-Na, поскольку, известно, что ДДС-Na в данной концентрации не оказывает заметного цитотоксического действия по отношению к живым клеткам в течение короткого времени наблюдения (3 ч) [40]. Препараты ЛПС иерсиний, хранившиеся при температуре ‒70°С, после размораживания подвергали низкоскоростному центрифугированию (13000 g, 15 мин), надосадочную жидкость переводили в ЗФР с 0.01%-ным ДДС-Na. Лиофильно высушенный препарат ЛПС E. coli растворяли в ЗФР с 0.01% ДДС-Na. В качестве контроля использовали препарат БСА (“Sigma Aldrich”, США) в указанном буфере. Бактериофаг суспендировали в буфере SM (0.58% NaCl, 0.2% MgSO4·7 H2O, 0.05 M трис-HCl, pH 7.5) до конечной концентрации 8 × 105 бляшкообразующих единиц (БОЕ)/ мл. Затем смешивали 100 мкл раствора антигенов (или БСА) в концентрации 1 мг/мл с 20 мкл суспензии бактериофага и инкубировали на термошейкере Thermo Shaker PST-60HL-4 (“BIOSAN”, Латвия) при 500 об./мин в течение 3 ч при температуре 37°С. По окончании инкубации суспензии разбавляли 1 : 100 в буфере SM и полученные разведения высевали по методике определения титра бактериофага.
Сенсибилизация микросфер Сенсибилизация микросфер препаратами ЛПС. В качестве сенситинов использовали препараты ЛПС, выделенные из биомассы клеток Y. pseudotuberculosis, выращенных при температуре 10 и 37°С (далее ЛПС 10 и ЛПС 37), и из клеток Y. pestis EV, культивированных при 27°С (далее ЛПС EV). Каждый из трех препаратов разводили карбонат-бикарбонатным буфером (КББ), рН 9.5, до конечной концентрации ЛПС 1.5 мг/мл, после чего инкубировали на термошейкере при 37°С (250 об./мин) в течение 1 ч. Растворы центрифугировали (13 000g, 15 мин), затем супернатанты объемом 340 мкл переносили в сухие пробирки и добавляли к ним по 40 мкл суспензии полистирольных микросфер диаметром 1 мкм (“Polyscience”, США). Полученные смеси инкубировали на термошейкере в указанном выше режиме в течение 1 ч, после чего выдерживали их в течение ночи при 4°С. Затем микросферы отмывали ЗФР (3 раза по 1 мл) и добавляли в каждую пробирку по 1 мл 1%-ного раствора БСА в ЗФР. Начиная с этого момента, готовили таким же образом контрольные микросферы, обработанные только БСА, добавляя к 1 мл 1%-ного раствора БСА 40 мкл исходного препарата микросфер. Все образцы инкубировали на термошейкере при 37°С (250 об./ мин) в течение 1 ч, после чего однократно отмывали 1 мл ЗФР. К осадку микросфер приливали 250 мкл ЗФР, тщательно ресуспендировали и добавляли в каждую пробирку азид натрия до конечной концентрации 0.01%. Препараты хранили при температуре 4–6°С.
Сенсибилизация микросфер препаратами поринов. В качестве сенситинов использовали препараты поринов OmpC и OmpF, выделенные из клеток Y. pseudotuberculosis, а также порин OmpF из клеток E. coli. Все три препарата предварительно диализовали против КББ с использованием центрифужных концентраторов “Amicon Ultra-4 10К” (“Merсk”, “Millipore”, Германия). После заключительного центрифугирования (5000g, 15 мин) 250 мкл диализата с концентрацией белка ∼300 мкг/мл переносили в чистую пробирку и добавляли 40 мкл суспензии полистирольных микросфер диаметром 1 мкм (“Polyscience”, США). Дальнейшая последовательность операций идентична той, что использовалась для сенсибилизации микросфер препаратами ЛПС (см. выше).
Адсорбция бактериофага на сенсибилизированные микросферы. Микросферы, сенсибилизированные исследуемыми антигенами и БСА, а также контрольные, несенсибилизированные микросферы в расчетной конечной концентрации 7.2 × 106/мл, суспендировали в ЗФР до концентрации, соответствующей оптической плотности 1.2, измеренной на спектрофотометре SmartSpec Plus (“BioRad”, США) при длине волны 600 нм. Затем смешивали 100 мкл суспензии тех или иных микросфер и 20 мкл разведенного в буфере SM бактериофага с концентрацией 8 × 105 БОЕ/мл. Смесь инкубировали на термошейкере Thermo Shaker PST-60HL-4 (“Biosan”, Латвия) при 500 об./мин в течение 3 ч при температуре 37°С. После этого микросферы осаждали на центрифуге Centrifuge 5424 (“Eppendorf”, Германия) при 13 000 g в течение 10 мин, надосадочные жидкости разбавляли 1 : 100 буфером SM и высевали на чашки Петри по методике определения титра бактериофага.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для определения значимости отдельных бактериальных антигенов в адгезивности фагов используют метод, основанный на определении количества фаговых частиц, адсорбировавшихся на живых (реже инактивированных) бактериальных клетках, различающихся способностью экспрессировать исследуемый антиген. С этой же целью применяют метод, основанный на способности антигена связывать фаг в растворе, что препятствует последующей адсорбции таких фаговых частиц на поверхности микробной клетки [41]. В настоящей работе для изучения процессов адгезии бактериофагов предлагается новый подход, основанный на использовании полистирольных микросфер с адсорбированными на поверхности целевыми бактериальными антигенами.
Ранее нами были разработаны простые и эффективные методики иммобилизации ЛПС [42] и поринов [43] на поверхности полистирольных микросфер. Схема их приготовления в качестве обязательной стадии включала инкубацию микросфер, сенсибилизированных тем или иным антигеном, в растворе с заведомо избыточной концентрацией БСА с целью блокирования оставшихся свободными участков полистирола. В качестве контроля использовали микросферы, покрытые БСА. Снижение титра фага в надосадочной жидкости после совместной инкубации и центрифугирования суспензии сенсибилизированных микросфер и фага по сравнению с контролем расценивалось как участие соответствующего антигена-сенситина в адгезии бактериофага.
На первом этапе работы было исследовано влияние поверхностных бактериальных антигенов (ЛПС и неспецифических поринов), находящихся в растворе, на литическую активность ПДБ. Под литической (бляшкообразующей) активностью здесь понимается способность фага вызывать лизис культуры референс-штамма, которая выражается в количестве бляшек, образовавшихся после высева методом Грациа [33]. В этих экспериментах снижение литической активности (или титра) бактериофага квалифицировали как результат его связывания с исследуемыми антигенами в процессе их совместной инкубации. В связи с тем, что в данной работе БСА использовали в качестве нейтрального белка в контрольных препаратах микросфер, в опытах по определению связывания бактериофага с антигенами в растворе его добавляли и в контрольный раствор.
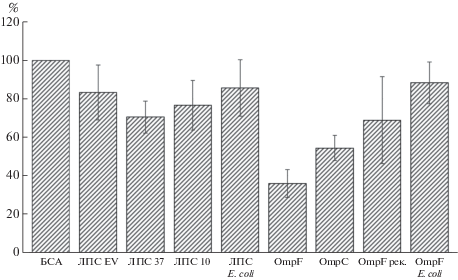
Использованные в работе препараты ЛПС иерсиний показали слабо выраженную способность связывать ПДБ в растворе (рис. 1). Для этой группы антигенных препаратов число оставшихся частиц бактериофага, способных к литической активности, составило 70–85%. Напротив, порины, выделенные из НМ клеток Y. pseudotuberculosis, продемонстрировали наибольший ингибирующий эффект в отношении бляшкообразующей активности исследуемого фага. Так, значения показателя БОЕ для суспензий фага, инкубированных с OmpF и OmpС белками, составили соответственно 35.9 и 54.4% от значения этого показателя для контрольной суспензии фага с БСА (рис. 1). Способность снижать литическую активность бактериофага проявил также рекомбинантный белок, OmpFрек псевдотуберкулезного микроба, экспрессируемый в клетках E. coli, но в меньшей степени, чем OmpF порин, полученный из бактерий Y. pseudotuberculosis. В отличие от поринов иерсиний, OmpF порин, выделенный из клеток E. coli, подобно ЛПС из этих же бактерий, не оказывал существенного влияния на оцениваемую активность (рис. 1).
Рис. 1.
Связывание ПДБ с антигенами в растворе (%). БСА – бычий сывороточный альбумин; ЛПС EV – ЛПС, выделенный из клеток Y. pestis штамма EV, выращенных при температуре 27°C; ЛПС 37, ЛПС 10 – ЛПС, выделенные из клеток Y. pseudotuberculosis серотипа 1 b, выращенных при температурах 10 и 37°С соответственно; ЛПС E. coli – ЛПС, выделенный из клеток E. coli 055:В5; OmpF и OmpС – соответственно порины OmpF и OmpС Y. pseudotuberculosis; O-mpFрек. – рекомбинантный порин OmpF Y. pseudotuberculosis; OmpF E. coli – порин OmpF E. coli.
Результаты опытов второго этапа работы (определение уровня адсорбции бактериофага на полистирольных микросферах, сенсибилизированных исследуемыми антигенными препаратами) представлены на рис. 2. Обнаружено, что интактные, (“голые”) полистирольные микросферы хорошо адсорбировали не только различные сенситины (ЛПС, порины, БСА), но и частицы собственно бактериофага. Так, если принять количество несвязавшегося бактериофага в надосадочной жидкости контрольных микросфер, покрытых БСА, за 100%, то доля частиц фага, не связавшихся с интактными микросферами, составила 36.9% от этого количества.
Рис. 2.
Адсорбция ПДБ на сенсибилизированные антигенами микросферы (%). bs + БСА – микросферы, покрытые БСА; bs + ЛПС EV – микросферы, покрытые ЛПС, выделенным из клеток Y. pestis штамма EV, выращенных при температуре 27°C; bs + ЛПС 37, bs + ЛПС 10 – микросферы, покрытые ЛПС, выделенным из клеток Y. pseudotuberculosis серотипа 1 b, выращенных при температурах 10 и 37°C соответственно; bs + OmpF и bs + OmpС – микросферы, покрытые соответственно поринами OmpF и OmpС Y. pseudotuberculosis; bs + OmpF E. coli – микросферы, покрытые порином OmpF E. coli; bs – микросферы интактные.
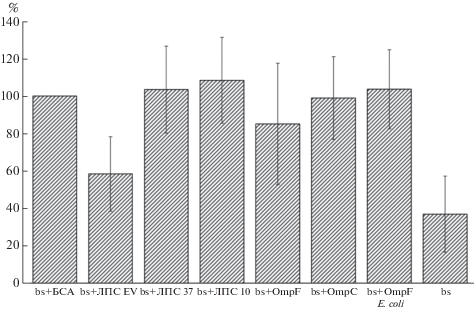
Из числа микросфер, сенсибилизированных исследуемыми антигенами, наибольшую способность к адсорбции ПДБ (41.5%) показали микросферы, покрытые ЛПС из клеток Y. pestis штамма EV. Некоторую способность к адсорбции ПДБ показали микросферы, сенсибилизированные OmpF порином, выделенным из клеток Y. pseudotuberculosis, которые в среднем, адсорбировали 14.8% фаговых частиц. Обнаружено, что микросферы, покрытые OmpС из Y. pseudotuberculosis и OmpF из E. coli, не адсорбировали ПДБ, так же как и микросферы, сенсибилизированные ЛПС из клеток Y. pseudotuberculosis, выращенных при температурах 10 и 37°С, т.е. из бактерий “гладких” и “шероховатых” колоний соответственно.
Сравнительная оценка результатов использования двух модельных систем, включающих бактериофаг и антигены НМ бактерий (в растворе и на микросферах) позволила сделать некоторые выводы об особенностях процесса адгезии бактериофага ПДБ на поверхности бактерий Y. pseudotuberculos и выявить как общие закономерности, так и некоторые различия в процессе взаимодействия антигенов с ПДБ. Первый из использованных подходов ранее уже применялся для этих целей [41]. Второй подход, рецепция в гетерогенной системе, с нашей точки зрения, дает более наглядное представление о взаимодействии фаговых частиц с бактериями, поскольку микросферы сходны по размерам с микробной клеткой.
В растворе все использованные препараты ЛПС по сравнению с белковыми антигенами показали менее выраженную способность к взаимодействию с частицами бактериофага. Это может быть связано с тем, что в водных растворах молекулы ЛПС способны с течением времени к самосборке и агломерации, что приводит к образованию молекулярных агрегатов различных форм и размеров [44] и соответствующему снижению доступности рецепторов для взаимодействия с фаговыми частицами. Неожиданно противоречивые результаты для этих антигенов были получены в случае взаимодействия фаг-антиген в гетерогенной системе. Так, микросферы, сенсибилизированные препаратами ЛПС, выделенными из клеток Y. pseudotuberculosis, как из “гладких”, так и “шероховатых” колоний микроорганизма, вообще не адгезировали частицы фага, в то время как ЛПС Y. pestis штамма EV, иммобилизованный на микросферах, адсорбировал более 40% ПДБ (рис. 2).
Полученные результаты могут быть объяснены следующим образом. Во-первых, ПДБ не является строго видоспецифическим фагом и способен, в частности, с высокой степенью эффективности лизировать клетки Y. pestis вакцинного штамма EV. Во-вторых, рецептор для этого фага, как было показано нами ранее, расположен скорее на коровой части молекулы ЛПС псевдотуберкулезного микроба [23]. Это согласуется с данными литературы, свидетельствующими о том, что рецепторы многих бактериофагов, специфичных в отношении иерсиний, локализованы именно в этой части молекулы ЛПС [20]. Кроме того, подтверждением такому объяснению служит и тот факт, что ЛПС Y. pestis, в отличие от ЛПС Y. pseudotuberculosis, полностью лишен О-антигена, а коровые области ЛПС двух близкородственных микробов Y. pestis и Y. pseudotuberculosis имеют высокую степень гомологии [45]. Именно этим можно объяснить наблюдаемый высокий уровень адсорбции фага при использовании микросфер, покрытых ЛПС Y. pestis.
Вместе с тем, следует отметить, что некоторые бактериофаги в качестве рецепторов используют также О-антиген грамотрицательных бактерий [46, 47]. Белки “хвоста” таких фагов, обладающие ферментативной активностью, могут гидролизовать или деацилировать О-антиген с последующим взаимодействием с вторичными рецепторами [6].
Однако полученные нами экспериментальные данные свидетельствуют о том, что во взаимодействии бактерий Y. pseudotuberculosis с ПДБ О-антиген не только не участвует в рецепции специфического фага, но и препятствует ей, экранируя рецепторный участок кора иерсиний, полностью доступный для контакта с ПДБ у клеток Y. pestis. Именно этим можно объяснить наблюдаемый высокий уровень адсорбции фага при использовании микросфер, покрытых ЛПС Y. pestis. Дополнительным косвенным подтверждением такого вывода может служить также некоторое снижение литической активности фага препаратами ЛПС из клеток Y. pseudotuberculosis, культивированных при 10°С по сравнению с ЛПС из бактерий, выращенных при 37°C (рис. 1), поскольку известно, что при понижении температуры культивирования Y. pseudotuberculosis увеличивается длина полисахаридных цепей ЛПС [48]. Вышеизложенное полностью соотносится с результатами ранее опубликованных результатов о влиянии О-антигена на рецепцию иерсиниозных бактериофагов микробными клетками [23, 49, 50].
Таким образом, совокупность приведенных данных литературы и представленных выше результатов эксперимента дает основание утверждать, что коровая область ЛПС двух указанных видов патогенных иерсиний, Y. pestis и Y. pseudotuberculosis, содержала рецепторы бактериофага ПДБ, скорее всего, близкие или идентичные по структуре.
Порины OmpF и OmpC Y. pseudotuberculosis также показали способность участвовать в адсорбции ПДБ. OmpF порин, продуцируемый бактериальными клетками при пониженных температурах культивирования [51, 52], обнаружил большую способность к взаимодействию с ПДБ по сравнению с OmpС порином, биосинтез которого доминировал при температуре 37°С. При этом взаимодействие бактериофага с OmpF в растворе оказалось более выраженным нежели с антигеном, нанесенным на микросферы (рис. 1 и 2). OmpF порин, выделеный из клеток E. coli, не проявил способности связывать исследуемый бактериофаг ни в растворе, ни на поверхности микросфер, что, по-видимому, может свидетельствовать о достаточно высокой специфичности фаговых рецепторов OmpF порина Y. pseudotuberculosis.
Следует отметить, что использование двух модельных систем позволило получить взаимодополняющую картину исследуемого взаимодействия “бактериофаг – микробная клетка”. Некоторые количественные расхождения полученных результатов могут объясняться несколькими причинами, прежде всего, различиями в условиях проведения эксперимента.
Исследование активности различных по структуре ЛПС иерсиний и неспецифических поринов разных типов как фаговых рецепторов позволило предположить, что не только структура, но и конформационное состояние поверхностных антигенов имеет существенное значение при взаимодействии бактерий с фагами. Так, в случае ЛПС способность его молекул агрегировать в водных растворах, а также увеличение длины О-специфических цепей снижают эффективность связывания с ПДБ.
Результаты взаимодействия препаратов поринов с ПДБ позволили предположить, что они обладают собственной активностью (связывание бактериофага), не зависящей от структуры примесного ЛПС. Такое заключение подтверждается более выраженной адгезивностью препарата OmpF по сравнению с OmpС, несмотря на то, что в препарате OmpF белка присутствует ЛПС с более длинными полисахаридными цепями, которые, как показали эксперименты по связыванию ПДБ в растворе, снижали рецепторные свойства ЛПС по отношению к фагу. Для поринов, нанесенных на микросферы, возможно, большое значение имело изменение конформации белковой молекулы в результате адсорбции на полистироле. Следствием этого могли стать изменения в доступности сайтов белковой молекулы, участвующих в рецепции фагов. Часть из них в результате связывания антигенов с полистиролом могли оказаться “закрытыми”. Наиболее заметно это проявилось в случае OmpC порина.
Также следует отметить, что при оценке роли ЛПС и поринов в адгезии ПДБ учитывали тот факт, что все поверхностные компоненты НМ интактной микробной клетки тесно интегрированы. Известно, что с одним тримером порина могут быть с разной степенью прочности связаны до 10 молекул ЛПС, причем одна из молекул – особо прочно [53]. Например, ЛПС, выделенный даже с помощью жесткой водно-фенольной экстракции, содержит прочно связанные примесные белки в количестве 1–3%. В изолированных препаратах поринов также присутствует 5–8% примесного ЛПС [54]. В нашем эксперименте свидетельством совокупного вклада этих двух доминантных компонентов НМ в рецепцию ПДБ является тот факт, что рекомбинантный OmpF порин Y. pseudotuberculosis, содержащий следовое количество эндотоксина (0.31 мкг ЛПС на 1 мг белка) связывал частицы фага в растворе в меньшей степени по сравнению с нативным OmpF, содержащим, как правило, до 8% ЛПС. Кроме того, этот результат может указывать и на значимость конформации белкового рецептора ПДБ в исследуемом взаимодействии, поскольку различная степень активности этих белков может быть связана с неполной ренатурацией рекомбинантного порина.
В заключение следует отметить, что в литературе имеются данные о бактериофагах, адгезия которых на бактериальной клетке может быть опосредована одним рецептором или протекать в два этапа. В двустадийной адгезии могут принимать участие как полисахаридные, так и белковые компоненты НМ бактерий, которые могут быть как первичными, так и вторичными рецепторами фага [6, 55]. Продемонстрированная в работе способность ЛПС и неспецифических поринов Y. pseudotuberculosis инактивировать ПДБ свидетельствовала о сложности процесса адгезии фага к микробным клеткам. Полученные результаты могут быть использованы при разработке новых средств специфической профилактики и диагностики бактериальных инфекций.
Статья подготовлена в рамках гранта Президента Российской Федерации для государственной поддержки молодых российских ученых-кандидатов наук (№ МК-3383.2021.1.4).
Список литературы
Cabanel N., Galimand M., Bouchier C., Chesnokova M., Klimov V., Carniel E. // Int. J. Med. Microbiol. 2017. V. 307. № 7. P. 371–381.
Rohde C., Wittmann J., Kutter E. // Surgical Infections. 2018. V. 19. № 8. P. 737–744.
Sharma S., Chatterjee S., Datta S., Prasad R., Dubey D., Prasad R.K., Vairale M.G. // Folia Microbiol. 2017. V. 62. P. 17–55.
Летаров А.В., Куликов Е.Е. // Успехи биологической химии. 2017. Т. 57. С. 153–208.
Silva J.B., Storms Z., Sauvageau D. // FEMS Microbiol. Lett. 2016. V. 363. № 4. https://doi.org/10.1093/femsle/fnw002
Broeker N.K., Barbirz S. // Mol. Microbiol. 2017. V. 105. №. 3. P. 353–357.
Gonzalez F., Helm R.F., Broadway K.M., Scharf B.E. // J Bacteriol. 2018. V. 200. № 19. e00363–18.
Pajunen M.I., Molineux I.J., Skurnik M. // Adv. Exp. Med. Biol. 2003, V. 529. P. 233–240.
Chatterjee S., Rothenberg E. // Viruses. 2012. V. 4. № 11. P. 3162–3178.
Tomas J.M., Jofre J.T. // J. Bacteriol. 1985. V. 162. № 3. P. 1276–1279.
Nobrega F.L., Vlot M., de Jonge P.A., Dreesens L.L., Beaumont H.J.E., Lavigne R., Dutilh B.E., Brouns S.J.J. // Nature Reviews Microbiology. 2018. V. 16. P. 760–773.
Power M.L., Ferrari B.C., Littlefield–Wyer J., Gordon D.M., Slade M.B., Veal D.A. // Appl. Environ. Microbiol. 2006. V. 72. № 12. P. 7930–7932.
Langenscheid J., Killmann H., Braun V. // FEMS Microbiology Letters. 2004. V. 234. № 1. P. 133–137.
Gibbs K.A., Isaac D.D., Xu J., Hendrix R.W., Silhavy T.J., Theriot J.A. // Mol. Microbiol. 2004. V. 53. № 6. P. 1771–1783.
Trojet S.N., Caumont–Sarcos A., Perrody E., Comeau A.M., Krisch H.M. // Genome Biol. Evol. 2011. V. 3. P. 674–686.
Bekhit A., Fukamachi T., Saito H., Kobayashi H. // Biol. Pharm. Bull. 2011. V. 34. P. 330–334.
Zhao X., Cui Y., Yan Y., Du Z., Tan Y., Yang H. et al. // J. Virology. 2013. V. 87. № 22. P. 12260–12269.
Ho T.D., Slauch J.M. // J. Bacteriol. 2001. V. 183. № 4. P. 1495–1498.
Rashid M.H., Revazishvili T., Dean T., Butani A., Verratti K., Bishop–Lilly K.A., Sozhamannan S., Sulakvelidze A., Rajanna C. // Bacteriophage. 2012. V. 2. № 3. P. 168–177.
Filippov A.A., Sergueev K.V., He Y., Huang X.-Z., Gnade B.T., Mueller A.J., Fernandez–Prada C.M., Nikolich M.P. // PLoS One. 2011. V. 6. № 9. e25486. https://doi.org/10.1371/journal.pone.0025486
Skurnik M. // Adv. Exp. Med. Biol. 2012. V. 954. P. 293–301.
Kiljunen S., Hakala K., Pinta E., Huttunen S., Pluta P., Gador A., Lönnberg H., Skurnik M. // Microbiology. 2005. V. 151. № 12. P. 4093–4102.
Бывалов А.А., Дудина Л.Г., Конышев И.В., Литвинец С.Г., Мартинсон Е.А. // Бюллетень экспериментальной биологии и медицины. 2015. Т. 160. № 11. С. 622–625.
Lu Q., Wang J., Faghihnejad A., Zeng H., Liu Y. // Soft Matter. 2011. V. 7. № 19. P. 9366–9379.
Burks G.A., Velegol S.B., Paramonova E., Lindenmuth B.E., Feick J.D., Logan B.E. // Langmuir. 2003. V. 19. № 6. P. 2366–2371.
Zou D., Wu W., Zhang J., Ma Q., Fan S., Cheng J., Li D., Niu J., Qian X., Li W., Cui D.// RSC Adv. 2019. V. 9. P. 39976–39985.
Xie S., Chen S., Zhu Q., Li X., Wang D., Shen S., Jin M., Zhou G., Zhu Y., Shui L. // ACS Appl Mater Interfaces. 2020. V. 12. № 23. P. 26374–26383.
Filippov A.A., Sergueev K.V., He Y., Nikolich M.P. // Adv. Exp. Med. Biol. 2012. V. 954. P. 123–134.
Zhao X., Skurnik M. // Adv. Exp. Med. Biol. 2016. V. 918. P. 361–375.
Чернядьев А.В., Дудина Л. Г., Литвинец С.Г., Черников В.П., Бывалов А.А. // Проблемы особо опасных инфекций. 2014. № 4. С. 80–82.
Filippov A.A., Sergueev K.V., Nikolich M.P. // Bacteriophage. 2012. V. 2. № 3. P.186–189.
Molecular Cloning: a Laboratory Manual. V. 1. 3rd. Ed. / J. Sambrook, D.W.Russell. N.Y.: Cold Spring Harbor Laboratory, 2001. 794 p.
Лабинская А.С. Микробиология с техникой микробиологических исследований. М.; 1978, 394 с.
Westphal O., Jann K. // Methodes Carbohydr. Chem. 1965. V. 5. P. 83–91.
Бывалов А.А., Дудина Л.Г., Литвинец С.Г., Новикова О.Д., Хоменко В.А., Портнягина О.Ю., Оводов Ю.С. // Прикл. биохимия и микробиология. 2014. Т. 50. № 2. С. 203–210.
Новикова О.Д., Федореева Л.И., Хоменко В.А., Портнягина О.Ю., Ермак И.М., Лихацкая Г.Н., Мороз С.В., Соловьева Т.Ф., Оводов Ю.С. // Биоорган. химия. 1993. Т. 19. № 5. С. 536–547.
Garavito R.M., Rosenbusch J.P. // Methods of Enzymology. 1986. V. 125. P. 309–329.
Laemmly U.K. // Nature. 1970. V. 227. № 5259. P. 680–685.
Хоменко В.А., О.Ю. Портнягина, О.Д. Новикова, М.П. Исаева, Н.Ю. Ким, Г.Н. Лихацкая, О.П. Вострикова, Т.Ф. Соловьева // Биоорган. химия. 2008. Т. 34. № 2. С. 162–168.
Schöler N., Olbrich C., Tabatt K., Müller R.H., Hahn H., Liesenfeld O. // Int. J. Pharm. 2001. V. 221. P. 57–67.
Takeda K., Uetake H. // Virology. 1973. V. 52. № 1. P. 148–159.
Konyshev I., Byvalov A., Ananchenko B., Fakhrullin R., Danilushkina A., Dudina L. // J. Biomech. 2020. V. 99. 109504.https://doi.org/10.1016/j.jbiomech.2019.109504
Бывалов А.А., Конышев И.В., Новикова О.Д., Портнягина О.Ю., Белозеров В.С., Хоменко В.А., Давыдова В.Н. // Биофизика. 2018. Т. 63. № 5. С. 913–922.
Santos N.C., Silva A.C., Castanho M.A., Martins–Silva J., Saldanha C. // Chembiochem. 2003. V. 4. № 1. P. 96–100.
Книрель Ю.А., Анисимов А.П. // Acta Naturae. 2012. Т. 4. № 3. С. 49–61.
Salem M., Skurnik M. // Viruses. 2018. V. 10. № 4. 174. https://doi.org/10.3390/v10040174
Kunstmann S., Scheidt T., Buchwald S., Helm A., Mulard L.A., Fruth A., Barbirz S. // Viruses. 2018. V. 10. № 8. 431. https://doi.org/10.3390/v10080431
Ho N., Kondakova A.N., Knirel Y.A., Creuzenet C. // Mol. Microbiol. 2008. V. 68. № 2. P. 424–447.
Kiljunen S., Datta N., Dentovskaya S.V., Anisimov A.P., Knirel Y.A., Bengoechea J.A., Holst O., Skurnik M. // J. Bacteriol. 2011. V. 193. № 18. P. 4963–4972.
Born F., Braun P., Scholz H.C., Grass G. // Pathogens. 2020. V. 9. № 8. 611. https://doi.org/10.3390/pathogens9080611
Begic S., Worobec E.A. // Microbiology. 2006. V. 152. № 2. P. 485–491.
Быстрицкая Е.П. // Вестник ДВО РАН. 2014. № 1. С. 164–168.
Holzenburg A., Engel A., Kessler R., Manz H.J., Lustig A., Aebi U. // Biochemistry. 1989. V. 28. № 10. P. 4187–4193.
Новикова О.Д., Вакорина Т.И., Хоменко В.А., Лихацкая Г.Н., Ким Н.Ю., Емельяненко В.И., Кузнецова С.М., Соловьева Т.Ф. // Биохимия. 2008. Т. 73. № 2. С. 173–184.
Bertozzi Silva J., Storms Z., Sauvageau D. // FEMS Microbiol. Lett. 2016. 363. https://doi.org/10.1093/femsle/fnw002
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


