Прикладная биохимия и микробиология, 2021, T. 57, № 4, стр. 388-393
Влияние феруловой кислоты на рост колоний и размножение клеток эндофитного штамма бактерий Bacillus subtilis 26Д
Е. Р. Сарварова 1, Р. М. Хайруллин 1, *, И. В. Максимов 1
1 Институт биохимии и генетики – обособленное структурное подразделение Федерального государственного бюджетного научного учреждения Уфимский федеральный исследовательский центр РАН
450054 Уфа, Россия
* E-mail: krm62@mail.ru
Поступила в редакцию 26.08.2020
После доработки 24.12.2020
Принята к публикации 22.02.2021
Аннотация
В стрессовых условиях, в том числе в ответ на инфицирование фитопатогенами, растения вырабатывают различные соединения, являющиеся активаторами роста, например, оксикоричные кислоты (ОК), в том числе феруловую кислоту (ФК). Роль ОК во взаимоотношениях растений с эндофитными бактериями детально не исследована. В работе изучали влияние ФК в пределах концентраций 1.0–1000 мкг/л на размножение и рост эндофитного штамма Bacillus subtilis 26Д на агаризованных и жидких средах. Установлено, что на 1.5%-ной агризованной среде ФК подавляла, а при меньшей концентрации агара (0.7%) увеличивала размеры бактериальных колоний. В жидкой среде ФК стимулировала размножение клеток бактерий. Показано, что бактерии штамма B. subtilis 26Д способны к деструкции ФК.
В настоящее время не вызывает сомнений, что присутствие во внутренних тканях растений микроорганизмов может благоприятно влиять на рост и устойчивость организма-хозяина. Такие бактерии, проникающие во внутренние растительные ткани без повреждений, вызванных воздействием каких-либо других факторов, и способные жить внутри растений, не нанося им вреда, относят к эндофитам [1]. Ценным свойством эндофитных бактерий, позволяющим использовать их в защите растений, является их способность к синтезу антибиотических соединений, ингибирующих рост и размножение фитопатогенов, а также индукции защитных реакций самого растения [2].
Хорошо известно, что одной из универсальных защитных реакций растений при патогенезе является формирование в растительных тканях сложного полимера лигнина из мономерных фенольных соединений, создающего своеобразный защитный барьер на пути распространения инфекции. Ключевым фенольным компонентом, укрепляющим клеточные стенки растений, является оксикоричная феруловая кислота (ФК) [3]. При этом сами фенольные соединения, вовлекающиеся в лигнификацию, способны непосредственно подавлять рост фитопатогенных грибов и выступать в роли природных пестицидов [4]. В этой связи возникает вопрос, как влияют подобные фенольные соединения на самих эндофитов, так как по аналогии с действием на фитопатогены, эти вещества могут подавлять рост и размножение мутуалистических эндофитных бактерий.
Анализ работ, посвященных изучению действия оксикоричных кислот (ОК) на бактерии, свидетельствует о том, что эти соединения по отношению к некоторым видам микроорганизмов проявляют антимикробное действие. Авторы работы [5] наблюдали подавление роста бактерий Escherichia coli DMF 7503, Bacillus cereus DMF 2001, Listeria monocytogenes DMF 5776 под действием ФК. Такой эффект Боргес с соавт. [6] объяснили влиянием ОК на физико-химические свойства внешних структур бактериальных клеток, поверхностный заряд, целостность бактериальной цитоплазматической мембраны. Вместе с тем у представителей Bacillus subtilis обнаружена способность использовать ФК в качестве единственного источника углерода [7].
Бактерии рода Bacillus довольно часто встречаются среди эндофитов [8]. В связи с этим возникает вопрос, как ФК могут влиять на рост и размножение эндофитных представителей рода Bacillus. Работы, отвечающие на данный вопрос, в известной нам литературе не найдены.
Цель работы – исследование влияния ФК в концентрациях, близких к содержанию в ризосфере растений, на рост на агаризованных средах и в жидкой культуре эндофитного штамма бактерий B. subtilis 26Д – основы хорошо известного коммерческого фунгицида Фитоспорин-М.
МЕТОДИКА
В экспериментах использовали ФК (trans-ferulic acid, 99%) компании “Sigma-Aldrich” (США). Для изучения влияния кислоты на рост колоний штамма B. subtilis 26Д (коллекция ВНИИСХМ, №128) использовали агаризованную среду LB (Luria Bertani), следующего состава (%): триптон – 1.0, дрожжевой экстракт – 0.5, хлорид натрия – 1.0, картофельно-глюкозный отвар (КГА, отвар картофеля – 200 г/л) – 200 мл, глюкоза – 20, вода дистиллированная 1 л, агар-агар – 1.5, а также полусинтетическую среду (ПСС), состав которой приведен в работе [9].
Для инокуляции твердых сред использовали жидкие 24-часовые культуры. ФК в асептических условиях растворяли в стерильных пробирках в 96%-ном этаноле и выдерживали 60 мин в темноте для исключения возможной полимеризации из-за образования на свету свободных радикалов. Раствор вносили в незастывшую агаризованную среду с температурой 45°С и перемешивали для равномерного распределения кислоты. При этом объем вносимого этанола был одинаков во всех вариантах эксперимента.
Влияние ФК на рост колоний на плотных средах и его характер изучали в нескольких экспериментах. В одной серии на каждую чашку Петри, содержащую определенную концентрацию кислоты в питательной среде (1.5% агара), наносили по 5 мкл суспензии 24-часовой бактериальной культуры в 6 повторностях. Чашки помещали в термостат и инкубировали в течение 24 ч при температуре 37°С. Для оценки диаметра колоний измеряли два перпендикулярных диаметра, из 12 замеров рассчитывали средний диаметр в мм.
В другой серии экспериментов одновременно определяли возможность распространения колонии бактерий по типу скольжения по поверхности полутвердой среды (0.7% агара) с содержанием 5 мM KCl [10], на этой же среде выясняли наличие хемотаксиса, используя метод, описанный в работе [11]. Для этого в чашку Петри вначале заливали питательную среду с содержанием ФК в концентрации 10, 100, или 1000 мкг/л, формируя скошенную поверхность наклоном чашки. После затвердевания первой среды, чашку ставили горизонтально и наливали питательную среду без ФК, формируя горизонтальную поверхность, под которой оставалась скошенная среда, концентрация ФК в которой менялась от 0 до 10 или 100, или 1000 мкг/л. В центр чашки Петри на поверхность наносили суспензию клеток бактерий, культивировали при 37°С 24 ч, характер роста колонии оценивали визуально. При наличии хемотаксиса форма колонии должна быть вытянутой в сторону увеличения концентрации испытуемого вещества.
Так как ФК могла неравномерно диффундировать в скошенной среде, для оценки характера распределения ее концентрации в чашке Петри формировали среду, как описано в работе [11], но используя при этом чистый 1.5%-ный агар. Чашку выдерживали 24 ч в термостате при 37°С, затем вырезали три цилиндрических блока равной массы: по краям чашки с минимальной и максимальной концентрацией ФК, а также в центре. ФК в вырезанных образцах экстрагировали 96%-ным этанолом. Оптическую плотность (ОП) растворов при 311 нм определяли на спектрофотометре UNICO 2000 (“United Products & Instruments”, США). Установлено, что через 24 ч градиент концентрации ФК в среде сохранялся: при концентрациях ФК в среде 0 и 1000 мкг/л ОП была 0.005 и 0.090, в среде в центре чашки Петри 0.05.
Для оценки влияния ФК на рост бактерий в жидкой культуре LB в каждую колбу с равным объемом среды и определенной концентрацией кислоты добавляли по 100 мкл суспензии 24-часовой бактериальной культуры. Колбы (три повторности для каждого варианта) помещали в термостатируемый шейкер и инкубировали 24 ч при 37°С. Концентрацию клеток определяли по ОП суспензии на спектрофотометре Bio-Rad SmartSpec Plus (“Bio-Rad Laboratories”, США) при длине волны 600 нм и оценивали, сравнивая со стандартом мутности.
Способность бактерий B. subtilis 26Д продуцировать ферменты деструкции ФК оценивали спектрофотометрически по методу, предложеному в работе [12].
Культуру клеток B. subtilis 26Д выращивали 12 ч на жидкой среде LB с ФК в концентрации 100 мкг/л при 37°C. Клетки отделяли центрифугированием при 5000 g, промывали трижды раствором 70 мМ фосфатно-солевого буфера (ФБС, 0.15 М NaCl в натрий-фосфатном буфере, pH 6.0) и ресуспендировали в объеме, в 5 раз меньшем, по сравнению с исходным объeмом культуры. Затем клетки ресуспендировали в ФБС до половины исходного объема культуры. Суспензию клеток делили на 2 части. Одну часть (контроль) – прогревали при 100°С на кипящей водяной бане 5 мин, вторую использовали для оценки активности ферментов, разрушающих ФК. К 9.8 мл каждой из суспензий добавляли 0.2 мл раствора ФК (10 мг в 1 мл 96%-ного этанола). Реакционную смесь выдерживали при температуре 30°С на качалке 120 мин, отбирали 1 мл пробы и отделяли клетки центрифугированием. К 200 мкл супернатанта добавляли 2.8 мл ФБС и определяли спектр поглощения в диапазоне от 250 до 400 нм на спектрофотометре UNICO 2000.
Статистическая обработка результатов экспериментов проведена с использованием программы Exel Microsoft. На гистограммах вертикальными линиями указаны пределы значений стандартных отклонений от среднего значения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что ФК, как и другие ОК, находится в растительных тканях в связанной форме в структуре лигнина [3]. Однако, по данным Ву с соавт. [13], она может выделяться в окружающую корни среду в виде цис-формы, в среднем, в концентрации 2.3 мкг/л, в транс-форме – 10.2 мкг/л. На основании этих данных в работе использовали концентрации ФК 10 и 100 мкг/л, а в некоторых экспериментах и 1000 мкг/л.
На агаризованной богатой среде LB (1.5% агара) бактерии росли лучше, и ожидаемо хуже на обедненной белками минеральной среде ПСС (рис. 1а). В присутствии ФК рост колоний бактерий подавлялся на всех изученных средах, достоверно при концентрации ФК 100 мкг/л.
Рис. 1.
Влияние феруловой кислоты на рост колоний B. subtilis 26Д (мм) на агаризованных средах КГА, LB и ПСС (а) и на размножение клеток (109 кл./мл) в жидкой среде LВ (б): 1 – 24; 2 – 48 ч.
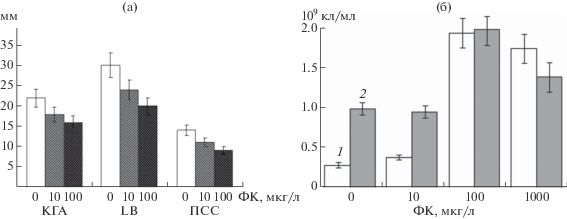
При культивировании микроорганизмов в жидкой питательной среде выявлен обратный эффект действия ФК на размножение бактерий (рис. 1б). Например, при концентрации ФК 100 мкг/л наблюдалось шестикратное увеличение плотности клеток по сравнению с контрольной средой.
Ингибирование роста колоний на плотной среде могло быть связано с описанным ранее Боргес с соавт. [6] непосредственным влиянием ФК не только на поверхностный заряд клетки и целостность цитоплазматической мембраны, но и на подвижность бактерий. Известно, что бактерии используют различные двигательные механизмы для колонизации окружающей среды, такие как жгутико-зависимое плавание и роение, а также жгутико-независимое скольжение. В работе Р. Херши [14] указывает, что скользящая подвижность является пассивным способом перемещения бактериальных клеток для распространения по поверхностям. Наименее исследованы механизмы скольжения бактерий – движения клеточной массы силой пролиферации клеток на среде с поверхностью, уменьшающей трение между клетками и субстратом [15].
Для исследования возможности распространения бактерий по поверхности твердой среды по типу скольжения и, одновременно, возможно, благодаря хемотаксису, использовали полутвердую среду LB (0.7% агара) с градиентом ФК, сформированном как описано в разделе “Методика”. Выявлено, что на такой среде с ФК размеры колоний бактерий многократно увеличивались (рис. 2). При этом не было выявлено преимущественного роста колоний в сторону увеличения концентрации ФК – колонии формировались правильной круглой формы. На среде LB без ФК клетки формировали типичные для штамма B. subtilis 26Д сухие, морщинистые колонии с четко очерченными фестончатыми краями. На среде с ФК колонии “расплывались”, края были нечеткими, лучистыми, превышающими диаметр колоний на контрольной среде без ФК от полутора до двух раз.
Рис. 2.
Форма колоний B. subtilis 26Д на полутвердой среде с градиентом концентрации ФК. Стрелкой показано направление увеличения концентрации ФК в среде: контроль (1), 0–10 (2), 0–100 (3) и 0–1000 мкг/л (4).

Поскольку в жидкой среде ФК стимулировала размножение клеток бактерий, можно предположить, что это соединение способно выступать не только как регулятор скольжения, но и как питательный субстрат или регулятор размножения, несмотря на незначительную концентрацию в среде.
Известно, что некоторые штаммы B. subtilis способны к деструкции ОК благодаря наличию гена, кодирующего синтез декарбоксилазы фенольных кислот (PAD, phenolic acid decarboxylase) [16], транскрипционно регулируемой кумаровой, феруловой или кофейной кислотами [17].
На основе этих данных проведен анализ наличия у бактерий штамма B. subtilis 26Д ферментативной активности, способной привести к деструкции ФК. Для этого оценивали изменение спектра поглощения ФК в среде с живыми и инактивированными клетками бактерий (рис. 3). Спектры поглощения исходных растворов ФК без клеток бактерий (рис. 3, 1), а также в суспензии живых клеток бацилл (рис. 3, 2) совпадали. Уменьшение показателя поглощения в суспензиях клеток можно объяснить частичной адсорбцией этого соединения на стенках клеток. Двухчасовая инкубация ФК с живыми клетками в течение 2 ч меняла спектр поглощения ФК, что согласовывалось с результатами работы [12], объясняющими этот эффект деструкцией вещества. Спектр поглощения ФК при инкубировании в среде с инактивированным ферментом не изменялся. Таким образом, установлено, что бактерии штамма были способны метаболизировать ФК.
Рис. 3.
Изменение спектра поглощения ФК в среде с клетками B. subtilis 26Д: 1 – спектр поглощения ФК с живыми клетками в начале реакции; 2 – спектр поглощения ФК после инкубации клеток 120 мин в среде с инактивированными клетками; 3 – то же в среде с живыми клетками.
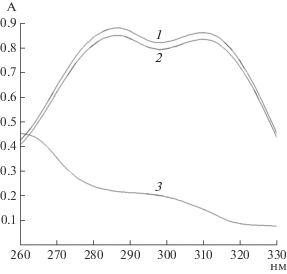
Результаты эксперимента по исследованию возможности деструкции ФК клетками бактерий B. subtilis 26Д могут свидетельствовать о том, что, несмотря на заявленную чистоту вещества, при проведении экспериментов часть ФК изомеризовалась в цис-форму, так как спектр поглощения смещался в коротковолновую область (рис. 3) [18]. Результаты анализа различных форм ФК в растениях показали, что в растительных тканях присутствуют обе формы кислоты при преобладании транс-изомера, при этом цис-изомер ФК способен ингибировать рост растений [19]. Таким образом, деструкция ФК эндофитным штаммом бактерий B. subtilis 26Д, особенно цис-изомера, может приводить к уменьшению концентрации этой формы, ингибирующей рост растений, что согласуется с данными о стимуляции роста различных сельскохозяйственных культур этой бактерией [1].
Подавление ФК роста колоний бактерий на твердых средах (1.5% агара, рис. 1а) было показано также другими авторами на других видах бактерий [5, 6]. В отличие концентраций ФК, использованных в цитируемых литературных источниках, в настоящей работе исследованы концентрации, близкие к выявленным при секреции ФК корнями растений в окружающую среду [14]. В результате поиска и анализа литературы не было найдено работ, в которых исследовали действие на бактерии ФК или других ОК в концентрациях, совпадающих с наблюдаемыми в ризосфере растений, что позволяет считать полученные результаты приоритетными. Способность бацилл к деструкции ФК описана [16, 17], однако ее влияние на свойства бактерий не только эндофитных, но и других штаммов в связи с их взаимоотношениями с растениями не рассматривалось.
В настоящее время функциональная роль ФК, как одного из ключевого соединения в структуре клеточной стенки растений [3], детально исследована. Хорошо известно, что ОК являются структурными компонентами лигнина – сложного полимера, входящего в состав клеточных стенок растений. Лигнин весьма плохо поддается деструкции ферментами микроорганизмов, поэтому его считают своеобразным защитным барьером в растительной клетке на пути проникновения инфекционных структур фитопатогенов. Активный синтез лигнина наблюдался при поранении растительных тканей, а также атаке грибных и бактериальных фитопатогенов [20]. Кроме механической барьерной функции лигнин может играть роль защитного химического барьера, так как при его разрушении такими ферментами, как, например, грибные лакказы [21], могут высвобождаться олигомеры и мономеры ОК, обладающие в высоких концентрациях бактериостатической активностью в отношении, например, условно-патогенных бактерий Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus и Listeria monocytogenes [5].
Несомненно, мономерные формы ОК должны присутствовать не только при деградации, но и при синтезе лигнина в ходе естественного физиологического процесса роста и старения клеток растений, а также при действиях экзогенных факторов – поранениях, атаке фитопатогенных микроорганизмов. В связи с этим интересно поведение мутуалистических бактерий-эндофитов, населяющих внутренние ткани растений при изменении концентрации ФК в растительных тканях. Понимание возможных реакций эндофитов на активизацию синтеза ФК и увеличение ее концентрации в растительных тканях, как при синтезе лигнина, так и при его деструкции, а также при выделении ФК в ризосферу корнями растений [13] могут способствовать полученные нами результаты.
Так, увеличение скорости роста колоний бактерий на полутвердой питательной среде с ФК (рис. 2) позволяет выдвинуть предположение о существовании своеобразного механизма движения клеток эндофитов вслед за хорошо растущими и развивающимися органами растений с высокой влажностью. Постепенная лигнификация стенок молодых растительных клеток, неразрывно связанная с синтезом лигнина и участием ФК создает определенный ее пул, что также может активизировать движение бактерий по развивающимся сосудам не только благодаря току воды при транспирации, но и наличию соединений, таких, как, например ФК, усиливающих двигательную активность эндофитов. Усиление лигнификации тканей характерное для роста и старения растений, сопровождающееся, как правило, уменьшением содержания влаги, способно автоматически тормозить распространение эндофитов. Возможно, таким образом формируется система контроля распространения эндофитов в растительных тканях. Вместе с этим, секреция ФК корнями растений [13] при наличии в достаточном количестве влаги в окружении может способствовать увеличению биомассы представителей рода Bacillus, и являться одним из первых механизмов, способствующих проникновению эндофитов в ткани растений.
Установленная способность клеток штамма B. subtilis 26Д утилизировать ФК (рис. 3) позволяет предположить, что эндофит может выполнять несколько функций, в том числе и неблагоприятного агента. С одной стороны, деструкция ФК и уменьшение ее содержания может быть своеобразным сигналом для растения-хозяина, свидетельствующим о возможности дальнейшего роста, то есть сигналом “омоложения”. Это предположение согласуется с работой Дос Сантос с соавт. [22], в которой выявлено, что обработка ФК корней сои ингибирует их рост, индуцируя синтез лигнина. Именно это свойство – стимуляция роста растений – характерно для данного штамма бактерии [1]. С другой стороны, высокая концентрация клеток эндофита в растительных тканях может приводить к уменьшению уровня ФК, что снижает эффективность защитного действия не столько самой бактерии, сколько растения-хозяина, так как появляется вероятность недостаточной лигнификации и формирования непрочного барьера на пути патогенов. Однако наличие известной антагонистической активности данного эндофита ко многим фитопатогенам позволяет проявиться эффекту замещения защитного механизма растения с помощью лигнификации на защиту с помощью антибиотических компонентов самого эндофита, присутствующего в растительных тканях. Таким образом, растение вместе с эндофитом представляет собой тонко и самостоятельно настроенную систему, контролирующую физиологическое развитие хозяина в благоприятной для него среде, также создающую многоуровневую защиту при атаке фитопатогенов.
Впервые показано, что при наличии в среде ФК в концентрациях, характерных для ее секреции корнями растений, рост и скорость распространения колоний бактерий B. subtilis по поверхности может возрастать. Установлена также способность бактерий B. subtilis штамма 26Д к деструкции ФК. Исследование влияния других ОК (кумаровой, синаповой, кофейной), а также оксибензойных кислот (галловой, сиреневой и других) на подвижность и размножение как эндофитных, так и фитопатогенных бактерий позволят, по мнению авторов, открыть новые механизмы взаимоотношений растений и микроорганизмов.
Работа выполнена по теме госзадания, № АААА-А16-116020350027-7 с использованием оборудования ЦКП “Биомика” (Отделение биохимических методов исследований и нанобиотехнологии, Региональный центр коллективного пользования “Агидель”).
Список литературы
Курамшина З.М., Смирнова Ю.В., Хайруллин Р.М. // Физиология растений. 2016. Т. 63. № 5. С. 679–687.
Khare E., Mishra J., Kumar N.A. // Front. Microbiol. 2018. V. 15. Art. 02732. https://doi.org/10.3389/fmicb.2018.02732
De Oliveira D.M., Finger-Teixeira A., Mota T.R., Salvador V.H., Moreira-Vilar1 F.C., Molinari H.B.C. et al. // Plant Biotechnology J. 2015. V. 13. Art. 12292. P. 1224–1232. https://doi.org/10.1111/pbi.12292
Patzke H., Schieber A. // Food Res. Int. 2018. V. 113. P. 18–23. https://doi.org/10.1016/j.foodres.2018.06.062
Merkl R., Hrádková I., Filip V., Šmidrkal J. // Czech. J. Food Sci. 2010. V. 28. P. 275–279. https://doi.org/10.17221/132/2010-CJFS
Borges A., Ferreira C., Saavedra M. J., Simoes M. // Microbial Drug Resistance. 2013. V. 19. № 4. P. 256–265. https://doi.org/10.1089/mdr.2012.0244
Gurujeyalakshmi G., Mahadevan A. // Current Microbiology. 1987. V. 16. № 2. P. 69–73.
Lopes R., Tsui S., Gonçalves P.J.R.O., de Queiroz M.V. // World J. Microbiol. Biotechnol. 2018. V. 34. № 7. Art 94. https://doi.org/10.1007/s11274-018-2479-7
Недорезков В.Д. Биологическая защита пшеницы от болезней в условиях Южного Урала. М.: Изд-во МСХА, 2002. 173 с.
Fall R., Kearns D.B., Nguyen T. // BMC Microbiology. 2006. V. 6. № 1. Art. 31. https://doi.org/10.1186/1471-2180-6-31
Hamouche L., Laalami S., Lakkis G., Kobaissi A., Chokr A., Putzer H., Hamze K. // Int. J. Scientific & Technology Research. 2015. V. 4. № 10. P. 14–20.
Degrassi G., de Laureto P.P., Bruschi C.V. // Appl. Environ. Microbiol. 1995. V. 61. № 1. P. 326–332. https://doi.org/10.1128/AEM.61.1.326-332.1995
Wu H., Haig T., Pratley J., Lemerle D., An M. // J. Chemical Ecology. 2000. V. 26. P. 2141–2154. https://doi.org/10.1023/A:1005520500110
Harshey R.M. // Ann. Rev. Microbiol. 2003. V. 57. № 1. P. 249–273. https://doi.org/10.1146/annurev.micro.57.030502.091014
Henrichsen J. // Bacteriol. Rev. 1972. V. 36. № 4. P. 478–503.
Cavin J.F., Dartois V., Diviès C. // Appl. Environ. Microbiol. 1998. V. 64. № 4. P. 1466–1471.
Tran N.P. Gury J., Dartois V., Nguyen T.K., Seraut H., Barthelmebs L., Gervais P., Cavin J.F. // J. Bacteriology. 2008. V. 190. № 9. P. 3213–3224. https://doi.org/10.1128/JB.01936-07
Istasse T., Jacquet N., Berchem T., Haubruge E., Nguyen B.K., Richel A. // Analytical Chemistry Insights. 2016. V. 11. P. 49–57. https://doi.org/10.4137/ACI.S39739
Salum M.L., Erra-Balsells R. // Environ. Control Biol. 2013. V. 51. № 1. P. 1–10.
Zhao Q. // Trends in Plant Science. 2016. V. 21. № 8. P. 713–721. https://doi.org/10.1016/j.tplants.2016.04.006
Johannes C., Majcherczyk A. // J. Biotechnol. 2000. V. 78. № 2. P. 193–199. https://doi.org/10.1016/s0168-1656(00)00208-x
Dos Santos W.D., Ferrarese, M.L.L., Nakamura C.V., Mourão K.S.M., Mangolin C.A., Ferrarese-Filho O. // J. Chemical Ecol. 2008. V. 34. P. 1230–1241. Art. 1230. https://doi.org/10.1007/s10886-008-9522-3
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


