Прикладная биохимия и микробиология, 2021, T. 57, № 4, стр. 394-401
Изучение взаимодействия ризосферных бактерий с неризобиальными эндофитными бактериями растений гороха (Pisum sativum L.), перемещающимися из их корней в прикорневую зону
Л. Е. Макарова 1, *, Ю. А. Маркова 1, А. С. Мориц 1, М. С. Карепова 1, А. В. Сидоров 1, Н. А. Соколова 1
1 Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, Россия
* E-mail: makarova@sifibr.irk.ru
Поступила в редакцию 30.12.2020
После доработки 19.02.2021
Принята к публикации 22.02.2021
Аннотация
Показано, что из 11 штаммов эндофитных бактерий, обнаруженных в семенах растений гороха (Pisum sativum L.), 6 оказывались в водной среде роста корней их проростков в условиях гидрокультуры. Обнаружено различное влияние бактерий инокулятов (Rhizobium leguminosarum bv. viceae, Pseudomonas syringae pv. pisi, Azotobacter chroococcum и Rhodococcus erythropolis) на состав и концентрацию эндофитных бактерий в прикорневой зоне проростков гороха. У всех 6 культур эндофитных бактерий, обнаруженных в зоне роста корней, выявлена различная способность к деградации N-фенил-2-нафтиламина (N-ФНА) с образованием фталатов. На неодинаковый характер катаболизма этими бактериями N-ФНА, негативного аллелопатического компонента корневых экссудатов бобовых культур, указывал процент неразрушенного в среде роста субстрата и соотношение видов фталатов, образовавшихся при его деградации. Эти показатели могли определять степень участия выявленных эндофитных бактерий в контроле взаимоотношений растений гороха с разнообразными по стратегии взаимодействия бактериями.
В публикации [1] сообщалось об исследованиях 50-летней давности, когда были получены первые доказательства сосуществования в клубеньках бобовых культур ризобий с эндофитными бактериями, а позднее показана неспособность последних самостоятельно вызывать образование клубеньков. Результатами многих исследований предоставлены доказательства важной роли непатогенных эндофитных бактерий в питании, защите от патогенов и регуляции роста растений [1–6]. В литературе приводятся свидетельства способности растений регулировать не только локализацию эндофитных бактерий в пределах организма, но и их численность, а также свидетельства возможности эндофитных ненодулирующих видов бактерий осуществлять биоконтроль растений. В публикации [7] высказано мнение, что поселяющиеся в клубеньках неризобиальные эндофитные бактерии способствуют функционированию азотфиксирующей системы, обеспечивая улучшение минерального питания и синтез биологически активных соединений. В настоящее время обсуждаемую группу бактерий объединяют термином PGPE (Plant Growth Promoting Endophytes), подобно бактериям, отнесенным к группе PGPR (Plant Growth Promoting Rhizobacteria), которые, как известно, также играют существенную положительную роль для растений [2].
В список таксонов эндофитных бактерий, встречающихся у бобовых культур, входит более 25 неризобиальных и 10 ризобиальных родов, включая Agrobacterium, Bacillus, Curtobacterium, Enterobacter, Erwinia, Mycobacterium, Paenibacillus, Pseudomonas, Phyllobacterium, Ochrobactrum, Sphin-gomonas, Rhizobium, Ensifer, Mesorhizobium, Burkholderia, Phyllobacterium, Devosia, Streptomyces, Rho-dococcus, Azospirillum и др. [4, 8].
В обзорах [2, 8] обсуждаются пути и механизмы проникновения эндофитных бактерий в ткани бобовых культур. Эндофитные бактерии попадают в растения в основном через корневую систему из почвы и, отчасти, через устьица. Существует вероятность проникновения этих бактерий также и с участием гидролитических ферментов. Экспериментально показано [5], что одним из путей попадания эндофитных бактерий в корни являются разрывы в области выхода боковых корней, и дальнейшее их проникновение в ткани коры и сосудистой системы, как полагают, осуществляется апопластическим путем. Допускают проникновение эндофитных неризобиальных бактерий в корни совместно с ризобиями через корневые волоски [4, 7].
Приведенные в ряде публикаций факты указывают на присутствие эндофитных бактерий у бобовых культур не только в клубеньках, но и в разных органах и в сосудистых системах [1, 2, 7–9].
У исследователей, работающих с бобовыми культурами, интерес вызывают в основном бактерии, поселяющиеся в корнях и корневых клубеньках. Носителями и местом временного сохранения эндофитных бактерий могут быть семена растений [8, 10]. Однако в семенах бобовых культур эти бактерии менее исследованы. Известно об изолировании из семян гороха Paenibacillus mendelii sp. nov. [11]. При прорастании семени вероятны перемещения эндофитных бактерий в ткани надземных и подземных органов проростков. Миграция из семени в корни – это еще один возможный путь для появления эндофитных бактерий не только в составе бактериальной ассоциации клубеньков, образующихся под влиянием ризобий, но также и в составе ризосферного микробиома. На перемещение эндофитных бактерий из корней в прикорневую зону проростков гороха также указывали результаты исследований, представленных в настоящей работе.
Растение может контролировать концентрацию бактерий в прикорневой зоне посредством биологически активных компонентов корневых экссудатов негативного действия. В числе негативных алелопатических соединений в корневых экссудатах растений гороха наряду с давно известным фитоалексином пизатином были выявлены N-фенил-2-нафтиламин (N-ФНА) и фталаты [12]. В недавно опубликованной работе [13] показано, что некоторые виды ризосферных бактерий способны осуществлять деградировать N-ФНА до фталатов, а также преобразовывать одни виды фталатов в другие. Можно предположить, что количество и качественный состав фталатов в прикорневой зоне растения формируются в результате экскреции этих соединений из корней и трансформации бактериями, присутствующими в ризосфере. Важно, что фталаты могут подавлять бактерии избирательно, в зависимости от вида бактерий, типа алкильных заместителей в молекулах фталатов и концентрации их в среде [14]. На степень разнообразия бактерий ризосферного микробиома могут влиять возникающие в прикорневой зоне количественные и качественные изменения в составе фталатов. Количество этих соединений может возрастать благодаря присутствующим в ризосфере видам бактерий, способных образовывать фталаты при деградации полициклических соединений [13]. Падение их количества вероятно при деградации фталатов по β-кетоадипатному пути до кислот цикла Кребса [15]. Один из двух путей биодеградации полициклических ароматических соединений, который приводил к образованию о-фталевой кислоты, чаще всего выявляли у представителей таких родов бактерий, как Pseudomonas, Rhodococcus, Bacillus, Acinetobacter, Sphingomonas, Micrococcus, Burkholderia [15–18]. К некоторым из перечисленных родов бактерий относятся виды эндофитных бактерий, поселяющихся в тканях бобовых культур [4, 8].
Цель работы – выяснение роли эндофитных бактерий, обнаруживаемых в прикорневой зоне корней проростков гороха в результате перемещения из корневых тканей во внешнюю среду, в биоконтроле ризосферного микробиома.
МЕТОДИКА
Объекты исследований. Объектами исследования служили семена и проростки гороха (Pisum sativum L.) сорта Торсдаг. Семена урожая 2017 г. получены при выращивании растений гороха в открытом грунте на территории СИФИБР СО РАН. В качестве инокулятов использовали бактерии Rhizobium leguminosarum bv. viceae (штамм 245 а – RCAM 1022, получен из Всероссийского института сельскохозяйственной микробиологии, г. Пушкин, Россия), и Pseudomonas syringae pv. pisi штамм. 1845, Azotobacter chroococcum штамм Az dl0 ВКМ В-2272 Д, Rhodococcus erythropolis штамм 108 ВКМ – Ac 2784 D из коллекции Центра коллективного пользования (ЦКП “Биоресурсный центр” Сибирского института физиологии и биохимии растений (СИФИБР СО РАН).
Эксперименты с проростками проводили по схеме, описанной нами ранее [12]. Согласно схеме прорастание семян и рост проростков, служивших исходным материалом в работе, проводили на влажной фильтровальной бумаге в термостате без освещения при температуре 21°С в течение 48 ч. Далее проростки инкубировали в условиях гидрокультуры в камере BINDER KBW-240 (“Binder”, Германия) при 21°С, освещении 81 мкМ ⋅ м–2 ⋅ с–1 и фотопериоде 16/8 ч (день/ночь) в течение 24 ч. При изучении межбактериальных взаимодействий эндофитных бактерий с вносимыми в среду бактериями в составе инокулятов верхнюю часть проростков (семя + + эпикотиль) располагали на поверхности пластиковой решетки. В отверстия решетки, служившей также крышкой сосуда с водной средой объемом 240 мл, пропускали корни проростков, которые на расстоянии 1.5 см от поверхности решетки погружали в водную среду. При таком размещении верхняя часть проростков не контактировала с водой. Для предотвращения проникновения в сосуды бактерий из внешней среды сверху на крышку сосудов с растениями помещали плотно прилегающие по ее краям стеклянные чашки. Для получения достоверных доказательств выхода эндофитных бактерий из корней в прикорневую зону при проведении экспериментов использовали специальную конструкцию. Она представляла собой стеклянный цилиндр, сверху закрываемый ватным тампоном, и помещенную вертикально в его нижней части пластиковую непрозрачную пробирку объемом 15 мл с крышкой. В отверстие в крышке пробирки продевали корни проростков. Корни внутри пробирки на расстоянии 1.5 см от крышки погружали в водную среду без бактерий.
Средние размеры корней исходных проростков имели длину 30–35 мм, по окончании эксперимента – 46–58 мм. Для оценки взаимодействия растения с возникающими в водной среде ассоциациями бактерий прослеживали влияние последних на рост корней.
В водную среду для проростков вносили необходимые для роста микроэлементы из расчета 1 мл/л воды каждого раствора солей: ZnSO4 (0.05 г/л), NaMoO4 (1.76 г/л), CuSO4 (0.05 г/л), MnCl2 (0.35 г/л), H3BO3 (0.5 г/л). Одновременно с помещением корней проростков в водную среду в нее вносили бактерии R. leguminosarum bv. viceae, P. syringae pv. pisi A. chroococcum, R. erythropolis. В среду с контрольными растениями инокулят не вносили. В начале и конце эксперимента (экспозиции) в водной среде, где росли корни проростков, подсчитывали количество колониеобразующих единиц (КОЕ).
Поверхностное обеззараживание семян, используемых для исследования в них эндофитных бактерий и для получения проростков, проводили в 3 этапа. Вначале промывали их мыльным раствором, затем помещали на 10 мин в 95%-ный этанол, а после отмывания – на 30 мин в 3%-ный раствор пероксида водорода. После отмывки от раствора пероксида семена на 30 мин заливали нагретой до 60°С водой. Для получения проростков после остывания воды семена набухали в течение 6–7 ч. Набухание семян, рост проростков, процедуры, проводимые с проростками, происходили в строго соблюдаемых асептических условиях.
Наличие и состав эндофитных бактерий в семенах исследовали через 24 ч их набухания в стерильной воде. Семена, растирали до кашицы в керамической ступке, заливали небольшим объемом стерильной воды, перемешивали полученную массу и после 24-часового настаивания отбирали 1 мл жидкости для микробиологического анализа.
Культуры бактерий. Культуры бактерий выращивали на твердых агаризованных средах. Для бактерий R. leguminosarum bv. viceae и P. syringae pv. pisi среды готовили на гороховом отваре по прописи Берестецкого [19], для бактерий A. chroococcum использовали среду Эшби, для R.erythropolis – питательный агар на основе гидролизата говяжьего мяса (ГМФ-Агар, “Научно-исследовательский центр фармакотерапии ООО”, Россия).
Определение количества бактерий в водной среде роста корней. Титр бактерий, вносимых в водную среду, определяли по оптической плотности при 595 нм на фотометре для микропланшетов “iMark” (“Bio-Rad Microplate Manager”, США), и по количеству КОЕ. КОЕ в водной среде определяли в момент помещения на неё корней и через 24 ч. КОЕ подсчитывали, после разведения и высева разбавленных в 102–106 раз суспензий на твердые агаризованные среды. Суспензии с бактериями из водной среды с проростками контроля наносили на твердую среду, приготовленную на гороховом отваре в соответствии с прописью из работы [19]. Рост бактерий инокулятов оценивали по соотношению КОЕ в средах с растениями в начале и через 24 ч экспозиции, выраженному в процентах. Содержание (общее) эндофитных бактерий за 24 ч экспозиции в тех же средах оценивали по соотношению КОЕ для них и бактерий инокулятов, и выражали в %. Основой для дифференцированного подсчета КОЕ для этих двух групп бактерий были морфологические показатели для их колоний.
Исследование состава эндофитных бактерий. Состав эндофитных бактерий исследовали на основании морфологических признаков колоний на твердых средах в чашках Петри, которые засевали водными суспензиями из сосудов с растениями, а также из водных вытяжек семян. Для микроскопических исследований окрашенных по Граму клеток использовали инвертированный микроскоп “Axio Observer” (“Carl Zeiss Microscopy”, Германия).
Изучение деструкции N-ФНА эндофитными бактериями. Суспензию клеток (смыв с твердого субстрата) переносили для адаптации в течение суток в конические колбы с жидкой минимальной средой, приготовленной, как описано в работе [20]. Суспензии с адаптированными бактериями переносили в ту же культуральную среду (объемом 250 мл) внесенную в коническую стеклянную колбу объемом 500 мл для инкубациив течение 1 сут с 10 мкМ N-ФНА (“Sigma”, США). При исследованиях деградации N-ФНА объем вносимых суспензий рассчитывали для получения конечного титра бактерий – 1.5 × 103 кл./мл. Титр суспензии рассчитывали, измеряя оптическую плотность на планшетном спектрофотометре “Immunochem-2100” при 675 нм (“High Technology Inc.”, США).
Колбы с бактериями помещали на роторную качалку (60 об./мин) и выращивали при температуре 20–22°С. Выросшую культуру центрифугировали при 8000 g в течение 20 мин при 4°С. Из супернатанта после подкисления 2 н HCl до рН 3.0–4.0 этилацетатом экстрагировали ароматические соединения. Полученные экстракты упаривали досуха в вакууме в темноте, сухой остаток растворяли в небольших объемах очищенного от перекисей этилацетата и помещали в стеклянные бутылочки для газо-хромато-масс-спектрометрического (ГХ-МС) анализа
Анализ состава ароматических продуктов деградации N-ФНА. Анализ состава этилацетатных экстрактов из культуральных сред проводили методом ГХ-МС на газожидкостном хроматографе с масс-спектрометрическим детектором с использованием хромато-масс-спектрометра “7000QQQTripleQuad/ 7890A MSD/DS” (“Agilent Technology”, США), как описано в работе [13]. Для идентификации анализируемых соединений использовали библиотеки масс-спектров NIST08 и WILEY7, а также проводили сравнение с аутентичными образцами N-ФНА (“Sigma”, США), бис (2-этил-гексил) фталата (синоним – диоктилфталат), диэтилфталата (“Sigma–Aldrich”, Германия) и дибутилфталата (“Реахим”, Россия).
Статистическая обработка. Для статистической обработки полученных результатов использовали пакет R 3.6.2. На рис. 1 и в табл. 2 и 3 приведены средние значения полученных показателей и стандартные отклонения для них, рассчитанные из трех независимых экспериментов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ.
Для выяснения роли эндофитных бактерий, появляющихся в прикорневой зоне корней проростков гороха в результате перемещения из корневых тканей во внешнюю среду, в биоконтроле ризосферного микробиома исследования проходили по двум направлениям. Первое из них связано с выявлением изменений в составе и концентрации бактерий в водной среде для роста корней проростков гороха (Pisum sativum L.) через 1 сут после внесения в нее разных видов ризосферных бактерий. Второе направление исследований связано с выяснением возможного вклада изучаемых эндофитных бактерий в метаболизм N-ФНА.
Приведенные в табл. 1 результаты свидетельствуют об обнаружении эндофитных бактерий гороха в семенах и появлении части этих бактерий в ризосфере корней проростков. Результаты в табл. 1 показали, что максимально 6 из 11 выделенных из семян культур бактерий обнаруживались в водной среде, где происходил рост корней проростков гороха. Верхняя часть проростков (семя + эпикотиль и часть прилегающего к ним корня длиной 1.5 см) не касались поверхности водной среды (см. Методику), куда была погружена большая часть корня. Наиболее вероятно, что обнаруженные в водной среде бактерии перемещались в среду из семени через ткани корня.
Таблица 1.
Культуры эндофитных бактерий, обнаруженные в семенах и водных средах корней проростков гороха
| № культуры | Семя | Водная среда для роста корней | ||||
|---|---|---|---|---|---|---|
| без инокуляции (контроль) | инокулированные бактерии | |||||
| R. leguminosarum bv. viceae | P. syringae pv. pisi | Az. chroococcum | Rh. erythropolis | |||
| 1 | + | + | + | – | – | + |
| 2 | + | + | + | + | + | – |
| 3 | + | + | + | + | + | – |
| 4 | + | + | + | – | + | + |
| 5 | + | + | + | – | – | – |
| 6 | + | + | + | – | + | – |
| 7 | + | – | – | – | – | – |
| 8 | + | – | – | – | – | – |
| 9 | + | – | – | – | – | – |
| 10 | + | – | – | – | – | – |
| 11 | + | – | – | – | – | – |
Все эти бактерии были грамположительными. Из них 4 культуры (№ 2, 7, 8, 11, табл. 1) палочковидной формы, спорообразующие, относились к роду Bacillus. В культурах 1, 3, 4, 5, 10 (табл. 1) представлены бактерии, имеющие форму кокков, а культуры 6, 10 не образующие споры палочки.
Таблица 2.
Изменение количества бактерий инокулятов и их соотношения с количеством эндофитов в среде роста корней проростков гороха после 24 ч экспозиции
| Бактерии инокулята | Изменение КОЕ бактерий инокулятов, % к исходному | Отношение: КОЕ эндофитные бактерии/КОЕ бактерий инокулята, % |
|---|---|---|
| R. leguminosarum bv. viceae | 312 ± 36 | 129 ± 25 |
| P. syringae pv. pisi | 195 ± 27 | 35 ± 1 |
| A. chroococcum | 489 ± 57 | 49 ± 8 |
| R. erythropolis | 242 ± 1 | 11 ± 1 |
Таблица 3.
Состав фталатов, образовавшихся при деградации N-фенил-2-нафтиламина культурами эндофитных бактерий, показатели времени удерживания (tуд) и степени вероятности (Ver, %)
| Соединение | tуд, мин |
Ver, % |
Относительная площадь пика, % | |||||
|---|---|---|---|---|---|---|---|---|
| № 1 | № 2 | № 3 | № 4 | № 5 | № 6 | |||
| Диэтилфталат | 14.2 | 80.0 | 0.9 ± 0.1 | – | – | – | – | – |
| Бутил-тетрадецил фталат | 19.7 | 16.6 | 1.9 ± 0.4 | – | – | 1.5 ± 0.3 | 0.8 ± 0.2 | 3.3 ± 0.9 |
| Дибутилфталат | 21.6 | 34.8 | 75.7 ± 6.4 | 66.5 ± 4.2 | 54.0 ± 5.3 | 40.2 ± 3.1 | 20.2 ± 1.8 | 100 |
| Диоктилфта-лат | 31.5 | 70.7 | 67.1 ± 7.1 | 12.9 ± 2.2 | 100 | 31.3 ± 3.6 | 3.3 ± 0.9 | 79.7 ± 8.0 |
| N-фенил-2-нафтиламин | 26.2 | 46.6 | 100 | 100 | 18.7 ± 1.7 | 100 | 100 | 30.2 ± 3.5 |
В настоящее время не ясно, почему только 6 из 11 обнаруженных нами в семенах эндофитных бактерий оказались способными транспортироваться из корней в водную среду. Возможно, ответом станут данные по определению у них активности гидролитических ферментов, которые, скорее всего, и обусловливают их продвижение через ткани корней.
Обнаружение бактерий в прикорневой зоне проростков гороха послужило основанием для изучения их взаимодействия с ризосферными бактериями. Такие взаимодействия неизбежно должны происходить с нодулирующими корни гороха бактериями R. leguminosarum. Вероятны они и с бактериями, являющимися патогенами для названного растения, к которым, в частности, относятся P. syringae pv. pisi, использованные в экспериментах. Без сомнения, те же эндофитные бактерии в ризосфере будут иметь влияние на свободноживущие почвенные бактерии. Такое влияние было подтверждено результатами работы, в которой в качестве инокулятов для корней проростков использовали представителей свободноживущих бактерий A. chroococcum и R. erythropolis. A. chroococcum – азотфиксирующие бактерии, могли оказывать положительное влияние на рост растений гороха [21]. R. erythropolis, был выделен из ризосферы растений Elytrigia repens, росших на загрязненных нефтепродуктами почвах. Штамм способен активно деградировать полициклические ароматические соединения и положительно влиял на рост растений в условиях загрязнения почв нефтепродуктами [22, 23].
Соотношения концентраций эндофитных бактерий и бактерий, использованных в качестве инокулятов, определенные в водной среде по величине КОЕ через 1 сут экспозиции может служить показателем межмикробных взаимодействий в прикорневой зоне проростков гороха. Вторым показателем взаимодействий является количество вариантов эндофитных бактерий, появившихся на твердой среде совместно с бактериями инокулятов.
Титр бактерий инокулятов, вносимых в среду для корней проростков гороха, рассчитывали по показателям оптической плотности и затем корректировали по КОЕ после высева суспензии на твердые среды в чашках Петри. В начале экспериментов показатели КОЕ варьировали в пределах 0.1–0.3 × 107 кл./мл – для ризобий, и 1.4–1.9 × × 107 кл./мл – для псевдомонад, азотобактеров и родококков. Бактерии в среде роста корней неинокулированных проростков (контроль) в начале экспозиции отсутствовали, а через 24 ч их роста суммарный показатель КОЕ для всех обнаруженных нами в этой среде эндофитных бактерий составлял 2.29 ± 0.03 × 107 кл./мл.
Компоненты корневых экссудатов, по-видимому, способствовали росту бактерий, внесенных в водную среду в качестве инокулята, но в разной степени для различных исследуемых видов. Из результатов табл. 2 следует, что максимальный прирост КОЕ наблюдали у A. chroococcum. За ним в порядке убывания могут быть размещены ризобии, родококки и псевдомонады.
О различном характере взаимодействий бактерий, внесенных в водную среду роста корней в виде инокулята, с бактериями, поступившими в эту среду из корней можно судить по результатам, приведенным в табл. 2. Так, в водной среде с ризобиями доля эндофитных бактерий выше, чем ризобий (табл. 2). При этом состав колоний эндофитных бактерий по морфолого-культуральным показателям был аналогичен их составу в среде контроля (табл. 1). Возможно, имеет место совместимость исторически сформировавшихся бактериальных ассоциаций, которые благоприятны для сосуществования каждого из представителей не только в тканях растения, но и в ризосфере растения-хозяина.
В среде с азотобактером обнаружено всего четыре варианта эндофитных бактерий (табл. 1). Это может быть связано со слабым ростом некоторых эндофитов на среде Эшби. В процессе работы выяснилось, что очень слабый рост на среде Эшби имели 2 из 6 культур (культуры бактерий № 1 и 5, табл. 1) эндофитных бактерий, выделенных из водных сред. По результатам, представленным в табл. 2, количество эндофитных бактерий в среде роста корней составляло около 50% от количества клеток A. chroococcum. Это достаточно хороший показатель совместного роста бактерий азотобактера и эндофитных бактерий. К такому заключению можно придти, учитывая, что доминирующие в ростовой среде бактерии A. chroococcum отличались от трех других видов инокулированных бактерий наиболее высоким приростом (табл. 2).
Твердые среды на основе горохового отвара и ГМФ-агара, использованные, соответственно, для анализа состава бактерий в водных средах с псевдомонадами и родококками (см. Методику), вполне подходили и для роста на них колоний всех выделенных изолятов эндофитных бактерий. Поэтому наблюдаемое в табл. 1 отсутствие четырех форм эндофитных бактерий в водных средах с P. syringae pv. pisi и R. erythropolis, наиболее вероятно объясняется антибактериальным действием этих двух видов бактерий. Кроме того, можно утверждать, что псевдомонады и родококки сосуществовали с двумя, но не одинаковыми представителями эндофитных бактерий семян гороха. Можно предположить избирательное подавление псевдомонадами и родококками эндофитных бактерий. Подтверждают отмеченное выше действие псевдомонад и родококков в отношении эндофитных бактерий растений гороха представленные в табл. 2 показатели относительного содержания последних в средах роста корней. Они более низкие, чем в средах с ризобиями и азотобактером. При этом самое низкое содержание эндофитных бактерий в среде с родококками.
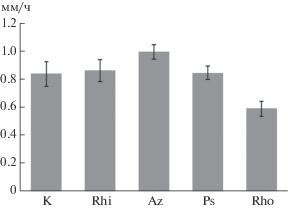
Для оценки взаимодействия растения с формирующимися в водной среде ассоциациями бактерий прослеживали их влияние на линейный рост корней проростков гороха. Оказалось, что инокуляция бактериями R. leguminosarum bv. viceae и P. syringae pv. pisi не приводила к изменениям скорости их роста (рис. 1). Бактерии A. chroococcum усиливали, а бактерии R. erythropolis, напротив, заметно снижали рост корней. Примечательно, что два последних вида характеризовались высокой гормонсинтезурующей активностью [23, 24]. Именно этим свойством A. chroococcum объяснялось ускорение роста инокулированных этими бактериями корней проростков гороха в работе [21]. Однако причина ингибирующего влияния бактерий R. leguminosarum erythropolis, также активно синтезирующих ростстимулирующие фитогормоны, на рост корней тех же растений пока не ясна. Возможно, в клетках этого вида бактерий образуются соединения неизвестной природы негативно действующие на эндофитные бактерии растений гороха и на рост его корней.
В работах [12, 25] было показано, что в корнях бобовых культур и их корневых экссудатов обнаружены вещества N-ФНА и фталаты. Названные соединения оказывали ростподавляющее действие на бактерии R. leguminosarum bv. viceae, P. syringae pv. pisi, Clavibacter michiganensis sps. sepedonicus [12, 13]. Было установлено, что перечисленные виды бактерий способны образовывать фталаты при деградации N-ФНА [13]. То есть ряд видов бактерий, отнесенные к разным родам, способны деградировать полициклические ароматические соединения (ПАУ) по пути с образованием о-фталевой кислоты и затем фталатов. Обнаружена аналогичная способность к деструкции N-ФНА и у штамма A. chroococcum (данные не опубликованы), использованного в работе. У R. erythropolis способность к деградации N-ФНА не была исследована, однако ранее у этого вида установили высокую активность при деградации ПАУ нефти с образованием протокатеховой кислоты [22].
Обнаружение в среде роста корней проростков гороха эндофитных бактерий позволило предположить, что в их взаимоотношениях с ризосферными бактериями также могут быть задействованы N-ФНА и фталаты. В составе этих соединений, являющихся компонентами корневых экссудатов растений гороха [12, 25], возможны количественные и качественные (в составе фталатов) изменения при участии ризосферных бактерий, способных деградировать N-ФНА и преобразовывать одни виды фталатов в другие [14]. Правомерным является выяснение роли эндофитных бактерий в возникновении изменений в количестве N-ФНА и в составе фталатов.
Результаты, представленные в табл. 3, показали, что все 6 бактериальных культур, которые были выявлены в зоне роста корней проростков гороха, способны деградировать N-ФНА с образованием фталатов. Наиболее высокая деградирующая активность у культур № 3 и № 6, самая низкая – у культуры № 5. У исследуемых культур при деградации N-ФНА в культуральных средах, где они инкубировались в присутствии вышеназванного субстрата, оказалось различным соотношение видов фталатов (табл. 3). Диоктилфталат, характеризующийся сильным антибактериальных действием [13, 14], среди продуктов деградации N-ФНА преобладал в среде, куда вносили бактерии культуры № 3 и составлял большой процент в среде с бактериями культур № 1 и № 6. Дибутилфталат доминировал среди продуктов деградации N-ФНА в средах с бактериями большинства культур (исключая культуру № 6). Наиболее активно образовывали дибутилфталат бактерии культуры № 6. Данное соединение не всегда выказывает негативное действие на бактерии. Исследованиями авторов работы [14] обнаружено ингибирование этим соединением образования бактериальных биопленок. Подавление роста бактерий в планктонной культуре он вызывал только при высоких концентрациях, а при более низких стимулировал этот процесс. Таким образом, показано, что обнаруженные в ризосфере проростков гороха эндофитные бактерии способны образовывать фталаты при деградации N-ФНА.
Итак, приведенные в настоящей работе результаты показывают, что в ризосфере растений гороха наблюдался различный характер взаимодействия между эндофитными бактериями и свободноживущими ризосферными бактериями, характеризующимися разными типами отношений с растениями гороха. Благоприятным оказалось сосуществование этих бактерий с ризобиями, нодулирующими корни гороха. P. syringae pv. pisi, патоген для растений гороха, поражающий органы надземной части данного растения, по сравнению с тремя другими исследуемыми нами видами бактерий, показал наименее интенсивный рост в среде роста корней (табл. 3) и обнаружил способность подавлять эндофитные бактерии растения-хозяина (табл. 1, 3). Бактерии A. chroococcum и R. erythropolis, использованные в эксперименте, существенно различались по активности роста в среде обитания корней и по характеру влияния на эндофиты гороха. Влияние корневых экссудатов гороха, очевидно, способствовало хорошей адаптации бактерии A. chroococcum , которые при этом не вызвали значительных изменений в составе и концентрации эндофитных бактерий. Этот вид бактерий положительно влиял на рост корней проростков гороха. В противоположность азотобактерам, родококки показали в водной среде невысокий прирост и наибольшую для четырех обсуждаемых видов бактерий антибактериальную активность, а также ингибирующее действие на рост корней гороха.
Обнаруженное у эндофитных бактерий, перемещающихся из тканей корней растения гороха во внешнюю среду, свойство деградировать N-ФНА, одного из негативных аллелопатических компонентов корневых экссудатов, позволяет предположить важную роль образующихся при этом фталатов в их взаимоотношениях как с бактериями, проникающими в ткани данного растения, так и со свободноживущими ризосферными бактериями.
Работа выполнена на оборудовании Центра коллективного пользования (ЦКП) “Биоаналитика” Сибирского института физиологии и биохимии растений СО РАН (Иркутск, Россия).
Работа выполнена в рамках проекта под № гос.регистрации АААА-А17-117011810099-8.
Список литературы
Muresu R., Polone E., Sulas L., Baldan B., Tondello A., Delogu G. et al. // FEMS Microbiol Ecol. 2008. V. 63. P. 383–400.
Гарипова С.Р. // Успехи современной биологии. 2012. Т. 132. № 5. С. 493–505.
Чеботарь В.К., Мальфанова Н.В., Щербаков А.В., Ахтемова Г.А., Борисов А.Ю., Люгтенберг Б., Тихонович И.А. // Прикл. биохимия и микробиология. 2015. Т. 51. № 3. С. 283–289.
Martinez-Hidalgo P., Hirsh A.M. // Phytobioms. 2017. V. 1. № 2. P. 70–82.
Гарипова С.Р., Гарифуллина Д.В., Баймиев А.Х., Хайруллин Р.М. // Прикл. биохимия и микробиология. 2017. Т. 53. № 3. С. 299–307
Иванчина Н.В., Гарипова С.Р., Хайруллин Р.М. // Агрохи-мия. 2018. № 4. С. 39–44.
Benito P., Alonso-Vega P., Aguado C., Luján R., Anzai Y., Hirsch A.M., Trujillo M.E. // Sci. Rep. 2017. V. 7. № 11051 https://doi.org/10.1038/s41598-017-11428-1
Dudeja S.S., Giri R., Saini R., Suneja-Madan P., Kothe E. // J. Basic Microbiol. 2012. V. 52. № 3. P. 248–260.
Кузнецова И.Г., Сазанова А.Л., Сафронова В.И., Пинаев А.Г., Верхозина А.В., Тихомирова Н.Ю., Оследкин Ю.С., Белимов А.А. // Сельскохозяйственная биология. 2015. Т. 50. № 3. С. 345–352.
Щербаков А.В., Заплаткин А.Н., Чеботарь В.К. // Достижения науки и техники АПК. 2013. № 7. С. 35–38.
Smerda J., Sedlacek I., Pacova Z., Durnova E., Smiskova A., Havel L. // International Journal of Systematic and Evolutionary Microbiology. 2005. V. 55. № 6. P. 2351–2354.
Макарова Л.Е., Петрова И.Г., Соколова Н.А., Мориц А.С. // Агрохимия. 2020. № 3. С. 62–69.
Макарова Л.Е., Мориц А.С., Соколова Н.А., Петрова И.Г., Семенов А.А., Дударева Л.В., Третьякова М.С., Сидоров А.В. // Прикл. биохимия и микробиология. 2020. Т. 56. № 2. С. 165–173.
Шафикова Т.Н., Омеличкина Ю.В., Еникеев А.Г., Бояркина С.В., Гвильдис Д.Э., Семенов А.А. // Докл. Академии наук. 2018. Т. 480. № 3. С. 381–383.
Liang D.-W., Zhang T., Fang H.H.P., He J. // Appl. Microbiol. Biotechnol. 2008. V. 80. № 2. P. 183–198.
Seo J.S., Keum Y.-S., Li Q.X. // Int. J. Environ. Res. Public Health. 2009. V. 6. P. 278–309.
Eaton R.W., Ribbons D.W. // J. Bacteriol. 1982. V. 151, № 1. P. 48–57.
Chang H.K., Zylstra G.J. // J. Bacteriol. 1998. V. 180. № 24. P. 6529–6537.
Берестецкий В.А. Методические рекомендации по получению новых штаммов Rhizobium leguminosarum и оценки их эффективности. Л.: ВНИИСХМ, 1976. 31 с.
Hartwig U.A., Josef C.M., Phillips D.A. // Plant Physiol. 1991. V. 95. № 3. P. 797–803.
Акимова Г.П., Верхотуров В.В., Соколова М.Г., Белопухов С.Л. // Известия ТСХА. 2019. № 1. С 138–145.
Беловежец Л.А. Макарова Л.Е., Третьякова М.С., Маркова Ю.А., Дударева Л.В., Семенова Н.В. // Прикл. биохимия и микробиология. 2017. Т. 53. № 1. С. 76–81
Третьякова М.С., Беловежец Л.А., Маркова Ю.А., Макарова Л.Е. // Агрохимия. 2017. № 12. С. 46–51
Пaтeнт PФ. 2004. № 2231546.
Макарова Л.Е., Смирнов В.И., Клыба Л.В., Петрова И.Г., Дударева Л.В. // Прикл. биохимия и микробиология. 2012. Т. 48. № 4. С. 394–402.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология