Прикладная биохимия и микробиология, 2021, T. 57, № 4, стр. 402-414
Влияние аллельных вариантов ароматической алкогольдегидрогеназы CADim на микроморфологические и химические показатели тканей у яровой мягкой пшеницы Triticum aestivum L.
А. А. Коновалов 1, *, Е. В. Карпова 2, И. К. Шундрина 2, Е. П. Размахнин 3, И. В. Ельцов 4, Н. П. Гончаров 1, 5
1 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
2 Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
3 Сибирский научно-исследовательский институт растениеводства и селекции – филиал ИЦиГ СО РАН
630501 пос. Краснообск, Новосибирская область, Новосибирский район, Россия
4 Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, Россия
5 Новосибирский государственный аграрный университет
630039 Новосибирск, Россия
* E-mail: konov@bionet.nsc.ru
Поступила в редакцию 14.12.2020
После доработки 15.02.2021
Принята к публикации 22.02.2021
Аннотация
В работе изучали наследование аллельных вариантов ароматической алкогольдегидрогеназы CADim (CAD intermediate) и их влияние на выраженность признаков растений яровой мягкой пшеницы: флуоресценцию срезов проростков, микроморфологию и химический состав тканей. Растения с контрастными генотипами CADim (гомозиготы +/+ и –/–) использовали для изучения автофлуоресценции тканей, микроморфологии и химического состава. Толщина стенок соломины у генотипа CADim– выше, чем у генотипа CADim+, что может влиять на устойчивость растений пшеницы к полеганию. Наблюдали различия по содержанию хлорофилла и, особенно, по соотношению хлорофиллов A и B, что вероятно влияет на фотосинтез. Обнаружено повышенное содержание карбонильных групп у генотипа CADim+, а так же различия по коричным мономерам лигнина. Из полученных результатов следует, что аллельные варианты CADim+ и CADim– оказывают существенное влияние на ряд признаков растения, и, следовательно, полиморфизм по локусу CADim является функциональным, что позволяет использовать его в селекции и биотехнологии.
Полиморфизм по ферментным локусам у растений влияет на многие признаки, связанные с ростом и развитием и может приводить к существенным изменениям микроморфологии тканей и их химического состава [1]. Изучение таких различий способствует лучшему пониманию механизмов формирования признаков растения и свойств растительного сырья, и может иметь прикладное значение для селекции и в биотехнологии [2].
Фенилпропаноидный путь метаболизма, присутствующий у всех сосудистых растений, приводит к синтезу лигнина и формированию склеренхимы, ткани, выполняющей механические и защитные функции [3]. Кроме лигнина, продуктами фенилпропаноидного пути являются лигнаны и ароматические гликозиды [4], также обладающие защитными функциями.
Терминальная реакция фенилпропаноидного пути – восстановление коричных альдегидов до спиртов, таких как п-кумаровый, конифериловый и синаповый, – контролируется семейством ферментов CAD (Cinnamyl alcohol dehydrogenase – дегидрогеназа коричного спирта; КФ 1.1.1.195) [3, 5]. Полиморфизм по генам, кодирующим CAD обнаружен у многих видов растений, и во многих случаях это приводит к существенным изменениям свойств и признаков растений [2]. Наличие или отсутствие одного из изоферментов CAD в тканях растения вызывает изменения в спектре метаболитов, образующихся в данном участке обмена веществ, что в свою очередь может привести к изменениям других признаков, таких как устойчивость к полеганию [6–10].
У мягкой пшеницы (Triticum aestivum L.) описаны два набора гомеологических генов: НАДФ-зависимая CAD, гены которой локализованы в длинных плечах хромосом 5-й гомеологической группы, и неспецифическая НАД(Ф)-зависимая CAD, гены которой локализованы в хромосомах 6-й гомеологической группы [11–13]. Ранее было установлено, что полиморфизм CAD у пшеницы влияет на механическую прочность соломины [14], и на устойчивость к листовым инфекциям – мучнистой росе и листовой (бурой) ржавчине [15].
У сорта яровой мягкой пшеницы Новосибирская 29 в промежутке между спектрами НАДФ-CAD и НАД(Ф)-CAD присутствует дополнительный изофермент CAD (intermediate, CADim). Было установлено, что наличие или отсутствие этого изофермента влияет на устойчивости к грибным инфекциям [15].
Цель работы – изучение влияния изофермента CADim на микроморфометрические характеристики и химический состав тканей пшеницы.
МЕТОДИКА
Для исследования были использованы образцы мягкой яровой пшеницы Triticum aestivum L., контрастные по спектрам САD: сорт Новосибирская 29 селекции СибНИИРС, у которой присутствует изофермент САDim+ (intermediate) с подвижностью, промежуточной между НАДФ-CAD и НАД(Ф)-CAD, и сортобразец Яровая-9 (селекционер Е.П. Размахнин), у которых этот изофермент отсутствовал.
Гибриды первого поколения имели фенотип CADim+, т.е. признак CADim+ являлся доминантным. Во втором поколении наблюдалось расщепление в соотношении 3 : 1 CADim+ к CADim– (образцы, не содержащие изофермент). Скрещивание и последующее выделение потомства F3 (третьего поколения) позволило выровнять генетический фон, поскольку исходные образцы могли различаться по другим генам. Среди растений F3 были отобраны гомозиготные потомства с контрастными фенотипами CADim+ и CADim–, ставшие объектами данного исследования.
Изоферментные спектры CAD определяли методом гель-электрофореза, с последующей окраской на CAD-активность тетразолиевым методом, с использованием НАДФ в качестве кофактора и коричного спирта в качестве субстрата [11].
Автофлуоресценцию изучали на поперечных срезах недельных проростков. Срезы толщиной 30 мкм получали на замораживающем микротоме Криостат HM 550 (“Termo Scientific”, Финляндия), препараты просматривали на флуоресцентном микроскопе AxioImager Z1 с приставкой ApoTome и программой AxioVision (“Carl Zeiss”, Германия), при возбуждении флюоресценции излучением с длинами волн 365, 470 и 546 нм. Микроморфологические показатели стеблей зрелых растений определяли с помощью сканирующего электронного микроскопа (СЭМ) TM-1000 (“Hitachi”, Япония). Параметры работы СЭМ – ускоряющее напряжение 15 кэВ, режим низкого вакуума. Образцы поперечных срезов стеблей без предварительной обработки фиксировались на предметном столике с помощью токопроводящего скотча.
Термогравиметрический анализ (ТГА) проводили на приборе NETZSCH STA 409 (Германия). Содержание золы определяли как остаток после нагревания при 600°С.
Высушенные на воздухе стебли пшеницы измельчали и экстрагировали смесью толуол/этанол (2 : 1 по объему) в аппарате Сокслета в течение 8 ч. Содержание целлюлозы и лигнина Комарова определяли по стандартной методике [16]. Раствор после отделения лигнина Комарова использовался для спектрофотометрического определения содержания кислоторастворимого лигнина [17]. Соотношение гидроксифенильных, гваяцильных и сирингильных звеньев в структуре лигнина определяли методом нитробензольного окисления (НБО), как в предыдущей работе [14].
Для определения содержания флавоноидов навеску спирто-толуольного экстракта стеблей растений растворяли в этаноле в ультразвуковой ванне (УЗВ), раствор центрифугировали, аликвоту раствора смешивали с раствором хлорида алюминия в этаноле, фотометрировали на спектрофотометре Cary-5000 (“Varian”, США), в 1 см кювете. Содержание флавоноидов определяли по калибровочному графику в эквиваленте кверцетина на г сырья (мгQE/г).
Содержание остаточных хлорофиллов в зрелых растениях (в мг/г сухого сырья) определяли двумя способами. В первом случае навеску спирто-толуольного экстракта растворяли в ацетоне в УЗВ, раствор центрифугировали и фотометрировали в 1 см кювете. Во втором варианте навеску исходного сухого сырья экстрагировали ацетоном в УЗВ в течение часа, раствор фильтровали и фотометрировали в 1 см кювете. Содержание хлорофиллов рассчитывали по поглощению при 662 и 644 нм [18]. Для растворов пигментов в неразбавленном ацетоне использовали следующие уравнения:
Выделение образцов диоксанлигнинов и их анализ ЯМР-спектроскопией проводили как описано ранее [9]. Отнесение сигналов протонного магнитного резонанса (ПМР) и магнитного резонанса по 13С проводили согласно [19]. Отнесение кросс-сигналов 1Н/13С в HSQC-спектрах (heteronuclear single quantum coherence) диоксанлигнинов проводилось по [20, 21]. Относительное содержание основных типов связей в макромолекуле лигнина, концевых групп, молярное соотношение мономерных звеньев (H : G : S), содержание кумаратов и ферулатов определяли согласно [21]. ИК-спектры экстрактов и образцов диоксанлигнина регистрировали на ИК-Фурье спектрометре Tensor 27 (“Bruker”, Германия) в диапазоне 4000–400 см–1, с разрешением 4 см–1 по 32 сканирования.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
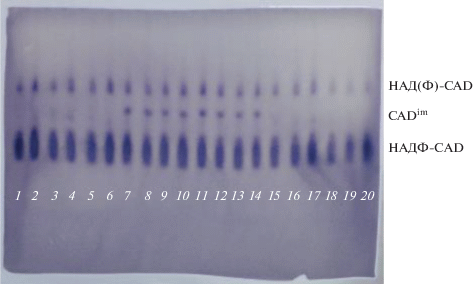
Изофермент CADim на зимограмме располагался между спектрами НАДФ-CAD (в “быстрой” зоне) и НАД(Ф)-CAD (в “медленной” зоне) (рис. 1). Аллельные варианты выглядят как присутствие или отсутствие окрашенной зоны, соответственно, аллельные варианты были обозначены как CADim+ (наличие изофермента) и CADim– (отсутствие изофермента), генотипы соответственно +/+ или –/–.
Во втором поколении расщепление в потомствах соответствовало моногенному соотношению 3 : 1, как у прямых, так и обратных гибридов, то есть реципрокные различия отсутствовали (табл. 1). Из этого следовало, что фермент CADim контролируется одним ядерным геном с аллелями CADim+ и CADim–. Аллель CADim+ является функциональным, аллель CADim– относится к так называемым нулевым аллелям, лишённым специфической активности. Растения, гомозиготные по функциональному и нулевому аллелю фермента, могли различаться по набору метаболитов и другим показателям. В следующем поколении F3 (третье поколение гибридов) были выделены гомозиготные потомства (потомства, где все растения имели генотип +/+ или –/–, и соответствующий фенотип: наличие или отсутствие изофермента CADim), которые были использованы для изучения свойств тканей.
Таблица 1.
Расщепление в реципрокных потомствах F2 (второе поколение гибридов) яровой мягкой пшеницы
| Потомство | CADim + | CADim– | χ2 |
|---|---|---|---|
| (Я-9 × Н29) | 132 | 49 | 0.41 |
| (Н29 × Я-9) | 168 | 69 | 2.13 |
| Всего | 300 | 118 | 2.32 |
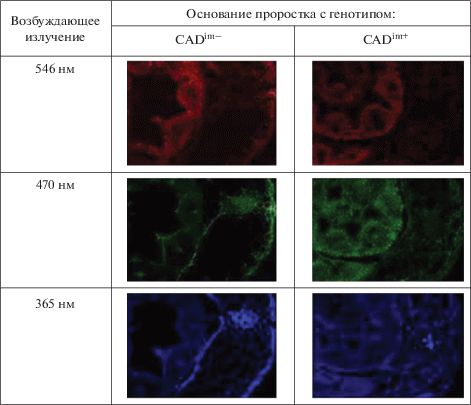
На срезах недельных проростков изучаемых генотипов обнаружены различия по автофлуоресценции тканей (рис. 2). Генотип CADim– сильнее флуоресцирует в красной и зелёной областях, генотип CADim+ в синей, коротковолновой области.
Генотипы CADim+ и CADim– различались по морфологии клеток в тканях стебля (табл. 2, рис. 3). Толщина стенок у клеток генотипа CADim– выше, чем у генотипа CADim+, при этом толщина склеренхимного слоя и толщина стенки соломины не различались.
Таблица 2.
Морфология тканей на срезах стеблей пшеницы
| Показатель | Генотип | |
|---|---|---|
| CADim+ | CADim– | |
| Толщина стенки клетки эпидермиса, мкм | 1.5 ± 0.1 | 2.8 ± 0.2 |
| Толщина стенки склеренхимных клеток, мкм | 2.5 ± 0.3 | 3.6 ± 0.1 |
| Толщина склеренхимного слоя, мкм | 60 ± 10 | 60 ± 10 |
| Толщина стенки стебля, мкм | 400 ± 20 | 415 ± 20 |
Анализ химического состава тканей стеблей растений показал, что содержание полимерных компонентов в образцах довольно близко (табл. 3). Различия наблюдались в зольности, соотношении гваяцильных и сирингильных мономеров в структуре лигнинов, а также в соотношении пигментов. Соотношение хлорофиллов A и B менялось в зависимости от способа экстракции, однако в обоих случаях обнаружено аномально высокое содержание хлорофилла B у генотипа CADim–, содержание флавоноидов также выше у растений этого генотипа.
Таблица 3.
Химический анализ состава стеблей генотипов CADim + и CADim–
| Генотип | CADim+ | CADim– |
|---|---|---|
| Зольность 600°C, % | 5.20 | 6.12 |
| Экстрактивные вещества, % | 4.59 | 4.13 |
| Лигнин, % | 21.60 | 21.53 |
| Кислоторастворимый лигнин, % | 1.50 | 1.51 |
| H : G : S | 0 : 1 : 0.97 | 0 : 1 : 1.10 |
| Целлюлоза, % | 47.48 | 49.17 |
| Хлорофиллы (1 способ): | ||
| ChlА, мг/г | 0.101 ± 0.005 | 0.106 ± 0.006 |
| ChlB, мг/г | 0.029 ± 0.001 | 0.123 ± 0.005 |
| ChlA/ChlB | 3.48 | 0.86 |
| Хлорофиллы (2 способ): | ||
| ChlА, мг/г | 0.013 | 0.013 |
| ChlB, мг/г | 0.007 | 0.011 |
| ChlA/ChlB | 1.86 | 1.18 |
| Содержание флавоноидов | 0.65 ± 0.01 | 0.72 ± 0.02 |
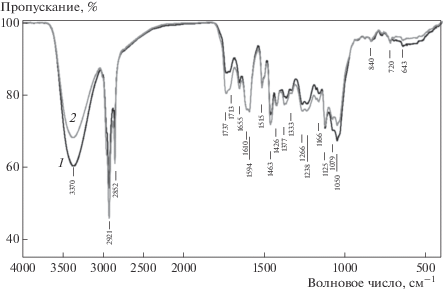
На рис. 4 приведены ИК-спектры спирто-толуольных экстрактов стеблей растений сравниваемых генотипов (спектры нормированы по полосе 1597 см–1 – поглощение ароматических колец). Большая интенсивность полосы 1737 см–1 в спектре генотипа CADim– подтверждает данные о повышенном содержании остаточных хлорофиллов в этих растениях. Небольшое различие в интенсивности полосы 1656 см–1 указывало на меньшее содержании флавоноидов в стеблях генотипа CADim+. В то же время интенсивность полосы 1100–1000 см–1 выше в спектре экстракта стеблей генотипа CADim+, что могло быть связано с большим содержанием в них углеводов. Интенсивность полосы 1713 см–1 (поглощение карбонильных и карбоксильных групп) выше в спектре экстракта CADim–, что связано с большим содержанием в нем альдегидов и кислот.
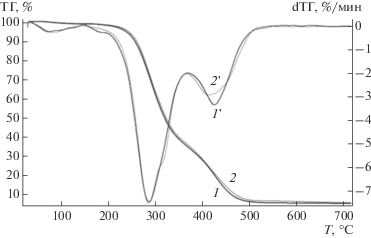
Метод термогравиметрии использовался для оценки содержания лигнина и целлюлозы без их выделения из тканей растений с помощью химических методов. Анализ основан на том, что лигнин и целлюлоза разлагаются в разных температурных диапазонах. Целлюлоза разлагается при более низкой температуре по сравнению с лигнином. На рис. 5 приведены термограммы разложения образцов с CADim+ и CADim–. Потери массы для них на первой и второй ступенях разложения одинаковы, что указывает на отсутствие различий в содержании целлюлозы и лигнина. Этот результат согласуется с данными табл. 3.
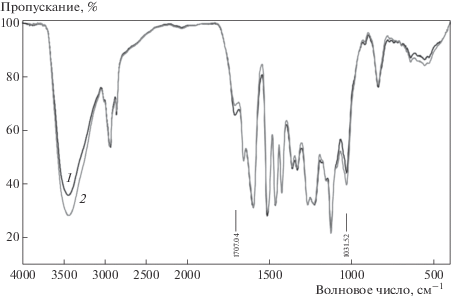
Различия в структуре лигнинов сравниваемых генотипов изучались методами ИК- и ЯМР-спектроскопии на препаратах диоксанлигнинов, выделенных из стеблей растений. По данным ИК-спектроскопии (рис. 6), в препарате диоксанлигнина из пшеницы генотипа CADim+ выше содержание карбонильных групп (полоса 1707 см–1), в препарате диоксанлигнина из пшеницы генотипа CADim– выше содержание алифатических гидроксильных групп (полоса 1031 см–1).
Спектры ПМР препаратов диоксанлигнинов показывают несколько большее содержание альдегидных групп в препарате диоксанлигнина из стеблей пшеницы генотипа CADim+ (табл. 4).
Таблица 4.
Относительное содержание структурных фрагментов препаратов диоксанлигнинов по данным ПМР (qx = Ix/Iобщ)
| Диапазон хим. сдвигов 1Н (м.д.) | Фрагменты и группы | Отнесение | CADim + | CADim– |
|---|---|---|---|---|
| 14.0–12.0 | Н(С=О)ОН | ОН карбоксильных групп | 0.008 | 0.007 |
| 9.7–9.0 | Н(С=О)Н | Н альдегидных групп | 0.014 | 0.010 |
| 12.4–9.3 | НОНфен(1) | ОН при С-4 в гваяцильных фрагментах (G) | 0.009 | 0.007 |
| 9.3–8.4 | НОНфен(1) | ОН при С-4 в сирингильных звеньях (S), гваяцильных звеньях с 5-5 (C) и β-5 (B) связями | 0.016 | 0.013 |
| 8.4–6.3 | Нар | Атомы водорода ароматических колец | 0.201 | 0.189 |
| 6.3–2.9 | НО-ал | СН=СН-, СНО-, СН2О-, СН3О-группы в α, β, γ-положениях к ароматическому кольцу, СНО углеводов | 0.721 | 0.737 |
| 2.3–0.3 | Нα,β,γ | СН-, СН2-, СН3-группы в α, β, γ-положениях к ароматическому кольцу, СНО углеводов | 0.040 | 0.039 |
Содержание структурных фрагментов (рис. 7, 8) в препаратах диоксанлигнинов, оценивалось по спектрам 13С-ЯМР (табл. 5 ) и 2Д-ЯМР (табл. 6).
Рис. 7.
Структурные фрагменты макромолекулы лигнина: G – гваяцил, S – сирингил, А/А' – β-О-4' арилэфир, B – фенилкумаран, C – резинол, E – α-O-4′ арилэфир, F –спиродиенон, I – концевые группы коричного спирта, J – концевые группы коричного альдегида, PCA – п-кумараты, FA – ферулаты, Т – трицин.
Рис. 8.
Области HSQC-спектров препаратов диоксанлигнинов стеблей растений генотипов CADim+ (а, в) и CADim– (б, г): области 50–90 ppm (a, б), области 90–155 ppm (в, г).
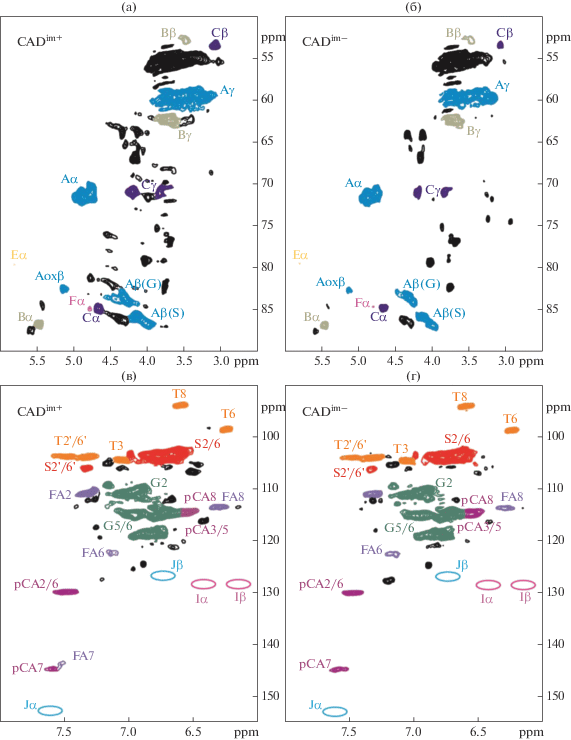
Таблица 5.
Содержание структурных элементов на одно ароматическое кольцо nx в препаратах диоксанлигнинов по данным 13С-ЯМР
| Диапазон | Отнесение | CADim+ | CADim– |
|---|---|---|---|
| 220–190 | С=О кетонов | 0.515 | 0.268 |
| 210–185 | (С=О)Н альдегидов | 0.556 | 0.279 |
| 185–163.5 | С=О(О) карбоксильные и сложноэфирные | 0.391 | 0.285 |
| 156–120 | СН=СН в связях Ar-CH=CH-R | 3.331 | 3.212 |
| 156–150 | С-3, С-5 в сирингильных звеньях (S), С-4 в гваяцильных (G) (в том числе при кето-группе в α-положении к АК) | 0.455 | 0.744 |
| 150–141 | С-3/С-4 в гваяцильных звеньях (G), С-3/С-5 в незамещенных сирингильных звеньях (S) | 1.145 | 0.852 |
| 141–123 | С-1 в гваяцильных (G) и сирингильных (S) звеньях | 1.552 | 1.433 |
| 138.8–133.3 | С-4 в сирингильных звеньях (S) | 0.482 | 0.580 |
| 124.5–117 | С-6 в гваяцильных звеньях (G) | 0.522 | 0.556 |
| 117–112.8 | С-5 в гваяцильных звеньях (G) | 0.700 | 0.750 |
| 112.8–95 | С-1/С-3 в окисленных β-О-4 структурах (А') | 1.731 | 1.596 |
| 112.8–108 | С-2 в гваяцильных звеньях (G) | 0.530 | 0.472 |
| 108–104 | С-2/С-6 в сирингильных звеньях (S) (в том числе при кето-группе в α-положении к АК) | 0.651 | 0.789 |
| 104–102.5 | С-2/С-6 в сирингильных звеньях (S) | 0.372 | 0.259 |
| 104–95 | С-5 β-О-4 структур (А и А') | 0.551 | 0.334 |
| 90–78 | Сα,β в (A) и фенилкумарановых (В) структурах | 0.504 | 0.920 |
| 80–67 | Сα,β-ОН | 0.626 | 1.116 |
| 74–64 | Сγ в СН2-О-R, СН2-ОН | 0.562 | 0.935 |
| 64–58 | Ar-OCH3 β-О-4 структурах А' | 0.552 | 0.869 |
| 58–54 | метоксильные группы | 2.038 | 2.342 |
| 54–52 | Сβ в структуре резинола (С) | 0.115 | 0.116 |
| 54–50 | Сβ в фенилкумарановых структурах (В) | 0.135 | 0.126 |
| 35–5 | СН, СН2, СН3 алифатические | 0.131 | 0.405 |
| 102.6–95 | Углеводы | 0.184 | 0.077 |
Таблица 6.
Структурные характеристики препаратов диоксанлигнинов по данным 2D-ЯМР
| Структурный фрагмент | CADim+ | CADim– |
|---|---|---|
| β-О-4’ арилэфир (А/ А') | 74.2 | 77.3 |
| В том числе окисленный в α-положении β-О-4′ арилэфир | 1.3 | 1.0 |
| Фенилкумараны (B) | 14.3 | 11.6 |
| Резинолы (C) | 10.9 | 10.7 |
| α-O-4′ арилэфир (E) | 0.2 | 0.1 |
| Спиродиеноны (F) | 0.4 | 0.3 |
| Концевые группы | ||
| Концевые группы коричного спирта (I) | – | – |
| Концевые группы коричного альдегида (J) | – | – |
| п-кумараты (pCA) | 3.7 | 3.3 |
| Ферулаты (FA) | 5.8 | 5.2 |
| Трицин (Т) | 0.08 | 0.08 |
До недавнего времени солома злаков (стебли и листья), а также отходы обмолота (мякина) считались малоценным продуктом растениеводства и использовались нерационально. В настоящее время активно разрабатываются химические и микробиологические методы рационального использования возобновляемого растительного сырья [22, 23]. Основное влияние на свойства растительных тканей оказывают генотипы растений по генам, контролирующим соответствующие участки метаболизма.
Влияние генотипов CAD на микроморфологию тканей стебля было обнаружено ранее в работе на диплоидной пшенице [14]. В данном исследовании отсутствие изофермента CADim сказывалось на толщине клеточных стенок растения, при этом общая толщина стенок соломины оставалась неизменной. Можно предположить, что такой полиморфизм может влиять на механическую прочность соломины, как это было на диплоидной пшенице, что, в свою очередь, влияет на такой важный производственный показатель как полегаемость посевов. Влияние гена пшеницы TaCAD1 на полегание пшеницы (lodging) обнаружено в работе [24], однако соответствует ли ген TaCAD1 гену CADim, пока не установлено. В настоящее время селекция на устойчивость к полеганию основана в основном на генах короткостебельности [25], использование полиморфизма CAD может быть дополнительным фактором устойчивости.
Флуоресцентные методы исследования хотя и не позволяют идентифицировать конкретный метаболит, но дают общую картину содержания и локализации флуоресцирующих веществ в тканях и широко используются при изучении микроморфологии растений [26]. Обнаруженная несколько более сильная флуоресценция в красной области у генотипа CADim– могла быть вызвана избытком хлорофилла B (табл. 3). Хлорофилл B флуоресцирует в более дальней (более “красной”) области, чем хлорофилл A. Более сильная флуоресценция генотипа CADim– в зеленой области, по-видимому, вызвана повышенным содержанием флавоноидов (табл. 3), дающих максимум флуоресценции в диапазоне 530–560 нм. Более сильная флуоресценция генотипа CADim+ в “синей” коротковолновой области (рис. 1) могла быть связана с несколько повышенным содержанием экстрактивных веществ, среди которых присутствовали ароматические кислоты, которые флуоресцируют в этой области. Покровные ткани флуоресцируют преимущественно синим, тогда как зеленым и красным – ткани паренхимы. Вероятно, фенольные соединения, которые флуоресцируют в более коротковолновой области, локализуются во внешних слоях, в паренхиме локализованы хлорофиллы, и, возможно, флавоноидные пигменты, флуоресценция которых сдвинута в длинноволновую область [26, 27].
Химический анализ стеблей растений (табл. 3) и ТГА (рис. 4) не выявил различий по содержанию полимерных компонентов клеточной стенки в сравниваемых генотипах. Различия наблюдались в содержании экстрактивных веществ, особенно хлорофиллов.
У растений с полным набором хлорофиллов соотношение ChlA/ChlB варьирует у разных видов растений от 1.7 до 5–6, т.е. концентрация хлорофилла B не превышает 60% от хлорофилла A, обычно 15–25% от общего содержания хлорофиллов [28]. У трансгенного арабидопсиса со сверхэкспрессией хлорофиллид-а-оксигеназы, при которой синтезируется повышенное количество хлорофилла B, соотношение составляло 0.92–1.13 в зависимости от световых условий [29], но у обычных нетрансгенных растений такое соотношение не описано. Следует подчеркнуть, что в данной работе изучено содержание остаточных хлорофиллов в сухом материале, которое различается в зависимости от метода выделения. Полученные генотипы в дальнейшем могут быть использованы для изучения прижизненных показателей содержания фотосинтетических пигментов, и их влияния на продуктивность.
Несмотря на то, что содержание лигнина в стеблях обоих генотипов практически одинаково, соотношение мономерных единиц, определенное методом нитробензольного окисления, показало различия в содержании сирингильных звеньев. Полное отсутствие п-гидроксифенилпропановых звеньев в лигнинах указывало на то, что в обоих генотипах не накапливался п-кумаральдегид, т.е. активность HCT (Hydroxycinnamoyl-CoA: shikimate hydroxycinnamoyl transferase) и/или С3Н (4-coumarate 3-hydroxylase) выше активности CCR (Cinnamoyl-CoA reductase) [30]. Пониженное соотношение сирингил/гваяцил в лигнине стеблей генотипа CADim+ может быть связано с повышенной активностью CAD над CAld5H (Coniferaldehyde 5-hydroxylase или F5H) в этих растениях [31].
По данным спектроскопии ЯМР содержание кето-, альдегидных и карбоксильных групп на одно ароматическое кольцо выше в лигнине пшеницы генотипа CADim+ (почти в два раза для карбонильных групп, табл. 4). Эти данные подтверждают ИК-спектры препаратов диоксанлигнинов. Относительное содержание атомов водорода ароматических колец по данным ПМР выше в диоксанлигнине генотипа CADim+, что согласовывалось с данными НБО по содержанию гваяцильных/сирингильных фрагментов в структурах.
Двойные связи в лигнине однодольных растений в основном содержат концевые группы конифериловых и синаповых спиртов и альдегидов. Часто в структуру лигнина внедряются концевые группы коричного спирта (I), коричного альдегида (J), а также п-кумараты (PCA) и ферулаты (FA), образующие сложноэфирные связи с гидроксилом при Сγ [32]. Содержание концевых групп оценивали по 2D-ЯМР-спектрам выделенных препаратов диоксанлигнинов. На рис. 8 в соответствии с цветом структурных фрагментов из рис. 7 показаны кросс-сигналы 1Н–13С в HSQC-спектрах. Эти спектры показывают, какие фрагменты и в каком количестве присутствуют в выделенных препаратах лигнина каждого генотипа. В препаратах диоксанлигнинов обоих изучаемых генотипов отсутствуют концевые группы коричных альдегида и спирта (пустые области спектров Jα, Jβ, Iα, Iβ) (рис. 8).
Как показывают 2D-ЯМР спектры основным типом связывания структурных единиц лигнина в растениях обоих генотипов является β-О-4′ ариловый эфир (структурные фрагменты А). Содержание окисленных структур β-О-4′ арилэфира выше в лигнине растений генотипа CADim+. Количество резинольных структур (С) и α-O-4′ связей арилэфира (Е) примерно одинаково в лигнинах обоих генотипов. Содержание фенилкумарановых структур (В) и спиродиенонов (F) выше в лигнине растений генотипа CADim+, так же как и содержание п-кумаратов (pCA) и ферулатов (FA). Трицин (T) присутствует в лигнинах растений обоих генотипов в одинаковом количестве.
Полученные данные по строению лигнина показали, что наличие дополнительного варианта CAD способствует накоплению карбонильных групп в структуре лигнина.
Ранее было установлено влияние полиморфизма CAD на многие признаки, не связанные напрямую с фенилпропаноидным путем метаболизма, в частности, на хлорофилл-связывающий белок хлоропластов (chlorophyll a/b binding protein) [33–35]. К тому же фенилпропаноидный путь метаболизма является продолжением шикиматного пути, который локализован в хлоропластах [3]. В дальнейших исследованиях предстоит выяснить, есть ли функциональная связь между синтезом хлорофилла и фенилпропаноидным метаболизмом или это случайное совпадение.
Из полученных результатов следует, что аллельные варианты CADim+ и CADim– оказывают существенное влияние на ряд признаков растения, и, следовательно, полиморфизм по локусу CADim является функциональным. Изученные в данном исследовании генотипы дают возможность оценить вклад данного полиморфизма в селекционно значимые признаки у сортообразцов яровой мягкой пшеницы. Кроме того, результаты могут быть использованы при разработке технологических методов рационального использования соломы.
Автофлуоресценцию изучали на поперечных срезах недельных проростков в ЦКП микроскопического анализа биологических объектов СО РАН. Спектральные и аналитические измерения проведены в Химическом исследовательском центре коллективного пользования СО РАН.
Работа поддержана бюджетными проектами № 0259-2021-0012 (ИЦИГ СО РАН) и 0302-2020-0005 (НИОХ СО РАН), а также региональным проектом РФФИ 19-44-540003 р_а.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Yoon J., Choi H., An G. // J. Integr. Plant Biol. 2015. V. 57. P. 902–912.
Коновалов А.А., Шундрина И.К., Карпова Е.В. // Успехи современной биологии. 2015. Т. 135. № 5. С. 496–513.
Гудвин Т., Мерсер Э. Введение в биохимию растений. 2 Изд. М.: Мир, 1986. Т. 1. 393 с. Т. 2. 312 с.
Himi E., Maekawa M., Noda K. // International J. Plant Genomics. 2011. V. 374: 369460. https://doi.org/10.1155/2011/369460
Dixon R. A., Chen F., Guo D., Parvathi K. // Phytochemistry. 2001. V. 57. P. 1069–1084. https://doi.org/10.1016/S0031-9422(01)00092-9
Hepworth D.G., Vincent J.F.V. // Annals of Botany. 1998. V. 81. № 6. P. 751–759.
Li X, Yang Y, Yao J, Chen G, Li X, Zhang Q, Wu C. // Plant Mol. Biol. 2009. V. 69. № 6. P. 685–697.
Ookawa T., Inoue K., Matsuoka M., Ebitani T., Takarada T., Yamamoto T., Ueda T., Yokoyama T., Sugiyama C., Nakaba S., Funada R., Kato H., Kanekatsu M., Toyota K., Motobayashi T., Vazirzanjani M., Tojo S., Hirasawa T. // Sci. Rep. 2014. V. 4: 6567 https://doi.org/10.1038/srep06567
Коновалов А.А., Шундрина И.К., Карпова Е.В., Ельцов И.В., Орлова Е.А., Гончаров Н.П. // Вавиловский журн. генетики и селекции. 2017. Т. 21. № 6. С. 686–693. https://doi.org/10.18699/VJ17.286
Карпова Е.В., Шундрина И.К., Орлова Е.А., Коновалов А.А. // Химия растительного сырья. 2019. №4. С. 87–95. https://doi.org/10.14258/jcprm.2019045238
Jaaska V. // Theoretical and Applied Genetics. 1978. V. 53. № 5. P. 209–217.
Hart G.E., Gale M.D., McIntosh R.A. Linkage Maps of Triticum aestivum (Hexaploid wheat, 2n = 42, Genomes A, B & D) and T. tauschii (2n = 14, Genome D) // Genetic maps. 6 ed. Cold Spring Harbor Lab. Pres, 1993. P. 6.204–6.219.
Коновалов А.А., Шундрина И.К., Карпова Е.В., Гончаров Н.П., Кондратенко Е.Я. // Генетика. 2016. Т. 52. № 10. С. 1222–1228. https://doi.org/10.7868/S0016675816080051
Коновалов А.А., Шундрина И.К., Карпова Е.В., Нефедов А.А., Гончаров Н.П. // Генетика. 2014. Т. 50. № 11. С. 1310–1318.
Коновалов А.А., Орлова Е.А., Карпова Е.В., Шундрина И.К. Генофонд и селекция растений. Новосибирск: ИЦиГ СО РАН, 2020. С. 147–150. https://doi.org/10.18699/GPB2020-38
Оболенская А.В., Щёголев В.П., Аким Г.Л., Аким Э.Л. Практические работы по химии древесины и целлюлозы. М.: Лесн. промышленность, 1965. 412 с.
Swan B. // Svensk Papperstidn. 1965. V. 68. № 22. P. 791–795.
Гавриленко В.Ф., Ладыгина М.Е., Хандовина Л.М. Большой практикум по физиологии растений. М.: “Высшая школа”. 1975. 392 с
Калабин Г.А., Каницкая Л.В., Кушнарев Д.Ф. Количественная спектроскопия ЯМР природного органического сырья и продуктов его переработки. М.: Химия, 2000. 408 с.
Белый В.А., Алексеев И.Н., Садыков Р.А. // Изв. Коми науч. центра УрО РАН. 2012. Т. 3. № 11. С. 20–26.
del Río J.C., Lino A.G., Colodette J.L., Lima C.F., Gutiérrez A., Martínez Á.T., Lu F., Ralph J., Rencoret J. // Biomass and Bioenergy. 2015. V. 81. P. 322–338.
Моисеев И.И. // Вестник Российской Академии наук. 201. Т. 81. № 5. С. 405–413.
Онищенко Д.В., Рева В.П., Воронов Б.А. // Доклады Российской Академии Сельскохозяйственных наук. 2013. № 4. С. 58–60.
Ma Q.-H. // J. Exp. Bot. 2010. V. 61. № 10. P. 2735–2744. https://doi.org/10.1093/jxb/erq107
Сухих И.С., Вавилова В.Ю., Блинов А.Г., Гончаров Н.П. // Генетика. 2021. Т. 57. № 2. С. 127–139. https://doi.org/10.31857/S0016675821020107
Talamond P., Verdeil J.L., Conéjéro G. // Molecules. 2015. V. 20. № 3. P. 5024–5037. https://doi.org/10.3390/molecules20035024
Donaldson L. // Molecules. 2020. V. 25. № 10. 2393. doi.org/https://doi.org/10.3390/molecules25102393
Тютерева Е.В., Дмитриева В.А., Войцеховская О.В. // Сельскохозяйственная биология. 2017. Т. 52. № 5. С. 843–855. https://doi.org/10.15389/agrobiology.2017.5.843rus
Sakuraba Y., Balazadeh S., Tanaka R., Mueller-Roeber B., Tanaka A. // Plant Cell Physiol. 2012. V. 53. № 3. P. 505–517. https://doi.org/10.1093/pcp/pcs006
Ralph J., Akiyama T., Kim H., Lu F., Schatz P.F., Marita J.M., Ralph S.A., Reddy M.S.S., Chen F., Dixon R.A. // J. Biol. Chem. 2006. V. 281. P. 8843–8853.
Takeda Y., Koshiba T., Tobimatsu Y., Suzuki S., Murakami S., Yamamura M., Rahman M.M., Takano T., Hattori T., Sakamoto M., Umezawa T. // Planta. 2017. V. 246. № 2. P. 337–349. https://doi.org/10.1007/s00425-017-2692-x
Ralph J., Lapierre C., Boerjan W. // Curr. Opin. Biotechnol. 2019. V. 56. P. 240–249. https://doi.org/10.1016/j.copbio.2019.02.019
Dauwe R., Morreel K., Goeminne G., Gielen B., Rohde A., Van Beeumen J., Ralph J., Boudet A.M., Kopka J., Rochange S.F., Halpin C., Messens E., Boerjan W. // Plant J. 2007. V. 52. № 2. P. 263–285.
Yan L., Liu S., Zhao S., Kang Y., Wang D., Gu T., Xin Z., Xia G., Huang Y. // Physiol. Plant. 2012. V. 146. № 4. P. 375–387.
Yan L., Xia G.-M., Huang Y.-H., Zhao Sh.-Y. // Plant Physiol. J. 2013. V. 49. № 12. P. 1433–1441.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология