Прикладная биохимия и микробиология, 2021, T. 57, № 4, стр. 362-373
Характеристика и функциональные свойства лактобацилл, выделенных из кефирных грибков
А. В. Бегунова 1, О. С. Савинова 2, К. В. Моисеенко 2, О. А. Глазунова 2, И. В. Рожкова 1, Т. В. Фёдорова 2, *
1 Всероссийский научно-исследовательский институт молочной промышленности
115093 Москва, Россия
2 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: fedorova_tv@mail.ru
Поступила в редакцию 02.02.2021
После доработки 15.02.2021
Принята к публикации 22.02.2021
Аннотация
Кефирный грибок представляет собой естественный симбиотический консорциум бактерий и дрожжей и является уникальным источником новых пробиотических микроорганизмов. В данной работе три новых изолята лактобацилл – Lactobacillus helveticus и два штамма Lacticaseibacillus paracasei – были выделены из кефирного грибка, происходящего из Северо-Кавказского региона России, и проведена их биохимическая и молекулярно-генетическая идентификация. Для всех штаммов были описаны профили ферментативных активностей, а также проведен скрининг устойчивости к антимикробным препаратам и наличия генетических детерминант антибиотикорезистентности. При ферментации коровьего молока все три штамма показали более низкую кислотообразующую активность по сравнению с кефирной закваской, но сопоставимую с ней протеолитическую, антиоксидантную и гипотензивную активности.
За последнюю пару десятилетий произошел существенный сдвиг в понимании взаимосвязи питания и здоровья. Взгляд, который можно охарактеризовать фразой “еда как источник веществ и энергии”, постепенно дополнился новой формулировкой – “еда как лекарство” [1]. Помимо обеспечения организма питательными веществами, необходимыми для нормального протекания метаболических процессов, еда теперь рассматривается как инструмент для улучшения самочувствия и профилактики заболеваний [2]. Сегодня, более чем когда-либо прежде, потребители заинтересованы в контроле над своим здоровьем. Отражением данной тенденции является появление таких новых терминов, как “функциональное питание”, “нутрицевтики”, “пробиотики” и “пребиотики” [3].
Новый взгляд на питание изменил отношение потребителей к ряду давно известных продуктов, а в особенности к ферментированной пище. Если ранее ферментация рассматривалась как способ приготовления пищи, при котором рост и метаболическая активность микроорганизмов используются для сохранения продуктов, то сейчас ферментированная еда рассматривается как важный источник биологически активных соединений [4]. В случае кисломолочных продуктов, последние тенденции указывают на неуклонно возрастающий интерес к продуктам, подвергающимся естественному сквашиванию при помощи спонтанно сформировавшихся микробных консорциумов [5].
Кефир – традиционный кисломолочный продукт, произведенный путем смешанного (молочнокислого и спиртового) брожения с использованием закваски, приготовленной на кефирных грибках, или “кефирных зернах” (“kefir grains”) [6, 7] без добавления чистых культур молочнокислых микроорганизмов и дрожжей. Кефирный грибок – единственная спонтанно сформировавшаяся естественная симбиотическая закваска, применяемая в промышленном масштабе. Кефирные грибки содержат различные бактерии и дрожжи, заключенные в матрицу белка и полисахаридов [8]. Исследования ряда авторов показали, что в качестве доминирующих микроорганизмов в составе кефирных грибков определяются лактобациллы 70–95%, лактококки – 5–8%, дрожжи – 0.5–3% и уксуснокислые бактерии – около 0.05% [7]. Лактобациллы представлены такими видами как Lactobacillus kefiranofaciens, Lactobacillus kefir, Lactobacillus parakefir, Lactobacillus casei, Lactobacillus acidophilus, Lactobacillus rhamnosus и др.; лактококки – преимущественно Lactococcus lactis. Среди дрожжей идентифицированы такие виды как Kazachstania exigua, Dekkera bruxellensis и Kluyveromyces marxianus. Многовидовая микрофлора кефирного грибка существенно влияет на качество (вкус и консистенцию) и функциональные свойства кефира. Вместе с тем, видовой состав кефирных грибков в большой степени зависит от места их происхождения и различается в разных географических регионах [8]. Данные различия могут быть связаны как с разными источниками выделения кефирных грибков, так и с разными технологиями, используемыми во время их культивирования и обработки [9].
Изучение микробного состава и функциональных свойств кефира является одной из актуальных тем для исследований в последние десятилетия [10]. Регулярное потребление кефира улучшает пищеварение, оказывает антибактериальный, гипохолестеринемический, антигипертензивный, противовоспалительный эффекты на организм, а также способствует снижению глюкозы в плазме крови [7]. Подобные оздоравливающе эффекты кефира, как правило, связывают с наличием лактобацилл в составе кефирных грибков.
Цель работы – выделение отдельных штаммов лактобацилл из кефирного грибка и исследование их функционального потенциала, что позволит в дальнейшем разрабатывать с их использованием ассоциации заквасочных культур для производства кисломолочных продуктов с определенным направленным оздоравливающим действием.
МЕТОДИКА
Культуры. В работе использовались кефирные грибки из коллекции Всероссийского научно-исследовательского института молочной промышленности (ВНИМИ), полученные на Северных склонах кавказского хребта (Россия). Для культивирования использовали пастеризованное обезжиренное молоко.
Реактивы. В работе использовались реактивы производства фирмы “Sigma-Aldrich” (США), остальные реактивы отечественного производства имели квалификацию “ос. ч.” или “х. ч.”. Все буферы, использованные в работе, были профильтрованы через нитроцеллюлозные мембраны фирмы “Millipore” (Германия) с диаметром пор 0.45 мкм.
Выделение чистых культур лактобацилл. Перед проведением исследований кефирные грибки культивировали в пастеризованном обезжиренном коровьем молоке для получения кефирной закваски в соответствии с “Технологической инструкцией по приготовлению и применению заквасок для кисломолочных продуктов на предприятиях молочной промышленности” [11]. После чего кефирные грибки отделяли от кефирной закваски с использованием профламбированного сита, отбирали 10 г кефирного грибка и ресуспендировали в 90 мл стерильного раствора хлористого натрия, далее гомогенизировали с использованием лабораторного блендера (“Bosh”, Германия). Из полученной суспензии готовили ряд десятикратных разведений в стерильном растворе хлористого натрия и проводили посев в MRS-бульон с добавлением 10% этанола. Посевы культивировали при температуре 30 ± 1°С в течение 3–5 сут для обогащения среды лактобациллами. Для выделения отдельных штаммов проводили посев обогащенной культуры лактобацилл на агаризованную среду MRS (pH = 5.4) и инкубировали в анаэробных условиях с использованием газогенерирующей системы GasPak EZ Anaerobe Container System (“BD Biosciences”, США) при температуре 30 ± ± 1°С в течение 3–5 сут. Среди морфологически идентичных колоний (по окраске, форме, текстуре) для выделения в чистую культуру выбирали одну и пересевали на питательную среду MRS-бульон (pH 5.4), после чего инкубировали при температуре 30 ± 1°С в течение 24–48 ч для накопления клеток.
Идентификация изолятов лактобацилл. Биохимическую идентификацию выделенных лактобацилл проводили с использованием тест-систем API 50CH (“BioMerieux”, Франция). Для этого суспензию чистой культуры микроорганизма, приготовленную по стандарту мутности 2 Mac Farland на основе жидкой среды API 50 CHL, инокулировали в лунки стрипа API 50CH сразу после приготовления. Стрипы в специальных закрытых контейнерах инкубировали в термостате при 37°С. Окончательный учёт результатов проводили через 48 ч. Видовую принадлежность микроорганизма определяли с помощью веб-сервера “APIWEB” (https://apiweb.biomerieux.com).
Для подтверждения фенотипической и биохимической идентификации полученных изолятов было проведено их генотипирование. Для генотипирования изолятов лактобацилл 16-часовая культура каждого штамма высевалась на жидкую MRS среду и инкубировалась анаэробно в течение 48 ч при 37°C. Геномную ДНК выделяли с использованием коммерческого набора DNeasy Mini Kit (“Qiagen”, США). Выделенную ДНК хранили при –20°C и в дальнейшем использовали во всех ПЦР в данном исследовании.
ПЦР амплификацию гена 16S рРНК проводили согласно [12] с использованием набора Taq ДНК-полимераза (“Евроген”, Россия) и праймеров bak11w (5'-AGT TTG ATC MTG GCT CAG-3') и bak4 (5'-AGG AGG TGA TCC ARC CGC A-3'). Для проверки успешности ПЦР-амплификации проводили электрофорез в 2%-ном агарозном геле. Успешно амплифицированные ПЦР продукты выделяли из агарозного геля с использованием коммерческого набора QIAquick Gel Extraction Kit (“Qiagen”, США). Секвенирование по Сэнгеру очищенных ПЦР продуктов осуществлялось с применением тех же праймеров, что и для проведения ПЦР.
Для описания морфологии колоний и клеток микроорганизмов использовали иммерсионную микроскопию (микроскоп BX50, “Olympus”, Япония).
Ферментативный профиль лактобацилл. Оценку ферментативной активности выделенных из кефирного грибка штаммов лактобацилл проводили с использованием наборов API ZYM (“BioMerieux”, Франция). Система API ZYM позволяет проводить полуколичественное измерение ферментативных активностей. Эта система представляет собой стрип с 20 лунками, 19 из которых содержат дегидратированный хромогенный субстрат для выявления активности различных ферментов и лунку без субстрата в качестве отрицательного контроля. В лунки добавляли буфер и суспензию клеток исследуемых бактерий, после чего тест-полоска инкубировалась 48 ч при 37°С. Далее проводили визуальную оценку изменения цвета субстрата в лунке по шкале 0–5 по сравнению с контролем.
Определение антибиотикорезистентности. Антибиотическая резистентность штаммов лактобацилл анализировалась диско-диффузным методом с помощью набора дисков, пропитанных различными видами антибиотиков. Диски накладывались на плотную питательную среду, засеянную культурой исследуемого штамма, после чего осуществляли культивирование в течение суток при температуре 37°С и последующее измерение диаметра зоны задержки роста вокруг дисков.
Для проверки наличия генов антибиотикорезистентности проводили ПЦР-амплификацию с выделенной геномной ДНК, используя набор Taq ДНК-полимераза (“Евроген”, Россия), согласно инструкции производителя. Последовательности праймеров и основные параметры амплификации приведены в табл. 1. Для проверки успешности ПЦР-амплификации, проводили электрофорез в 2%-ном агарозном геле.
Таблица 1.
Праймеры для проверки наличия генов антибиотикорезистентности и параметры ПЦР-амплификации
| Ген | Праймеры | Последовательность | ПЦР | Ссылка |
|---|---|---|---|---|
| Аминогликозиды: | ||||
| aac(6′)-aph(2″) | aac_F | 5'-CCAAGAGCAATAAGGGCATA-3' | Tm = 60°C ≈220 bp |
[36] |
| aac_R | 5'-CACTATCATAACCACTACCG-3' | |||
| aad(E) | aad(E)_F | 5'-GCAGAACAGGATGAACGTATTCG-3' | Tm = 55°C ≈369 bp |
[37] |
| aad(E)_R | 5'-ATCAGTCGGAACTATGTCCC-3' | |||
| Тетрациклины: | ||||
| RPP* | DI | 5'-GAYACNCCNGGNCAYRTNGAYTT-3' | Tm = 50°C ≈1083 bp |
[38] |
| DII | 5'-GCCCARWANGGRTTNGGNGGNACYTC-3' | |||
| Tet-1 | 5'-GCTCACGTTGACGCAGGAA-3' | Tm = 50°C ≈1300 bp |
[39] | |
| Tet-2 | 5'-AGGATTTGGCGGGACTTCTA-3' | |||
| tet(K) | tet(K)_F | 5'-TTATGGTGGTTGTAGCTAGAAA-3' | Tm = 45°C ≈348 bp |
[40] |
| tet(K)_R | 5'-AAAGGGTTAGAAACTCTTGAAA-3' | |||
| tet(L) | tet(L)_F | 5'-GTMGTTGCGCGCTATATTCC-3' | Tm = 45°C ≈696 bp |
|
| tet(L)_R | 5'-GTGAAMGRWAGCCCACCTAA-3' | |||
| Амфениколы: | ||||
| cat | cat_F | 5'-ATGACTTTTAATATTATTRAWTT-3' | Tm = 49°C ≈648 bp |
[41] |
| cat_R | 5'-TCATYTACMYTATSAATTATAT-3' | |||
| MLS: | ||||
| erm(A) | erm(A)_F | 5'-TCTAAAAAGCATGTAAAAGAA-3' | Tm = 48°C ≈645 bp |
[42] |
| erm(A)_R | 5'-CTTCGATAGTTTATTAATATTAGT-3' | |||
| erm(B) | erm(B)_F | 5'-GAAAAGGTACTCAACCAAATA-3' | Tm = 50°C ≈639 bp |
|
| erm(B)_R | 5'-AGTAACGGTACTTAAATTGTTTAC-3' | |||
| erm(C) | erm(C)_F | 5'-TCAAAACATAATATAGATAAA-3' | Tm = 43°C ≈642 bp |
|
| erm(C)_R | 5'-GCTAATATTGTTTAAATCGTCAAT-3' | |||
| erm(F) | erm(F)_F | 5'-CGGGTCAGCACTTTACTATTG-3' | Tm = 500°C ≈466 bp |
[43] |
| erm(F)_R | 5'-GGACCTACCTCATAGACAAG-3' | |||
| erm(T) | erm(T)_F | 5'-CCGCCATTGAAATAGATCCT-3' | Tm = 55°C ≈478 bp |
[44] |
| erm(T)_R | 5'-GCTTGATAAAATTGGTTTTTGGA-3' | |||
| mef(A) | mef(A)_F | 5'-ACCGATTCTATCAGCAAAG-3' | Tm = 43°C ≈940 bp |
[45] |
| mef(A)_R | 5'-GGACCTGCCATTGGTGTG-3' |
Функциональные свойства штаммов лактобацилл и кефирной закваски. Для изучения функциональных свойств кефирной закваски и штаммов лактобацилл в стерильное обезжиренное молоко вносили 1% инокулята соответствующих микроорганизмов и проводили культивирование в термостате при температуре (24 ± 2)°С (кефирная закваска), 30°С (L. paracasei) и 37°С (L. helveticus) в течение 72 ч. В ходе ферментации через 6, 16, 24, 48 и 72 ч стерильно отбирали аликвоты молока, после чего проводили измерение количества жизнеспособных клеток (КОЕ) и рН с использованием рН-метра Seven Easy (“Mettler Toledo”, США). В белково-пептидных фракциях ферментированного молока определяли протеолитическую, антиоксидантную и АПФ-ингибирующую (гипотензивную) активности.
Определение количества жизнеспособных клеток. В кефирной закваске определяли общее количество жизнеспособных молочнокислых микроорганизмов методом наиболее вероятного числа молочнокислых бактерий (НВЧ) при помощи посева в пробирки со стерильным обезжиренным молоком и инкубирования при 30°С в течение 72 ч. Количество клеток определяли по ГОСТ 33951–2016 [13].
Количество клеток лактобацилл определяли методом посева на питательную среду MRS-агар (ООО “НПЦ Биокомпас-С”, Россия). Культивирование проводили в анаэробных условиях при 30 ± 1°С для L. paracasei и 37 ± 1°С для L. helveticus c использованием анаэростата (“Oxiod”, США) и газ-пакетов GasPak (“BD Biosciences”, США), подсчитывались все выросшие на среде в течение 72 ч колонии.
Получение белково-пептидных фракций. Аликвоту (15 мл) образца ферментированного молока центрифугировали при температуре 4°С в течение 30 мин при 10 000 g на центрифуге 5702R (“Eppendorf”, Германия) и фильтровали надосадочную жидкость вместе с жировым слоем через складчатый бумажный фильтр (MN 640W, “Macherey-Nagel”, Германия). рН фильтрата доводили до 4.6 добавлением 0.1 М раствора гидроксида натрия, после чего фильтрат центрифугировали при 4°С в течение 30 мин при 10 000 g на центрифуге 5702R (“Eppendorf”, Германия) и фильтровали через шприцевые фильтры с гидрофильной мембраной с диаметром пор 0.45 мкм (“Sartorius”, Германия). Полученные белково-пептидные фракции замораживали и хранили при температуре –73°С до проведения анализа.
Перед проведением анализа образцы белково-пептидных фракций ферментированного молока размораживали и дополнительно фильтровали с помощью шприцевых фильтров с гидрофильной PVDF-мембраной с диаметром пор 0.45 мкм (“Carl Roth”, Германия).
Протеолитическая активность. Протеолитическую активность определяли путем измерения количества высвобождаемых аминогрупп в исследуемых образцах спектрофотометрическим методом с использованием 2,4,6-тринитробензолсульфоновой кислоты (TNBS) [14]. Оптическую плотность растворов определяли на микропланшетном фотометре-флуориметре Synergy2 (“BioTek”, США) при длине волны 340 нм. В качестве стандарта для определения протеолитической активности использовали L-лейцин (“Sigma-Aldrich”, США). Результаты измерений выражали в мМ эквивалентов лейцина.
Антиоксидантная активность. Антиоксидантную активность in vitro в образцах определяли флуоресцентным методом ORAC (oxygen radical absorbance capacity) с помощью микропланшетного фотометра-флуориметра BioTek Synergy 2 (“BioTek”, США) с генерацией пероксильного радикала в реакционной среде [15].
АПФ-ингибирующая (гипотензивная) активность. Гипотензивную активность in vitro в образцах определяли по их способности ингибировать ангиотензин-1-превращающий фермент (АПФ) – ключевое звено ренин-ангиотензиновой системы, участвующей в регуляции артериального давления – как описано в работе [15]. Измерения проводили с помощью микропланшетного фотометра-флуориметра BioTek Synergy 2 (“BioTek”).
Все эксперименты были выполнены в 3 биологических повторностях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выделение, биохимическая и молекулярно-генетическая идентификация штаммов. По результатам последних исследований перспективными источниками новых эффективных пробиотических штаммов могут быть кисломолочные продукты, получаемые путем естественного сквашивания [16]. В этом отношении внимания заслуживают естественно сформированные популяции микроорганизмов, входящие в состав кефирных грибков [8, 17].
Для выделения чистых культур микроорганизмов, кефирные зерна отделяли от закваски, гомогенизировали и вносили в жидкую накопительную среду с добавлением спирта, способствующую преимущественному росту бактерий семейства Lactobacillaceae (поскольку лактобациллы более спиртоустойчивы, по сравнению с лактококками). При дальнейшем высеве накопительной культуры на агаризованную среду наблюдали поверхностные колонии округлой формы и вытянутые глубинные. При микроскопировании изолятов в первые дни после выделения наблюдали многочисленные длинные цепочки палочек, напоминающие сплетение стромы кефирного грибка. Через несколько пересевов цепочки палочек распадались и наблюдались лишь отдельные короткие и длинные палочки. В результате из кефирной закваски в чистую культуру были выделены три штамма лактобацилл.
Результаты биохимической идентификации с использованием системы API 50CH не дали однозначной идентификации в случае изолята № 1 и выделенный микроорганизм был предварительно отнесен к Lactobacillus acidophilus (табл. 2). Изоляты № 2 и № 3 были отнесены к Lactobacillus curvatus (99.9% идентичности) и Lactobacillus plantarum (98.7% идентичности) соответственно (табл. 2). Как было отмечено ранее в работе Королевой [18], при выделении отдельных молочнокислых бактерий из кефирного грибка, возникали трудности, связанные с тем, что чистые культуры микроорганизмов, либо не росли в молоке, либо утрачивали свою биохимическую активность. В связи с этим их биохимическая идентификация могла быть затруднена, и для однозначного определения родовой и видовой принадлежности требовалось использование молекулярно-генетических методов.
Таблица 2.
Биохимические свойства изолятов лактобацилл: Lactobacillus helveticus KF3 – (изолят № 1); Lacticaseibacillus paracasei KF1 – (изолят № 2); Lacticaseibacillus paracasei ABK – (изолят № 3)
| Соединение | Биохимическая реакция, № изолята | Соединение | Биохимическая реакция, № изолята |
||||
|---|---|---|---|---|---|---|---|
| № 1 | № 2 | № 3 | № 1 | № 2 | № 3 | ||
| Глицерин | – | – | – | Салицин | – | + | + |
| Эритрол | – | – | – | D-целлобиоза | – | + | + |
| D-арабиноза | – | – | – | D-мальтоза | – | + | + |
| L-арабиноза | – | – | – | D-лактоза | + | + | + |
| D-рибоза | – | + | + | D-мелибиоза | – | – | + |
| D-ксилоза | – | – | – | D-сахароза | – | – | – |
| L-ксилоза | – | – | – | D-трегалоза | – | + | + |
| D-адонитол | – | – | – | Инулин | – | – | – |
| Метил-βD-ксилапиранозид | – | – | – | D-мелецитоза | – | + | + |
| D-галактоза | – | + | + | D-раффиноза | – | – | – |
| D-глюкоза | + | + | + | Крахмал | – | – | – |
| D-фруктоза | – | + | + | Гликоген | + | – | – |
| D-манноза | + | + | + | Ксилит | – | – | – |
| L-сорбоза | – | – | – | Гентиобиоза | + | – | + |
| L-рамноза | – | – | – | D-тураноза | – | + | + |
| Дульцитол | – | – | – | D-ликсоза | – | – | – |
| Инозит | – | – | – | D-тагатоза | – | + | – |
| D-маннит | – | + | + | D-фукоза | – | – | – |
| D-сорбит | – | – | – | L-фукоза | – | – | – |
| Метил-αD-маннопиранозид | – | – | – | D-арабит | – | – | – |
| Метил-αD-гдюкопиранозид | – | – | – | L-арабит | – | – | – |
| N-ацетилглюкозамин | – | + | + | Глюконат калия | – | – | – |
| Амигдалин | – | – | – | 2-кетоглюконат калия | – | – | – |
| Арбутин | – | – | + | 5-кетоглюконат калия | – | – | – |
| Эскулин, цитрат железа | + | – | + | ||||
На рис. 1 приведено филогенетическое дерево, построенное на основе как полученных в данной работе последовательностей 16S рРНК выделенных лактобацилл, так и последовательностей 16S рРНК из штаммов микроорганизмов, ранее использованных в работе [19] в качестве типовых для своего вида. Расположение выделенных штаммов на дереве позволило однозначно определить их родовую и видовую принадлежность: изолят № 1 был идентифицирован как Lactobacillus helveticus, а изоляты № 2 и № 3 – как Lactobacillus paracasei (в соответствии с новой классификацией Lacticaseibacillus paracasei). Полученные последовательности 16S рРНК были депонированы в базу данных GenBank, а штаммам присвоены коллекционные номера: L. helveticus KF3 – MW558120 (изолят № 1); L. paracasei KF1 – MW558119 (изолят № 2); L. paracasei ABK – MN994625 (изолят № 3).
Рис. 1.
Филогенетическое дерево, включающее типовые штаммы для различных видов лактобацилл и штаммы, выделенные в данной работе (отмечены красным). Эволюционное расстояние, соответствующее 1 замене нуклеотида на каждые 100, показано масштабом. Статистическая достоверность порядка ветвления, определенная с помощью “bootstrap”-анализа, показана цветными кружками.
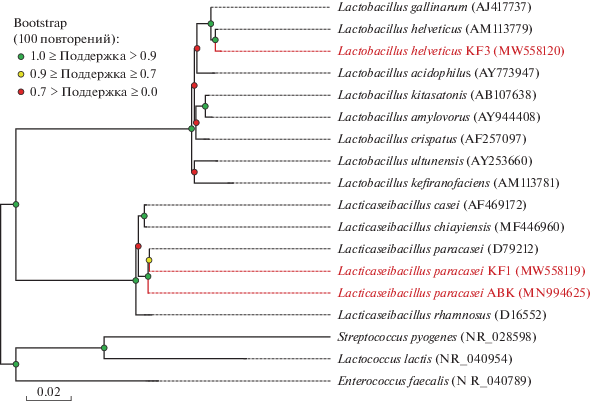
Интересно отметить, что штамм L. helveticus KF3 из кефирного грибка значительно отличался по биохимическому профилю от штамма L. helveticus NK1, выделенного из ЖКТ человека [20]. В отличие от последнего, он был не способен сбраживать D-фруктозу, D-целлобиозу, D-мальтозу, D-сахарозу и N-ацетилглюкозамин, однако обладал способностью утилизировать гентиобиозу, гликоген и эскулин с добавлением цитрата железа (табл. 2). Что касается двух штаммов L. paracasei, то оба изолята были способны ферментировать рибозу, но не глицерин и ксилозу, что отличает данный вид от других родственных видов лактобацилл. Кроме того, два разных изолята L. paracasei отличались друг от друга по способности утилизировать арбутин и эскулин с добавлением цитрата железа, а также способностью ферментировать D-мелибиозу, D-тагатозу и гентиобиозу.
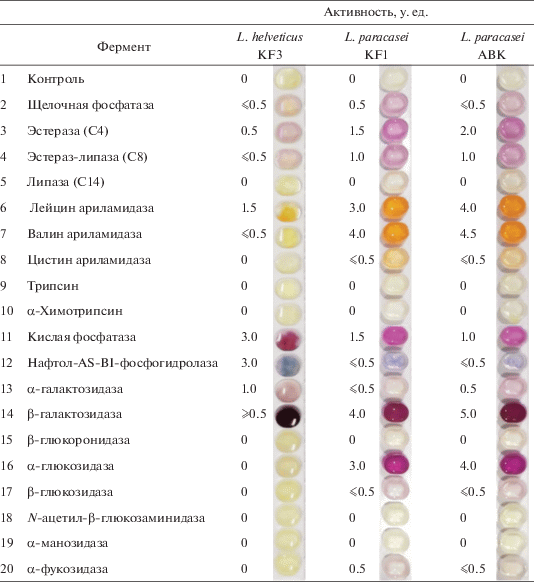
Ферментативная активность штаммов лактобацилл. Актуальной задачей является исследование ферментативного профиля пробиотических штаммов бактерий, в том числе, активности протеолитических и гидролитических ферментов, а также ферментов антиоксидантной защиты. Качественные и количественные характеристики ферментативной активности молочнокислых бактерий имеют большое значение при выборе микроорганизмов в качестве заквасок и пробиотических препаратов. В результате действия ферментов, вырабатываемых населяющими кишечник микроорганизмами, образуются различные соединения, которые оказывают влияние на эпителиальный обмен, обеспечивают конъюгацию желчных кислот, принимают участие в метаболизме билирубина и восстановлении холестерина до копростерина, повышают осмотическое давление в просвете кишки при одновременном понижении рН и тем самым стимулируют перистальтику кишечника и др. [21]. Большое значение имеют также гликозил-гидролазы, которые участвуют в метаболизме многих биологически активных соединений растительного происхождения [22]. Некоторые виды микроорганизмов, используемые в качестве пробиотиков и йогуртных заквасок, являются продуцентами гликозил-гидролаз, отсутствующих или недостаточно активных у человека [23]. При употреблении людьми кисломолочных продуктов, содержащих данные микроорганизмы, в их кишечнике появляется активность α-галактозидазы и увеличивается активность β-галактозидазы (лактазы), недостаточность которой приводит к непереносимости лактозы.
Оценка ферментативной активности штаммов лактобацилл проводилась полуколичественным способом с использованием наборов API ZYM (рис. 2). Было показано, что штаммы L. paracasei в целом обладали выраженной и разнообразной гликозилгидролазной активностью, в то время как у штамма L. helveticus KF3 были выявлены активности всего трёх гликозил-гидролаз. У всех штаммов лактобацилл была обнаружена умеренная α-галактозидазная (0.5–1 у. ед.) и высокая β‑галактозидазная активность (4–5 у. ед.). У штаммов L. paracasei наблюдали достаточно высокую активность α-глюкозидазы (3–4 у. ед.), но при этом невысокую активность β-глюкозидазы (≤0.5 у. ед.) и α-фукозидазы (~0.5 у. ед.), а штамм L. helveticus KF3 не проявлял этих ферментативных активностей. Активности β-глюкуронидазы, α-маннозидазы и α-фукозидазы отсутствовали у всех тестируемых штаммов. Штаммы L. paracasei показали также высокую аминопептидазную активность (лейцин- и валин аминопептидазы, 3–5 у. ед.) (рис. 2), при этом активностей протеиназ (трипсин и α-химотрипсин) обнаружено не было. Штамм L. helveticus демонстрировал слабые аминопептидазную и протеазную активности, но показал достаточно высокие активности кислой фосфатазы и фосфогидролазы в диапазоне 1.5–3.5 у. ед. У обоих штаммов L. paracasei была выявлена умеренная активность эстеразы (C4) и эстераз-липазы (C8) (средняя активность в диапазоне 1–2.5 у. ед.), у L. helveticus активность данных ферментов не обнаружена. У всех трех штаммов отсутствовала липазная активность (C14).
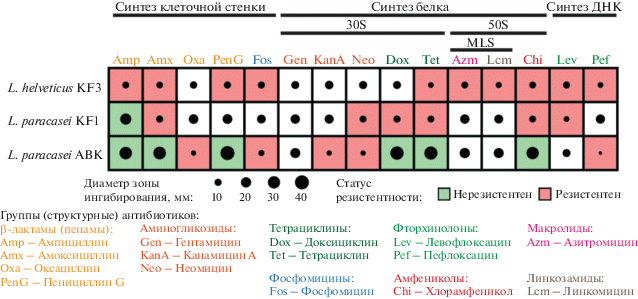
Антибиотикорезистентность штаммов лактобацилл. В работе была определена чувствительность выделенных из кефирного грибка штаммов лактобацилл к 15 антибактериальным препаратам, наиболее часто используемым в клинической практике для лечения различных кишечных и легочных инфекций, а также заболеваний мочевыводящих путей. Выбранные антибиотики относились к восьми различным структурным семействам и функционально подразделялись на ингибиторы биосинтеза клеточной стенки, белка и ДНК (рис. 3).
Как видно из рис. 3 резистентность к наибольшему числу антибиотиков наблюдали для штамма L. helveticus KF3. Этот штамм был устойчив практически ко всем антибиотикам, нарушающим процесс синтеза клеточной стенки, за исключением оксациллина. Из антибиотиков, ингибирующих синтез белка, L. helveticus KF3 был устойчив ко всем антибиотикам, связывающимся в пептидилтрансферазном центре 50S рибосомальной субъединицы, и лишь к одному, тетрациклину, связывающемуся в A-сайте 30S субъединицы рибосомы. Также данный штамм был устойчив ко всем антибиотикам, блокирующим синтез ДНК. Крайне интересным оказался факт значительно различающейся устойчивости к антибиотикам штаммов L. paracasei KF1 и L. paracasei ABK. Эти два микроорганизма показывали совпадающие статусы антибиотикорезистентности только для неомицина, к которому оба были устойчивы, и для ампициллина, который достоверно подавлял оба штамма. Для таких антибиотиков как амоксициллин, доксициклин, тетрациклин и хлорамфеникол результаты были диаметрально противоположны: если штамм L. paracasei KF1 проявлял к ним резистентность, то штамм L. paracasei ABK ими достоверно подавлялся.
Чтобы определить, имеет ли наблюдаемая антибиотикорезистентность штаммов лактобацилл переносимый характер, все изученные штаммы прошли ПЦР-проверку на наличие генов антибиотикорезистентности (AR-генов). Проверяемые гены (табл. 1) включали те, возможность горизонтального переноса которых была ранее показана у лактобацилл [24–28].
ПЦР-анализ показал отсутствие всех проверяемых генов у трех выделенных штаммов лактобацилл. Таким образом, с высокой вероятностью можно заключить, что наблюдаемая в тестах in vitro, антибиотикорезистентность штаммов носит не передаваемый характер. Возможно, различный уровень резистентности исследованных штаммов лактобацилл носит “врожденный” характер и объясняется индивидуальными мутациями и уровнями экспрессии определенных генов.
Сравнительная характеристика параметров ферментации коровьего молока кефирной закваской и выделенными чистыми культурами лактобацилл. Основные параметры ферментации и динамика изменения протеолитической, антиоксидантной и АПФ-ингибирующей активностей ферментированного коровьего молока для кефирной закваски и выделенных из кефирного грибка штаммов лактобацилл представлены на рис. 4. Из сопоставления графиков по изменению количества жизнеспособных клеток лактобацилл и pH можно заключить, что штамм L. helveticus KF3 – наименее кислотоустойчив по сравнению с обоими штаммами L. paracasei, его рост замедлялся уже после 25 ч культивирования при достижении значения pH 5.5. Наиболее кислотообразующим и при этом самым кислотоустойчивым был штамм L. paracasei ABK, в присутствии которого закисление среды происходило быстрее остальных, но при этом не оказывало видимого ингибирующего эффекта на его рост. Самую низкую скорость кислотообразования показал штамм L. paracasei KF1, для которого значения pH ферментированного молока в ходе всего культивирования, за исключением 72 ч, были выше по сравнению с двумя другими штаммами. Это объясняет его стабильный рост и замедление выхода на стационарную фазу за наблюдаемый период времени.
Рис. 4.
Изменение количества жизнеспособных клеток лактобацилл (а), активной кислотности (б), протеолитической (в), антиоксидантной (г) и гипотензивной (д) активностей при ферментации обезжиренного коровьего молока при помощи трех штаммов лактобацилл и кефирной закваски. 1 – L. paracasei KF1, 2 – L. paracasei ABK, 3 – L. helveticus KF3, 4 – кефирная закваска (цвет кривых для штаммов одинаков на всех рисунках).
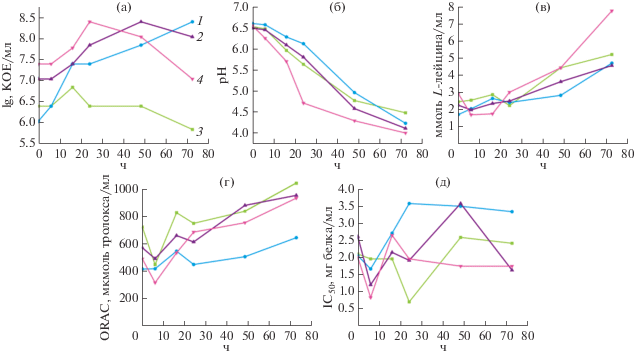
Несмотря на различную скорость роста штаммов, динамика их протеолитической активности была сопоставима в интервале от 0 до 48 ч. К 72 ч ферментации протеолитическая активность значительно увеличивалась у кефирной закваски, что могло быть связанно с возрастающей активностью других микроорганизмов в составе закваски, таких как уксуснокислые бактерии и дрожжи, причем к этому моменту времени количество молочнокислых бактерий значительно снижалось. Как для кефирной закваски, так и для отдельных штаммов наблюдалось увеличение протеолитической активности на относительно поздних стадиях ферментации при выходе на стационарную фазу или в фазе клеточной гибели.
В целом изменение антиоксидантной активности положительно коррелировало со степенью гидролиза, в то время как АПФ-ингибирующая активность оставалась практически неизменной на поздних этапах ферментации. Наблюдаемые различия в паттернах развития антиоксидантной и АПФ-ингибирующей активностей для исследуемых штаммов можно объяснить общими требованиями к пептидам, проявляющим данные активности. В случае антиоксидантной активности пептиды должны быть короткими (до 20 аминокислот) и содержать высокую долю гидрофобных аминокислот [29–31]. Поскольку многие пептиды могут удовлетворять этим минимальным требованиям, любая молочнокислая бактерия потенциально может продуцировать среди прочих некоторое количество таких пептидов. Следовательно, чем больше общее количество пептидов (то есть степень протеолиза) в ферментированном молоке, тем большее количество антиоксидантных пептидов оно будет содержать и тем более высокой антиоксидантной активностью оно будет обладать. Следует отметить, что такое же соотношение протеолитической и антиоксидантной активности ранее сообщалось в работах [32–34]. В отличие от антиоксидантных, АПФ-ингибирующие пептиды очень специфичны к аминокислотной последовательности, поскольку они должны осуществлять конкурентное ингибирование каталитического сайта ангиотензин-превращающего фермента [31]. Следовательно, их продукция сильно зависит от способности протеолитической системы конкретного микроорганизма высвобождать из аминокислотной последовательности белка пептиды, состоящие из определенных аминокислот. Таким образом, только небольшая фракция пептидов, если таковая имеется, будет обладать АПФ-ингибирующей активностью независимо от степени протеолиза.
Необходимо отметить, что, несмотря на значительно большую степень протеолиза белков молока, ферментированного кефирной закваской, его антиоксидантные свойства были сопоставимы, а гипотензивные свойства (АПФ-ингибирующая активность) в первые 24 ч культивирования были слабее выражены, чем у молока, заквашенного чистыми культурами лактобацилл. Однако в ходе дальнейшей ферментации кефирной закваской АПФ-ингибирующая активность сквашенного молока увеличивалась и становилась выше, чем при ферментации отдельными штаммами лактобацилл. Это может объясняться присутствием отличных от лактобацилл микроорганизмов в составе кефирной закваски на данных этапах ферментации. Действительно, ранее была показана способность кефира снижать артериальное давление и частоту сердечных сокращений за счет ингибирования АПФ в крови крыс с экспериментальной гипертензией [35].
Таким образом, из кефирного грибка были выделены три штамма лактобацил, относящиеся к видам L. helveticus и L. paracasei, обладающие широким спектром ферментативных активностей, включая α- и β-галактозидазную, α-глюкозидазную, фосфатазную, аминопептидазную и липазную. В тестах in vitro показаны антиоксидантные и гипотензивные свойства молока, ферментированного этими штаммами лактобацилл, которые сопоставимы со свойствами молока, ферментированного кефирной закваской. Как показали результаты анализа ПЦР, в геномах выделенных штаммов лактобацилл отсутствовали гены антибиотикорезистентности aad, aac6′-aph2″, RPP (включая tet(M), tet(O) и др.), tetK/L, ermA/B/C/F/T, cat, mefA как в хромосомах, так и в плазмидах. Поэтому новые штаммы лактобацилл могут быть использованы в качестве пробиотических культур при формировании ассоциаций заквасочных культур для разработки кисломолочных продуктов с лечебно-профилактическим действием, и для прямого использования в качестве пробиотиков, поскольку не могут служить источником генов устойчивости к антибиотикам в микробиоме человека. Тем не менее, необходимо подтверждение пробиотических свойств выделенных из кефирных грибков штаммов лактобацилл в in vivo экспериментах.
Исследование выполнено при частичной финансовой поддержке РФФИ и НИФ в рамках научного проекта № 19-54-60002 и в рамках НИР по Госзаданию (шифр темы 0578-2019-0023).
Список литературы
Turkmen N., Akal C., Özer B. // J. Funct. Foods. 2019. V. 53. P. 62–75.
German J.B., Zivkovic A.M., Dallas D.C., Smilowitz J.T. // Annu. Rev. Food Sci. Technol. 2011. V. 2. № 1. P. 97–123.
Kwak N.-S., Jukes D.J. // Food Control. 2001. V. 12. № 2. P. 99–107.
Şanlier N., Gökcen B.B., Sezgin A.C. // Crit. Rev. Food Sci. Nutr. 2019. V. 59. № 3. P. 506–527.
Gänzle M.G. // Curr. Opin. Food Sci. 2015. V. 2. P. 106–117.
Rozhkova I.V., Moiseenko K. V., Glazunova O.A., Begunova A.V., Fedorova T.V. // Food Science and Technology / Ed. O.A. Ijabadeniyi Berlin: De Gruyter, 2020. P. 215–234.
Rosa D.D., Dias M.M.S., Grześkowiak Ł.M., Reis S.A., Conceição L.L., Peluzio M. do C.G. // Nutr. Res. Rev. 2017. V. 30. № 1. P. 82–96.
Plessas S., Nouska C., Mantzourani I., Kourkoutas Y., Alexopoulos A., Bezirtzoglou E. // Fermentation. 2016. V. 3. № 1. P. 1.
Nielsen B., Gürakan G.C., Ünlü G. // Probiotics Antimicrob. Proteins. 2014. V. 6. № 3–4. P. 123–135.
Leite A.M.O., Miguel M.A.L., Peixoto R.S., Ruas-Madiedo P., Paschoalin V.M.F., Mayo B., Delgado S. // J. Dairy Sci. 2015. V. 98. № 6. P. 3622–3632.
Технологическая инструкция по приготовлению и применению заквасок и бактериальных концентратов для кисломолочных продуктов. Москва, 2004. С. 56.
Dasen G., Smutny J., Teuber M., Meile L. // Syst. Appl. Microbiol. 1998. V. 21. № 2. P. 251–259.
ГОСТ 33951-2016 Молоко и молочная продукция. Методы определения молочнокислых микроорганизмов. Москва: Стандартинформ, 2016. P. 15.
Adler-Nissen J. // J. Agric. Food Chem. 1979. V. 27. № 6. P. 1256–1262.
Торкова А.А., Рязанцева К.А., Агаркова Е.Ю., Кручинин А.Г., Центалович М.Ю., Фёдорова Т.В. // Прикл. биохимия и микробиология. 2017. Т. 53. № 6. С. 580–591.
Zielińska D., Kolozyn-Krajewska D., Laranjo M. // Biomed Res. Int. 2018. V. 2018. P. 5063185.
Mantzourani I., Chondrou P., Bontsidis C., Karolidou K., Terpou A., Alexopoulos A., Bezirtzoglou E., Galanis A., Plessas S. // Ann. Microbiol. Annals of Microbiology, 2019. V. 69. № 7. P. 751–763.
Koroleva N.S. // Therapeutic properties of fermented milks / Ed. R.K. Robinson. London: Elsevier Applied Science, 1991. P. 159–179.
Zheng J., Wittouck S., Salvetti E., Franz C.M.A.P., Harris H.M.B., Mattarelli P., O’Toole P.W., Pot B., Vandamme P., Walter J., Watanabe K., Wuyts S., Felis G.E., Gänzle M.G., Lebeer S. // Int. J. Syst. EV. Microbiol. 2020. V. 70. № 4. P. 2782–2858.
Фёдорова Т.В., Васина Д.В., Бегунова А.В., Рожкова И.В., Раскошная Т.А., Габриэлян Н.И. // Прикл. Биохимия и Микробиология. 2018. Т. 54. № 3. С. 264–276.
Molinero N., Ruiz L., Sánchez B., Margolles A., Delgado S. // Front. Physiol. 2019. V. 10. P. 10:185.
Braune A., Blaut M. // Gut Microbes. 2016. V. 7. № 3. P. 216–234.
Marco M.L., Heeney D., Binda S., Cifelli C.J., Cotter P.D., Foligné B., Gänzle M., Kort R., Pasin G., Pihlanto A., Smid E.J., Hutkins R. // Curr. Opin. Biotechnol. 2017. V. 44. P. 94–102.
Sharma P., Tomar S.K., Goswami P., Sangwan V., Singh R. // Food Res. Int. 2014. V. 57. P. 176–195.
Roberts M.C. // FEMS Microbiol. Lett. 2005. V. 245. № 2. P. 195–203.
Roberts M.C. // FEMS Microbiol. Lett. 2008. V. 282. № 2. P. 147–159.
Mathur S., Singh R. // Int. J. Food Microbiol. 2005. V. 105. № 3. P. 281–295.
Ammor M.S., Belén Flórez A., Mayo B. // Food Microbiol. 2007. V. 24. № 6. P. 559–570.
Sarmadi B.H., Ismail A. // Peptides. 2010. V. 31. № 10. P. 1949–1956.
Pihlanto A. // Int. Dairy J. 2006. V. 16. № 11. P. 1306–1314.
Udenigwe C.C., Aluko R.E. // J. Food Sci. 2012. V. 77. № 1. P. R11–R24.
Ramesh V., Kumar R., Singh R.R.B., Kaushik J.K., Mann B. // Dairy Sci. Technol. 2012. V. 92. № 2. P. 179–188.
Virtanen T., Pihlanto A., Akkanen S., Korhonen H. // J. Appl. Microbiol. 2007. V. 102. № 1. P. 106–115.
Begunova A. V., Savinova O.S., Glazunova O.A., Moiseenko K. V., Rozhkova I. V., Fedorova T. V. // Foods. 2021. V. 10. № 1. P. 17.
Kanbak G., Uzuner K., Kuşat Ol K., Oğlakçı A., Kartkaya K., Şentürk H. // Clin. Exp. Hypertens. 2014. V. 36. № 1. P. 1–8.
Rojo-Bezares B., Sáenz Y., Poeta P., Zarazaga M., Ruiz-Larrea F., Torres C. // Int. J. Food Microbiol. 2006. V. 111. № 3. P. 234–240.
Klare I., Konstabel C., Werner G., Huys G., Vankerckhoven V., Kahlmeter G., Hildebrandt B., Müller-Bertling S., Witte W., Goossens H. // J. Antimicrob. Chemother. 2007. V. 59. № 5. P. 900–912.
Clermont D., Chesneau O., De Cespédès G., Horaud T. // Antimicrob. Agents Chemother. 1997. V. 41. № 1. P. 112–116.
Barbosa T.M., Scott K.P., Flint H.J. // Environ. Microbiol. 1999. V. 1 № 1. P. 53–64.
Gevers D., Danielsen M., Huys G., Swings J. // Appl. Environ. Microbiol. 2003. V. 69. № 2. P. 1270–1275.
Hummel A., Holzapfel W.H., Franz C.M.A.P. // Syst. Appl. Microbiol. 2007. V. 30. № 1. P. 1–7.
Rizzotti L., Simeoni D., Cocconcelli P., Gazzola S., Dellaglio F., Torriani S. // J. Food Prot. 2005. V. 68. № 5. P. 955–965.
Roberts M.C., Chung W.O., Roe D., Xia M., Marquez C., Borthagaray G., Whittington W.L., Holmes K.K. // Antimicrob. Agents Chemother. 1999. V. 43. № 6. P. 1367–1372.
Woodbury R.L., Klammer K.A., Xiong Y., Bailiff T., Glennen A., Bartkus J.M., Lynfield R., Van Beneden C., Beall B.W. // Antimicrob. Agents Chemother. 2008. V. 52. № 3. P. 1140–1143.
Luna V.A., Cousin S. J., Whittington W.L.H., Roberts M.C. // Antimicrob. Agents Chemother. 2000. V. 44. № 9. P. 2503–2506.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология