Прикладная биохимия и микробиология, 2021, T. 57, № 4, стр. 374-379
Влияние иммобилизации микромицета Aspergillus ochraceus ВКМ-F4104D на полимерных носителях на образование фибринолитической протеазы-активатора протеина c плазмы крови
С. К. Комаревцев 1, 2, С. Н. Тиморшина 1, М. Р. Леонтьева 1, С.В. Шабунин 2, Е.С. Лобакова 1, А. А. Осмоловский 1, 2, *
1 Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
2 Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии
394087 Воронеж, Россия
* E-mail: aosmol@mail.ru
Поступила в редакцию 21.10.2020
После доработки 01.12.2020
Принята к публикации 22.12.2020
Аннотация
Проведен поиск среди наиболее известных полимеров (альгинат, каррагинан и акриламид) для использования в качестве носителей клеток мицелия Aspergillus ochraceus ВКМ-F4104D – продуцента фибринолитической протеазы-активатора протеина С плазмы крови человека при его г-лубинном культивировании. Показны морфо-цитологические особенности развития мицелия A. ochraceus ВКМ-F4104D в гранулах каррагинана и альгината кальция. Оптимизированы условия культивирования микромицета, иммобилизованного в гранулах 3.5%-ного альгината кальция. Показано, что иммобилизованные клетки мицелия продуцента имели повышенную стабильность и были способны синтезировать протеазу-активатор протеина С плазмы крови на максимальном уровне в течение 10 сут и более. Кроме того, иммобилизованные клетки мицелия при культивировании могли быть использованы многократно (до 5 циклов).
Протеин С плазмы крови представляет собой один из важных антикоагулянтных факторов, который подавляет образование тромбина, стимулирует фибринолиз и также обладает свойствами цитопротекторной сигнальной молекулы [1–3]. Он образуется в печени в виде неактивного одноцепочечного предшественника и переходит в двуцепочечную активную форму в процессе ограниченного протеолиза. В физиологических условиях это достаточно сложный процесс, проходящий на поверхности эндотелиальных клеток, в который вовлечены тромбин и два мембранных рецептора – тромбомодулин и эндотелиальный рецептор протеина С (EPCR) [4, 5]. В современной медицине и диагностике активно используются активаторы протеина С, способные напрямую превращать протеин С из предшественника в активную форму [6, 7]. В состав наиболее распространенных препаратов такого типа действия входят активаторы протеина С из яда змей, в частности южноамериканского медноголового щитомординика Agkistrodon contortrix contortrix [8, 9].
Ранее было показано, что секретируемая внеклеточная протеаза, образуемая штаммом микромицета Aspergillus ochraceus ВКМ-F4104D, способна активировать протеин С из неактивного предшественника [10–12]. Изучение свойств этой протеазы показало ее сходство с активатором протеина С из яда Agkistrodon c. contortrix, в частности, по способности к гидролизу специфичных хромогенных субстратов, оптимуму рН и температурной стабильности, а также чувствительности к ряду ингибиторов [13, 14]. Способность микромицетов к культивированию на простых питательных средах позволяет рассматривать протеазу, образуемую микромицетом A. ochraceus, в качестве доступного аналога активатора протеина С из яда Agk. contortrix, перспективного для использования в диагностических, медицинских и ветеринарных целях [15, 16].
Иммобилизация клеток микроорганизмов в гранулах различных полимерных носителей широко используется в современной биотехнологии [17]. Она позволяет существенно повысить эффективность процесса ферментации за счет увеличения стабильности продуцента и возможности его использования в нескольких циклах культивирования, а также облегчения разделения культуральной жидкости и биомассы [18, 19]. Среди наиболее популярных полимерных носителей, используемых для иммобилизации, можно выделить альгинат кальция, каррагинан и полиакриламид, которые обладают хорошими механическими и адсорбционными свойствами, не требуют сложных технологических процессов при использовании и имеют невысокую стоимость [20, 21].
Цель работы – исследование влияния иммобилизации микромицета A. ochraceus ВКМ-F4104D на полимерных носителях на образование фибринолитической протеазы-активатора протеина С плазмы крови человека.
МЕТОДИКА
Объект исследования. Использовали изученный ранее [15] штамм микромицета A. ochraceus ВКМ F-4104D, продуцирующий протеазу-активатор протеина С. Для получения посевного материала микромицет выращивали в пробирках на скошенном сусло-агаре (3°Б) в течение 7 сут при 28°С.
Иммобилизация A. ochraceus ВКМ F-4104D. Для иммобилизации клеток использовали акриламид, альгинат кальция и каррагинан. С поверхности культуры микромицета делали смыв спор стерильной водой, содержащей 0.0001% Твин-80, после чего споры смешивали с растворами иммобилизующих агентов. Полимеризацию акриламида (4%) проводили добавлением персульфата аммония и тетраметилэтилендиамина, после чего полученный гель разрезали скальпелем на кубики размером ребра около 3–5 мм и промывали стерильной водой.
Смеси суспензии спор с растворами альгината (2.5–5.5%) и каррагинана (3%) по каплям добавляли к охлажденным растворам 0.3 М CaCl2 и 2%-ного KCl соответственно, инкубировали в течение 8 ч при 4°С для формирования гранул, после чего промывали стерильной водой. Полученные гранулы иммобилизованных спор A. ochraceus ВКМ F-4104D вносили в питательную среду для дальнейшего культивирования.
Глубинное культивирование A. ochraceus ВКМ F-4104D. Культивирование микромицета проводили в две последовательные стадии по ранее описанной схеме [15]. На предварительной стадии смыв спор микромицета с агаризованной среды вносили в посевную среду следующего состава (%): сусло – 6.7, глюкоза – 1, пептон – 0.1, рН 5.5–6.0, и выращивали в течение 2 сут. Часть биомассы переносили в ферментационную среду (%): глюкоза – 3.5, гидролизат рыбной муки – 1, NaCl – 0.2, крахмал – 0.125, пептон – 0.1, KH2PO4 – 0.05, MgSO4 – 0.05, рН 5.5–6.0, для проведения основной стадии культивирования, во время которой происходит наработка протеазы-активатора протеина С. Выращивание проводили в качалочных колбах объемом 750 мл, содержащих 100 мл питательной среды, при температуре 28°С в шейкере-инкубаторе Biosan ES 20/60 (“Biosan”, Латвия) при 200 об./мин.
Подбор оптимальных условий для иммобилизации. Для выбора наиболее подходящего носителя проводили культивирование иммобилизованного A. ochraceus ВКМ F-4104D в 4.0%-ном полиакриламиде (акриламид – 3.9%, метиленбисакриламид – 0.1%), 3.5%-ном альгинате и 3.0%-ном каррагинане [17–21], культивировали в ферментационной среде с предварительным выращиванием в течение 2 сут в посевной среде с иммобилизованным носителем (вариант 1) и без него (вариант 2). Оценивали активность и динамику образования протеазы-активатора протеина С в культуральной жидкости в процессе культивирования. Для подбора оптимальной концентрации носителя, показавшего лучшие результаты, его концентрацию меняли в пределах от 2.5 до 5.5% с шагом в 1%. Культивирование проводили в качалочных колбах емкостью 750 мл, со 100 мл питательной среды и суммарным объемом гранул иммобилизующего носителя 25 мл при температуре 28°С, на орбитальной качалке при 200 об./мин.
Полунепрерывное культивирование иммобилизованного A. ochraceus ВКМ F-4104D. Выращивание проводили, используя подобранные в ходе работы оптимальные параметры. После достижения максимальной активности протеазы-активатора протеина С в культуральной жидкости проводили замену питательной среды на свежую и продолжали культивирование.
Определение протеолитической активности. Ферментативную активность протеазы-активатора протеина С определяли по реакции специфического расщепления бесцветного хромогенного пептидного субстрата п-нитроанилида тозил-глицил-пролил-аргинина (Tos-Gly-Pro-Arg-pNA), сопровождающегося накоплением окрашенного в желтый цвет свободного п-нитроанилина, как было описано ранее [10]. Измерение оптической плотности проводили при 405 нм на спектрофотометре “Eppendorf BioSpectrometer” (Германия). За единицу активности (E) принимали количество мкмоль п-нитроанилина, образовавшегося в результате гидролиза субстрата за 1 мин в 1 мл культуральной жидкости.
Световая и сканирующая электронная микроскопия. Для изучения влияния иммобилизации A. ochraceus ВКМ F-4104D на полимерных носителях на морфологию мицелия на 4 сут культивирования, в период максимальной продукции протеазы-активатора протеина С, отбирали гранулы полимеров, содержащий гифы микромицета.
Световую микроскопию проводили непосредственно изучая поверхность гранул с помощью микроскопа Микромед-1 (“ЛОМО”, Россия), оснащенного камерой UCMOS05100KPA (“Toupcam”, Китай). Для цифровой визуализации и обработки изображения использовали программу TopView.
Для сканирующей электронной микроскопии гранулы фиксировали 2.5%-ным раствором глутарового альдегида в 0.1 М фосфатном буфере (рН 7.3) в течение 12 ч и обезвоживали в растворах этанола возрастающей концентрации (30–96%). После окончательной дегидратации в абсолютном этаноле гранулы выдерживали 12 ч в ацетоне и высушивали на установке HCP-2 (“Hitachi”, Япония). Далее образцы гранул напыляли смесью металлов Au-Pd Eiko IB-3 Ion Coater (“Hitachi”, Япония) и исследовали с помощью сканирующего электронного микроскопа JSM-6380LA (“Jeol”, Япония), при ускоряющем напряжении 15 кВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате иммобилизации микромицета A. ochraceus ВКМ F-4104D в 4.0%-ном полиакриламиде, 3.5%-ном альгинате кальция и 3.0%‑ном каррагинане были получены однородные гранулы с размером около 3–5 мм (рис. 1а, 1б). Гранулы были охарактеризованы как механически устойчивые, не склонные к агрегации или распаду в процессе культивирования и подготовительных к нему манипуляций. При этом во всех использованных полимерных материалах при наблюдении под микроскопом отмечали проникновение мицелия в полимерный носитель, сопровождающееся ростом мицелия как внутри, так и на поверхности гранул носителя (рис. 1) без образования флоккул в среде, характерного для роста не иммобилизованной культуры.
Рис. 1.
Гранулы полимерных носителей каррагинана (а) и альгината (б) без мицелия (1) и с иммобилизованным мицелием A. ochraceus (2) и гифы тонкого (двойные стрелки) и толстого (одиночные стрелки) мицелия на поверхности гранул альгината (в); масштабный отрезок на фрагментах 1а и 1б – 5 мм, на фрагменте 1в – 20 мкм.

Морфо-цитологические особенности иммобилизованного A. ochraceus ВКМ F-4104D изучали при помощи СЭМ (рис. 2а–2е). Микроскопию проводили для вариантов микромицета, иммобилизованного в альгинате кальция и каррагинане без предварительного культивирования в посевной среде (вариант 2). Как видно на рис. 2а и 2г, наиболее плотный слой иммобилизованного мицелия продуцента располагался на поверхности гранул и имел ширину около 200 мкм. При иммобилизации в обоих типах полимерных носителей развивались гифы микромицета различной толщины, которая внутри гранул составляла около 4 мкм (рис. 1в, рис. 2в и 2е), а на поверхности наблюдали образование как тонких гиф диаметром 2.0–3.0 мкм, так и толстых гиф диаметром 7.0–7.5 мкм (рис. 2б и 2д). Такая особенность мицелия оказалась характерной для A. ochraceus ВКМ F-4104D, иммобилизованного в гранулах как альгината кальция, так и каррагинана. Однако только при иммобилизации в альгинате кальция микромицет образовывал в условиях глубинного культивирования малиново-бордовый пигмент, характерный для продуцента при росте без иммобилизации, что подтверждало наличие физиологических различий при иммобилизации A. ochraceus ВКМ F-4104D в разных типах полимерных носителей.
Рис. 2.
Сканирующая электронная микроскопия гранул альгината (а–в) и каррагинана (г–е) с иммобилизированным мицелием A. ochraceus ВКМ F-4104D: наружный мицелий (а, г), поверхность гранул (б, д) и мицелий, включенный в гранулы (в, е) (одиночными стрелками обозначены толстые гифы, двойными – тонкие).

В табл. 1 приведены результаты экспериментов по выбору оптимального полимерного носителя для иммобилизации и условий культивирования микромицета A. ochraceus ВКМ F-4104D. Наибольшую активность протеазы-активатора протеина С по сравнению с контролем со свободными клетками наблюдали при иммобилизации спор продуцента в гранулах альгината кальция. При этом максимальный выход целевого продукта был получен при культивировании иммобилизованного продуцента в ферментационной среде без предварительного выращивания продуцента в посевной среде (вариант № 2). Активность протеазы при иммобилизации микромицета в гранулах каррагинана была также достаточно высокой, однако ниже, чем при иммобилизации в гранулах альгината кальция. При иммобилизации микромицета в гранулах полиакриламида активность протеазы-активатора протеина С была существенно ниже как по сравнению с контролем, так и другими носителями. Таким образом, для дальнейших экспериментов в качестве носителя был выбран альгинат кальция с оптимальным режимом культивирования в ферментационной среде (вариант № 2).
Таблица 1.
Образование фермента при иммобилизации микромицета A. ochraceus ВКМ F-4104D на различных носителях
| Носитель для иммобилизации | Максимальная протеолитическая активность при различных вариантах культивирования, E/мл × 10–3 | |
|---|---|---|
| вариант 1 | вариант 2 | |
| Альгинат | 71 | 139 |
| Каррагинан | 24 | 124 |
| Полиакриламид | 12 | 2 |
| Без иммобилизации | 118 | нет данных |
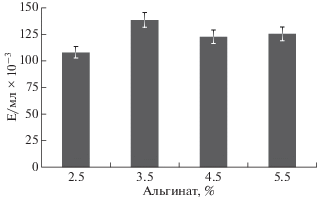
Для выбора оптимальной концентрации альгината кальция для иммобилизации и выхода фермента измеряли активность протеазы-активатора протеина С во время культивирования микромицета с концентрациями гранул альгината кальция от 2.5 до 5.5%. Как видно на рис. 3, разброс значений активности протеазы-активатора протеина С в исследуемом диапазоне концентраций альгината оказался небольшим − 110–130 Е/мл × 10–3. Наивысшее значение наблюдали при концентрации альгината кальция 3.5% (145 Е/мл × 10–3). Для проведения дальнейших экспериментов по изучению динамики образования протеиназы при полунепрерывном культивировании использовали эту концентрацию носителя. Полученные результаты хорошо согласовывались с данными литературы, согласно которым оптимальная концентрация альгината кальция для иммобилизации клеток микроорганизмов находится в диапазоне от 2.0 до 5.0% [17–21].
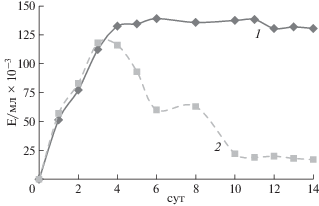
На рис. 4 приведена динамика образования протеазы-активатора протеина С при глубинном культивировании иммобилизованного в альгинате кальция и свободнорастущего микромицета A. ochraceus ВКМ F-4104D в течение 14 сут. Показано, что активность фермента достигла своего максимального значения на 3–4 сут культивирования при выращивании продуцента без носителя, после чего снижалась в 2 раза на 6–7 сут и в 4 раза – на 10 сут. В тоже время при культивировании иммобилизованного микромицета максимальный уровень активности фермента также наблюдали на 4 сут культивирования, а затем этот уровень активности практически не изменялся в течение последующих 10 сут, что свидетельствовало о более стабильном синтезе целевого продукта иммобилизованным продуцентом по сравнению со свободно растущим.
Рис. 3.
Зависимость максимальной активности протеазы-активатора протеина С от концентрации альгината кальция при иммобилизации.
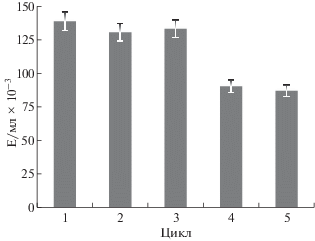
Для исследования возможности многократного использования иммобилизованного в альгинате кальция микромицета в биотехнологических процессах было проведено пять циклов полунепрерывного культивирования A. ochraceus ВКМ F-4104D с заменой питательной среды на свежую перед каждым циклом. Активности целевого фермента в культуральной жидкости, полученные в процессе такого культивирования, показаны на рис. 5. Наибольшую активность наблюдали в первых трех циклах выращивания, после чего наблюдали снижение выхода активности примерно на треть по сравнению с первоначальными значениями. Полученные результаты показали возможность многократного повторения культивирования иммобилизованного в альгинате кальция микромицета A. ochraceus ВКМ F-4104D для получения протеазы-активатора протеина С.
Рис. 4.
Динамика образования протеазы-активатора протеина С при глубинном культивировании микромицета A. ochraceus ВКМ F-4104D, иммобилизованного в альгинате кальция (1) и без иммобилизации (2).
Таким образом, установлено, что иммобилизация микромицета A. ochraceus ВКМ F-4104D на полимерных носителях увеличивала время образования фибринолитической протеазы-активатора протеина С плазмы крови, повышала стабильность продуцента и позволяла многократно использовать в процессе полунепрерывного культивирования.
Работа выполнена при финансовой поддержке Российского научного фонда в рамках грантового соглашения № 20-16-00085.
Рис. 5.
Образование протеазы-активатора протеина С в нескольких циклах полунепрерывного культивирования микромицета A. ochraceus ВКМ F-4104D, иммобилизованного в альгинате кальция.
СЭМ-микроскопию проводили в ЦКП УНО “Электронная микроскопия в науках о жизни” Московского государственного университета им. М.В. Ломоносова.
Список литературы
Griffin J.H., Zlokovic B.V., Mosnier L.O. // Blood. 2018. V. 132. № 2. P. 159–169.
Bouwens E.A., Stavenuiter F., Mosnier L.O. // J. Thromb. Haemost. 2013. V. 11. № 1. P. 242–253.
Струкова С.М. // Биохимия. 2004. Т. 69. № 10. С. 1314–1331.
Chen K., Stafford A.R., Wu C., Yeh C., Kim P.Y., Fredenburgh J.C., Weitz J.I. // Biochemistry. 2017. V. 56. № 24. P. 3119–3128.
Griffin J.H., Fernandez J.A., Gale A.J., Mosnier L.O. // J. Thromb. Haemost. 2007. V. 5. № 1. P. 73–80.
Mohammed S., Favaloro E.J. // Methods Mol. Biol. 2017. V. 1646. № 10. P. 137–143.
Barranco-Medina S., Murphy M., Pelc L., Chen Z., Di Cera E., Pozzi N. // Sci. Rep. 2017. V. 7. № 44596. P. 1–8.
Asmat A., Ramzan F. // Protein Pept. Lett. 2018. V. 25. № 7. P. 643–651.
Gempeler-Messina P.M., Müller C. // Toxin Rev. 2006. V. 25. № 4. P. 335–349.
Осмоловский А.А., Крейер В.Г., Кураков А.В., Баранова Н.А., Егоров Н.С. // Прикл. биохимия и микробиология. 2012. Т. 48. № 5. С. 537–542.
Осмоловский А.А., Звонарева Е.С., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Биоорганическая химия. 2014. Т. 40. № 6. С. 688–694.
Пaтeнт PФ. 2011. № 2460772.
Осмоловский А.А., Крейер В.Г., Баранова Н.А., Кураков А.В., Егоров Н.С. // Прикл. биохимия и микробиология. 2015. Т. 51. № 1. С. 86–92.
Осмоловский А.А., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Прикл. биохимия и микробиология. 2017. Т. 53. № 4. С. 373–379.
Осмоловский А.А., Крейер В.Г., Баранова Н.А., Кураков А.В., Егоров Н.С. // Прикл. биохимия и микробиология. 2013. Т. 49. № 6. С. 580–586.
Осмоловский А.А., Орехова А.В., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Биомедицинская химия. 2018. Т. 64. № 1. С. 115–118.
Guisan J.M. Immobilization of Enzymes and Cells: Third Ed. N.Y.: Humana Press, 2013. 377 p.
Zhang Y., Li X., Zhang C., Yu X., Huang F., Huang S., Li L., Liu S. // World J. Microbiol. Biotechnol. 2017. V. 33. № 176. P. 1–7.
Chattergee S. // J. Adv. Pharm. Technol. Res. 2015. V. 6. № 1. P. 2–6.
Yewale T., Panchwagh S., Rajagopalan S., Dhamole P.B., Jain R. // 3 Biotech. 2016. V. 6. № 75. P. 1–10.
Mostafa Y.S., Alamri S.A. // Saudi J. Biol. Sci. 2012. V. 19. № 2. P. 241–246.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


