Прикладная биохимия и микробиология, 2021, T. 57, № 3, стр. 245-250
Реконструкция HYDSL гидрогеназы Thiocapsa roseopersicina BBS после ингибирования цианидом
Н. А. Зорин 1, А. Н. Хуснутдинова 1, А. С. Стародубов 1, И. И. Проскуряков 1, А. А. Цыганков 1, *
1 Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение, Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”
142290 Московская обл., Пущино, Россия
* E-mail: ttt@issp.serpukhov.su
Поступила в редакцию 06.10.2020
После доработки 27.11.2020
Принята к публикации 22.12.2020
Аннотация
В работе показано, что после длительной обработки цианидом каталитический центр HydSL гидрогеназы Thiocapsa roseopersicina остается активным. Обнаружено, что при инкубации гидрогеназы, обработанной цианидом, в присутствии бета-меркаптоэтанола, трехвалентного железа и сульфида натрия активность гидрогеназы в реакции окисления водорода в присутствии метилвиологена восстанавливалась. Процесс реконструкции активности зависел от времени и достигал максимального значения (~60%) в течение 30 мин при комнатной температуре. При этом в спектре поглощения гидрогеназы появлялась полоса поглощения при 420 нм, присутствующая в нативной гидрогеназе и исчезающая после обработки цианидом, что свидетельствовало о реконструкции железосерных кластеров. Таким образом, вместо выращивания бактерий в присутствии изотопа железа можно замещать 56Fe на 57Fe в выделенном ферменте, что позволит использовать значительно меньшие количества 57Fe.
Гидрогеназами называют большую группу металлоферментов, катализирующих обратимую реакцию восстановления протонов до молекулярного водорода.
Различают три группы гидрогеназ по содержанию металлов в активном центре: NiFe-гидрогеназы, содержащие биметаллический железо-никелевый активный центр, FeFe-гидрогеназы, содержащие двухатомный кластер железа в активном центре и Fe-гидрогеназы, не содержащие металлов в белковой глобуле, но включающие Fe-содержащий кофактор [1–3]. Для изученных NiFe-гидрогеназ показано, что биметаллический кластер активного центра ковалентно связан с белком четырьмя остатками цистеина, два из которых образуют связывающий мостик между ионами Ni и Fe, а два других координируют ион Ni. Атом железа в составе активного центра связан с тремя небелковыми двухатомными лигандами (одним СО-лигандом и двумя CN–-лигандами) [1].
Термостабильная гидрогеназа HydSL из пурпурной серной бактерии Thiocapsa roseopersicina BBS (КФ: 1.12.99.6) относится к 1 группе, e подгруппе NiFe-гидрогеназ [3] и состоит из двух субъединиц с молекулярной массой 64 и 34 kDa. NiFe-активный центр находится в большой субъединице (HydL) [1, 5], причем, как и у других NiFe-гидрогеназ содержит двухатомные СО и СN-лиганды [7]. Малая субъединица (HydS) содержит три FeS-кластера, которые образуют транспортную систему для внутримолекулярного переноса электронов между активным центром и поверхностью фермента. На основании анализа консервативных участков гидрогеназ подгруппы 1е был сделан вывод, что эти гидрогеназы содержат два 4Fe4S кластера (проксимальный и дистальный относительно активного центра) и 3Fe4S в качестве медианного кластера [1, 3]. Исследования FeS-кластеров у гидрогеназы Aquifex aeolicus, относящейся к 1е подгруппе, также подтвердило наличие именно этих кластеров [6], причем с помощью мессбауэровской спектроскопии обнаружено необычное [4Fe4S]3+ состояние проксимального кластера.
Для HydSL гидрогеназы Thiocapsa roseopersicina таких работ не проводилось, хотя это могло бы дать существенную информацию о редокс состояниях FeS-кластеров при переносе электрона в процессе поглощения водорода. Использование мессбауэровской спектроскопии или ядерно-резонансной колебательной спектроскопии [7] для анализа редокс-состояний требует наличия в кластере изотопа 57Fe. Для получения гидрогеназы с таким изотопом железа необходимо выращивание большого количества биомассы в присутствии только этого изотопа железа. Представляется перспективным поиск специфического ингибитора, разрушающего FeS-кластеры с последующей их реконструкцией в присутствии 57Fe. Такой подход, в случае его реализации, является более экономичным с точки зрения использования 57Fe.
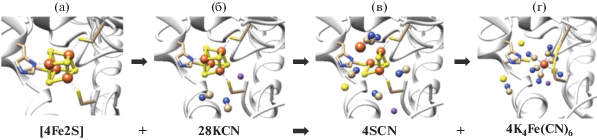
Известны ингибиторы, разрушающие FeS-кластеры. В частности, показано, что продолжительное инкубирование гидрогеназы T. roseopersicina с цианидом вызывает потерю активности фермента в реакции поглощения водорода с метилвиологеном в качестве акцептора [8]. Это сопровождается разрушением железо-серных кластеров, и появлением в растворе ферроцианида. В качестве примера можно привести иллюстрацию разрушения 4Fe4S кластера под действием цианида (рис. 1). В то же время после обработки цианидом каталитический железо-никелевый центр по-прежнему содержит CO и CN--лиганды [8]. Однако данные о каталитической активности активного центра после такого воздействия отсутствуют.
Рис. 1.
Гипотетическая схема разрушения 4Fe4S кластера при действии цианида. (а) – нативный 4Fe4S кластер (на основе кластера из Ralstonia eutropha, pdb ID: 5MDJ); (б) – в присутствии цианида; (в) – частичное разрушение FeS кластера с образованием Fe(CN)2 и SCN. (г) – полное разрушение кластера с образованием феррицианида и дисульфидных связей цистеинов. Рисунок сделан с использованием пакета программ CHIMERA.
Реконструкция FeS-кластеров в различных белках после их разрушения возможна. Например, для ферредоксина показана возможность практически полного восстановления спектральных характеристик, функций и нативной структуры после их обработки соединениями ртути [9].
Цель работы − выявление каталитической активности NiFe -центра и подбор условий для реконструкции FeS-кластеров после длительной обработки гидрогеназы HydSL цианидом.
МЕТОДИКА
В работе использовали тяжелую воду (99.9% D2O), цианид калия, метилвиологен и реактивы для электрофореза в ПААГ фирмы “Sigma-Aldrich” (США), фенилсефарозу CL-4B фирмы “Pharmacia” (Швеция), ДЭАЭ-целлюлозу DE52 фирмы “Whatman” (Англия), и дитионит натрия фирмы “Fluka” (Швейцария). Остальные реактивы – отечественного производства марок х. ч. и ос. ч.
Клетки пурпурной серной бактерии T. roseopersicina BBS выращивали в анаэробных фотогетеротрофных условиях на модифицированной среде Пфеннига [10] в присутствии 0.2% ацетата натрия при 28°С и освещении лампами накаливания (~50 Вт м–2).
Получение экстрактов клеток и очистка гидрогеназы. Для получения бесклеточных экстрактов клетки, отобранные в конце экспоненциальной фазы роста, отделяли от культуральной жидкости на проточной центрифуге. Выделение гидрогеназы проводили как описано ранее [8]. В процедуру выделения входило разрушение клеток, обработка ацетоном, фракционирование сульфатом аммония, жидкостная хроматография на колонках с фенилсефарозой CL-4B и ДЭАЭ-целлюлозой DE52, а также препаративный электрофорез.
Определение гидрогеназной активности. Активность гидрогеназы определяли по реакции восстановления окисленного метилвиологена водородом в кювете Тунберга спектрофотометрическим методом [8]. Реакционная смесь (общий объем 2 мл) содержала: 50 мМ Трис-HCl буфер, рН 9.0, 4 мМ метилвиологен и 1–10 мкг гидрогеназы. Кювету заполняли водородом, иногда для инициирования реакции добавляли следовые количества (5–10 мкл) 20 мМ раствора дитионита натрия, приготовленного в анаэробных условиях. Все измерения активности фермента проводили при температуре 30°С. Для расчета активности использовали коэффициент экстинкции восстановленного метилвиологена ε600 = 13.00 мМ–1 · см–1. Ферментативную активность выражали в мкмоль Н2/мин на 1 мг белка.
Активность гидрогеназы в реакции изотопного обмена водорода в системе Н2/D2O регистрировали на изотопном масс-спектрометре Delta V Advantage (“Thermo Fisher”, Германия) по образованию HD. Реакцию проводили в сосуде объемом 14 мл, содержащем 1 мл жидкой фазы − 0.8 мл 50 мМ К-фосфатного буфера, рН 7.0, 0.2 мл D2O и 10 мкл 20 мМ раствора дитионита натрия. Газовая фаза содержала 2% H2 в гелии. Сосуд был соединен с масс-спектрометром отрезком вакуумного шланга с двумя стопорами. Отрезок шланга между стопорами служил пробоотборником. Реакцию проводили при комнатной температуре (22°С), начинали введением в сосуд 2 мкг гидрогеназы. Каждые 3 мин отбирали пробу (300 мкл) газовой фазы и вводили в масс-спектрометр, измеряя сигнал HD. В качестве контроля служил такой же сосуд с D2O и всеми компонентами реакционной смеси и газовой фазы за исключением гидрогеназы.
Ингибирование гидрогеназы цианидом и реконструкция FeS-кластеров. Для обработки гидрогеназы ингибитором использовали свежеприготовленный раствор 1.0 М KCN, который добавляли до концентрации 50 мМ. Инкубацию фермента с ингибитором проводили, при комнатной температуре до достижения ~95% падения активности, аналогично описанному ранее [8]. Фермент отмывали от цианида трехкратно 20 мМ K-фосфатным буфером, pH 7.0, с использованием микроконцентраторов Amicon “Microcon-10” (“Merk”, международная группа компаний, зарегистрирована и в России https://www.merckgroup.com/ru-ru). Далее измеряли остаточную активность гидрогеназы и проводили реконструкцию FeS-кластеров согласно методу, аналогичному описанному ранее [11] со следующими особенностями. К раствору фермента в анаэробных условиях добавляли бета-меркаптоэтанол до концентрации 0.5%. Через 10 мин добавляли раствор 30 мМ FeCl3 в воде до концентрации 0.15 мМ. Через 5 мин после добавления FeCl3 добавляли 30 мМ раствор Na2S в воде до концентрации 0.15 мМ. Смесь фермента с добавками инкубировали при комнатной температуре и через определенные промежутки времени отбирали аликвоты раствора (5 мкл) для определения гидрогеназной активности.
Регистрация спектров поглощения препаратов гидрогеназы. Для контроля разрушения и восстановления FeS-кластеров регистрировали спектры поглощения до и после обработки препаратов гидрогеназы цианидом, а также после инкубации в растворе для реконструкции. Спектры поглощения образцов гидрогеназы в области 350–600 нм измеряли на спектрофотометре “Shimadzu 1600” (Япония) при комнатной температуре.
Статистический и регрессионный анализ проводили с помощью SigmaPlot 12.0. Данные по H/D изотопному обмену усредняли по 150 точкам (скользящий временной интервал 15 с), остальные эксперименты проводили 3–8 раз.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Использование различных ингибиторов широко применяется в энзимологии для изучения механизма действия и структуры ферментов. Цианид является одним из специфичных ингибиторов металлоферментов, включая гидрогеназу. Действие цианида на гидрогеназы имеет сложный характер. Ранее было показано, что цианид ингибирует очищенную гидрогеназу из Azotobacter vinelandii [12]. При этом ингибирование наблюдалось лишь когда фермент был в окисленном состоянии. В восстановленном состоянии гидрогеназа не ингибировалась цианидом. Позднее было обнаружено, что цианид быстро реагирует с гидрогеназами Hyd1 и Hyd2 из Escherichia coli [13], если они находятся в окисленном состоянии. Согласно предложенному механизму ингибирования цианид действует как сильный промотор формирования неактивного состояния Ni-B активного центра ферментов. При этом ингибирование снималось восстановлением гидрогеназ.
Недавно было обнаружено, что при длительном (часы) воздействии этого соединения на HydSL гидрогеназу T. roseopersicina происходит специфичное разрушение FeS-кластеров [8]. После 20 ч инкубации с цианидом остаточная активность гидрогеназы в реакции поглощения водорода с метилвиологеном в качестве акцептора электронов не проявлялась. При этом, согласно результатам ИК-Фурье спектроскопии, CO и CN лиганды в активном центре гидрогеназы сохранялись. Процесс переноса электронов по цепи внутримолекулярных кластеров необходим в случае взаимодействия фермента с акцептором электронов в реакции поглощения водорода или с донором электронов в реакции выделения водорода. Для активации молекулы водорода гидрогеназой перенос электронов через FeS кластеры не требуется [4], причем такая активация может быть обнаружена по реакции обмена в системе Н2/D2O или D2/H2O. Ранее было показано, что HydSL гидрогеназа T. roseopersicina может катализировать реакции изотопного обмена в системе Н2/D2O или D2/H2O [14]. Таким образом, можно предполагать, что гидрогеназа после ингибирования цианидом может осуществлять дейтериевый обмен.
Для проверки этого предположения нативную гидрогеназу и гидрогеназу после ее обработки цианидом инкубировали в растворе D2O в присутствии H2, как описано в Методах исследования с периодическим анализом содержания HD в газовой фазе (рис. 2).
Рис. 2.
Изменение содержания HD в газовой фазе в присутствии нативной гидрогеназы (1), гидрогеназы после инкубации с 50 мМ цианидом калия в течение 24 ч (2), а также в отсутствие фермента (3).
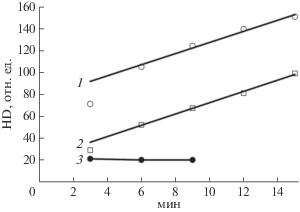
Обнаружено, что в сосудах с нативной (рис. 2, 1) и обработанной цианидом гидрогеназой (рис. 2, 2) содержание HD в газовой фазе возрастало. В то же время в сосуде без гидрогеназы содержание HD в газовой фазе не увеличивалось (рис. 2, 3). Аппроксимацию накопления HD проводили в соответствии с уравнением HD = HD0 + Vt, где HD0 – концентрация HD в нулевой момент времени, V – скорость накопления HD в газовой фазе, t – время. При этом учитывали 4 точки, поскольку первая точка имела заниженное значение вследствие лаг-периода, обусловленного активацией гидрогеназ и диффузионными процессами перехода HD из жидкости в газ. Согласно полученным данным (табл. 1) скорости изменения содержания HD в газовой фазе для нативной и обработанной цианидом гидрогеназ совпадали при высоких коэффициентах корреляции экспериментальных данных и результатов аппроксимации. Таким образом, после обработки цианидом активный центр гидрогеназы не только не терял CO и CN лигандов, но и полностью сохранял свою активность.
Таблица 1.
Результаты аппроксимации накопления HD в присутствии нативной и обработанной цианидом гидрогеназ (рис. 2)
| Параметр уравнения | Нативная гидрогеназа | Гидрогеназа после обработки цианидом |
|---|---|---|
| Коэффициент корреляции, R | 0.9937 | 0.9985 |
| HD0, отн. ед | 76.49 ± 4.47 | 20.68 ± 2.19 |
| V | 5.07 ± 0.406 | 5.15 ± 0.199 |
В литературе описаны попытки восстановления нативной структуры белков после разрушения FeS-кластеров. В одной из первых публикаций описана реконструкция клостридиального ферредоксина из его апобелка, которая приводила к восстановлению 78% исходной активности [9]. В работах по восстановлению структуры кластера FB фотосистемы I, разрушенного при действии соединений ртути, использовали разные комбинации бета-меркаптоэтанола, FeCl3 и сульфида в анаэробных условиях. Авторами показано практически полное восстановление FB кластера [11, 15, 16].
Для восстановления структуры мы также использовали добавление бета-меркаптоэтанола, в качестве восстановителя SH-групп цистеина, FeCl3 и Na2S в качестве структурных элементов FeS-кластеров, однако добавляли их последовательно с промежуточной инкубацией перед каждой следующей добавкой, как описано в Методах исследования. Их совместное действие приводило к восстановлению 60% активности гидрогеназы в реакции поглощения водорода в присутствии восстановленного метилвиологена уже через 30 мин после добавления последнего компонента (рис. 3).
Рис. 3.
Процесс восстановления активности гидрогеназы, инактивированной цианидом, в реакции поглощения водорода в присутствии восстановленного метилвиологена, 0.5% бета-меркаптоэтанола, 0.15 мМ FeCl3 и 0.15 мМ Na2S при комнатной температуре.
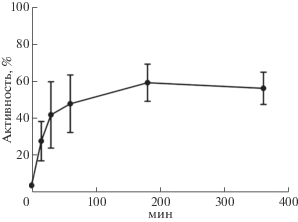
Важно отметить, что в аэробных условиях восстановления гидрогеназной активности не происходило. Как показано в таблице 2 добавление всех этих соединений необходимо для достижения максимальной активности HydSL гидрогеназы T. roseopersicina после ингибирования цианидом. Замена FeCl3 на FeSO4 также приводила к восстановлению гидрогеназной активности, но до меньшего значения (табл. 2). Замена бета-меркаптоэтанола на дитиотрейтол или восстановленный L-цистеин, а также изменение условий инкубации (порядок добавления и время инкубации между добавками восстановителя, железа и сульфида) не приводили к повышению эффективности восстановления активности гидрогеназы (данные не приведены). При более длительной инкубации происходило снижение наблюдаемой активности.
Таблица 2.
Влияние различных добавок на восстановление активности гидрогеназы после ингибирования цианидом
| Реакционная система | Активность, % | Доверительный интервал |
|---|---|---|
| Гидрогеназа нативная | 100 | – |
| Гидрогеназа + KCN | 4 | 2 |
| Гидрогеназа (после ингибирования KCN) + бета-меркаптоэтанол | 4 | 2 |
| Гидрогеназа + бета-меркаптоэтанол + FeCl3 | 6 | 2 |
| Гидрогеназа + бета-меркаптоэтанол + Na2S | 4 | 3 |
| Гидрогеназа + бета-меркаптоэтанол + FeCl3 + Na2S | 60 | 8 |
| Гидрогеназа + бета-меркаптоэтанол + FeSO4 + Na2S | 20 | 5 |
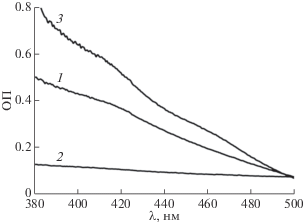
Для подтверждения восстановления структуры FeS кластеров проводили запись оптических спектров нативной гидрогеназы, после ее обработки цианидом и после реконструкции в диапазоне 380–500 нм (рис. 4). Известно, что FeS кластеры поглощают в области 415–422 нм. Нативная гидрогеназа также имеет поглощение в этой области спектра (рис. 4, 1). После обработки цианидом это поглощение исчезало (рис. 4, 2), а после реконструкции поглощение в этой области снова проявлялось (рис. 4, 3).
Рис. 4.
Спектры поглощения нативной гидрогеназы (1), после обработки цианидом и отмывки (2) и после инкубации с бета-меркаптоэтанолом, FeCl3 и Na2S (3).
Механизм восстановления FeS кластеров можно наглядно представить на рис. 5 для 4Fe4S кластера.
Рис. 5.
Гипотетическая схема реконструкции 4Fe4S кластера после разрушения цианидом. (а) – разрушенный 4Fe4S кластер; (б) – присутствие бета-меркаптоэтанола; (в) – разрыв дисульфидных связей; (г) – реконструкция кластера.
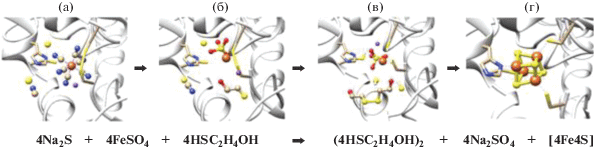
Таким образом, полученные результаты свидетельствуют о том, что активный железоникелевый центр HydSL гидрогеназы не разрушается под действием цианида. Инкубация обработанной цианидом гидрогеназы с бета-меркаптоэтанолом, FeCl3 и Na2S приводила не только к восстановлению 60% активности, но и реконструкции железосерных кластеров. Такая реконструкция может быть полезной при изучении железосерных кластеров гидрогеназ. Например, замена при реконструкции 56Fe на 57Fe позволит в дальнейшем определить какие кластеры подвержены разрушению в наибольшей степени, а также изучать редокс состояния кластеров при переносе электрона с помощью мессбауэровской спектроскопии или ядерно-резонансной колебательной спектроскопии.
Исследование поддержано грантом РНФ 19-14-00255.
Список литературы
Vignais P., Billoud B. //Chem. Rev. 2007. V. 107. № 6. P. 4206–4272.
Lubitz W., Ogata H., Rüdiger O., Reijerse E. // Chem. Rev. 2014. V. 114. № 8. P. 4081–4148.
Greening C., Biswas A., Carere C.R., Jackson C.J., Taylor M.C., Stott M.B., Cook G.M., Morales S.E. //The ISME J. 2016. V. 10. № 3. P. 761–77.
Shafaat H.S., Rudiger O., Ogata H., Lubitz W. //Biochim. Biophys. Acta. 2013. V. 1827. № 8–9. P. 986–1002.
Гоготов И.Н., Задворный О.А., Зорин Н.А., Серебрякова Л.Т. // Фотосинтезирующие микроорганизмы. / Ред. В.Ф. Гальченко. Труды Института микробиологии им. С.Н. Виноградского, 2010. Т. 15: М.: МАКС Пресс, С. 260–289.
Pandelia M.E., Nitschke W., Infossi P., Giudici-Orticoni M.T., Bill E., Lubitz W. // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 15. P. 6097–102.
Lauterbach L., Wang H.X., Horch M., Gee L.B., Yoda Y., Tanaka Y., Zebger I., Lenz O., Cramer S.P. // Chem Sci. 2015. V. 6. № 2. P. 1055–60.
Zorin N.A., Zabelin A.A., Shkuropatov A.Ya., Tsygankov A.A. // J. Inorganic Biochemistry. 2017. V. 177. № 1. P. 190–197.
Malkin R., Rabinowitz J.C. //Biochem. Biophys. Res. Commun. 1966. V. 23. № 3. P. 822–827.
Зорин Н.А., Стародубов А.С., Цыганков А.А. // Прикл. биохимия и микробиология. 2020. Т. 56. № 1. С. 135–140.
Parret K.G., Mehari T., Golbeck J.H. //Biochim. Biophys. Acta. 1990. V. 1015. № 2. P. 341–352.
Seefeldt L.C., Arp D.J. // J. Bacteriol. 1989. V. 171. № 6. P. 3298–3303.
Hexter S.V., Chung M.-W., Vincent K.A., Armstrong F.A. // J. Am. Chem. Soc. 2014. V. 136. № 29. P. 10470–10477.
Zorin N.A., Dimon B., Gagnon J., Gaillard J., Carrier P., Vignais P.V. // Eur. J. Biochem. 1996. V. 241. № 4. P. 675–681.
Jung Y.-S., Yu L., Golbeck H. //Photosynthesis Research. 1995. V. 46. № 1. P. 249–255.
Mehari T., Parret K.G., Warren P.V., Golbeck J.H. // Biochim. Biophys. Acta – Bioenergetics. 1991. V. 1056. № 1. P. 139–148.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


