Прикладная биохимия и микробиология, 2021, T. 57, № 3, стр. 251-261
Характеристика нового штамма Xanthomonas campestris М 28– продуцента ксантана, исследование генома, условий культивирования и физико-химических и реологических свойств полисахарида
В. В. Ревин 1, Е. В. Лияськина 1, *, Б. В. Покидько 2, Н. В. Пименов 3, А. В. Марданов 3, Н. В. Равин 3
1 Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева
430005 Саранск, Россия
2 Российский технологический университет
119571 Москва, Россия
3 Институт биоинженерии Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академиии наук
117312 Москва, Россия
* E-mail: liyaskina@yandex.ru
Поступила в редакцию 30.10.2020
После доработки 15.12.2020
Принята к публикации 22.12.2020
Аннотация
Получен новый высокопродуктивный штамм – продуцент ксантана Xanthomonas campestris М 28, образующий до 28 г/л полисахарида на среде с мелассой, что почти в два раза превышало продуктивность штамма NRRL B-1459. Проведено полногеномное секвенирование штамма с использованием метода Illumina и нанопорового секвенирования. Геном X. campestris M 28 содержал одну хромосому длиной 5102828 нуклеотидов со средним содержанием G + C 65.03%. Изучены структура, физико-химические и реологические свойства полученного ксантана. Установлено, что добавление ксантана в дисперсии бентонита приводило к образованию первичных глинистых частиц (70 нм) и агрегатов ~190 нм без образования осадка. Это свидетельствовало о взаимодействии макромолекул с частицами и агрегатами с формированием полимерглинистых мостиковых структур, обеспечивая стабильность глинистых дисперсий и позволяя достичь необходимых реологических свойств буровых растворов на ксантане, полученном на среде с мелассой, тем самым снижая его себестоимость.
Ксантан – биополимер, который благодаря своим ценным и уникальным свойствам нашёл применение в пищевой, нефтяной, фармацевтической, горнодобывающей, текстильной и других отраслях промышленности [1–6]. Этот полимер экологически безопасен, нетоксичен, используется в пищевой промышленности как стабилизатор и загуститель под названием Е 415. В последнее время ксантан привлекает особое внимание исследователей в связи с перспективами его использования в тканевой инженерии, для получения биокомпозитов с регенеративными и антибактериальными свойствами [6–10].
Особое значение ксантан имеет в нефтегазодобыче при горизонтальном бурении в качестве добавки, улучающей реологию и фильтрационные характеристики буровых растворов на основе бентонита. Одно из важных свойств ксантана – это стойкость его водных растворов к добавкам электролитов. По отношению к бентонитам (частицы и агрегаты минерала монтмориллонита) полисахарид выполняет важную функцию – предотвращает коагуляцию частиц с образованием компактных агрегатов, выпадающих в осадок, а также структурообразующую функцию, способствующую образованию в водных средах тиксотропных гелей с уникальными реологическими и технологическими свойствами [11].
В настоящее время производство микробных полисахаридов типа ксантанов на территории России отсутствует, при этом осуществляются крупнотоннажные закупки китайского сырья различного качества, несмотря на то, что композиции с ксантаном затрагивают такие важные стратегические области народного хозяйства, как строительство, лакокрасочная промышленность, нефте-газовый комплекс, производство товаров бытовой химии и косметики, а также препаратов медицинского назначения и др.
Для промышленного получения ксантана необходимы, в первую очередь, высокоэффективные технологии и высокопродуктивные штаммы бактерий.
Продуценты ксантана – бактерии рода Xanthomonas относятся к семейству Pseudomonaceae, типу Proteobacteria, классу Альфа-протеобактерии. Род Xanthomonas включает такие виды, как X. сampestris, X. arboricola, X. axonopodis, X. fragaria, X. gummisudans, X. juglandis, X. phaseoli, X.vasculorium и др. [6, 12]. В промышленном производстве используется бактерия Xanthomonas campestris [13].
Большую роль в интенсификации производства ксантана сыграло применение высокоактивных штаммов продуцентов, полученных с помощью различных методов прикладной генетики и селекции [14]. Полностью описаны геномы штаммов X. campestris NRRL B-1459 (ATCC 13951) [15], X. campestris pv. campestris В 100 [13, 16], X. campestris JX [17], X. campestris pv. campestris WHRI 3811 [18]. Показано, что размер хромосом X. campestris составляет от 4.8 до 5.1 Мb [15–17]. Содержание ГЦ-оснований в хромосоме X. campestris составляет 63.7–65.3% [15–17]. Установлено, что ряд штаммов X. cаmpestris имеют плазмиды различных размеров, отвечающие за устойчивость к антибиотикам, металлам и т.д.
Стоимость, реологические свойства и выход ксантана зависят от среды для культивирования штамма [19–21]. Для получения ксантана, чаще всего, используются среды сложного состава, включающие, в основном, 2–4% глюкозы и сахарозы, 0.05–0.1% источников азота, таких как дрожжевой экстракт, пептон, нитрат аммония [3, 4, 22], имеющие достаточно высокую стоимость. Для снижения себестоимости ксантана предложены среды, в состав которых включают различные отходы промышленности и сельского хозяйства [24–30]. Это позволяет решать и экологические проблемы утилизации отходов, оказывающих негативное влияние на состояние окружающей среды [31].
Цель работы – анализ генома и изучение условий культивирования нового штамма Xanthomonas sp. М 28 на среде с мелассой для получения ксантана с приемлемыми физико-химическими свойствами и реологическими характеристиками, пригодными для использования в нефтегазодобыче и горизонтальном бурении.
МЕТОДИКА
Объект исследования и источник выделения. В качестве объекта исследования использовали штамм-продуцент ксантана Xanthomonas campestris М 28, который был получен селекционным путем из штамма, выделенного из пораженной ткани капусты. Штамм депонирован во Всероссийской коллекции микроорганизмов (ВКМ) под номером B-3503D. В качестве контроля использовали штамм ВКМ В-611 (=NRRL B-1459=ATCC 13951).
Условия культивирования. Для поддержания бактерий использовали агаризованную среду с сахарозой следующего состава (г/л): сахароза – 20.0; дрожжевой экстракт – 5.0; пептон – 10.0; агар-агар – 20.0. рН 6.8 – 7.0. Для получения ксантана использовали среду с мелассой следующего состава ( г/л): меласса – 45.0 и 90.0; K2НРО4 – 3.0, рН среды – 6.8–7.0.
Культивирование осуществляли в конических колбах на 250 мл в 100 мл среды с мелассой. В качестве посевного материала использовали культуру, выращенную на скошенной агаризованной среде. Колбы засевали 10 мл суспензии бактерий, полученной в результате смыва с поверхности агаризованной среды. Инокулят выращивали на шейкере-инкубаторе ES-20/60 “BIOSAN” (Латвия) при 250 об./мин и температуре 28 ± 1°С в течение 1 сут. Полученным инокулятом в количестве 10% от объема среды засевали опытные колбы, которые затем помещали в шейкер-инкубатор ES-20/60 при 250 об./мин на 5 сут. Культивирование осуществляли также в биореакторе BIOSTAT® A PLUS (“Sartorius”, Германия) емкостью 1 л при температуре 28 ± 1°С и, перемешивании со скоростью 300 об./мин с подачей воздуха со скоростью 1 л воздуха/0.8 л среды × мин (степень аэрации 1.25 мин–1).
Секвенирование и анализ генома Xanthomonas sp М 28. Геномную ДНК выделяли с помощью набора mericon DNA Bacteria Kit (Qiagen, США) по протоколу выделения ДНК у грамотрицательных бактерий. Полученный препарат очищали с помощью набора DNA Clean & Concentrator Kit (“Zymo Research”, Германия). Для определения полного генома штамма М 28 использовали технологии Illumina (“Illumina Inc”, США) и мономолекулярного нанопорового секвенирования (“Oxford Nanopore”, Великобритания). Для приготовления библиотеки геномной ДНК, предназначенной для секвенирования на приборе Illumina, использовали набор реактивов NEBNext ULTRA II DNA Library Prep Kit (“New England Biolabs”, США). Полученную библиотеку секвенировали на Illumina HiSeq2500 с использованием набора MiSeq Reagent Kit V3 (600 циклов). В результате было получено 3.0 млн. пар чтений, суммарная длина которых составила 1.6 млрд нт. Парные пересекающиеся прочтения объединяли с помощью программы FLASH v.1.2.11 [32], последовательности с низким качеством прочтения удаляли с помощью программы Sickle v. 1.33 (https://github.com/najoshi/sickle). Дополнительно геномную ДНК секвенировали на MinION (“Oxford Nanopore”, Великобритания), с использованием набора реактивов Ligation Sequencing kit 1D (SQK-LSK109) согласно протоколу производителя. Было получено 262685 чтений со средней длиной 4458 нт.
Для сборки полной последовательности генома из прочтений, полученных на Illumina и MinION, использовали программу Unicycler v.0.4.8 [33]. Поиск генов и их аннотацию проводили с использованием сервера RAST [34] с последующей проверкой аннотации в результате сравнения последовательностей предсказанных белков с базами данных NCBI. Средние уровни идентичности нуклеотидных последовательностей для полных геномов определяли с помощью программы FastANI [35].
Определение количества ксантана и биомассы. Количество биомассы определяли весовым методом после отделения клеток центрифугированием при 8000 g в течение 40 мин, ксантана – после осаждения экзополисахарида 96%-ным этиловым спиртом в соотношении 1 : 2 по об./об. Ксантан высушивали лиофильно на сушилке Freeze Dryer “Labconco” (США).
Определение сахаров методом ВЭЖХ. Для количественного определения сахаров проводили высокоэффективную жидкостную хроматографию с помощью высокоэффективного жидкостного хроматографа LC-20A с рефрактометрическим и УФ-детектором (“Shimadzu”, Япония). Определение сахаров проводили с УФ-детектированием (254 нм) на хроматографической колонке 250 × 4.6 мм Supelcosil LC-NH2 (“Merck”, Германия). Хроматографический анализ проводили в градиентном режиме при расходе элюента 0.4 мл/мин и температуре термостата колонки 40°С. В качестве подвижной фазы использовали 75%-ный ацетонитрил. Для отделения биомассы культуральную жидкость центрифугировали на высокоскоростной центрифуге “Sorvall RC-6 Plus” (США) при 10 000 об./мин в течение 15 мин. Супернатант смешивали с ацетонитрилом в соотношении 1 : 3 и вновь центрифугировали на лабораторной центрифуге “ELMI CM-50” (Латвия) при 10 000 об./мин 5 мин.
Спектрофотометрия. Спектрофотометрическое исследование образцов ксантана проводили на инфракрасном спектрометре с преобразованием Фурье IRPrestige-21 (“SHIMADZU”, Япония). ИК-спектры были получены исследованием образцов в таблетках с KBr.
ЯМР 13С спектроскопия. Регистрация твердотельных спектров ЯМР 13C выполнена на спектрометре JEOL JNM-ECX400 (“JEOL”, Япония) (9.39 Т, 100.5 MГц) в твердой фазе при комнатной температуре с применением техники кросс-поляризации (CPMAS) со скоростью вращения 10 кГц в 7 мм роторах из диоксида циркония. Магический угол вращения образца (MAS) определяли при скорости вращения 10 кГц. Все MAS эксперименты проводились при комнатной температуре; протонную развязку осуществляли с помощью двойной импульсной модуляцией фазы (TPPM). При регистрации спектров 13С MAS ЯМР использовали роторно-синхронизацию последовательности эха (RSE) или один импульс возбуждения (SP) на ларморовской частоте 100.6 МГц. Для оптимизации процесса регистрации спектра было подобрано время релаксации ядер углерода. Длительность импульса для угла 90° составила 6 мс, а для 180° – 12 мс, общее количество сканов 256. Спектры обрабатывались с помощью программы ACD/NMRProcessorAcademicEdition, Ver. 12.01.
Определение молекулярной массы. Молекулярную массу ксантана определяли методом капиллярной вискозиметрии с использованием капиллярного вискозиметра Оствальда, термостатированного при температуре 25°С. Расчет проводился по уравнению Марка-Хаувинка (1):
Значения констант K и α принимались равными 2.79 × 10–5 и 0.78 соответственно [36].
Исходные растворы полимеров концентрацией 0.5% (масс.) готовили путем растворения навесок полимера в 0.01 М растворе хлорида натрия. Диспергирование осуществляли на магнитной мешалке с применением кратковременной УЗ-обработки, используя ванну UС-7000. Спустя несколько часов, после получения полностью гомогенного прозрачного раствора проводили серию разбавлений 0.01 М NaCl с получением серии разбавленных растворов. Растворы гомогенизировались путем механического перемешивания и выдерживали сутки до проведения измерений.
Определение реологических свойств. В качестве основного компонента буровых растворов использовали бентонитовый глинопорошок Зыряновского месторождения марки ПБМБ (“Бентонит Кургана”, Россия) с содержанием монтмориллонита порядка 60%, активированного 4%-ной кальцинированной содой. В качестве модификаторов использовали коммерческий ксантан MHO–80D (Китай) и ксантан, образуемый X. campestris М 28.
Для тестирования влияния ксантановых модификаторов на реологические свойства дисперсий в присутствии солей были изготовлены 6%-ные дисперсии бентонита в холодной водопроводной воде (жесткость порядка 5 мг-экв/л), содержащей 2.5 и 30% хлорида натрия. Изготовление дисперсий осуществлялось на смесителе Воронеж при 8000 об. в течение 20 мин. После изготовления дисперсии выдерживались в течение 1 ч до наступления равновесия. Было показано, что порядок ввода компонентов (глина/полимер/соль) слабо меняло реологию дисперсий, то есть показатели были в данном случае равновесными. В предварительных экспериментах было показано, что достаточный уровень устойчивости частиц в присутствии соли обеспечивался при содержании ксантана не менее 4% от массы бентонита.
Исследование реологических свойств полимер-бентонитовых дисперсий проводили с помощью ротационного вискозиметра “Fann Instrument Company” (США).
Реологические свойства оценивали, используя уравнение Бингама (2):
Уравнение (2) содержит две константы, характеризующие реологию: предел текучести τ0 обозначается в реологии буровых растворов как YP (yield point) и характеризует прочность структуры (динамическое напряжение сдвига), показатель пластической вязкости (PV, plastic viscosity) характеризует ньютоновскую составляющую вязкости, то есть реологию системы после ее разрушения под действием высоких сдвиговых напряжений. Во многих случаях этот показатель пропорционален дисперсности частиц или, точнее, объемной доле дисперсной фазы с учетом существования сольватных оболочек. Кроме того для характеристики систем используются показатели эффективной вязкости, в частности параметр AP, (apparent viscosity) при высоких скоростях сдвига (600 об./мин).
Фильтрационные показатели дисперсий (объем фильтрата в мл) оценивали с использованием воронки Бюхнера и колбы Бунзена (диаметр 10 мм) с водоструйным насосом, создающим давление около 1 атм. Для фильтрования применялась стандартная обеззоленная фильтровальная бумага (белая лента). Фильтрацию проводили при постоянном давлении в течение постоянного времени – 5 мин. Указанный способ измерения был соотнесен со стандартным тестом на определение фильтрации (измерения с использованием стандартного фильтр пресса). Для приведения в соответствие с методикой API показателей фильтрации, полученных по лабораторной методике, в независимых опытах был определен коэффициент пересчета (относительная ошибка менее 3%).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Штамм продуцент ксантана Xanthomonas sp. М 28 был получен селекционным путем из штамма, выделенного из пораженной ткани капусты. Идентификация штамма произведена на основании культурально-морфологических, биохимических и генетических характеристик.
Культурально-морфологические и физиологические свойства. Клетки штамма Xanthomonas sp. М 28 грамотрицательные палочки, с закругленными концами, расположенные одиночно и попарно, размеры: 0.4–0.7 × 0.7–2.0 мкм. На агаризованной среде с глюкозой и сахарозой при 28°С на третьи сутки роста штамм Xanthomonas sp. М 28 образует слизистые колонии диаметром 5–8 мм, светло-желтого цвета с прозрачной зоной по периферии (рис. 1а). В процессе хранения при температуре 4–9°С размер колоний увеличивался за 7 сут до 20–30 мм. Контрольный штамм ВКМ В-611 (=NRRL B-1459=ATCC 13951) образовывал более мелкие колонии диаметром 2 – 3 мм ярко-желтого цвета (рис. 1б). Известно, что бактерии рода Xanthomonas имеют две характерные особенности: образование экзополисахарида ксантана и образование специфических мембраносвязанных пигментов – ксантомонадинов, что обеспечивает мукоидность и желтую окраску колоний. По сравнению с контрольным штаммом ВКМ В-611 колонии штамма Xanthomonas sp. М 28 имели менее интенсивную пигментацию, но значительно более выраженную мукоидность.
Рис. 1.
Колонии Xanthomonas sp. М 28 (а) и X. campestris ВКМ В-611 (=NRRL B-1459=ATCC 13951) (б) на среде с глюкозой на 3 сут роста.

Штамм Xanthomonas sp. М 28 является аэробным, мезофильным гетеротрофом. Растет в пределах температур 4–37°С с оптимальной температурой для роста 28–30°С и в диапазоне рН 5.0–7.5 с оптимумом при 6.8–7.0. В качестве источников углерода и энергии штамм использует глюкозу, сахарозу, галактозу, мальтозу, раффинозу. Штамм каталазоположительный и оксидазоотрицательный, разжижает желатин, пептонизирует молоко, не восстанавливает нитраты, гидролизует крахмал.
Основные характеристики генома. В результате секвенирования генома Xanthomonas sp. М 28 с помощью двух технологий – Illumina и мономолекулярного нанопорового секвенирования, была определена полная последовательность его хромосомы длиной 5102828 нт со средним содержанием G + C 65.03%, плазмиды найдены не были. В результате анализа генома было обнаружено 2 копии оперона генов рибосомной РНК (16S–23S-5S), 55 генов транспортных РНК (тРНК), и 4747 потенциальных белок-кодирующих генов.
Последовательность гена 16S рРНК, идентифицированного в геноме, на 100% идентична последовательностям генов 16S рРНК различных штаммов Xanthomonas, отнесеннным к видам X. campestris, X. arboricola, X. hortorum и X. gardneri. Поиск в GenBank близких к Xanthomonas sp. М 28 полногеномных последовательностей, показал, что ближайшим является геном штамма X. campestris pv. campestris B1459 (GenBank assembly GCA_001372255.1), со средней идентичностью нуклеотидных последовательностей (ANI) 99.87 на 94% длины генома штамма Xanthomonas sp. М 28. С другими видами Xanthomonas уровень ANI не превышал 90%, причем участки с высокой гомологией последовательностей составляли менее 80% генома Xanthomonas sp. М 28. На основании этих данных можно сделать вывод о том, что Xanthomonas sp. М 28 представляет новый штамм X. campestris pv. campestris.
В результате анализа генома Xanthomonas campestris М 28 идентифицирован кластер биосинтеза ксантана, включающий гены gumA и оперон gumB-gumN. Нуклеотидная последовательность соответствующего участка генома практически идентична (99.86%) ранее описанной для штамма X. campestris B1459 (GenBank U22511).
Геном штамма X. campestris M28 депонирован в GenBank под номером CP062066 (BioProject PRJNA664929, BioSample SAMN16237388).
Образования ксантана штаммом X. campestris М 28. Динамика образования ксантана и биомассы штаммом X. campestris М 28 изучалась при выращивании в колбах и биореакторе BIOSTAT® A PLUS на среде с мелассой.
Меласса – побочный продукт конечной стадии кристаллизации в процессе производства сахара и один из наиболее экономичных источников углерода в микробиологической промышленности. Меласса содержит около 80% сухих веществ, из которых около 48% представлено сахарозой. Она также богата белками и органическим азотом.
Согласно данным литературы, оптимальной концентрацией сахарозы в среде для штамма X. campestris NRRL B-1459 была концентрация 25 г/л [20]. Выход ксантана при этом составлял 15.8 г/л. Штамм X. campestris MO-03 образовывал максимальное количество ксантана (20.5 г/л) в среде с мелассой, содержащей сахарозу в концентрации 40 г/л [30].
В настоящей работе исследовали образование ксантана на средах с мелассой в концентрации 45 и 90 г/л с содержанием сахарозы 25 и 50 г/л соответственно. Максимальное количество ксантана образовывалось на 5 сут культивирования и составляло 22.10 ± 0.3 г/л (рис. 2a) и 24.29 ± 0.20 (рис. 2б) на средах с мелассой в концентрации 45 и 90 г/л соответственно.
Рис. 2.
Динамика образования биомассы (1), ксантана (2) и изменения рН (3) в процессе культивирования X. campestris М 28 на среде с мелассой в концентрации 45 (a) и 90 г/л (б).
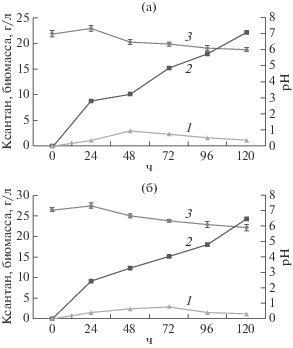
Максимальное накопление ксантана совпадало со снижением прироста биомассы бактерий. Наибольшее количество биомассы накапливалось на 48 ч культивирования и составляло 3.01 ± ± 0.08 г/л на среде с мелассой в концентрации 45 г/л. При использовании среды с мелассой в концентрации 90 г/л максимум накопления биомассы наблюдался на 3 сут культивирования.
При изучении динамики изменения pH культуральной жидкости показано, что на первые сутки культивирования наблюдалось незначительное повышение значений рН, вероятно за счет потребления органических кислот, присутствующих в мелассе (молочная, янтарная, глутаровая, яблочная и др.). В дальнейшем наблюдалось снижение значений рН, что, вероятно, обусловлено образованием органических кислот как продуктов неполного окисления углеводов и образования ксантана, являющегося кислым гетерополисахаридом. В целом, значения рН были оптимальными как для роста бактерий, так и для образования ксантана (рН 6.5–7.5).
В процессе культивирования штамма X. campestris М 28 проводилось количественное определение сахарозы в культуральной жидкости методом высокоэффективной жидкостной хроматографии (рис. 3).
Рис. 3.
Изменение концентрации сахарозы в культуральной жидкости в процессе культивирования X. campestris М 28 на среде с начальной концентрацией мелассы 45 (1) и 90 г/л (2) (ВЭЖХ).
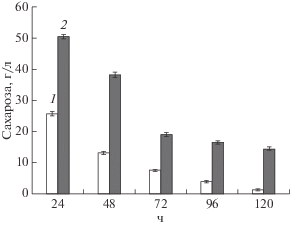
Согласно представленным данным, за трое суток культивирования наблюдалось практически полное потребление сахарозы в среде при ее начальной концентрацией 25 г/л. При использовании же среды с содержанием сахарозы 50 г/л, ее значительное количество (14.58 ± 0.49 г/л) оставалось в среде после культивирования бактерий.
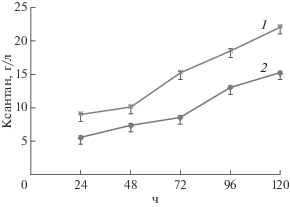
Таким образом, в процессе культивирования штамма X. campestris М 28 на средах с мелассой в колбах выход ксантана составлял 22–24 г/л, что превышало аналогичные показатели контрольного штамма X. campestris ВКМ В-611, образующего полисахарид в концентрации не более 15 г/л на 5 сут культивирования (рис. 4).
Рис. 4.
Динамика образования ксантана штаммами X. campestris М 28 (1) и X. campestris ВКМ В-611 (2).
На следующем этапе работы была исследована кинетика образования ксантана в биореакторе BIOSTAT® A PLUS объемом 1 л. Максимальное количество ксантана образовывалось штаммом X. campestris М 28 при перемешивании со скоростью 300 об./мин и степени аэрации 1.25 мин–1 на пятые сутки культивирования и составляло 27.91 ± ± 0.14 г/л (рис. 5). Полученные результаты согласуются с литературными данными, согласно которым максимальный выход ксантана в биореакторе наблюдался при перемешивании со скоростью 300 об./мин [41 ] .
Рис. 5.
Образования ксантана (1), изменения рО2 (2) и рН (3) в процессе культивирования X. campestris М 28 в биореакторе (45 г/л мелассы).
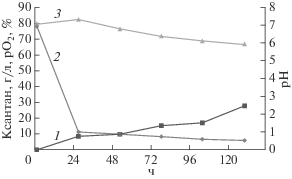
В первые часы культивирования насыщение кислородом составляло около 80%. Далее количество кислорода снизилось до 10% за первые сутки роста, что вероятно связано с увеличением вязкости культуральной жидкости в результате образования ксантана. Также в первые часы культивирования наблюдалось незначительное повышение pH культуральной жидкости, что вероятно связано с потреблением органических кислот, входящих в состав мелассы. В дальнейшем наблюдалось понижение pH культуральной жидкости, что можно объяснить образованием органических кислот как продуктов неполного окисления углеводов и образованием ксантана, который является кислым гетерополисахаридом.
Полученный ксантан после выделения и очистки (рис. 6) получали в порошкообразном виде после лиофильного высушивания.
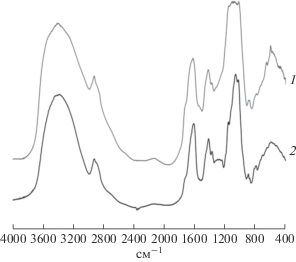
Изучение физико-химических и реологических свойств ксантана. Исследование ксантана методом ИК-спектроскопии показало сходство инфракрасных спектров ксантана X. campestris М 28 и коммерческого ксантана (рис. 7). Присутствие пиранозных колец в образцах ксантана исследуемых штаммов подтверждалось наличием пиков поглощения в области 950–800 см–1. Поглощение в области 1050–1100 см–1 соответствует асимметричным валентным колебаниям эфирной связи C1–O–C4, с одним атомом углерода, входящим в пиранозное кольцо, и вторым атомом, образующим связь с гликозидным гидроксилом или с молекулой углеводорода. Наличие поглощения в области 1800–1500 см–1 с хорошо выраженным максимумом при 1640 см–1 соответствует валентным колебаниям групп C=O и свидетельствует о том, что в кислых экзополисахаридах, к которым принадлежит ксантан, имеются карбоксильные группы. Для свободных OH-групп характерно поглощение в области больших волновых чисел 3600–3200 см–1. При этом поглощение OH-групп, участвующих в образовании водородных связей, смещено в область более низких частот. Максимумы в области 890–900 см–1, характерны для деформационных колебаний аксиальной связи C-H у первого атома гексоз, присутствие которых в спектре указывает на наличие β-гликозидных связей.
Молекула ксантана имеет в своем составе главную цепь полимера (a, b) идентичную молекуле целлюлозы и ответвления, представляющие собой трисахарид состоящий из остатков молекул глюкозы (c), маннозы (e), глюкуроновой кислоты (d), а также пируватные и ацетные группы (рис. 8a).
Рис. 8.
Структурная формула фрагмента макромолекулы ксантана (a) и ЯМР 13С спектр ксантана X. campestris М 28 (б).
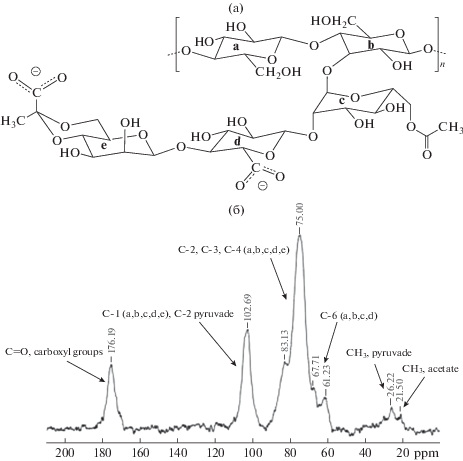
На рис. 8б представлен 13C ЯМР спектр ксантана X. campestris М 28. Спектр однозначно доказывает наличие карбоксильных групп (СОО), остатков пировиноградной и уксусной кислот, фрагментов глюкозы, маннозы и глюкуроновой кислоты.
Таким образом, полученные ИК и ЯМР спектры однозначно свидетельствуют о том, что X. campestris М 28 синтезирует микробный полисахарид, полностью совпадающий со структурой ксантана.
На следующем этапе задачей работы было сравнительное изучение физико-химических и реологических характеристик ксантана X. campestris М 28 в сравнении с коммерческим ксантаном.
Для исследуемых полимеров молекулярная масса составила 940 000 г/моль для коммерческого ксантана и 530 000 г/моль для ксантана X. campestris М 28.
На рис. 9 приведены кривые объемного распределения частиц по размерам в разбавленных 0.5%ных дисперсиях бентонита ПБМБ без полимера и в присутствии 4% ксантана, полученные с использованием анализатора размеров частиц Malvern ZetaSizer.
Рис. 9.
Дифференциальные кривые распределения частиц по размерам в 0.5%-ных дисперсиях бентонита: 1–исходный бентонит, 2 – дисперсия бентонита с добавкой ксантана (4% вес. от массы бентонита).
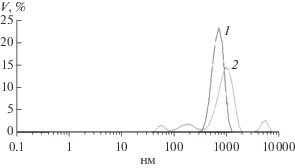
Для исходного бентонита в водной дисперсии характерно наличие агрегатов частиц со средним размером фракции порядка 0.6 мкм. В присутствии ксантана наблюдалось одновременно диспергирование агрегатов до первичных частиц (70 нм) и агрегатов размерами ~190 нм, а также образование агломератов или флоккул микронных размеров, без образования осадка, что свидетельствует о взаимодействии макромолекул с частицами и агрегатами с формированием полимер-глинистых мостиковых структур.
В табл. 1 приведены результаты определения реологических и фильтрационных характеристик глинистых дисперсий.
Таблица 1.
Основные показатели 6%-ных растворов бентонита, модифицированного ксантаном (4%) при различном содержании хлорида натрия.
| Система | 2.5% NaCl, ксантан | 30% NaCl, ксантан | ||
|---|---|---|---|---|
| X. campestris М 28 | коммерческий | X. campestris М 28 | коммерческий | |
| YP, Па | 2.4 | 5.9 | 2.9 | 6.8 |
| PV, мПа × с | 5 | 8 | 7.5 | 19 |
| AV, мПа × с | 7.5 | 14 | 10.2 | 26 |
| F, мл | 5.9 | 14.2 | 4.6 | 7.2 |
Использование ксантана X. campestris М 28 обеспечивало достаточную стабильность глинистых дисперсий. При этом добавки ксантана придавали буровым растворам на глинистой основе уникальную устойчивость к воздействию электролитов, способствуют сохранению реологии растворов при бурении в осложненных условиях, а также в породах сложного состава. В таких системах полимерные молекулы ксантана обеспечивали устойчивость глинистых частиц и агрегатов, сохраняли гелеобразную структуру раствора с необходимым уровнем тиксотропных свойств, высоким уровнем эффективной вязкости, и достаточной прочностью структуры. Это происходило за счет возможной адсорбции макромолекул на поверхности мотмориллонита и образования полимерглинистых мостиковых структур.
Способность ксантана к стабилизации глинистых дисперсий возрастает с ростом молекулярной массы ксантана, в тоже время рост молекулярной массы приводит к снижению скорости растворения полимера, особенно в средах с повышенным содержанием электролита. В этом случае, при снижении стоимости производства ксантана, несмотря на меньшую молекулярную массу продукта, увеличение количества добавляемого ксантана вполне может компенсировать недостаток, связанный с менее высокими значениями молекулярной массы.
Результаты показали, что в глинистых системах достигался стабилизирующий эффект, достаточный для обеспечения высокого уровня эксплуатационных и технологических характеристик, даже при использовании равных масс высокомолекулярного коммерческого ксантана и экспериментального ксантана полученого в работе.
* * *
В связи с широким применением ксантана в различных областях промышленности важным является получение новых высокопродуктивных штаммов, способных продуцировать полисахарид с высоким выходом и необходимыми технологическими свойствами. В настоящей работе получен новый высокоэффективный продуцент ксантана X. campestris M 28, образующий до 28 г/л полисахарида на среде с мелассой, что почти в 2 раза превышает продуктивность контрольного штамма X. campestris NRRL B-1459. При этом полученный полимер обеспечивал в композиции с бентонитом необходимую реологию бурового раствора, не уступающую по эффективности растворам на основе высокомолекулярных форм ксантана.
Таким образом, результаты данного исследования свидетельствуют о получении ксантана с физико-химическими свойствами и реологическими характеристиками, пригодными для использования при бурении нефтяных и газовых скважин с использованием высокопродуктивного штамма и побочных продуктов пищевой промышленности для его выращивания, которые могут способствовать снижению производственных затрат.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ (грант FZRS-2020-0003).
Список литературы
Ревин В.В., Лияськина Е.В. Биотехнология бактериальных экзополисахаридов. Саранск: Изд-во Мордов. ун-та, 2019. 192 с.
Mohsin A., Zaman W.Q., Guo M., Ahmed W., Khan I.M., Niazi S., Rehman A., Hang H., Zhuang Y. // Int. J. Biol. Macromol. 2020. V. 162. P. 43–49. https://doi.org/10.1016/j.ijbiomac.2020.06.008
Habibi H., Khosravi-Darani K. // Biocatal. Agric. Biotechnol. 2017. V. 10. P. 130–140. https://doi.org/10.1016/j.bcab.2017.02.013
Garcia-Ochoa F., Santos V.E., Casas J.A., Gomez E. // Biotechnol. Adv. 2000. V. 18. P. 549–579. https://doi.org/10.1016/S0734-9750(00)00050-1
Jang H.Y., Zhang K., Chon B.H., Choi H.J. // J. Ind. Eng. Chem. 2015. V. 21. P. 741–745. https://doi.org/10.1016/j.jiec.2014.04.005
Petri D.F.S. // J. Appl. Polym. Science. 2015. V. 132. P. 42035 https://doi.org/10.1002/app.42035
Kumar A., Rao K.M., Han S.S. // Carbohydr. Polym. 2018. V. 180. P. 128–144. https://doi.org/10.1016/j.carbpol.2017.10.009
Raschip I.E., Fifere N., Varganici C-D., Dinu M.V. // Int. J. Biol. Macromol. 2020. V. 156. P. 608–620. https://doi.org/10.1016/j.ijbiomac.2020.04.086
Wang Z., Yang Q., Wang X., Li R., Qiao H., Ma P., Sun Q., Huiru Zhang H. // Int. J. Biol. Macromol. 2020. V. 153. P. 539–544. https://doi.org/10.1016/j.ijbiomac.2020.03.044
Ćirić A., Medarević Đ., Čalija B., Dobričić V., Mitrić M., Djekic L. // Int. J. Biol. Macromol. 2020. V. 148. P. 942–955. https://doi.org/10.1016/j.ijbiomac.2020.01.138
Erasov V., Pokidko B., Pletnev M.Y. // J. Dispers. Sci. Technol. 2019. P. 1–10. https://doi.org/10.1080/01932691.2019.1611445
Rottava I., Batesini G., Silva M.F. // Carbohydr. Polym. 2009. V. 77. P. 65–71. https://doi.org/10.1016/j.carbpol.2008.12.001
Alkhateeb R.S., Vorholter F.J., Ruckert C., Mentzc A., Wibberg D., Hublik G., Niehaus K., Pühler A. // J. Biotechnol. 2016. V. 225. P. 18–28. https://doi.org/10.1016/j.jbiotec.2016.03.020
Kamall F., Mehrgan H., Mortazavi S. // Iran. Biomed. J. 2003. V. 7. № 3. P. 91–98.
Wibberg D., Alkhateeb R.S., Winkler A., Albersmeier A., Schatschneider S., Albaum S., Vorhölter F.-J. // J. Biotechnol. 2015. V. 204. P. 45–46. https://doi.org/10.1016/j.jbiotec.2015.03.026
Vorhölter F.-J., Schneiker S., Goesmann A., Krause L., Bekel T., Kaiser O., Pühler A. et al. // J. Biotechnol. 2008. V. 134. № 1–2. P. 33–45. https://doi.org/10.1016/j.jbiotec.2007.12.013
Tao F., Wang X., Ma C., Yang C., Tang H., Gai Z., & Xu P. // J. Bacteriol. 2012. V. 194. № 17. P. 4755–4756. https://doi.org/10.1128/jb.00965-12
Kong C., Horta de Passo V., Fang Z., Yang L., Zhuang M., Zhang Y., Lv H. // Mol. Plant-Microbe Inter. 2019. V. 32. P. 1571–1573. https://doi.org/10.1094/mpmi-07-19-0177-a
Garcia-Ochoa F., Gomas E. // Biotechnol. Bioeng. 2005. V. 92. № 6. P. 761–772. https://doi.org/10.1002/bit.20638
Faria S.A., Vieira P.A., Resende M.M. // Appl. Biochem. Biotechnol. 2009. V. 156. P. 475–488. https://doi.org/10.1007/s12010-008-8485-8
Assis D.A, Brandão L.V., de Sousa Costa L.A. // Appl. Biochem. Biotechnol. 2014. V. 172. № 5. P. 2769–2785.
Carignatto C.R.R., Oliveira K.S.M., de Lima V.M.G., de Oliva Neto P. // Ind. J. Microbiol. 2011. V. 51. № 3. P. 283–288. https://doi.org/10.1007/s12088-011-0171-9
Wang Z., Wu J., Gao M.J., Zhu L., Zhan X.-B. // Prep. Biochem. Biotechnol. 2017. V. 47. P. 468–472.
Wang Z., J. Wu, L. Zhu, X. Zhan. // Bioresour. Technol. 2016. V. 211. P. 390–397. https://doi.org/10.1016/j.biortech.2016.03.096
Li P., Li T., Zeng Y. // Carbohydrate Polymers. 2016. V. 151. P. 684–691. https://doi.org/10.1016/j.carbpol.2016.06.017
Niknezhad S.V., Asadollahi M.A., Zamani A., Biria D., Doostmohammadi M. // Food Sci. Biotechnol. 2015. V. 24. P. 453–460. https://doi.org/10.1007/s10068-015-0060-9
Bhatia S.K., Kumar N., Bhatia R.K. // 3 Biotech. 2015. V. 5. P. 735–739. https://doi.org/10.1007/s13205-014-0273-2
Da Silva J.A., Cardoso L.G., de Jesus Assis D., Gomes G.V.P., Oliveira M.B.P.P., de Souza C.O., Druzian J.I. // Appl. Biochem. Biotechnol. 2018. V. 3. P. 750–763. https://doi.org/10.1007/s12010-018-2765-8
Gilani S.L., Najafpour G.D., Heydarzadeh H.D., Zare H. // Chem. Ind. Chem. Eng. Q. 2011. V. 17. № 2. P. 179–187. https://doi.org/10.2298/ciceq101030002g
Ozdal M., Başaran Kurbanoglu E. // Fermentation. 2019. V.5. № 1. P. 9. https://doi.org/10.3390/fermentation5010009
Yang L., Han D.H., Lee B.M., Hur J. // Chemosphere. 2015. V. 127. P. 222–228. https://doi.org/10.1016/j.chemosphere.2015.02.028
Magoč T., Salzberg S.L. // Bioinformatics. 2011. V. 27. 21. P.2957–2963.
Wick R.R., Judd L.M., Gorrie C.L., Holt K.E. // PLoS Comput. Biol. 2017. V. 13. P. e1005595. https://doi.org/10.1371/journal.pcbi.1005595
Brettin T., Davis J.J., Disz T., Brettin T., Davis J.J., Disz T., Edwards R.A., Gerdes S., Olsen G.J., Xia F. // Sci. Rep. 2015. V. 5. № 1. P. 8365. https://doi.org/10.1038/srep08365
Jain C., Rodriguez-R.L.M., Phillippy A.M., Konstantinidis K.T., Aluru S. // Nat. Commun. 2018. V. 9. P. 5114. https://doi.org/10.1038/s41467-018-07641-9
Masuelli M.A. // J. Polym. Biopolym. Phys. Chem. 2014. V. 2. № 2. P. 37–43.
Borges C.D., da Moreira A.S., Vendruscolo C.T., Ayub M.A // Rev. Argent. Microbiol. 2008. V. 40. № 2. P. 81–85.
Hublik G. Polymer Science: A Comprehensive Reference. I / Eds. M. Moeller, K. Matyjaszewski, Elsevier Science., 2012. P. 221–229. https://doi.org/10.1016/B978-0-12-803581-8.01529-0
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология