Прикладная биохимия и микробиология, 2021, T. 57, № 3, стр. 262-269
Влияние трансглютаминазы на свойства пленок на основе хитозана и желатина
Д. А. Кадималиев 1, *, О. В. Парчайкина 1, И. В. Сюсин 1, И. В. Чаиркин 2, А. Н. Малафеев 1, А. А. Девяткин 1, В. В. Ревин 1
1 Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва,
Факультет биотехнологии и биологии
430005 Саранск, Россия
2 Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
119991 Москва, Россия
* E-mail: cadimded@yandex.ru
Поступила в редакцию 13.11.2020
После доработки 18.12.2020
Принята к публикации 22.12.2020
Аннотация
Оптимизированы условия получения и исследованы характеристики биоразлагаемых хитозан-желатиновых пленок, сшитых различными микробными трансглутаминазами (трансглутаминаза 1 – содержащая мальтодекстрин, трансглутаминаза 2 – содержащая мальтодекстрин и молочный белок). Свойства пленок зависели как от условий сшивки, так и от вида и соотношения исходного сырья. Гели и пленки, полученные с применением трансглутаминазы 1 имели очень низкие характеристики, по сравнению с пленками, полученными с применением трансглутаминазы 2. Методами инфракрасной спектроскопии, рентгеновской томографии и растровой атомно-силовой электронной микроскопии показано, что трансглутаминаза 2 образует сшивки как между аминогруппами желатина, так и хитозана, улучшая характеристики пленок. Пленки на основе хитозана, желатина и глицерина, сшитые трансглютаминазой 2 имели следующие характеристики: прочность – 15.8 МПа, растяжение – 220.0%, толщина – 73.1 мкм, плотность – 1.9 г/см3. Биоразлагаемость пленок зависела от состава пленок и составляла от 20 до 30 сут. Полученные пленки могут служить матрицей для получения медицинских материалов, обладающих антибактериальными и ранозаживляющими свойствами.
Создание биоразлагаемых материалов на основе смесей природных полимеров, которые могли бы распадаться в окружающей среде на безвредные для природы вещества, является одной из приоритетных задач современности. Особый интерес вызывают полимеры, полученные из отходов вторичного или возобновляемого сырья, такие как хитин (ХТ), желатин (ЖТ), молочная сыворотка, дрожжевые отходы, микробные полисахариды, соевый белок. Из них можно получать упаковочные изделия [1], композиционные материалы [2–5], пленки [6–10], которые можно применять в строительстве, сельском хозяйстве, медицине, пищевой и текстильной промышленности [11–14].
ЖТ – продукт переработки коллагена, распространённого в природе белкового вещества, образующего главную составную часть соединительной ткани позвоночных, особенно в коже, оссеине костей и в сухожилиях. По аминокислотному и элементарному составу желатин близок к коллагену.
Хитозан (ХЗ) является N-дезацетилированным производным природного полимера хитина, обладающим антибактериальными свойствами. Чем выше степень удаления ацила, тем выше функциональный эффект данного продукта. Молекула ХЗ содержит в себе большое количество свободных аминогрупп, что позволяет ему связывать ионы водорода и приобретать избыточный положительный заряд (свойства катионита) [15].
Трансглутаминаза (КФ 2.3.2.13) представляет собой кальций-зависимый фермент, который катализирует образование ковалентных связей между свободными аминогруппами (свободных, либо из боковых цепей лизина) и гамма-карбоксамидными группами глутамина, способствуя внутри- и межмолекулярному перекрестному сшиванию белковых молекул. Из Streptoverticillium mobaraense были получены кальций независимые микробные формы трансглутаминазы (мTГ-аза).
В ряде работ показано, что ЖТ, сывороточные белки, ХЗ, пектин в присутствии мTГ-азы образуют вязкие гели, которые можно использовать для получения пленок и полимеров. Причем качество пленок зависит от вида и условий их получения [16–18].
Однако имеющиеся данные очень противоречивы и не до конца объясняют вклад отдельных компонентов на свойства полученных пленок.
Цель работы – изучение влияния соотношения ХЗ и ЖТи мTГ-азы на свойства биоразлагаемых пленок на их основе.
МЕТОДИКА
Для получения биополимерных пленок использовали ХЗ, полученный в лабораторных условиях из хитина панцирей раков. ХТ получали по методу [19, 20]. Наличие аминогрупп и степень дезацетилирования определяли по ИК-спектрам и потенциометрческим титрованием. Потенциометрическое титрование растворов хитозана раствором гидроксида натрия точной концентрации проводили с помощью иономера Seven Compact pH/Ion S220 (“Mettler Toledo AG”, Швейцария). Полученную кривую (зависимость рН раствора от объема титранта) графически обрабатывали и находили объемы титранта (NaOH), соответствующие точкам эквивалентности соляной кислоты и солянокислого хитозана. Степень деацетилирования образца (СД) в процентах вычисляли по формуле: СД = 203.2 × 100/[42.0 + 1000 m0/(СNaOH dVNaOH)], где m0 – масса хитозана в навеске, г; СNaOH – точная концентрация раствора гидроксида натрия, моль/дм3; dVNaOH – объѐм раствора гидроксида натрия, пошедший на титрование аминогрупп, см3; 203.2; 42.0; 100; 1000 – пересчѐтные коэффициенты. За окончательный результат принимали среднее арифметическое значение результатов 3 параллельных измерений, относительное расхождение между которыми не превышало 2.0%. [21]. Вязкость определяли на приборе Gotech rion viscotester VT-04R (Китай) на приборе Реометр “Haake Mars III” (Германия). Молекулярную массу (ММ) образцов, полученных в результате кислотного гидролиза, определяли вискозиметрически. Гидролизованные образцы деацетилировали в стандартных условиях. Стандартное деацетилирование гидролизованных в НСl образцов хитина проводили в 50%-ном растворе NaOH при 100°C.
В работе использовали ЖТ пищевой (10%-ный водный раствор, ГОСТ 11293-89 (NF V59-001-1982), производства “ДТ-холдинг” (Россия).
Препрат фермента мTГ-азы 1* – PROBIND TX (содержащая мальтодекстрин) и мTГазы 2* – REVADA TG 11 (содержащая молочный белок и мальтодекстрин) производства BDF Natural Ingredients, SL. (Испания). Количество вносимой мTГ-азы рассчитывали по количеству белка. Содержание белка в молочной сыворотке и ферменте определяли методом Бредфорда [22].
При получении пленок в раствор из ХЗ, ЖТ и мТГазы в качестве пластификатора добавляли глицерин (ГЦ, ГОСТ 6259–75, ISO 2096:1972), “Глицерин.ру”, Россия).
ХЗ (2.0 г) растворяли в 100 мл 2%-ной уксусной кислоты при комнатной температуре. К полученному раствору ХЗ добавляли 10%-ный водный раствор ЖТ в различных соотношениях и смешивали. В смесь добавляли глицерин, а затем водный раствор мTГ-азы с концентрацией по белку от 0.9 до 14 мг/мл, смесь перемешивали на магнитной мешалке при температуре 55°С.
Пленки формировали методом свободного вообще то называется литья растекания на гладкую стеклянную поверхность заданной формы с испарением растворителя в течении 1–2 сут при температуре 24–28°С.
Толщину пленок определяли на приборе CHY-C2 (“Labthink Instruments Co.”, Китай), предел прочности и растяжение на универсальной испытательной машине XLW(PC) (“Labthink Instruments Co.”, Китай), плотность на плотномере H-200L (“Hildebrand Pruf-und Mebtechnik GmbH”, Германия) в соответствии с Международным стандартом [23].
Для исследования структурных изменений в биопленках использовали методы ИК-спектроскопии, компьютерной рентгеновской микротомографии, электронную и сканирующую микроскопию. ИК-спектры снимались в диапазоне 4000–800 см–1 на ИК-Фурье спектрометре Shimadzu IRPrestige-21 (“Shimadzu”, Япония). Для удобства идентификации проводили коррекцию базовой линии и проводили нормирование с помощью программы Shimadzu IRsolution (“Shimadzu”, Япония). Компьютерную рентгеновскую микротомографию производили с помощью микротомографа SkyScan-1172 (“SkyScan”, Бельгия). Результаты реконструкции микрофотографий анализировали в прилагаемом комплексе программ: CTan, CTvol, CTvox, CTviewer. Электронную сканирующую микроскопию производили на многофункциональном растровом электронном микроскопе SEM Quanta 200i 3D (“FEI Company”, США-Голландия).
Биоразлагаемость пленки определяли по количеству дней или месяцев необходимых для ее деградации в почве.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
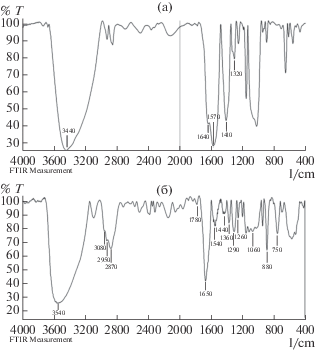
Степень дезацетилирования полученного ХЗ составила 78%, молекулярная масса – 170 кДа ±3%. ИК-спектры ХТ и ХЗ, полученного из ХТ, представлены на рис. 1а, 1б.
В спектре ХТ можно наблюдать характерные полосы при 3600–3200, 1640 см–1, обусловленные колебаниями N–Н- и О–Н-групп, и при 1410 см–1 колебаниями -СН2-группы. В ИК-спектре ХЗ наблюдались характерные полосы поглощения в областях 3600–3300 см–1 принадлежащие колебаниям связей О–Н и N–H, и 1650 см–1, которые свидетельствовали о присутствии NH2-группы. Деацетилирование ХТ приводило к появлению полосы поглощения при 1440 см–1, обусловленное деформационными колебаниями -СН2- и ‑СН3-групп, интенсивность которого свидетельствует о степени деацетилирования. О высокой степени дезацетилирования и наличия NH2-групп свидетельствовали также интенсивные и четкие полосы поглощения при частотах 1650 и 1540 см–1, характерные для амидных групп [24, 25]. По мнению ряда авторов, отношение поглощения в полосе 1650 см–1 к поглощению СН-группы при 2870 см–1, может служить показателем для оценки степени дезацетилированния ХТ [21, 25–27].
Известно, что эффективность сшивки белков и полисахаридов мTГ-азой зависит как от химической структуры полимеров, так и от вида и условий применения фермента. Например, в ряде работ показано, что мTГ-аза может сшивать различные биополимеры по свободным аминогруппам [28, 29]. На первом этапе исследовали влияние мTГ-азы 1 и 2 на агрегатное состояние ХЗ полученного нами из ХТ в лабораторных условиях.
Добавление мTГ-азы 1 и 2 к ХЗ вызывало образование стеклообразных ломких пластин с включениями. Причем при использовании мTГ-азы 2 образовывался более текучий и гелеобразный сгусток, из которого можно было формировать пленки. Вероятно, это связано с тем, что мTГ-аза 2 содержит молочный белок, придающий эластичность сгустку. Поэтому, для дальнейших исследований использовали мTГ-азу 2. По мнению ряда авторов аминогруппы ХЗ могут выступать в качестве акцептора ацила при сшивке мTГ-азой белок-белок и белок-ХЗ конъюгатов, которые в конечном итоге приводят к увеличению прочности геля [30].
С другой стороны, можно предположить, что наблюдаемый эффект связан с ретикуляцией фермента. Известно, что в присутствии сшивающих агентов, например, глутарового диальдегида в растворе ферментов, ферменты благодаря своей полифункциональности могут выступать в качестве носителей, при этом образуются нерастворимые сетки, в узлах которых находятся ферменты, связанные между собой азометиновыми связями. Такой подход, например, используют при ковалентной сшивке иммобилизованных ферментов. Возможно, в присутствии ХЗ и мTГ-азы 2, фермент выступает также в качестве мостика, при образовании ХЗ конъюгатов.
Известно, что мTГ-аза имеет большее сродство к ЖТ и сывороточным белкам, чем к полисахаридам. Причем, эффективность сшивки белков ферментом зависит от характеристик фермента, его источника, наличия наполнителей, коферментов, стабилизаторов и т.д. Кроме того, белки по сравнению с полисахаридами обладают большей пластичностью и гибкостью, и их наравне с пластификаторами вводят в смеси для получения гибких пленок [27]. В другой работе, показано, что формирование ХЗ-ЖТ полиэлектролитных комплексов может привести к снижению кристалличности системы [31]. Среди других факторов, влияющих на свойства ЖТ-ХЗ пленок можно отметить температуру испарения и наличие пластификаторов (воды и полиолов) [32]. Для улучшения характеристик пленок использовали смеси ХЗ в ЖТ в различных соотношениях, которые обрабатывали ферментом мTГ-азой 2 в различных концентрациях.
Было показано, что в отсутствии фермента полученные пленки были не эластичными, жесткими, с течением времени они становились ломкими, имели низкие значения прочности и растяжения (табл. 1). В присутствии фермента качество полученных пленок улучшалось. Лучшие образцы были получены при соотношении ХЗ-ЖТ 3 : 5. Такие образцы имели следующие показатели: прочность – 15.8 МПа, растяжение – 220.0%, толщина – 73.1 мкм, плотность – 1.9 г/см3 и по этим показателям уступали пленкам из полиэтилена. Дальнейшее увеличение содержания ЖТ снижало способность к растяжению. Для сохранения оптимальных значений прочности и растяжения в дальнейшем использовали соотношение ХЗ-ЖТ 3 : 5. По мнению некоторых авторов ХЗ не влияет на эффективность образования белковых гелей мTГ- азой. Однако эксперименты показали, что мTГ-аза ускоряла процесс образования ХЗ-ЖТ гелей. Причем в опытных образцах количество фермента оказывало незначительное влияние на прочность, плотность и толщину. В то же время существенно улучшало растяжение пленок. При увеличении количества фермента с 7 до 14 мг прочность практически не изменялась. Поэтому использование фермента в количестве более 7 мг по белку было нецелесообразным. В литературе широко дискутируется зависимость физико-механических показателей пленок, полученных из ХЗ и ЖТ, путем сшивки от соотношения компонентов [30]. По-видимому, одной из причин положительного влияния большего содержания ЖТ в исходном сырье является значение рН.
Таблица 1.
Влияние мTГ-азы на физико-механические (Ф-М) показатели пленок на основе ХЗ и ЖТ
| Ф-М параметры |
Соотно-шение ХЗ/ЖТ |
Концентрация фермента, мг белка/мл | |||||
|---|---|---|---|---|---|---|---|
| 0 | 0.9 | 1.8 | 3.5 | 7.0 | 14.0 | ||
| Прочность, МПа | 3 : 3 | 9.2 ± 0.3 | 11.2 ± 0.4 | 11.1 ± 0.5 | 12.8 ± 0.3 | 12.3 ± 0.7 | 10.5 ± 0.4 |
| 3 : 5 | 10.4 ± 0.3 | 12.1 ± 0.4 | 13.8 ± 0.4 | 15.2 ± 0.6 | 15.8 ± 0.6 | 15.5 ± 0.7 | |
| 3 : 10 | 11.2 ± 0.4 | 13.1 ± 0.4 | 14.1 ± 0.5 | 14.8 ± 0.6 | 14.5 ± 0.5 | 15.1 ± 0.6 | |
| Удлинение при растяжение , % | 3 : 3 | 28.1 ± 1.5 | 59.2 ± 3.2 | 72.2 ± 4.5 | 84.7 ± 7.5 | 134.7 ± 9.5 | 135.0 ± 9.1 |
| 3 : 5 | 29.5 ± 1.4 | 65.1 ± 2.5 | 78.2 ± 3.8 | 92.1 ± 4.5 | 210.1 ± 8.5 | 195.3 ± 8.1 | |
| 3 : 10 | 34.6 ± 2.1 | 41.6 ± 2.3 | 68.2 ± 3.5 | 73.1 ± 3.8 | 178.2 ± 8.3 | 145.3 ± 7.9 | |
| Толщина, мкм | 3 : 3 | 65.6 ± 1.5 | 68.5 ± 1.9 | 70.6 ± 3.1 | 73.7 ± 3.0 | 82.7 ± 3.5 | 84.1 ± 3.4 |
| 3 : 5 | 65.8 ± 2.1 | 62.1 ± 2.5 | 63.8 ± 2.3 | 65.2 ± 2.4 | 73.1 ± 2.9 | 90.1 ± 3.5 | |
| 3 : 10 | 61.2 ± 1.4 | 55.4 ± 2.1 | 65.2 ± 2.5 | 60.2 ± 1.9 | 56.3 ± 25.0 | 100.2 ± 4.1 | |
| Плотность, г/см3 | 3 : 3 | 1.52 ± 0.03 | 1.29 ± 0.02 | 1.38 ± 0.03 | 1.37 ± 0.03 | 1.41 ± 0.04 | 1.13 ± 0.03 |
| 3 : 5 | 1.61 ± 0.03 | 1.48 ± 0.04 | 1.43 ± 0.03 | 1.62 ± 0.04 | 1.91 ± 0.05 | 1.43 ± 0.03 | |
| 3 : 10 | 1.82 ± 0.04 | 1.24 ± 0.03 | 1.56 ± 0.03 | 1.64 ± 0.04 | 1.81 ± 0.04 | 1.42 ± 0.03 | |
Для сравнения пленки из полиэтилена со сравнимыми плотностью и толщиной имеют следующие характеристики: прочность на разрыв 13.7 МПа, удлинение при растяжении – 190%.
Известно, что оптимум рН микробных мTГ-аз находится в диапазоне 6.0–7.0 [33]. При смешивании используемого нами кислого ХЗ с ЖТ в соотношении 3 : 3 конечное значение рН было 4.8, а при соотношении 3 : 5 – 6.7. Кроме того, экспериментально показано, переход золь-гель уменьшается с увеличением содержания ХЗ. Высокое содержание ХЗ делает более трудным взаимодействие между цепями ЖТ и образованием гелевых сетей [31]. Добавление ХЗ в более высокой концентрации приводит к существенному увеличению модуля вязкости во время охлаждения и препятствует образованию сети белков в результате ХЗ-ЖТ взаимодействий. Хотя в некоторых работах показано, что прочность ХЗ-ЖТ гелей, катализируемых мТГ-азой, незначительно увеличивается с повышением содержания ХЗ [31, 32]. Вероятно, такие противоречивые результаты связаны с разными молекулярными массами используемого ХЗ, так как сшитый гель построен из полимеров (ЖТ и ХЗ) с бимодальными молекулярно-массовым распеределением.
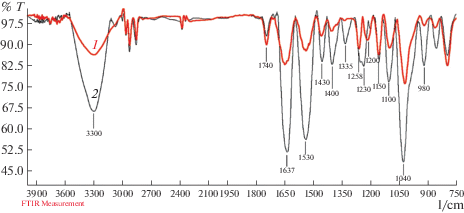
Для обнаружения образования связей между отдельными компонентами при формировании пленок регистрировали ИК-спектры контрольного и лучшего из опытных образцов (рис. 2). Данные сравнительного анализа спектров пленок в ИК-области показали, что в спектрах пленок из ХЗ, ЖТ и ГЦ, в отсутствии мTГ-азы наблюдались характерные полосы поглощения высокой интенсивности в диапазоне частот 3500–3300 см–1, 1650, 1550 и 1320 см–1, которые принято относить к полосам Амид А (NH), I (Co, NH), II (CH2, NH) и III (CN, NH) в молекулах ЖТ, а также ХЗ с незначительным смещением. Особое внимание заслуживают интенсивные полосы поглощения характерные для аминокислот ЖТ, а именно лизина – в области 1238–1230 см–1, и в области 1200–1020 см–1 – глутаминовой кислоты, глицина и аргинина, и 1150 см–1 – принадлежащей связи C–N в молекулах ХЗ (рис. 6, 7 ) [32]. В спектрах поглощения исходного ХЗ эти полосы размыты и четко не проявляются (рис. 1б). Когда два или более веществ смешиваются, химические взаимодействия отражаются изменениями в характерных спектрах поглощения этих веществ. При смешивании ХЗ и ЖТ полосы поглощения при 3540 см–1 на спектре хитозана, и 1650 и 1560 см–1 на спектре ХЗ и ЖТ смещаются, хотя интенсивность поглощения практически не изменяется. Вероятнее всего это связано с взаимодействием между гидроксильными или карбоксильными группами с аминогруппами ХЗ и ЖТ [34, 35]. Известно, что сложный контур полосы Амид I качественно объясняется наложением полос, отвечающих различным конформационным состояниям полипептидной цепи. Клубку соответствует полоса 1656 см–1, спирали – 1650 см–1, параллельной укладке цепей – 1630 см–1, антипараллельной укладке – 1685 см–1. Смещение полосы Амид I в низкочастотную область 1636 см–1 для гелей с добавками ХЗ по сравнению с чистым гелем ЖТ дает основание полагать, что конформационное состояние макромолекул ЖТ при комплексообразовании с ХЗ меняется в сторону увеличения доли упорядоченных структур. Например, показано, что добавление полисахаридов приводит к увеличению предела текучести и модуля упругости геля ЖТ. Можно полагать, что наблюдаемое возрастание прочности и вязкоупругих свойств гелей связано с изменением конформационного состояния макромолекул ЖТ при формировании межмолекулярных контактов с полисахаридом [36, 37]. В опытном образце в присутствии мTГ-азы даже с учетом того, что мTГ-аза содержит аминогруппы, наблюдалось снижение интенсивности поглощения в области 3500–3300 см–1, обусловленные колебаниями амида А (NH) свободных аминогрупп ЖТ. Наблюдалось расщепление и смещение полосы поглощения валентных колебаний N–H-связей в области 1238 см–1 характерных для лизина, а в диапазоне 1200–1020 см–1 – характерных для аминогрупп алифатических аминокислот – глутаминовой кислоты, глицина, аргинина и лизина, интенсивность поглощения уменьшалась (рис. 2, 1), что говорит об образовании ковалентных связей между свободными аминогруппами и гамма-карбоксамидными группами глутамина, способствуя сшиванию белковых молекул, в результате действия мTГ-азы. В итоге свободные аминогруппы сменяются связанными. Кроме того, в образование структуры определенный вклад могут вносить взаимодействия между карбоксильными группами ЖТ и аминогруппами ХЗ.
Анализ структурных изменений, происходящих в результате добавления в смесь мTГ-азы методом лазерной томографии и растровой электронной микроскопии показал, что добавление мTГ-азы 2 повышало плотность упаковки и образовывало сшивки между компонентами пленки (рис. 3, 4). На рис. 3а, 3б видно, что в отсутствии фермента пленка менее плотная, чем с ферментом. На фотографиях, полученных в электронном микроскопе, в пленках без фермента четко прослеживалась слоистая структура пленки, в отличии от пленок с ферментом, на которых можно наблюдать более целостную структуру (рис. 4а, 4б).
Рис. 3.
Рентгено-дифрактометрический анализ контрольных и опытных образцов пленок состава ХЗ-ЖТ-ГЦ (а) и ХЗ‑ЖТ-ГЦ-мTГаза (б).

Для проверки биоразлагаемости полученных пленок проводилась их деструкция в естественных условиях при непосредственном контакте почвы с пленкой. Данные по деструкции пленок представлены на рис. 5. Как видно из представленных рисунков в течении 20–30 сут происходило разложение пленок в естественных условиях.
* * *
В результате проведенных исследований выявлено, что применение трансглютаминазы способствует ускорению гелеобразования смеси хитозан- желатин, из которой можно формировать биоразлагаемые пленки по своим характеристикам не уступающим пленкам из полиэтилена. Полученные пленки можно использовать для изготовления упаковочных материалов и в медицине в качестве матрицы для иммобилизации лекарственных препаратов, обладающих антибактериальными свойствами и регенерирущими свойствами.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (выполнение государственного задания) в рамках научного проекта № FZRS-2020-0003.
Список литературы
Siracusa V., Rocculi P., Romani S., Rosa M.D. // Trends in Food Science & Technology. 2008. V. 19. P. 634–643.
Kadimaliev D.A., Telyatnik V.I., Revin V.V., Parshin A.A., Allahverdi S., Gunduz G., Kezina E.V., Asik N. // BioResources. 2012. V. 7. № 2. P. 1984–1993.
Kadimaliev D.A., Kezina E.V., Telyatnik V.I., Revin V.V., Parchaykina O.V., Syusin I.V. // BioResources. 2015. V. 10. № 1. P. 1644–1656.
Revin V.V., Kadimaliev D.A., Novokuptsev N. // BioResources. 2016. 11. № 2. P. 3244–3258.
Kadimaliev D.A., Novokuptsev N.V., Abd A.J., Revin V.V., Grunyushkin I.P., Pestov N.A. // J. Mater. Environ. Sci. 2018. V. 9. № 9. P. 2539–2548.
Пaтeнт PФ. 2015. № 2545293.
Briassoulis D. // J. Polym. Environ. 2004. V. 12. P. 65–81.
Пaтeнт PФ. 2016. № 2604223.
Пaтeнт PФ. 2020. № 2720099.
Kadimaliev D.A., Kezina E.V. // J. Biotechnol. 2015. V. 208. P. S 57–S58.
Montgomery R. // Biores. Technol. 2004. V. 91. P. 1–29.
Yang L., Paulson A.T. // Food Res. Int. 2000. V. 33. P. 563–570.
Пaтeнт PФ. 2018. № 2659175.
Громовых Т.И., Садыкова В.С., Луценко С.В., Дмитренок А.С., Фельдман Н.Б., Данильчук Т.Н., Каширин В.В. // Прикл. биохимия и микробиология. 2017. Т. 53. № 1. С. 69–75.
Скрябин К.Г., Вихорева Г.А., Варламов В.П. Хитин и хитозан. Получение, свойства и применение. / Ред. К.Г. Скрябин, Г.А. Вихорева, В.П. Варламов. М.: Наука, 2002. 365 с.
Vera A., Tapia C., Abugoch L. // Int. J. Biol.Macromol. 2020. V. 144. P. 536–543.
Minh N.P., Nhan N.P.T., Phuong N.T.T., Vinh T.Q., Van Quy T., Binh L.T. // J. Pharm. Sci. & Res. V. 11. № 4. 2019. P. 1487–1492.
Fernandez J.G., Seetharam S., Ding C., Feliz J., Doherty E., Ingber D.E. // Tissue Engineering Part A. 2017. V. 23. № 3–4. P. 135–142.
Пaтeнт PФ. 1997. № 2116314.
Быкова В.М. Немцев С.В. // Хитин и хитозан. Получение, свойства и применение. М.: Наука, 2002. С. 7–23.
Арзамасцев О.С., Артеменко С.Е., Абдулин В.Ф., Арзамасцев С.В. // Вестник СГТУ. 2011. № 4(60). Вып. 2. С. 112–114.
Bradford M.M. // Anal. Biochem. 1976. V. 72. P. 248–254.
ASTM D882-12. Standard Test Method for Tensile Properties of Thin Plastic Sheeting. ASTM International. West Conshohocken. PA. 2012.
Гартман О.Р., Воробьева В.М. // Фундаментальные исследования. 2013. № 3. С. 1188–1192.
Кучина Ю.А., Долгопятова Н.В., Новиков В.Ю., Сагайдачный В.А., Морозов Н.Н. // Вестник МГТУ. 2012. Т. 15. № 1. С. 107–113.
Lawrie G., Keen I., Drew B., Chandler-Temple A., Rintoul L., Fredericks P., Grondahl L. // Biomacromolecules. 2007. V. 8. P. 2533–2541.
Rodrfguez-Nogales J.M. // Process Biochem. 2006. V. 1. P. 430–437.
Minh N.P., Nhan N.P.T., Phuong N.T.T., Vinh T.Q., Van Quy T. // J. Pharmaceutical Sciences and Research. 2019. V. 11. № 4. P. 1487–1492.
Fernandez J.G., Seetharam S., Ding C., Feliz J., Doherty E., Ingber D.E. // Tissue Engineering Part A. 2017. V. 23. № 3–4. P. 135–142.
Benjakul S., Visessanguan W., Phatchrat S., Tanaka M. // Journal of Food Biochemistry. 2003. V. 27. P. 53–66.
Gomez-Estaca J., Gomez-Gullen M.C., Fernandez-Martin F., Montero P. // Food hydrocolloids. 2011. V. 25. № 6. P. 1461–1469.
Yampolskaya G.P., Tarasevich B.N., Elenskiy A.A. // Kolloidnyiy zhurnal. 2005. V. 67. № 3. P. 426–432.
Jun-Hyun O. // Fish Aquat Sci. 2012. V. 15(1). P. 9–14.
Xu Y.X., Kim K.M., Hanna M.A., Nag D. // Industrial Crops and Products. 2005. V. 21. P. 185–192.
Meenakshi P., Noorjahan S.E., Rajini R., Venkateswarlu U., Rose C., Sastry T.P. // Bull. Mater. Sci. 2002. V. 25. P. 25–29.
Маклакова А.А., Воронько Н.Г., Деркач С.Р., Кадырова Г.И., Зотова К.В. // Вестник МГТУ. 2014. Т. 17. № 1. С. 53–60.
Деркач С.Р., Воронько Н.Г., Маклакова А.А., Кондратюк Ю.В. // Коллоидный журн. 2014. Т. 76. № 2. С. 164–170.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология