Прикладная биохимия и микробиология, 2021, T. 57, № 2, стр. 127-137
Иммунодоминантные белки покоящихся форм Mycobacterium tuberculosis
К. А. Трутнева 1, В. Г. Авдиенко 2, Г. Р. Дёмина 1, М. О. Шлеева 1, М. С. Шумков 1, Е. Г. Салина 1, А. С. Капрельянц 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Федеральное государственное бюджетное учреждение
“Центральный научно-исследовательский институт туберкулеза”
107564 Москва, Россия
* E-mail: arseny@inbi.ras.ru
Поступила в редакцию 26.08.2020
После доработки 20.10.2020
Принята к публикации 02.11.2020
Аннотация
Для выявления иммунодоминантных белков, экспрессируемых клетками Mycobacterium tuberculosis (Mtb) в условиях, приближенных к персистенции возбудителя туберкулеза в организме хозяина, изучали белковый профиль покоящихся клеток Mtb in vitro, образующихся в результате постепенного закисления среды выращивания и длительного хранения. Согласно 2D электрофорезу в таких клетках сохранялось большое разнообразие белков, хотя состав белков в протеомных профилях активно растущих и покоящихся клеток существенно отличался. Методом иммуноблоттинга с использованием пулированных сывороток крови больных туберкулезом в покоящихся клетках выявлено 10 белков, способных связываться с иммуноглобулинами. Два белка (Rv2018 и Rv0341) являются новыми иммуногенными, ранее не описанными в литературе. Из найденных иммуногенных белков были отобраны четыре (Rv0341, Rv2018, Rv1509, Rv2986) c наибольшей структурной специфичностью для Mtb за счет содержания уникальных протяженных доменов. Гены, кодирующие данные белки были клонированы в клетках E. coli для получения рекомбинантных белков на основе pET-вектора. Рекомбинантные белки распознавались антителами в индивидуальных сыворотках больных туберкулезом. От 5 до 45% больных (для разных антигенов) имели концентрации иммуноглобулинов, превышающие средние значения у здоровых доноров. Максимальное превышение демонстрировал белок Rv2986. Таким образом, изучение фенотипически измененных (покоящихся) клеток Mtb позволило обнаружить специфический набор иммунодоминантных белков, которые могут в дальнейшем быть использованы для выбора и конструирования полипептидов пригодных для серодиагностики активного/латентного туберкулеза.
Туберкулез (ТБ) остается опасным заболеванием, вызывающим 1.5 млн случаев смерти и около 10 млн новых случаев в год (https://www.who.int/ news-room/fact-sheets/detail/tuberculosis). Хотя ситуация с туберкулезом в России в последние годы стабилизируется, Российская Федерация по-прежнему находится в списке стран, где отмечена эпидемия туберкулеза. В 2019 г. Россия вошла в двадцатку стран с наиболее негативной ситуацией в отношении распространения туберкулеза. (https:// www. who.int/news-room/fact-sheets/detail/ tuberculosis). Ситуация осложняется высоким и растущим уровнем обнаружения штаммов, устойчивых к антибиотикам первой линии (до 29% в 2018 г).) [1]. Дополнительной проблемой в эпидемиологии туберкулеза является очень большое количество людей, имеющих латентную форму туберкулеза, до 1/4 населения Земли, по данным ВОЗ. Некоторые эпидемиологи считают, что около 80% населения России латентно инфицировано Mycobacterium tuberculosis (Mtb), в то время как выявление таких форм затруднено, поскольку в этом случае туберкулез связан с неактивными (покоящимися) и “некультивируемыми” бактериями, которые нуждаются в специальной процедуре для их реактивации.
Несмотря на значительный прогресс в понимании механизмов, лежащих в основе латентного туберкулеза, многие аспекты длительной персистенции возбудителя в организме хозяина остаются не разгаданными. Очевидно, что в этом процессе значительная роль отводится взаимодействию возбудителя и хозяина, в частности взаимодействию с его иммунной системой [2]. В этой связи особый интерес имеет установление набора иммуногенных белков покоящихся форм (ПФ) Mtb, которые по биохимическому составу значительно отличаются от активно размножающихся бактерий [3, 4].
С другой стороны, выявление пула иммунодоминантных белков ПФ Mtb может представлять интерес для выбора антигенов для серодиагностики ТБ. Необходимо отметить, что такой выбор, как правило, основан на знаниях о продукции белков Mtb во время активного роста, что на самом деле далеко от реальной ситуации пребывания Mtb в организме хозяина. Очевидно, для успешной серодиагностики необходимы знания о репертуаре антигенов Mtb, экспрессируемых in vivo в условиях воздействия стресса на патоген, например, факторов иммунной системы организма. В этом контексте покоящиеся формы Mtb, образующиеся в условиях стрессорных воздействий на клетки бактерий in vitro, могут представлять уникальную модель состояния возбудителя для изучения антигенного репертуара, близкого к ситуации in vivo. Это диктует необходимость проведения фундаментальных исследований в области “стрессорной” протеомики микобактерий.
Цель работы – выявление иммунодоминантных белков Mtb, экспрессируемых в экспериментальной модели стрессированных клеток in vitro методами протеомики и иммунологии.
МЕТОДИКА
Образование покоящихся форм M. tuberculosis. В работе был использован штамм Mtb дикого типа H37Rv (получен из ЦНИИ туберкулеза), который первоначально выращивали на стандартной среде Сотона (г/л): KH2PO4 – 0.5; MgSO4 · · 7H2O – 1.4; L-аспарагин – 4.0; цитрат аммония трехвалентного железа – 0.05; цитрата натрия – 2.0; 1%-ный ZnSO4 – 0.1 мл, глицерин – 60 мл; рН 7.0 (доводили 1 М NaOH) и добавляли АДС (бычий сывороточный альбумин, глюкоза и NaCl) и Tвин-80 – 0.05% [5].
Покоящиеся “некультивируемые” микобактерии, утратившие способность расти на плотных средах (“некультивируемость”, НК) вследствие постепенного подкисления среды в течение стационарной фазы роста, были получены, как описано ранее [3]. Бактерии выращивали в течение 12–15 сут в 50 мл среды Сотона с добавлением 0.05% Твин-80 и АДС в колбах объемом 100 мл на орбитальном шейкере (200 об./мин). Эти бактериальные культуры использовали для пересева в модифицированную среду Сотона с целью получения НК Mtb. Модификация среды Сотона заключалась в замене Tвин-80 на 0.025%-ный тилоксапол и АДС на 0.5%-ный бычий альбумин Cohn-Analog (“Sigma”, США) . В отличие от стандартной среды Сотона (с рН 7.0) начальные значения рН в модифицированных средах составляли 6.2. 200 мл модифицированной среды Сотона помещали в колбу объемом 500 мл (3–5 колб на один эксперимент) и инкубировали при 37°С в течение 40–60 сут при перемешивании. Величину рН среды измеряли периодически и, когда значение рН, пройдя через максимум (pH 7.7), вновь достигало 6.0–6.2 в стационарной фазе, культуры переносили в закрытые пластиковые 50-миллилитровые пробирки и добавляли 2-(N-морфолино)этансульфоновую кислоту (МЭС) для получения конечной концентрации 20 мМ и предотвращения дальнейшего подкисления при длительном хранении. Инкубацию продолжали в статических условиях при комнатной температуре в темноте в течение 1 г. после засева.
2D электрофорез. Активные и покоящиеся клетки, полученные в четырех биологических повторах эксперимента, описанного выше, объединяли. Количество клеток составляло приблизительно 3.5 г влажной массы. Бактериальную культуру центрифугировали при 7000 об./мин в течение 15 мин и 10 раз промывали буфером, содержащим (г/л): NaCl – 8, KCl – 0.2 и Na2HPO4 – 0.24 (pH 7.4). Осадок клеток ресуспендировали на льду в 100 мМ буфере HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) pH 8.0, содержащем коктейль ингибиторов протеаз (“Sigma”, США) и фенилметансульфонилфторид (PMSF), а затем разрушали клетки с использованием шариков циркония на гомогенизаторе FastPrep-24 (MP Biomedicals, США) в течение 1 мин 5 раз для активных клеток и 10 раз для покоящихся клеток. Лизат центрифугировали при 13 000 g в течение 15 мин при 4°С. Супернатант разделяли на мембранную (осадок) и цитозольную фракции (супернатант) с использованием ультрацентрифугирования при 100 000 g в течение 2 ч по принципу седиментации.
Мембранную фракцию трижды промывали буфером HEPES с использованием ультрацентрифугирования, выделяли экстракцией с использованием детергента додецилсульфата натрия (2%-ного ДДС-Na).
Цитозольную фракцию и мембранный экстракт осаждали с использованием набора для очистки ReadyPrep 2-D (“BioRad”, США) для селективного осаждения и удаления из образцов белка загрязнений, таких как детергенты, липиды и фенольные соединения. Такое осаждение позволяет ресуспендировать осадок белка в буфере для изоэлектрофокусирования, содержащем 8 М мочевину, 2 М тиомочевину, 10 мМ 1,4-дитиотреитол (ДТТ), 2 мМ трис (2-карбоксиэтил)фосфин-гидрохлорид (ТСЕР), 1% (вес/об. CHAPS, 1% (вес./об.) Tритон X-100, 1% (вес./об. амидосульфобетаин-14 (AСБ) и 0.4% (об./об. амфолитов (pH 3–10).
Изоэлектрическое фокусирование проводили в 5%-ном полиакриламидном геле (ПААГ) (30%, акриламид/бисакриламид, 8 М мочевина, 2% амфолитов, рН 3–10 и 4–6 (1 : 4), 1% CHAPS, 1% Tритон X-100, 0.4% AСБ) с использованием стеклянных трубочек с внутренним диаметром 2.4 мм в камере для изоэлектрофокусирования (модель Tube Cell 175, “BioRad”, США) до достижения 3700 В/ч вольт-часов.
Для анализа использовали 100 мкг белка каждого образца. После фокусировки гели извлекали из стеклянных трубок и фиксировали в буфере 1 (0.375 М Трис-HCl, рН 6.8, 2 М мочевина, 20%-ный (об./об.) глицерин, 2% ДДС, 2%-ный ДДТ) и буфере 2 (0.375 М Трис-HCl, рН 6.8, 2 М мочевина, 20%-ный глицерин, 2% ДДС и 0.01%-ный бромфеноловый синий) по 15 мин в каждом. Второе направление проводили как описано в работе О’Фарелл [6], на больших пластинах (20 × 20 см), в 12%-ных гелях ПААГ с ДДС-Na толщиной 1.5 мм в стандартном трис-глициновом буфере в ячейке PROTEAN II xi для вертикального электрофореза (“BioRad”, США). Гели окрашивали Coomassie CBBG-250 (Roti-Blue “Carl Roth”, Германия) с последующим окрашиванием серебром (https:// www.alphalyse.com/wp-content/uploads/2015/09/Silver-stained-protocol.pdf).
Фотографии гелей получали с использованием Syngene G: BOX Gel & Blot Imaging Systems (“Syngene”, Великобритания). Изображения гелей, окрашенные Coomassie, анализировали с использованием программного обеспечения TotalLab TL120 для расчета плотности пятна.
Каждое видимое пятно белка, соответствующее пятну на иммуноблоте вырезали вручную из геля и анализировали как отдельный образец с использованием анализа MALDI-TOF. Данные MS/MS, полученные после проведения MALDI-TOF, были использованы для поиска в базе данных Mascot Protein (MSDB) для определения белков. Функции белка были взяты из базы данных Tuberculist. Каждый образец для 2D анализа был проверен дважды.
Анализ белков методом MALDI-TOF. Триптический гидролиз белка в ПААГ, окрашенном Coomassie Brilliant Blue, проводили следующим образом. Кусочек геля размером 3–4 мм3 дважды промывали для удаления красителя в 100 мкл 40%‑ного раствора ацетонитрила в 0.1 М NH4HCO3 в течение 20 мин при 37°С.
Гидролиз белка в ПААГ, окрашенного серебром, проводили следующим образом. Кусочек геля размером 3–4 мм3 дважды промывали для удаления красителя в 100 мкл смеси 30 мМ K3Fe(CN)6 и 100 мМ Na2S2O3 (1 : 1) в течение 15 мин. Удалив жидкую фазу, 3 раза отмывали деионизированной водой в течение 10 мин. После удаления красителя гель промывали 40% раствором ацетонитрила в 0.1 М NH4HCO3 в течение 20 мин.
После удаления отмывочных растворов для дегидратации геля добавляли 100 мкл ацетонитрила. Удалив ацетонитрил и высушив кусочек геля, добавляли 3.5 мкл раствора модифицированного трипсина (“Promega”, США) в 0.05 М NH4HCO3 с концентрацией 15 мкг/мл. Гидролиз проводили в течение 5 ч при 37°С, затем к раствору добавляли 5.25 мкл 0.5%-ного ТФУ в 50%-ном растворе водного ацетонитрила и тщательно перемешивали. Раствор над гелем использовали для получения MALDI-масс-спектров.
Подготовка образцов для масс-спектрометрии проводилась следующим образом: на мишени смешивали по 1.5 мкл раствора образца и 0.5 мкл раствора 2,5-дигидроксибензойной кислоты (10 мг/мл в 20%-ном водном ацетонитриле, 0.5% ТФУ), полученную смесь высушивали на воздухе.
Масс-спектры были получены на MALDI-времяпролетно-времяпролетном масс-спектрометре Ultraflextreme (“Bruker”, Германия), оснащенном УФ лазером (Nd) в режиме положительных ионов с использованием рефлектрона. Точность измеренных моноизотопных масс после докалибровки по пикам автолиза трипсина составляла 0.007% (70 ррм). Спектры получали в диапазоне масс 500–6500 m/z, выбирая мощность лазера оптимальную для достижения наилучшего разрешения. Для получения спектров фрагментации использовали тандемный режим прибора, точность измерения фрагментных ионов была не менее 2 Да.
Идентификацию белков осуществляли при помощи сервиса NCBI Blast. По предполагаемым аминокислотным последовательностям спектров фрагментации отдельных пептидов были подобраны кандидаты среди белков других организмов. Масс-спектры были обработаны с помощью программного пакета FlexAnalysis 3.3 (“Bruker Daltonics”, Германия).
Иммуноблоттинг. Иммуноблоттинг проводили после переноса белков с геля на ПВДФ-мембрану в камере Protean (Bio-Rad, США). Реакцию первичных антител проводили в растворе, содержащем антитела больных или здоровых людей, разведенных в соотношении 1 : 300, 5%-ный бычий сывороточный альбумин, 0.1 M NaCl в течение 1 ч. Затем мембраны отмывали тем же раствором, не содержащим антител 3 раза по 10 мин. Гибридизацию вторичными антителами проводили с использованием иммунопероксидазного конъюгата козьих античеловеческих антител (“Sigma-Aldrich”, США), разведенных в соотношении 1 : : 20 000. После отмывки от вторичных антител визуализацию пятен проводили с помощью BCIP (5-бром-4-хлор-3-индолилфосфат) и NBT (нитро-синий тетразолий хлорид) (“Sigma-Aldrich”, США) согласно рекомендациям производителя.
Получение рекомбинантных белков. Клонирование генов, кодирующих белки Rv0341, Rv2018, Rv1509, Rv2986, Rv0432, Rv3676 осуществляли по геномной ДНК штамма M. tuberculosis H37Rv с использованием праймеров F 5'-GGCACGcatatgACCTCGCTTATCG-3' (строчными буквами выделен сайт узнавания рестриктазы NdeI) и R 5'-GCGTAggatccAGATCACGGTATGC-3' (выделен сайт BamHI) для гена Rv0341, F 5'-GTGAATcatatgGCTGGCGACC-3' (выделен сайт NdeI) и R 5'-GctcgagGATTCCGATCAGGCT-3' (выделен сайт XhoI) для гена Rv2018, F 5'-catatgGTGTTTGCGTTGAGTAATAATCTG-3' (выделен сайт NdeI) и R 5'-ggatccTTACCTCTTCGTTAGCCGCAC-3' (выделен сайт BamHI) для гена Rv1509, F 5'-ATCcatatgATGAACAAAGCAGAGCTCATT-3' (выделен сайт NdeI) и R 5'-CATggatccCTATTTGCGACCCCGCCGAGC-3' (выделен сайт BamHI) для гена Rv2986, F 5'-ATCggatccATGCCAAAGCCCGCCGATCAC-3' (выделен сайт BamHI) и R 5'-CATTaagcttGCCGGAACCAATGACACCGCA-3' (выделен сайт HindIII) для гена Rv0432, F 5'-ATCgaattcGTGGACGAGATCCTGGCCAGG-3' (выделен сайт EcoRI) и R 5'-CATTaagcttCCTCGCTCGGCGGGCCAGTCT-3' (выделен сайт HindIII) для гена Rv3676.
Полученные ПЦР-продукты генов Rv0341 и Rv1509 были лигированы в промежуточный вектор pGEM-T easy (“Promega”, США), а затем перенесены в конечную плазмиду pET19b. Клонирование кодирующей части генов Rv2018 и Rv2986 осуществляли непосредственно в вектор pET19b, без промежуточных этапов. Клонирование генов Rv0432, Rv3676 осуществляли в вектор pET23a. Конструкции трансформировали в экспрессионный штамм E. coli BL21DE3. Активация экспрессии рекомбинантных белков с полученных плазмид обеспечивала синтез белка с полигистидиновым тагом (10 Нis), расположенным на N-конце полипептида (вектор pET19b) и с полигистидиновым тагом (6 Нis), расположенным на C-конце полипептида (вектор pET23a). Как промежуточные, так и итоговые генетические конструкции были проверены методами ПЦР и секвенирования.
Для каждого белка были оптимизированы условия выделения и очистки с использованием металлохелатной хроматографии в денатурирующих условиях. Для получения белка отдельную колонию засевали в 50 мл МПБ с 100 мкг/мл ампициллина. Культуру инкубировали в течение ночи при перемешивании (220 об./мин) и 37°С. Затем 200 мл среды МПБ (2–4 колбы по 200 мл среды), содержащей 100 мкг/мл ампициллина, инокулировали 1% ночной культуры, индуктор экспрессии изопропил-β-D-тиогалактозид (ИПТГ, 1 мМ) вносили после достижении оптической плотности в культуре ОП600 0.5–0.6. Последующую инкубацию проводили с перемешиванием при температуре 37°С или при комнатной температуре (холодовая индукция) в течение 4–5 ч. При низком уровне экспрессии белка индукцию проводили в течение ночи. Клетки собирали центрифугированием 4000 g в течение 15 мин, ресуспендировали в 5 мл буфера, содержащего 5 мМ имидазол, 0.5 М NaCl, 20 мM Tрис-HCl, pH 8.0 (буфер 1х ВВ), в присутствии 8 М мочевины. Клеточную биомассу хранили при –20°С в течение 2–4 нед.
К размороженной клеточной биомассе добавляли ДНКазу (5 ед.) и РНКазу (5 мкг) в присутствии Mg2+ (5 мМ) и 1х ВВ, pH 8.0 (к рекомбинантному белку Rv1509 добавляли 1х ВВ, pH 9.0). После разрушения клеточной биомассы на ультразвуковом дезинтеграторе (3–5 раз по 1 мин) дважды проводили центрифугирование 10000 g в течение 30 мин при 4°С. Надосадочную жидкость наносили на колонку c Ni2+-NTA-сефарозой 6B, уравновешенную 1х ВВ. После нанесения образца колонку промывали 10 объемами 1х ВВ.
Белок получали в 2 стадии: 1 стадия – снижение концентрации мочевины с 8.0 М до 0 (градиент мочевины) в течение 40 мин; 2 стадия – элюция белка имидазолом 5–500 мМ (ступенчато) в течение 1ч 20 мин.
Диализ каждого рекомбинантного белка проводили с соответствующим буфером. Диализ белка Rv0341 проводили против буфера: 10 мМ Na2HPO4, 5 мМ NaCl, pH 8.0. Диализ белка Rv1509 проводили против буфера: 25 мM Трис-HCl, 250 мM NaCl, pH 9.0. Диализ белка Rv2018 проводили против буфера: 20 мM Трис-HCl, 200 мM NaCl, pH8.0. Диализ белков Rv2986, Rv0432, Rv3676 проводили против буфера: 40 мM Трис-HCl, 150 мM NaCl, pH 8.0. Диализ проводили дважды при температуре 4°С. Белки фильтровали через фильтр Millex-GV, Millipore 0.22 мкм (“Sartorius”, Германия) и хранили при 4°С.
Измерение концентрации белков проводили методом Флорес [7] и/или на спектрофотометре (“BioDrop”, Германия) по соотношению поглощения при 280 и 260 нм, с учетом коэффициента молярной экстинкции.
Чистоту рекомбинантных белков оценивали методом электрофореза в 12%-ном ПААГ и иммуноблотом, со специфическими анти-His антителами и подтверждали методом МАЛДИ.
Определение концентрации белков по Флорес. К 0.1 мл анализируемого раствора белка добавляли 0.9 мл раствора красителя (0.0075%-ный раствор бромфенолового синего, 15%-ный этанол и 2.5%‑ная уксусная кислота). Оптичекую плотность измеряли на спектрофотометре при 610 нм. Для построения калибровочной кривой использовали БСА. Каждую пробу анализировали в трех повторностях.
Определение концентрации иммуноглобулинов в сыворотках крови методом ELISA. Сорбцию препарата антигена осуществляли в лунках 96-луночного планшета “Costar, США” с высоким связыванием в течение ночи при 4°С из 100 мкл раствора с концентрацией 1.0 мкг/мл в 10 мМ фосфатном буфере, рН 7.4, с 0.17 М NaCl (ФБС). Планшет четырехкратно отмывали фосфатным буфером, содержащим 0.05% Tвин-20 (ФБСТ), после чего в лунки вносили по 100 мкл сывороток, разбавленных ФБСТ от 1 : 50, а также стандарты аффинновыделенных противотуберкулезных антител человека (от 0 до 1000 мкг/мл) и инкубировали 30 мин при 37°С. Затем планшет трехкратно отмывали, добавляя по 100 мкл раствора моноклональных антител против IgG человека в ФБСТ, меченных пероксидазой (1 : 1000), и инкубировали 30 мин при 37°С. После трехкратной отмывки планшета определяли иммуноферментную реакцию в каждой лунке. Для этого в лунки вносили по 100 мкл 50 мМ цитратно-ацетатного буфера, pH 5.2, с 0.035%-ным 3,3',5,5'-тетраметилбензидином, и 0.01%-ным Н2О2, инкубировали 15 мин при комнатной температуре, останавливали реакцию 1.0 M H2SO4 и измеряли ОП при 450 нм. Концентрацию связавшихся иммуноглобулинов рассчитывали по калибровочной кривой со стандартами противотуберкулезных антител человека.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для выявления иммунологически реактивных белков в клетках Mtb в состоянии, приближенному к ситуации in vivo, использовали покоящиеся клетки Mtb, образующиеся в результате длительного культивирования в условиях постепенного закисления среды при выращивании в пост-стационарной фазе [3]. Как известно, закисление среды является основным фактором, ограничивающим рост клеток возбудителя туберкулеза в макрофагах [8]. Из полученных таким образом клеток, а также из активно делящихся клеток Mtb были выделены белки цитозольной и мембранной фракции и получены белковые профили методом двумерного электрофореза (2D электрофореза) [4]. Несмотря на длительное хранение покоящихся клеток без деления протеом таких клеток сохранял большое количество белков, хотя и отличался по содержанию отдельных белков от протеома активных клеток. Стабильность белков, возможно связана с наличием значительного количества ферментов, участвующих в защите от окислительного стресса, а также шаперонов. Протеом покоящихся форм содержал ферменты, участвующие в специфических метаболических путях, потенциально обеспечивающих метаболизм на низком уровне, или эти белки могут быть “запасены” для использования в процессе реактивации до начала процессов биосинтеза [4].
Для обнаружения иммунореактивных белков в стрессированых клетках Mtb был проведен иммуноблоттинг с переносом белков (активных и покоящихся микобактерий), полученных при проведении 2D электрофореза. В качестве первичных антител использовали выделенные иммуноглобулины из пулированной сыворотки больных туберкулезом. В результате инкубации со вторичными антителами получали окрашенные пятна. Соответствующие белковые пятна на исходном геле вырезали и идентифицировали с помощью MALDI-TOF-анализа. В результате было выявлено 9 белков в покоящихся клетках и 21 в активных клетках (табл. 1). Необходимо отметить, что у активных и покоящихся клеток эти белки различались за исключением трех белков Rv1475c, Rv3804c, Rv1886c.
Таблица 1.
Пул белков, выявляющих связывание с иммуноглобулинами пулированной сыворотки больных*
| Тип клеток M.tuberculosis | Белковый продукт | Название гена | Rv номер |
|---|---|---|---|
| Активные\покоящиеся** | Малат синтаза G | glcB | Rv1837c |
| Активные\покоящиеся** | Возможная аконитаза | Acn | Rv1475c |
| Активные** | Универсальный стрессовый белок TB31.7 | TB31.7 | Rv2623 |
| Активные** | Возможная S-аденозилметионин-зависимая метил трансфераза | Rv0731c | Rv0731c |
| Активные** | Белок Wag31 семейства Diviva | wag31 | Rv2145c |
| Активные** | ДНК-зависимая РНК полимераза (α субединица) | rpoA | Rv3457c |
| Активные** | Секретируемая L-аланин дегидрогеназа | ald | Rv2780 |
| Активные** | Транскрипционный регуляторный белок MoxR1 | moxR1 | Rv1479 |
| Активные** | Липаза\эстераза LipN | lipN | Rv2970c |
| Активные** | Тригерный фактор (TF) | tig | Rv2462c |
| Активные** | Косервативный белок | Rv0831c | Rv0831c |
| Активные** | Энолаза Eno | eno | Rv1023 |
| Активные** | Консервативный белок | fhaA | Rv0020c |
| Активные** | β-кетоацил-АСР синтаза | kasB | Rv2246 |
| Активные** | Консервативный белок | 35kd_ag | Rv2744c |
| Активные** | Электрон транспортный флавопротеин | fixB | Rv3028c |
| Активные** | Транскрипционный анитерминирующий белок | nusG | Rv0639 |
| Активные** | Тиоредоксин | Rv1324 | Rv1324 |
| Активные** | Консервативный белок | Rv3075c | Rv3075c |
| Покоящиеся** | Консервативный белок | Rv2018 | Rv2018 |
| Покоящиеся** | Аконитаза | acn | Rv1475c |
| Покоящиеся*** | Шаперон GroEL | groEL1 | Rv3417c |
| Покоящиеся*** | Шаперон DnaK (HSP70) | dnaK | Rv0350 |
| Покоящиеся** | Каталаза-пероксидаза KatG | katG | Rv1908c |
| Покоящиеся** | Метионин синтаза | metE | Rv1133c |
| Покоящиеся*** | Изониазид-индуцибелный белок IniB | iniB | Rv0341 |
* Представлены иммунореактивные белки, выявленные в протеоме активного М. tuberculosis (10 сут роста культуры) и в протеоме покоящихся форм туберкулеза (12 мес. хранения культуры) с использованием пулированной сыворотки 10 больных туберкулезом. ** Белки цитоплазматической фракции. *** Белки мембранной фракции.
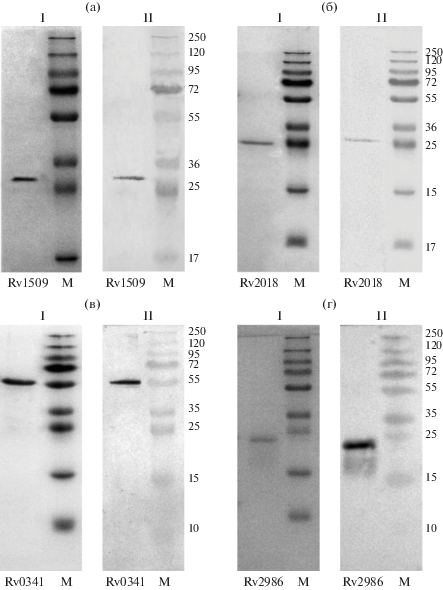
Сравнение аминокислотных последовательностей иммунореактивных белков покоящихся Mtb c белками других бактерий с использованием программы BLAST позволило ранжировать их по сходству с белками других бактерий за исключением представителей микобактериального комплекса (параметр “score” Табл. 2). Три белка с наименьшим значением score, то есть с наибольшей структурной специфичностью для Mtb за счет содержания уникальных для Mtb протяженных доменов, были далее более подробно изучены. Были клонированы соответствующие гены и получены рекомбинантные белки (Rv0341-белок, индуцируемый изониазидом IniB; Rv1509-белок с неизвестной функцией; Rv2018 – антитоксин) в виде His-tag белков на основе экспрессионной векторной системы pET19b (“Novagen”, Индия). Полученные рекомбинантные белки согласно электрофорезу в 12%-ном ПААГ и иммуноблоттингу связывались со специфическими к His-tag антителами (рис. 1). Их соответствие исходным белкам подтверждалось методом MALDI-TOF (не показано).
Таблица 2.
Структурная гомология иммунодоминантных белков, обнаруживаемых в покоящихся клетках M. tuberculosis
| Фракция клеток | Название белка | Номер гена | Молекулярная масса | M. tuberculosis комплекс** | Другие бактерии (score)* |
|---|---|---|---|---|---|
| Цитоплазма | Каталаза-пероксидаза KatG | Rv1908c | 80 572.8 | + | 1311 |
| Цитоплазма | Малат синтаза G | Rv1837c | 80403 | + | 1394 |
| Цитоплазма | Аконитаза | Rv1475c | – | 1741 | |
| Цитоплазма | Метионин синтаза | Rv1133c | 81 549.5 | + | 1384 |
| Мембраны | Шаперон DnaK | Rv0350 | 66 830.9 | + | 1258 |
| Мембраны | Шаперон GroEL1 | Rv3417c | 55 877.5 | + | 914 |
| Цитоплазма | Консервативный белок | Rv2018 | 26 034.5 | Кроме M. microtti | 433 |
| sds- мембраны | Изониазид-индуцибелный белок IniB | Rv0341 | 43 921.2 | + | 206 |
| sds- мембраны | Гипотетический белок | Rv1509 | 33 023.4 | Только у M. tuberculosis и М. сanetti | 492 |
| Цитоплазма | HU гомолог HupB | Rv2986c | 22 187.3 | + | 238 |
* Параметр “score” включает оценку покрытия последовательности и аминокислотное сходство в гомологичном белке по сравнению со сравниваемым белком из Мtb. Большие значения соответствуют большему сходству последовательностей. Приведены максимальные значения score. Жирным шрифтом выделены белки с минимальным значением score. ** +/– наличие или отсутствие гомолога данного белка у всех представителей бактерий туберкулезного комплекса.
Рис. 1.
Электрофорез в 12%-ном ПААГ с ДДС-Na (I) рекомбинантных белков: Rv1509 (а), Rv2018 (б), Rv0341 (в), Rv2986 (г) и соответствующий иммуноблот (II) со специфическими к His-tag антителами.
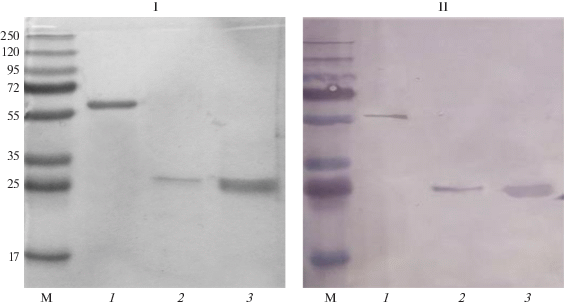
Полученные рекомбинантные белки были протестированы на способность связывания с антителами сывороток больных ТБ методом иммуноблоттинга. Для этой работы в качестве первичных антител использовали выделенные с помощью аффинной хроматографии из пулированной сыворотки 12 больных ТБ иммуноглобулины. Как оказалось, наилучшие результаты были получены если предварительно из сыворотки осаждали липопротеиды с помощью сульфата декстрана в присутствии ионов кальция. В качестве вторичных антител использовали конъюгаты античеловеческих антител с фосфатазой или конъюгат белка G с пероксидазой. В результате инкубации были получены окрашенные полосы, соответствующие белковым пятнам на исходном геле. Иммунореактивность данных рекомбинантных белков была проверена с двумя дополнительными панелями пулированных сывороток больных ТБ. Согласно иммуноблоттингу все три белка показали способность связываться с антителами сывороток (рис. 2).
Рис. 2.
Электрофорез в 12%-ном ПААГ с ДДС-Na рекомбинантных белков (I) Rv0341 (1), Rv2018 (2), Rv1509 (3) и соответствующий иммуноблот (II) с антителами пулированной сыворотки больных туберкулезом.
Поскольку существовала вероятность, что не все белки (особенно гидрофобные или находящиеся в виде олигомеров) могут быть обнаружены с помощью 2D электрофореза, было проведено разделение белков покоящихся клеток в одномерном ПААГ электрофорезе в присутствии ДДС-Na. Иммуноблоттинг разделенных таким образом белков позволил обнаружить иммунореактивную полосу с высокой активностью в районе 20 кДа. Согласно MALDI-TOF в иммунореактивной зоне были представлены три белка: Rv2986c, hupB (связывающийся с ДНК белок семейства HU); Rv0432, sodC (периплазматическая супероксиддисмутаза [Cu-Zn]); Rv3676, crp, (транскрипционный регулятор семейства Crp/Fnr белков). Для установления иммунореактивного белка все три гена были клонированы в клетках E. coli и соответствующие белки были получены в виде рекомбинантных белков в системе pET векторов (pET19в и pET23а). В результате были получены индивидуальные белки, которые были подвергнуты электрофорезу в ПААГ в денатурирующих условиях и проведен иммуноблоттинг с пулированными сыворотками больных туберкулезом. Оказалось, лишь белок Rv2986с проявлял способность связываться с иммуноглобулинами сывороток (рис. 3), который был использован в дальнейших экспериментах.
Рис. 3.
Электрофорез в 12%-ном ПААГ с ДДС-Na экстракта мембран клеток M. tuberculosis, трех рекомбинантных белков, обнаруженных в иммунореактивной полосе во фракции мембран (I) и соответствующий иммуноблот (II) с пулированной сывороткой больных туберкулезом: 1 – ДДС-Na экстракт из мембран; 2 – Rv3676; 3 – Rv0432; 4 – Rv2986.

Полученные четыре рекомбинантных белка были использованы для оценки наличия антител в индивидуальных сыворотках больных туберкулезом и здоровых доноров методом ИФА.
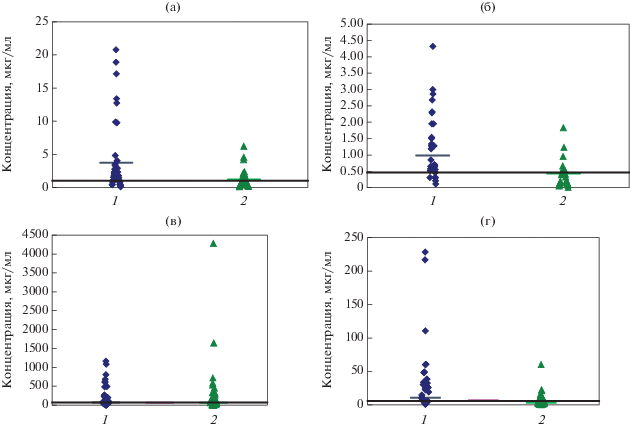
Всего было проведено четыре серии экспериментов (по одному для каждого белка). В каждом эксперименте использовались 42 сыворотки больных ТБ и 42 сыворотки здоровых доноров. Согласно полученным данным все четыре рекомбинантных антигена распознавались сыворотками больных ТБ (рис. 4). Однако лишь от 5 до 45% больных (для разных антигенов) имели концентрации иммуноглобулинов, которые превышали средние значения у здоровых доноров. Максимальное превышение демонстрировал белок Rv2986. В тоже время в сыворотках у 2–14% здоровых доноров также выявлялись антитела в концентрациях, превышающих теже средние значение.
Рис. 4.
ИФА связывания рекомбинантных белков Rv1509 (а), Rv0341 (б), Rv2018 (в), Rv2986 (г) с антителами сывороток крови индивидуальных больных туберкулезом (1) и здоровых доноров (2) (использовали 42 образца больных и 42 образца здоровых доноров).
Два из изученных белков (Rv2018 и Rv0341) являются новыми, ранее не описанными в литературе. Белок Rv2018 имел сходство с антитоксином семейства VapB, который обнаруживается в G/C богатых актинобактериях, в том числе микобактериях. Полагают, что системы “токсин-антитоксин” играют важную роль в переходе клеток бактерий в покоящееся состояние [9]. Белок, кодируемый геном Rv0341 (IniB – Isoniazid inducible gene protein) согласно BLAST обнаруживается исключительно у микобактерий и находится в составе крупных комплексов (680 кДа и более) в экстракте мембран покоящихся клеток M. tuberculosis. На ранней стадии реактивации покоящихся микобактерий начинается разрушение этих комплексов до мономерной формы белка, а в логарифмической фазе крупные комплексы с белком Rv0341 исчезают. Белок IniB со-локализуется с нуклеиновыми кислотами в экстрактах мембран покоящихся микобактерий [10]. IniB выявляется гиперэкспрессированным при заражении макрофагов клетками Mtb. Фрагменты белка IniB хорошо связываются с комплексом гистосовместимости МНС (Major Histocompatibility Complex) 1 и 2 класса лимфоцитов и таким образом, очевидно, что IniB участвует в клеточном иммунном ответе [11]. Согласно недавно опубликованной работе этот белок имеет хороший протективный потенциал для защиты от ТБ [12]. Однако данный белок ранее не был описан в качестве связывающегося с антителами, он также не вошел в списки иммуногенных белков, полученных на основе изучения тотального иммунопротеома активных клеток МТБ в публикациях 2010–2020 гг. [13–15]. Белок, кодируемый геном Rv2986c является ДНК-связывающим и относится к гистоноподобным белкам (HupB, HU-гомолог). Его экспрессия увеличивалась как в стационарной фазе роста Mtb, так и в гипометаболическом состоянии [16–18]. В качестве иммуногенного HupB, найденный во фракции клеточных стенок активных Mtb, был описан в литературе ранее [19]. Было также установлено, что концентрация антител против этого белка или фрагментов HupB в сыворотках больных ТБ достоверно превышает таковую у здоровых доноров [20, 21]. Однако эти данные не нашли подтверждения в исследованиях тотального иммунопротеома активных клеток Mtb. В таких исследованиях оценивали иммуногенность большинства белков, входящих в протеом Mtb [13, 15]. Так в работе 2010 г. [13] из общего пула белков Mtb было выявлено 484 белка в качестве распознающихся сыворотками больных, среди которых белки, выявленые в настоящем исследовании, отсутствовали (в том числе HupB). Из 484 белков была выделена группа из 13 белков, наиболее часто распознающихся индивидуальными сыворотками. Однако иммуногенность белков даже из этой группы варьировала существенно среди больных туберкулезом. Сходная большая вариабельность в иммуногенности была описана в недавно опубликованной работе по серодиагностике ТБ у 755 больных из нескольких стран с применением панели из 22 предварительно отобранных из полного протеома антигенов Mtb в виде рекомбинантных белков [14], а также в работе по выявлению биомаркеров для серодиагностики латентного ТБ [22].
Отсутствие антигенов, отобранных в нашем исследовании, в цитируемых выше публикациях возможно связано с методами, используемыми для экспрессии большого числа белков с применением специальных белковых микрочипов которые не покрывают на 100% протеом Mtb [13], и в которых чистота экспрессируемых белков может быть не достигнута [14]. Это отличается от экспрессии индивидуальных белков, когда проведена экспериментальная селекция и выявлены иммуногенные белки с помощью моделей in vitro, как в настоящем исследовании, и делает такое направление перспективным.
В целом, в результате такого подхода выявлены иммунодоминантные белки Mtb, в том числе новые, ранее не опубликованные, проявляющие способность связываться с антителами сывороток больных ТБ. Поскольку в настоящем исследовании использовались покоящиеся клетки Mtb, нельзя исключить, что наличие антител в сыворотках к обнаруженным иммунодоминантным белкам связано с наличием персистирующих клеток возбудителя в организме хозяина.
Как в цитируемых исследованиях, так и в настоящей работе содержание антител к отдельным антигенам сильно варьирует у больных туберкулезом. Как полагают это может быть связано с несколькими причинами, в том числе: 1) нахождение большинства клеток патогена в различном метаболическом и физиологическом состоянии у конкретного пациента и, соответственно различная экспрессия данного антигена в момент отбора образцов крови; 2) генетические особенности пациентов и связанные с этим особенности иммунного ответа, что также может отражаться на синтезе антител; 3) в среднем низкий уровень гуморального ответа у больных туберкулезом (особенно при хронической инфекции), который приводит к вариабельности содержания антител к конкретному антигену [13, 14]. С другой стороны, в сыворотках некоторых здоровых людей определяются антитела, реагирующие с теми же антигенами. Возможно, это связано с наличием неспецифичных для Mtb доменов в первичной структуре исследуемых белков. Изучение иммунореактивности полипептидов, сконструированных на основе специфических доменов белков, найденных в настоящем исследовании, может оказаться перспективным для серодиагностики туберкулеза.
При проведении исследований использовалось оборудование Центра коллективного пользования “Промышленные биотехнологии” Федерального исследовательского центра “Фундаментальные основы биотехнологии” Российской академии наук.
Работа выполнена при поддержке Российского научного фонда (грант № 16-15-00245-П).
Рекомбинантный белок Rv0341 был исследован при поддержке гранта РФФИ № 18-015-00239.
Список литературы
Нечаева О.Б. // Туберкулез и болезни легких. 2018. V. 8. № 96. P. 15–24.
Apt A.S., Logunova N.N., Kondratieva T.K. // Tuberculosis. 2017. V. 106. P. 1–8.
Shleeva M.O., Kudykina Y.K., Vostroknutova G.N., Suzina N.E., Mulyukin A.L., Kaprelyants A.S. // Tuberculosis. 2011. V. 91. № 2. P. 146–154.
Trutneva K.A., Shleeva M.O., Demina G.R., Vostroknutova G.N., Kaprelyans A.S. // Front. Cell. Infect. Microbiol. 2020. V. 10. P. 26
Connell N.D. // Methods cell biol. 1994. V. 45. P. 107–125.
O’Farrell P. H. // J. Biol. Chem. 1975. V. 250. P. 4007–4021.
Flores R. // Anal. Biochem. 1978. V. 88. P. 605–611.
Welin A., Raffetseder J., Eklund D., Stendahl O., Lerm M. // J. Innate Immun. 2011. V. 3. № 5. P. 508–518.
Barer M.R., Harwood C.R. // Adv. Microb. Physiol. 1999. V. 41. P. 93–137.
Shleeva M., Trutneva K., Shumkov M., Demina G., Kaprelyants A. // FEBS Open Bio. 2018. V. 8. № S1. P. 400
Flyer D.C., Ramakrishna V., Miller C., Myers H., McDaniel M., Root K., Flournoy C., Engelhard V.H., Canaday D.H., Marto J.A., Ross M.M., Hunt D.F., Shaba-nowitz J., White F.M. // Infect. Immun. 2002. V. 70. № 6. P. 2926–2932.
Bettencourt P., Müller J., Nicastri A., Cantillon D., Madhavan M., Charles P.D., Fotso C.B., Wittenberg R., Bull N., Pinpathomrat N., Waddell S.J., Stylianou E., Hill A., Ternette N., McShane H. // NPJ Vaccines. Springer US. 2020. V. 5. № 2. https://doi.org/10.1038/s41541-019-0148-y
Kunnath-Velayudhan S., Salamon H., Wang H.Y., Davidow A.L., Molina D.M., Huynh V.T., Cirillo D.M., Michel G., Talbot E.A., Perkins M.D., Felgner P.L., Liang X., Gennaro M.L. // Proc. Natl. Acad. Sci.USA. 2010. V. 107. № 33. P. 14703–14708.
Broger T., Basu Roy R., Filomena A., Greef C.H., Rimmele S., Havumaki J., Danks D., Schneiderhan-Marra N., Gray C.M., Singh M., Rosenkrands I., Andersen P., Husar G.M., Joos T.O., Gennaro M.L., Lochhead M.J., Denkinger C.M., Perkins M.D. // Clin. Infect. Dis. 2017. V. 64. № 7. P. 947–955.
Peng Z., Chen L., Zhang H. // J. Int. Med. Res. 2020. V. 48. № 3. https://doi.org/10.1177/0300060520910042
Matsumoto S., Furugen M., Yukitake H., Yamada T. // FEMS Microbiol. Lett. 2000. V. 182. № 2. P. 297–301.
Matsumoto S., Yukitake H., Furugen M., Matsuo T., Mineta T., Yamada T. // Microbiol. Immunol. 1999. V. 43. № 11. P. 1027–1036.
Lewin A., Baus D., Kamal E., Bon F., Kunisch R., Maurischat S., Adonopoulou M., Eich K. // BMC Microbiol. 2008. V. 8. P. 91
Yeruva V. C., Duggirala S., Lakshmi V., Kolarich D., Altmann F., Sritharan, M. // Clin. Vaccine Immunol. 2006. V. 13. № 10. P. 1137–1142.
Sritharan N., Choudhury M., Sivakolundu S., Chaurasia R., Chouhan N., Rao P.P., Sritharan M. // Eur. J. Clin. Microbiol. Infect. Dis. 2014. V. 34. № 1. P. 33–40.
Sivakolundu S., Mannela U.D., Jain S., Srikantam A., Peri S., Pandey S.D., Sritharan M. // Trans R Soc. Trop. Med. Hyg. 2013. V. 107. № 1. P. 43–50.
Zhou F., Xu X., Wu S., Cui X., Pan W. // BMC Infectious Diseases. 2017. V. 17. № 1. P. 793.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


