Прикладная биохимия и микробиология, 2021, T. 57, № 2, стр. 138-144
Свойства внеклеточной протеиназы микромицета Aspergillus ustus 1, обладающей высокой активностью при гидролизе фибриллярных белков
Е. А. Попова 1, В. Г. Крейер 1, С. К. Комаревцев 2, С. В. Шабунин 2, А. А. Осмоловский 1, 2, *
1 Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
2 Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии
394087 Воронеж, Россия
* E-mail: aosmol@mail.ru
Поступила в редакцию 27.06.2020
После доработки 07.09.2020
Принята к публикации 02.11.2020
Аннотация
Из комплекса белков, синтезируемых микромицетом Aspergillus ustus 1 в условиях твердофазного культивирования, была выделена новая протеиназа, гидролизующая коллаген, эластин и фибрин. Показано, что фермент имел молекулярную массу 33 кДа и изоэлектрическую точку (pI) 4.6 и не содержал углеводных остатков. Ингибиторный анализ позволил отнести протеиназу к сериновому типу. Установлено, что pH–оптимум действия фермента ~рН 6.0, температурный оптимум – 41°С. Коллагенолитическая активность выделенной протеиназы A. ustus 1 в 1.46 раз превышала активность препарата протеиназ A. terricola и была сопоставима с активностью препарата коллагеназы Clostridium histolyticum.
На протяжении многих лет выявление и изучение новых продуцентов высокоактивных протеиназ остается важной задачей современной микробиологии. В связи с разнообразием сфер их использования сохраняется потребность в протеолитических ферментах с различными свойствами. Микромицеты имеют ряд важных преимуществ по сравнению с другими продуцентами таких ферментов, поскольку они способны образовывать комплекс протеиназ, проявляющих активность в широком диапазоне pH и температур. Так, ранее было показано, что микромицет Aspergillus ustus 1 способен синтезировать протеиназы, обладающие высокой коллагенолитической, фибринолитической и эластинолитической активностью [1]. Такие протеиназы широко применяются в фармацевтической [2], легкой [3] и пищевой [4] отраслях промышленности. Можно было предположить, что протеолитические ферменты, образуемые микромицетом A. ustus 1, окажутся более доступными по сравнению с аналогами, сохраняя при этом высокую активность.
Цель работы – выделение комплекса протеиназ, синтезируемых микромицетом A. ustus 1 в условиях твердофазного культивирования, и изучение свойств наиболее активного фермента, способного гидролизовать коллаген, фибрин и эластин.
МЕТОДИКА
Объект исследования и условия культивирования. Использовали штамм микромицета A. ustus 1, отобранный ранее в качестве продуцента протеиназ, обладающих коллагенолитической, фибринолитической и эластинолитической активностью [1]. Твердофазное культивирование проводили в культуральных флаконах T-75 (“Eppendorf”, Германия) в статических условиях при 28°С. В качестве носителя использовали вермикулит, на 1 г которого добавляли 4.2 мл ферментационной среды следующего состава (%): глюкоза – 3.0, глицерин – 7.0, гидролизат рыбной муки – 0.5, NaNO3 – 0.2, KH2PO4 – 0.05 и MgSO4 – 0.05. Инокулирование осуществляли 1 мл суспензии спор с поверхностной культуры микромицета в 0.0001%-ном растворе Твин-80. По окончании культивирования в культуральные флаконы добавляли 20 мл 0.05 М Na-ацетатного буфера, рН 5.5, и инкубировали при перемешивании на орбитальной качалке (200 об./мин) в течение 30 мин. Культуральную жидкость отделяли фильтрованием через фильтровальную бумагу (“ФС”, Россия).
Выделение и фракционирование комплекса протеиназ микромицета A. ustus 1. Внеклеточные белки микромицета получали осаждением сульфатом аммония (608 г на 1 л культуральной жидкости). Осадок белков отделяли центрифугированием при 15000 g в течение 20 мин при 4°С, растворяли в 0.01 М Na-ацетатном буфере, рН 5.5, диализовали в диализных трубках против этого же буфера в течение 12 ч при 4°С и лиофильно высушивали.
Полученные белки фракционировали методом изоэлектрофокусирования в течение 36 ч в колонке объемом 110 мл (“LKB”, Швеция) в градиенте рН 2.5–10 (амфолинов) и плотности сахарозы 0–40% при напряжении 800 В [5]. Содержимое колонки собирали по фракциям объемом 1.5 мл, в каждой из которых определяли рН, содержание белка (при 280 нм) и протеолитическую активность.
Определение протеолитической активности. Определяли общую протеолитическую, коллагенолитическую, фибринолитическую и эластинолитическую активность.
Общую протеолитическую (казеинолитическую) активность определяли модифицированным методом Ансона–Хагихары по гидролизу 1%-ного раствора казеина по Хаммерштайну в 0.1 М Na-ацетатном буфере, рН 5.5, в течение 10 мин при 37°С, как описано ранее [6]. Активность рассчитывали по количеству тирозина в продуктах протеолиза, не осаждаемых трихлоруксусной кислотой (ТХУ). Оптическую плотность определяли спектрофотометрически при 275 нм и рассчитывали количество высвободившегося тирозина в пробе. Активность выражали в мкмолях тирозина, освобожденного за мин (ЕТир).
Фибринолитическую активность определяли аналогично общей протеолитической активности при гидролизе 1%-ной суспензии бычьего фибрина в 0.1 М Na-ацетатном буфере, рН 5.5, в течение 30 мин при 37°С [6, 7]. Активность выражали в ЕТир.
Коллагенолитическую активность определяли с использованием в качестве субстрата суспензии азоколлаген (2 мг/мл) по общепринятой методике [8, 9]. Активность выражали в мкг азоколла, расщепившегося в течение 1 мин (ЕАзк).
Эластинолитическую активность определяли по расщеплению Suc-Ala-Ala-Ala-pNA (0.05%-ный раствор), являющегося хромогенным пептидным субстратом эластазы, по общепринятой методике [1, 10] при рН 5.5 и 37°С. Активность выражали в мкмолях п-нитроанилина в мин (EпНА), содержание которого устанавливали спектрофотометрически при 405 нм на спектрофотометре BioSpecrtrometer kinetic (“Eppendorf”, Германия).
Аналогичным способом определяли активность по отношению к другим хромогенным субстратам, таким как p-Glu-Pro-Arg-pNA (субстрат активированного протеина С), Tos-Gly-Pro-Arg-pNA (субстрат тромбина), H-D-Val-Leu-Lys-pNA (плазмина), H-D-Ile-Pro-Arg-pNA (тканевого активатора плазминогена), p-Glu-Gly-Arg-pNA (субстрат урокиназы), Z-D-Arg-Gly-Arg-pNA (Xa- фактора), Ac-Phe-pNA (химотрипсина), Bz-Arg-pNA (трипсина) и Z-Ala-Ala-Leu-pNA (субтилизина).
Гидролиз осуществляли при постоянном перемешивании в термошейкере TS-100 (“BioSan”, Латвия). Опыты проводили в трех повторностях. Приведенные результаты представляли собой средние значения, ошибка которых не превышала 5–7%.
Электрофорез белков в полиакриламидном геле (ПААГ). Нативный электрофорез в ПААГ проводили по методу Дэвиса в трис-глициновом буфере, рН 8.3 [11]. Денатурирующий электрофорез проводили в ПААГ по методу Лэммли с изменениями при силе тока 50 мА [12].
Ингибиторный анализ. Ингибиторный анализ осуществляли как описано ранее [13], используя ингибиторы металлопротеиназ (этилендиаминтетрауксусная кислота (ЭДТА) и о-фенантролин), а также цистеиновых (пара-хлормеркурийбензоат, п-ХМБ) и сериновых (фенилметилсульфонилфторид, ФМСФ) протеиназ в молярном соотношении фермент : ингибитор 1 : 10 и 1 : 100. Остаточную активность фермента определяли при 37°С после его прединкубации с ингибитором в течение 90 мин при 25°С, используя в качестве субстрата азоколлаген. Активность выражали в процентах от контроля.
Определение углеводного компонента в молекуле протеиназы. Для выявления содержания углеводного компонента в молекуле выделенной протеиназы проводили качественную реакцию с периодной кислотой и реактивом Шиффа (фуксинсернистая кислота) методом дот-блоттинга на нитроцеллюлозных мембранах [14]. В качестве положительного контроля использовали раствор 0.5 мг/мл внеклеточной дрожжевой инвертазы, а в качестве отрицательного – 0.5 мг/мл БСА.
Определение рН-оптимума действия и рН-стабильности протеиназы. Зависимость активности протеиназы от pH определяли в 0.4 М универсальном (натрий-ацетат-фосфат-боратном) буфере, рН от 4.0 до 7.0. К 150 мкл буфера с соответствующим значением рН добавляли 100 мкл пробы фермента и 100 мкл суспензии азоколлагена (2 мг/мл). Для определения стабильности фермента при различных значениях pH его инкубировали в течение 2 ч в 0.4 М универсальном буфере с различными значениями рН (от 4.0 до 10.0) при 37°С и измеряли остаточную активность. Полученные результаты выражали в % от исходной активности.
Определение температурного оптимума активности и термостабильности протеиназы. Температурный оптимум действия протеиназы при гидролизе коллагена определяли в 0.05М трис-HCl-буфере, рН 8.2, в диапазоне от 20 до 55°С.
Термостабильность фермента изучали после его инкубации в течение 2 ч при заданных температурах (от 24 до 65°С). Полученные результаты выражали в % остаточной активности от исходной.
Сравнение протеиназы A. ustus 1 с протеиназами других микромицетов. Для сравнения коллагенолитической активности протеиназ, секретируемых A. ustus 1 и A. terricola, проводили гидролиз нативного бычьего коллагена в течение 5 ч при 37°С. Для этого к 7.0 мкл каждого фермента (1 мг белка/мл) добавляли 343 мкл суспензии коллагена (2 мг/мл) и инкубировали в течение 5 ч при 37°С. Реакцию останавливали 350 мкл 0.05 М трис-HCl буфера, pH 8.2, содержащего 12% полиэтиленгликоля 6000 (PEG 6000) и 25 мкМ ЭДТА, и нингидринового реагента. Затем смесь нагревали в течение 10 мин до 80°С. После охлаждения добавляли 500 мкл бидистилированой воды и измеряли оптическую плотность при 570 нм [15]. Для расчета коллагенолитической активности строили калибровочную кривую по L-лейцину. Активность выражали в единицах (ед.) расщепления коллагена (CDU). Одна ед. CDU высвобождала из коллагена (бычий, нативный из ахиллового сухожилия) пептиды, в количестве, эквивалентном 1.0 мкмоль L-лейцина в течение 5 ч при pH 7.4 и 37°C (после окраски нингидрином).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
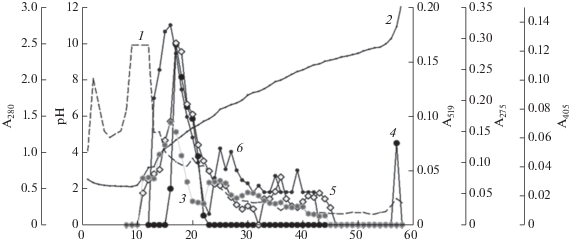
Изучение внеклеточных протеиназ микромицета A. ustus 1, активных по отношению к фибриллярным белкам, показало их перспективность для потенциального практического применения. Полученный комплексный препарат внеклеточных белков A. ustus 1 обладал как казеинолитической активностью, которая составляла 33.9 Eтир/мг белка, так и коллагенолитической активностью − 16.8 Eазк/мг белка × 10–3). В результате проведения изоэлектрофокусирования полученных внеклеточных белков было обнаружено несколько групп протеолитически активных фракций, концентрирующихся при различных значениях рН, что свидетельствовало о присутствии нескольких ферментов. Так, фракции, обладающие наибольшей фибринолитической, коллагенолитической, казеинолитической и эластинолитической активностью, концентрировались в одной фракции при pH 4.5–4.7 (рис. 1). Можно предположить, что в этой фракции присутствовала основная протеиназа, которая имела изоэлектрическую точку (pI) 4.6. В диапазоне pH 6.3–6.6 концентрировалась фракция, обладающая коллагенолитической, казеинолитической и эластинолитической активностью, при pH 7.5–7.8 – фракция с колллагенолитической и эластинолитической активностью, а при pH 8.2–8.4 – фракция, которая проявляла только коллагенолитическую активность. Однако уровень активности в этих фракций оказался существенно ниже (рис. 1).
Рис. 1.
Изоэлектрофокусирование внеклеточных белков в культуральной жидкости A. ustus 1: А280 (1), рН (2), казеинолитическая (3), фибринолитическая (4), эластинолитическая (5) и коллагенолитическая (6) активность.
Были изучены свойства выделенной основной протеазы. Результаты электрофореза в ПААГ по Лэммли в присутствии ДДС-Na представлены на рис. 2. Аналогичные результаты были получены при нативном электрофорезе в ПААГ по Дэвису (данные не представлены). Полученные результаты свидетельствовали о гомогенности выделенного фермента, который характеризовался молекулярной массой ~33 кДа.
Рис. 2.
Электрофорез по Лэммли в присутствии ДДС-Na внеклеточной протеиназы A. ustus 1 (1) и белков-маркеров (2) молекулярной массы: бета-галактозидаза (116 кДа), БСА (66.2 кДа), овальбумин (45 кДа), лактатдегидрогеназа (35 кДа), эндонуклеаза рестрикции Bsp98I (25 кДа), бета-лактоглобулин (18.4 кДа) и лизоцим (14.4 кДа).

В дальнейших экспериментах по установлению физико-химических свойств выделенной протеиназы использовали определение ее коллагенолитической активности.
Ингибиторный анализ внеклеточной протеиназы A. ustus 1 показал, что ее коллагенолитическая активность практически полностью ингибировалась ФМСФ, в то время как другие использованные ингибиторы не влияли на ее активность (табл. 1). Полученные результаты позволили отнести выделенный фермент к группе сериновых протеиназ.
Таблица 1.
Ингибиторный анализ внеклеточной протеиназы A. ustus 1
| Ингибитор | Молярное соотношение фермент : ингибитор | Остаточная активность, % |
|---|---|---|
| Контроль (без ингибитора) |
- | 100.0 |
| ЭДТА | 1 : 10 | 100.0 |
| 1 : 100 | 100.0 | |
| п-ХМБ | 1 : 10 | 100.0 |
| 1 : 100 | 100.0 | |
| о-фенантролин | 1 : 10 | 100.0 |
| 1 : 100 | 100.0 | |
| ФМСФ | 1 : 10 | 3.7 |
| 1 : 100 | 4.0 |
В результате изучения влияния температуры на коллагенолитическую активность протеиназы A. ustus 1 было показано, что оптимальная активность проявлялась при 41°С (рис. 3). Следует отметить, что более 80% коллагенолитической активности сохранялось в достаточно широком диапазоне температур от 39 до 55°С. Также было показано, что протеиназа сохраняла 100% коллагенолитической активности при инкубации в течение 2 ч при температурах от 24 до 45°С (рис. 3).
Рис. 3.
Активность (а, в) и стабильность (б, г) протеиназы A. ustus 1 при различных температурах (а, б) и рН (в, г).
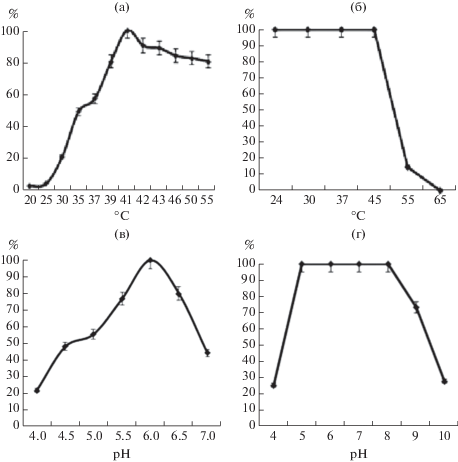
Изучение оптимального рН для проявления активности протеиназы A. ustus 1 показало, что наибольшая коллагенолитическая активность фермента была обнаружена при pH 6.0 (рис. 3). Фермент сохранял 100% активности в диапазоне pH от 5.0 до 8.0 и терял 26.6% активности при pH 9.0. При этом более 75% активности сохранялось в пределах от pH 5.5 до 6.5. При pH 4.0 и 10.0 активность составляла менее 30% от максимальной (рис. 3).
Рис. 4.
Определение с ШИК–реактивом методом дот-блоттинга гликопротеинов в молекулах протеиназы A. ustus 1 (3), инвертазы (1, положительный контроль) и БСА (2, отрицательный контроль).
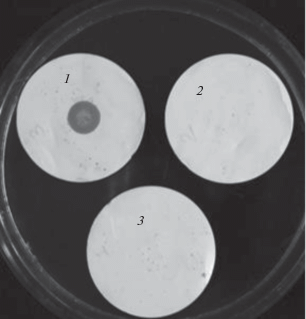
Определение содержания гликопротеинов в молекуле протеиназы A. ustus 1 показало, что фермент не гликозилирован (рис. 4), что позволяет в будущем рассматривать возможность его клонирования и экспрессии в прокариотических системах. На рис. 5 представлены результаты определения активности протеиназы A. ustus 1 при гидролизе хромогенных пептидных субстратов активированного протеина С, тромбина, плазмина, тканевого активатора плазминогена, урокиназы, Ха-фактора и трипсина. Видно, что наивысшую активность, равную 29.9 EpNA/мл × 10–3, фермент проявлял при гидролизе субстрата тромбина (Tos-Gly-Pro-Arg-pNA). Следует отметить также, что протеиназа A. ustus 1 преимущественно гиролизовала субстраты, содержащие остаток основной аминокислоты в положении P1, кроме того активность зависела от длины пептида.
Рис. 5.
Активность протеиназы A. ustus 1 по отношению к хромогенным субстратам, 1 – p-Glu-Pro-Arg-pNA (субстрат активированного протеина С), 2 – Tos-Gly-Pro-Arg-pNA (тромбина), 3 – H-D-Val-Leu-Lys-pNA (плазмина), 4 – H-D-Ile-Pro-Arg-pNA (тканевого активатора плазминогена), 5 – p-Glu-Gly-Arg-pNA (урокиназы), 6 – Z-D-Arg-Gly-Arg-pNA (Xa-фактора), 7 – Ac-Phe-pNA (химотрипсина), 8 – Bz-Arg-pNA (трипсина), 9 – Z-Ala-Ala-Leu-pNA (субтилизина).
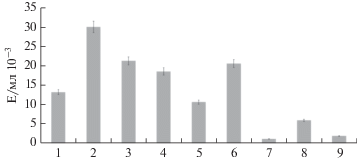
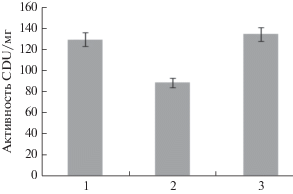
Рис. 6.
Сравнение коллагенолитической активности протеиназы A. ustus 1 (1), препарата “Террилитин” (2) и коммерческой коллагеназы C. histolyticum (3).
Свойства новой внеклеточной протеиназы, выделенной из комплекса внеклеточных белков микромицета A. ustus 1, сходны со свойствами некоторых протеиназ, синтезируемых другими видами рода Aspergillus (табл. 2), но отличались более широким спектром расщепляемых субстратов, включая такие, как фибрин и эластин. Эта особенность может быть востребована, например, при производстве белковых кормовых добавок, поскольку позволит снизить затраты на их ферментативную обработку.
Таблица 2.
Сравнение свойств протеиназы A.ustus 1 и протеиназ других аспергиллов
| Продуцент | pH- и темпера-турный оптимум действия фермента | Молекулярная масса, kДa | Действие ингибиторов | Гидролизуемые субстраты | Источник |
|---|---|---|---|---|---|
| Aspergillus oryzae | pH 7.0; 55°C | 43 | ФМСФ | Казеин | [16] |
| Aspergillus sp. (UCP 1276) | pH 8.0; 40°C | 28.7 | ФМСФ | Казеин, кератин, коллаген | [17] |
| Aspergillus ustus 1 | pH 6.0; 41°C | 33 | ФМСФ | Казеин, коллаген, фибрин, эластин | Настоящая работа |
Для сравнения коллагенолитической активности протеиназы A. ustus 1 и A. terricola, входящей в качестве действующее вещества в состав коммерческого коллагенолитического противоожогового препарата “Террилитин”, нативный бычий коллаген гидролизовали в течение 5 ч этими ферментами. Результаты данного эксперимента представлены на рис. 6. Как видно на гистограмме, коллагенолитическая активность протеиназы A. ustus 1 не только в 1.46 раз превышала активность протеиназы A. terricola, но и была сопоставима с активностью коллагеназы Clostridium histolyticum (“Sigma-Aldrich”, США). Полученные данные позволили рассматривать протеиназу A. ustus 1 в качестве основы для разработки более активных и простых в получении ферментных препаратов, способных стать полноценной альтернативой уже имеющимся препаратам противоожогового действия.
Таким образом, было установлено, что высокоактивный при гидролизе фибриллярных белков внеклеточный фермент, синтезируемый микромицетом A. ustus 1 в условиях твердофазного культивирования, представлял собой негликозилированную сериновую протеиназу с молекулярной массой 33 кДа и pI 4.6, которая характеризовалась проявлением максимальной активности при pH 6.0 и 41°С.
Работа выполнена при финансовой поддержке Российского Научного Фонда (проект № 20-16-00085).
Список литературы
Попова Е.А., Осмоловский А.А., Крейер В.Г., Котова И.Б., Егоров Н.С. // Микология и фитопатология. 2019. Т. 53. № 4. С. 229–235.
Erdeve O., Atasay B., Arsan S. // Ped. Dermatol. 2007. V. 24. № 2. P. 195–196.
Bhagwat P.K., Dandge P.B. // Biocat. Agric. Biotechnol. 2018. V. 15. P. 43–55.
Thapa S., Li H., OHair J., Bhatti S., Chen F.-C., Al Nasr K., Johnson T., Zhou S. // Mol. Biotechnol. 2019. V. 61. № 2. P. 579–601.
Осмоловский А.А., Крейер В.Г., Баранова Н.А., Кураков А.В., Егоров Н.С. // Прикл. биохимия и микробиология. 2013. Т. 49. № 6. С. 580–586
Осмоловский А.А., Попова Е.А., Крейер В.Г., Баранова Н.А, Егоров Н.С. // Вестник Московского университета. 2016. Т. 71. № 1. P. 71–76.
Осмоловский А.А., Рукавицына Е.Д., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Микробиология. 2017. V. 86. № 4. P. 504–509.
Chavira Jr.R., Burnett T.J., Hageman J.H. // Anal. Biochem. 1984. V. 136. № 2. P. 446–450.
Шаркова Т.С., Кураков А.В., Осмоловский А.А., Матвеева Э.О., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Микробиология. 2015. Т. 84. № 3. С. 316–322.
Bieth J., Wermuth C.G. // Biochem. Biophys. Res. Commun. 1973. V. 53. № 2. P. 383–390.
Davis B.J. // Ann. N.Y. Ac. Sci. 1964. V. 121. № 2. P. 404–427.
Laemmli U.K. // Nature. 1970. V. 227. № 5259. P. 680–685.
Крейер В.Г., Руденская Г.Н., Ландау Н.С., Покровская С.С., Степанов В.М., Егоров Н.С. // Биохимия. 1983. Т. 48. № 8. С. 1365–1373.
Thronton D.J., Carlstadt I., Sheehan J.K. // Mol. Biotechnol. 1996. V. 5. № 2. P. 171–176.
Zhang Y., Fu Y., Zhou S., Kang L., Li C. // Anal. Biochem. 2013. V. 437. № 1. P. 46–48.
Ao X.L., Yu X., Wu D.T., Li C., Zhang T., Liu S.L., Chen S.J., He L., Zhou K., Zou L.K. // AMB Exp. 2018. V. 8. № 1. P. 1–10.
Ferreira C.M.O., Correia P.C., Brandão-Costa R.M.P., Albuquerque W.W.C., Lin Liu T.P.S., Campos-Takaki G.M., Porto A.L.F. // Biomed. Chromatogr. 2017. V. 31. № 5. P. e3882.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


