Прикладная биохимия и микробиология, 2021, T. 57, № 2, стр. 145-151
Выделение, очистка и характеристика лектина Fusarium solani 4
Рин. С. Мухаммадиев 1, *, Риш. С. Мухаммадиев 1, Е. В. Скворцов 1, Л. Р. Валиуллин 1, А. П. Глинушкин 2, Т. В. Багаева 3
1 Федеральный центр токсикологической, радиационной и биологической безопасности
420075 Казань, Россия
2 Всероссийский научно-исследовательский институт фитопатологии
143050 Одинцово, Одинцовский район, Московская обл., Россия
3 Казанский (Приволжский) федеральный университет
420008 Казань, Россия
* E-mail: tanirtashir@mail.ru
Поступила в редакцию 02.11.2020
После доработки 02.11.2020
Принята к публикации 02.11.2020
Аннотация
Из мицелия микроскопического гриба Fusarium solani 4 выделен и очищен электрофоретически гомогенный лектин с удельной активностью 100.0 ед./мг белка. Определена молекулярная масса нативной молекулы лектина, равная 38 кДа, и установлено, что он состоит из двух идентичных субъединиц, молекулярная масса которых, определенная методом электрофореза в ПААГ в присутствии ДДС-Na, равнялась 19 кДа. Изучены физико-химические свойства и углеводная специфичность лектина, а также его влияние на раковые клетки млекопитающих in vitro. Полученные результаты открывают перспективы дальнейшего изучения лектина и его применения как потенциального средства медицинского назначения.
Лектины представляют собой моно- и поливалентную группу белков или гликопротеинов, способных с высокой специфичностью распознавать и обратимо связывать определенные углеводные структуры, не подвергая их химической модификации [1, 2]. Это уникальное свойство лектинов делает их бесценным инструментом при решении многих медико-биологических задач, в том числе, при создании противовирусных, антимикробных, противоопухолевых и иммуномодулирующих препаратов, а также для определения групп крови и диагностики различных заболеваний [3–7].
Лектины повсеместно встречаются в природе. Они найдены у различных организмов, включая вирусы, бактерии, актиномицеты, грибы, растения и животные [8]. Лектины участвуют в межклеточных взаимодействиях, в адгезии к клеточной поверхности, регулируют процессы внутриклеточного транспорта и осуществляют контроль роста и дифференциации тканей и органов [3], а также как сигнальные молекулы играют важную роль в формировании ответных реакций к биотическим и абиотическим факторам среды [9, 10]. Однако биологические функции и свойства многих лектинов до сих пор остаются малоизученными.
В последнее время среди значительного количества изучаемых биологических объектов особое внимание привлекают микроскопические грибы, в частности их способность к синтезу лектинов [11]. Углевод-связывающие белки грибов являются очень интересной в теоретическом и практическом плане группой белков, но к настоящему времени способность синтезировать лектины известна для немногих микромицетов. Установлено, что лектины присутствуют в мицелии и культуральной жидкости таких видов грибов, как Beauveria bassiana, Arthrobotrys oligospora, Aspergillus gorakhpurensis, Rhizoctonia crocorum и Trichophyton rubrum [12–15]. Имеется небольшое количество данных о способности плесневых грибов рода Fusarium к синтезу лектинов [16–18]. В предыдущих работах [19, 20] была изучена способность грибов рода Fusarium образовывать мицелиальные лектины, и изучены их некоторые биохимические свойства.
Необходимо отметить, что во многих биологических объектах часто наблюдается образование не одного лектина, а группы лектин-подобных белков или гликопротеинов, имеющих различную структуру и специфичность [8, 21]. Микроскопические грибы не являются исключением, однако для получения гомогенного лектина необходим подбор и выполнение соответствующих условий его выделения и очистки.
Цель работы – выделение, очистка и характеристика лектина микроскопического гриба Fusarium solani 4.
МЕТОДИКА
В работе использованы Трис (“ICN Biomedicals”, США), Сефадексы G-100 и G-75 (“Sigma”, Швеция), D-глюкоза, D-арабиноза, L-арабиноза, L-рамноза, D-ксилоза, L-фукоза, D-манноза, D-рибоза, D-лактоза, D-галактоза, D-маннит, D‑фруктоза, D-раффиноза, D-мальтоза, N-ацетил-D-галактозамин, D-глюкуроновая кислота, сахароза, целлобиоза, крахмал, ксилан, хондроитин-6-сульфат, фетуин и фибриноген (“Fluka”, Германия). Все остальные реагенты имели степень чистоты х. ч. и ч. д. а. (“Merck”, Германия, “Sigma”, США и “ПанЭко”, Россия).
Микроорганизм и условия культивирования. Объектом исследования служил микроскопический гриб Fusarium solani 4, полученный из музея культур микромицетов кафедры биохимии и биотехнологии Института фундаментальной медицины и биологии Казанского (Приволжского) федерального университета. Культивирование штамма микромицета проводили на картофельно-глюкозной среде, содержащий (г/л) картофель 200.0, глюкозу 20.0, с перемешиванием, при 28°C в течение 8 сут [20].
Выделение и очистка лектина. Мицелиальный лектин получали на 8 сут культивирования продуцента по методу, описанному в работе Розена с соавт. [12].
Мицелий собирали фильтрованием через стерильную нейлоновую ткань, тщательно промывали стерильной дистиллированной водой, а затем 20 мМ Tрис-HCl-буфером (рН 7.8). Белки из мицелия микромицета выделяли после гомогенизацией биомассы с помощью механического измельчения в 20 мМ Tрис-HCl-буфере (рН 7.8) в соотношении 1 : 1. Для более полного извлечения белков, однородную массу оставляли при перемешивании на 6 ч при температуре 4°С, полученный осадок отделяли центрифугированием (13500 g, 20 мин, 4°С). Затем белки осаждали 65%‑ным ацетоном (об./об.) в течение 1 сут. Осадок отделяли центрифугированием (10000 g, 15 мин, 4°С), растворяли в минимальном объеме 20 мМ трис-HCl буфера, рН 7.8, и диализовали против этого же буфера в диализных мешках (“Orange Scientific”, Бельгия) в течение 2 сут при 4°С. Полученный раствор белка использовали для дальнейшего выделения и очистки лектина.
Лектин выделяли из суммы белков с помощью хроматографической системы низкого давления BioLogic LP (“Bio-Rad”, США) на колонках с Phenyl Sepharose High Performance (1 мл), а затем на Bio-Scale™ Mini Macro-Prep High Q (3 мл) и Сефадексом G-75. Перед нанесением на колонки белки фильтровали через стерильные мембранные фильтры Millex (d 33 мм, d пор 0.45 мкм, полиэтилсульфон, “Merck Millipore”, США).
С первой колонки, содержащей гидрофобный сорбент, связавшийся белки элюировали градиентом концентрации (NH4)2SO4 от 1.5 до 0 М в 20 мМ Tрис-HCl буфере, рН 7.8, со скоростью потока 1.0 мл/мин. Со второго сорбента белки элюировали линейным градиентом NaCl от 0 до 1.0 М со скоростью 3 мл/мин. Элюцию белка при гель-фильтрации на Сефадексе G-75 осуществляли 20 мМ Tрис-HCl буфером, рН 7.8, со скоростью 0.5 мл/мин.
На каждой стадии очистки определяли концентрацию белка методом спектрофотометрии и рассчитывали гемагглютинирующую активность, степень очистки и выход белка.
Электрофоретический анализ и определение молекулярной массы. Степень чистоты и молекулярную массу лектина определяли методом электрофореза в 12.5%-ном полиакриламидном геле в денатурирующих условиях и гель-фильтрацией на колонке Сефадексе G-100.
Одномерный электрофорез в ПААГ с ДДС-Na проводили по методу Лэммли [22] в камере Mini-Protean Tetra Vertical Electrophoresis Cell (“Bio-Rad”, США). Окрашивание гелей проводили в растворе нитрата серебра, содержащего 0.4%-ный AgNO3, 0.09%-ный NaOH (об./об.) и 0.2%-ный NH3 (об./об.). В качестве маркеров использовали коммерческие наборы белков PageRuler Unstained Protein Ladder (“Fermentas”, Литва) с известной молекулярной массой (10–200 кДa).
Молекулярную массу нативного лектина определяли методом гель-фильтрации на колонке Econo – Column (1.5 × 50 см, “Bio-Rad”, США) с Сефадексом G-100 (диаметр частиц 40–120 мкм), уравновешенной 20 мМ Tрис-HCl буфером, рН 7.8. В качестве белков-маркеров применяли лизоцим (14 кДа), α-химотрипсин (26 кДа), пероксидазу (34 кДа) и бычий сывороточный альбумин (70 кДа). Пробы наносили на колонкув объеме 1 мл с концентрацией белка 2 мг/мл. Скорость элюции – 0.5 мл/мин.
Сканирование и анализ белковых полос гелей осуществляли на приборе ChemiDoc™ MP Imaging System (“Bio-Rad”, США) с помощью программы Image Lab™ Software.
Определение температурного и рН-оптимума, углеводной специфичности лектина, влияния ионов металлов на активность. Определение осуществляли согласно методу Сингха с соавт. [23].
Для определения рН-оптимума активности лектина осуществляли инкубацию его в различных буферных растворах при значениях рН от 3.0 до 11.0 в течение часа при 20°С, после чего анализировали активность лектина реакцией прямой гемагглютинации.
Для определения температурного оптимума активности лектина проводили инкубацию его в исходном буферном растворе в интервале от 10 до 90°C в течение 20 мин, после чего анализировали активность белка реакцией прямой гемагглютинации.
Действие ионов металлов на активность лектина устанавливали после взаимодействия с различными солями металлами. В качестве солей металлов были использованы от 1.25 до 20 мМ CaCl2, MgCl2, ZnCl2, AlCl3, FeCl3, FeSO4, CuSO4, MnCl2 и CoCl2.
Углеводную специфичность лектина устанавливали методом ингибирования реакции гемагглютинации по взаимодействию с моно- и полисахаридами в концентрациях 300 мМ и 5 мг/мл соответственно.
Определение цитотоксической активности лектина. Оценку проводили по выживаемости различных культур клеток с помощью МТТ-теста в соответствии с ранее описанной методикой [24]. Клеточные линии клеток рака печени (HEPG2, ATCC® HB-8065™), молочной железы (MCF-7, ATCC® HTB-22™) и простаты человека (PC-3, ATCC® CRL-1435™) были предоставлены из коллекции культур клеток Научно-образовательного центра фармацевтики (Казань, Россия).
Цитотоксичность лектина при воздействии на клетки в условиях in vitro выражали значениями IС50 (наименьшая ингибирующая концентрация, мкг/мл) лектина, которая способна вызывать 50%‑ное подавление роста популяции клеток изучаемой культуры. В качестве контроля использовали клетки, выдержанные без добавления лектина.
Определение гемагглютинирующей активности лектина. Активность лектина определяли реакцией прямой гемагглютинации с нативными эритроцитами человека группы крови 0 (I). В работе использовали 2%-ную суспензию эритроцитов (об./об.), полученную по методу Луцика с соавт. [8].
Статистическую обработку данных проводили с применением программного обеспечения Microsoft Office Excel 2013. Для определения средней арифметической и ее средней ошибки использовали данные трех независимых экспериментов. Нормальность распределения выборок устанавливали по критерию Шапиро–Уилка. Достоверность различий между группами оценивали с помощью t-критерия Стьюдента для независимых переменных. Достоверно отличными считали результаты при р < 0.05. Величину IС50 определяли на основе дозозависимых кривых с применением программы OriginТМ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящее время не существует универсальных методов выделения и очистки лектинов. Основная причина этого заключается в их структурно-функциональной гетерогенности и нестабильности при воздействии факторов внешней среды [11, 21]. Для получения гомогенного лектина из микромицета F. solani 4 была использована 5-стадийная очистка, результаты которой представлены в табл. 1.
Из мицелия F. solani 4 экстрагировали белки гомогенизацией биомассы путем механического измельчения ее в 20 мМ Tрис-HCl буфере (рН 7.8). Первоначально их осаждали из экстракта 65%‑ным сульфатом аммония. Однако при их осаждении ацетоном выход лектина оказался выше и составил 105.3%, а степень очистки повышалась в 1.9 раза. В связи с этим в дальнейшем белки осаждали только ацетоном.
Далее очистку лектина F. solani 4 осуществляли гидрофобной хроматографией (рис. 1а). Компоненты, обладающие лектиновой активностью, объединяли, определяли в них содержание белка и рассчитывали удельную гемагглютинирующую активность.
Рис. 1.
Хроматография белков Fusarium solani 4, полученная с помощью гидрофобной хроматографии на Phenyl Sepharose High Performance (а) и ионообменной хроматографии на Bio-Scale™ Mini Macro-Prep High Q (б). 1 – белок; 2 – градиент (NH4)2SO4 (а) или NaCl (б). Стрелкой указан белковый пик лектина.
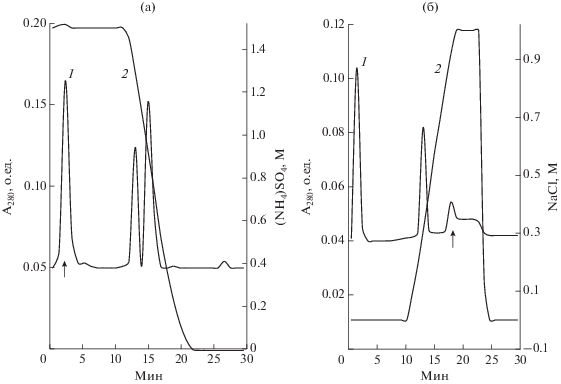
Поиск необходимого сорбента для очистки полученного белкового компонента показал, что наибольший его выход и чистоту удавалось получить при использовании анионообменного сорбента High Q (рис. 1б). При элюции градиентом NaCl белки, связавшиеся с этим сорбентом, разделялись на отдельные компоненты. Исследование их гемагглютинирующей активности показало, что только компоненты, содержащиеся во фракциях 18 и 19, можно было отнести к лектинам. После ионообменной хроматографии этот лектин имел достаточно высокую степень очистки по сравнению с исходным компонентом, а общий выход лектина составил 54.6%.
Учитывая, что использованные методы и приемы позволили лишь частично очистить лектин F. solani 4, на последнем этапе для его очистки применили гель-фильтрацию на Сефадексе G-75. В результате этого удалось полностью очистить лектин от балластных белков.
Таблица 1.
Выделение и очистка лектина из мицелия F. solani 4
| Стадия очистки | Объем, мл | Белок, мг/мл | Общий белок, мг | Титр ГА | Общая ГА, ед. | Удельная ГА, ед./мг | Степень очистки | Выход % |
|---|---|---|---|---|---|---|---|---|
| Исходный экстракт | 5.7 | 6.8 | 38.8 | 8 | 45.6 | 1.2 | 1 | 100 |
| Фракционирование ацетоном и диализ | 3.0 | 7.2 | 21.6 | 16 | 48.0 | 2.2 | 1.9 | 105.3 |
| Гидрофобная хроматография | 2.0 | 4.8 | 9.6 | 16 | 32.0 | 3.3 | 2.8 | 70.2 |
| Ионообменная хроматография High Q | 3.0 | 0.13 | 0.4 | 4 | 12.0 | 30.8 | 25.6 | 54.6 |
| Гель-фильтрация на сефадексе G-75 | 2.5 | 0.04 | 0.1 | 4 | 10.0 | 100.0 | 83.3 | 21.9 |
Таким образом, разработанная схема очистки агглютинина микромицета F. solani 4 позволила получить хроматографически очищенный лектин со степенью очистки 83.3 раз и выходом 21.9%. Следует отметить, что для успешной хроматографии лектина F. solani 4 имел значение выбор pH буферного раствора. Наиболее эффективно он сорбировался на сорбентах при слабощелочных значениях рН 7.6–8.0. Для агглютинина, выделенного и очищенного из мицелия другого штамма F. solani, наиболее эффективно связывание белка с сорбентом также происходило при слабощелочных рН (8.0) [16]. Однако предложенный в этой работе способ выделения и очистки агглютинина отличался от разработанной в данной работе схемы его получения. Так, в предложенной в работе [16] в схеме очистки отсутствовал этап ионообменной хроматографии.
Высокая степень очистки выделенного белка-лектина F. solani 4 была подтверждена присутствием только одного компонента на электрофореграмме, полученной методом ДДС-Na-ПААГ-электрофореза. Удельная активность выделенного и очищенного лектина составила 100.0 U/мг белка. Расчет показал, что из 1 г сухой массы мицелия можно получить 4.5 мкг/мл очищенного белка.
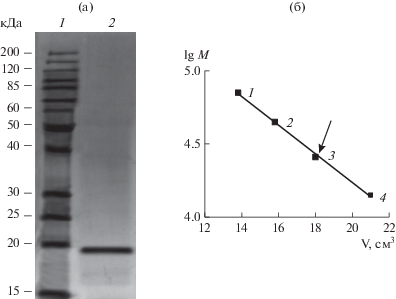
Применение стандартных белков-маркеров с молекулярной массой 15–200 кДа позволило определить, что в денатурирующих условиях с ДДС-Na при электрофорезе в ПААГ молекулярная масса лектина микромицета F. solani 4 составила 19.0 кДа (рис. 2а). Однако определение молекулярной массы лектина в нативных условиях методом гель-фильтрации на Сефадексе G-100 показало, что белок F. solani 4 имел молекулярный вес 38.0 кДа (рис. 2б). Это позволило предположить, что лектин представлял собой димер и состоял из двух идентичных субъединиц, каждая из которых имела молекулярную массу 19.0 кДа. Данная молекулярная масса лектина близка по размеру к агглютининам микромицетов Athelia rolfii, Arthrobotrys oligospora, Neurospora sitophila (36–40 кДа), для которых также было характерно гомодимерное строение белка [12, 13, 25].
Рис. 2.
Электрофореграмма лектина микромицета F. solani 4 после очистки ионобменной хроматографией на High Q и гель-фильтрации на Сефадексе G-75 (а) и окраски нитратом серебра (2), белки-маркеры молекулярной массы (1); зависимость логарифма молекулярной массы белков-маркеров от объема их элюирования (V) при гель-фильтрации на Сефадексе G-100 (б): белки-маркеры (кДа): бычий сывороточный альбумин (70, 1), овальбумин (45, 2), α-химотрипсин (26, 3), лизоцим (14, 4), объем элюции лектина отмечен стрелкой.
Получение лектина микроскопического гриба F. solani 4 в высокоочищенном гомогенном состоянии позволило исследовать его физико-химические свойства и биологическую активность.
Было установлено, что белок оставался полностью стабильным в диапазоне температур от 10 до 60°C. В связи с этим рН-оптимум активности лектина F. solani 4 устанавливали при 20°С. Для этого лектин инкубировали в течение 1 ч в различных буферных растворах, значения рН которых варьировали от 3.0 до 11.0.
Изучение влияния температуры и рН на активность лектина микромицета F. solani 4 показало, что он оказался термостабильным и щелочеустойчивым, поскольку обладал устойчивостью в широком интервале температур (10–60°C) и проявлял максимальную активность преимущественно при щелочных значениях рН (pH 6.5–8.5).
Полученные результаты согласовывались с данными, приведенными в работах [11, 26], в которых показано, что лектины микроскопических грибов могут функционировать в широком интервале температур и значений рН и сохранять активность в пределах температур от 5 до 100°C и рН от 1.5 до 12.5.
Проверка влияния широкого спектра ионов металлов на активность лектина F. solani 4 показала независимость гемагглютинирующей активности от их присутствия. Можно предположить, что это указывает на отсутствие ионов металлов в активном центре связывания углеводов. Для большинства лектинов микромицетов наличие ионов металлов в их составе не является строго необходимым [11].
Характеризуя агглютинин из мицелия микромицета F. solani 4, было интересно определить его специфичность к определeнным углеводам, поскольку именно это уникальное свойство служит основой классификации лектинов и делает их перспективными инструментами для решения многих медико-биологических задач [27].
В результате проведенных исследований удалось определить, что вызванная лектином F. solani 4 гемагглютинация не отменялась большинством использованных в экспериментах моно- и полисахаридов. Однако оказалось, что он проявлял сродство к N-ацетилнейраминовой и N-гликолилнейраминовой кислотам (с минимальной ингибирующей концентрацией 150 и 37.5 мМ соответственно). Эта уникальная специфичность лектина фузариума к сиаловым кислотам свойственна и для лектинов животного происхождения, которые относят к так называемым “иммуноглобулин-подобным сиало-связывающим лектинам” (Sialic acid-binding Ig-like lectins) [28]. Лектин также распознавал и связывался с углеводными детерминантами фибриногена и фетуина (минимальная ингибирующая концентрация – 0.08 и 0.01 мг/мл). Взаимодействие лектина с данными углеводами открывает перспективы применения его в таких важных областях как иммунология, онкология и медицина, а также для диагностики и терапии различных заболеваний [21, 28–30].
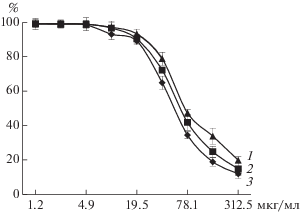
Была проведена оценка лектина F. solani 4 в качестве потенциального противоопухолевого агента на линиях раковых клеток печени (HEPG2), молочной железы (MCF-7) и простаты человека (PC-3). Установлено, что он ингибировал рост всех клеток изучаемых культур, но особенно был активен по отношению к клеточной линии гепатоцеллюлярной карциномы человека HEPG2, для которой величина IС50 соответствовала концентрации 53.61 ± ± 2.3 мкг/мл (рис. 3). Величина IС50 для линий опухолевых клеток простаты (PC-3) и молочной железы (MCF-7) составляла 65.19 ± 2.5 и 74.62 ± ± 3.6 мкг/мл соответственно.
Рис. 3.
Влияние лектина F. solani 4 на линии раковых клеток простаты PC-3 (1), молочной железы MCF-7 (2) и печени HEPG2 (3) человека.
Можно предположить, что неодинаковая чувствительность к лектину разных клеточных линий опухолевых клеток зависит от типичного набора углеводов на поверхности их клеточной мембраны, который и является как одним из решающих факторов при взаимодействии клеток с белком, так и определяющим дальнейшую их гибель. Следует отметить, что имеется немалое количество публикаций, подтверждающее данное предположение [29–33]. Это свойство является биологическим основанием для дальнейшего изучения лектина в качестве возможного противоопухолевого агента.
Таким образом, в результате многостадийной очистки из мицелия микромицета F. solani 4 был получен электрофоретически гомогенный лектин. Были изучены его физико-химические свойства. Установлено, что лектин представлял собой гомодимер, состоящий из двух идентичных субъединиц. Он обладал повышенным сродством к сиаловым кислотам по сравнению с гликопротеинами фетуином и фибриногеном. Лектин микроскопического гриба проявлял дозозависимое токсическое действие по отношению к линии раковых клеток печени (HEPG2), простаты (PC-3) и молочной железы (MCF-7). Его уникальная углеводная специфичность и биологическая активность открывает перспективы для дальнейшего изучения в качестве значимого препарата медицинского назначения.
Работа выполнена при финансовой поддержке 8 конкурса “Пятьдесят лучших инновационных идей для Республики Татарстан” и программы “Участник молодежного научно-инновационного конкурса” (проект 11717р/17263).
Авторы выражают благодарность А.А. Набатову (кафедра биохимии и клинической лабораторной диагностики Казанской государственной медицинской академии) за помощь и полезные советы в аналитических экспериментах.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kocourek J., Horejsi V. // in Lectins: Biology, Biochemistry, Clinical Biochemistry. / Eds. T.C. Bog-Hansen and G.A. Spengler, Berlin: Walter de Gruyter, 1983. V. 3. P. 3–6.
Singh R.S., Tiwary A.K., Kennedy J.F. // Crit. Rev. Biotechnol. 1999. V. 19. № 2. P. 145–178.
Goldstein I.J., Poretz R.D., Liener I.E., Sharon N. // In Lectins: Properties, Functions and Applications in Biology and Medicine. / Eds. I.E. Liener, N. Sharon, I.J. Goldstein. N.Y.: Academic Press, 1986. P. 33–247.
Konska G. // Int. J. Med. Mushrooms. 2006. V. 8. № 11. P. 19–30.
Movafagh A., Ghanati K., Amani D., Mahdavi S.M., Hashemi M., Abdolahi D.Z. et al. // J. Paramed. Sci. 2013. V. 4. P. 1–16.
Lagarda-Diaz I., Guzman-Partida A.M., Vazquez-Moreno L. // Int. J. Mol. Sci. V. 18. № 6. P. 1242–1260.
Hamid R., Masood A., Wani I.H., Rafiq S. // J. Appl. Pharm. Sci. V. 3. № 6. Suppl 1. P. S93–S103.
Луцик М.Д., Панасюк Е.Н., Луцик А.Д. Лектины. Львов: Вища школа, 1981. 152 с.
Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 160 с.
Larroque M., Ramirez D., Lafitte C., Borderies G., Dumas B., Gaulin E. // Protein Expr. Purif. 2011. V. 80. № 2. P. 217–223.
Khan F., Khan M.I. // Int. J. Biol. Chem. 2011. V. 5. № 1. P. 1–20.
Rosen S., Ek B., Rask I., Tunlid A. // J. Gen. Microbiol. 1992. V. 138. № 12. P. 2663–2672.
Kellens J.T., Allen A.K, Peumans W.J. // J. Gen. Microbiol. 1989. № 1. V. 135. P. 3127–3132.
Kossowska B., Zarawska E.L., Olczak M., Katnik-Prastowska I. // Comp. Biochem. Physiol. B. Biochem. Mol. Biol. 1999. V. 123. № 1. P. 23–31.
Bhowal J.M., Banerjee S., Sikdar S., Guha A.K., Chatterjee B.P. // Ind. J. Biochem. Bio. 2004. V. 41. № 2. P. 81–88.
Khan F., Ahmad A., Khan M.I. // Arch. Biochem. Biophys. 2007. V. 457. № 2. P. 243–251.
Singh R.S., Thakur S. // Biologia. 2014. V. 69. P. 1295–1302.
Bhari R., Kaur B., Singh R.S. // Braz. J. Microbiol. 2016. V. 47. № 3. P. 775–780.
Мухаммадиев Р.С., Мухаммадиев Р.С., Валиуллин Л.Р., Багаева Т.В. // Ветеринарный врач. 2018. Т 1. № 1. С. 10–14.
Багаева Т.В., Мухаммадиев Риш.С., Мухаммадиев Рин. С., Алимова Ф.К. // Микология и фитопатология. 2014. Т. 48. № 2. С. 107–111.
Подгорский В.С., Коваленко Э.А., Карпова И.С., Сащук Е.В., Гетьман Е.И. // Прикл. биохимия и микробиология. 2014. Т. 50. № 3. С. 256–263.
Laemmli U.K. // Nature. 1970. V. 77. № 4. P. 680–683.
Singh R.S., Kaur H.P., Kumar P., Kaur H. // Biologia. 2013. V. 68. № 6. P. 1034–1040.
Мухаммадиев Рин.С., Мухаммадиев Риш.С., Бирюля В.В., Идиятов И.И., Набатов А.А., Глинушкин А.П., Валиуллин Л.Р. // Сибирский онкологический журн. 2019. Т. 18. № 6. С. 90–95.
Ishikawa F., Oishi K. // Agr. Biol. Chem. 1989. V. 53. № 7. P. 1769–1776.
Singh R.S., Kaur R. // Appl. Biochem. Biotechnol. 2015. V. 175. № 3. P. 1938–1947.
Sharon N., Lis H. Lectins. Dordrecht: Kluwer Academic Publishers, 2003. 440 p.
Han J.W., Jung M.G., Shim E.Y., Shim J.B., Kim Y.M., Kim G.H. // Mar. Drugs. 2015. V. 13. № 4. P. 2183–2195.
Mody R., Joshi S., Chaney W. // J. Pharmacol. Toxicol. Methods. 1995. V. 33. № 1. P. 1–10.
Zhou R., Han Y., Zhang M., Zhang K., Ng T.B., Liu F. // AMB Express. 2017. V. 7. № 1. P. 47–55.
Catanzaro E., Cinzia C., Bishayee A., Fimognari C. // Mar. Drugs. 2020. № 1. V. 18. P. 11–16.
Yau T., Dan X., C.C. Ng, T.B. Ng // Molecules. 2015. V. 20. № 3. P. 3791–3810.
Audfray A., Beldjoudi M., Breiman A., Hurbin A., Boos I., Unverzagt C., Bouras M., Lantuejoul S., Coll J.L., Varrot A., Le Pendu J., Busser B., Imberty A. // PLoS One. 2015. V. 10. № 6. e0128190.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


