Прикладная биохимия и микробиология, 2021, T. 57, № 2, стр. 152-162
Патогенные свойства и липидный состав мицелия в процессе роста глубинной культуры гриба Stagonospora cirsii ВИЗР 1.41
Г. М. Фролова 1, Е. Р. Котлова 2, С. В. Сокорнова 1, С. В. Сеник 2, А. Л. Шаварда 2, А. Д. Мишарев 3, А. О. Берестецкий 1, *
1 Всероссийский научно-исследовательский институт защиты растений
196608 Пушкин, Россия
2 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, Россия
3 Ресурсный центр “Методы анализа состава вещества” Санкт-Петербургского государственного университета
198504 Петергоф, Россия
* E-mail: aberestetskiy@vizr.spb.ru
Поступила в редакцию 11.09.2020
После доработки 30.10.2020
Принята к публикации 02.11.2020
Аннотация
Для идентификации маркеров качества потенциального микогербицида против бодяка полевого (Cirsium arvense) на основе мицелия гриба Stagonospora cirsii ВИЗР 1.41 проанализированы изменения его патогенности и липидного профиля в процессе глубинного культивирования. Определены жирнокислотный состав и молекулярные виды доминирующих липидов. Показано, что липидный состав мицелия в процессе роста S. cirsii существенно меняется вместе с изменением его патогенных свойств. Наиболее патогенный мицелий (в фазе экспоненциального роста) характеризовался относительно максимальным содержанием таких структурных липидов, как фосфатидилхолины (ФХ), фосфатидилэтаноламины (ФЭ) и эргостерин. С возрастом культуры и со снижением патогенности мицелия их содержание в биомассе также снижалось. В начале стационарной фазы роста S. cirsii наблюдали максимальную концентрацию липидов, среди которых преобладали триацилглицериды. Установлено, что при старении мицелия снижался индекс двойных связей жирных кислот в составе глицеролипидов, а также происходила замена молекулярных форм ФХ (34:2 на 36:4) и ФЭ (36:4 на 34:2). Можно предположить, что маркерами качества мицелия S. cirsii могут служить высокий уровень э-ргостерина, триацилглицеридов, фосфатидилхолинов (в частности, 34:2-форм) и фосфатидилэтаноламинов (36:4-форм).
Липидный состав грибов – возбудителей заболеваний различных организмов, может быть связан с их вирулентными свойствами, такими как адгезия, инвазивность, развитие, персистентность [1]. Так, в мицелии и спорах микромицетов (например, фитопатогенных, энтомопатогенных и микоризообразующих) часто встречаются липидные включения [2–4]. Накапливающиеся в них триацилглицериды (ТАГ) служат не только резервным источником энергии для успешной колонизации хозяина, но и обеспечивают молекулярное разнообразие фосфолипидов в процессе ремоделлинга [5, 6]. В инфекционный процесс вовлечены мембранные липиды различных классов, обеспечивая взаимодействие патогена и хозяина [1, 7]. Этот процесс также зависит от фосфолипидного гомеостаза в клетках грибного патогена, в частности, концентрации и соотношения фосфатидилхолинов (ФХ) и фосфатидилэтаноламинов (ФЭ) [8–10], а также содержания эргостерина (ЭС) [11] и сфинголипидов, в особенности, гликоцерамидов (ГлЦер) [12, 13]. Несмотря на то, что липидный состав грибов, включая фитопатогенные виды, изучается достаточно давно [14], его роль во взаимоотношениях микромицетов с растениями исследована недостаточно [15].
В нашей работе [16] было изучено влияние источников азота различной природы на патогенность и липидный состав мицелия гриба Stagonospora cirsii J.J. Davis – перспективного для биологической борьбы с бодяком полевым (Cirsium arvense). Было сделано предположение, что повышенное содержание в его мицелии стеринов, свободных жирных кислот (ЖК) и определенных ГлЦер в экспоненциальной фазе роста S. cirsii может иметь связь с высоким уровнем патогенности этого микромицета при глубинном культивировании на среде с органическим источником азота [16]. В другой работе [17] было показано, что патогенные свойства мицелия S. cirsii существенно зависят также от возраста культуры. Учитывая, что липидный состав грибов меняется с возрастом культуры [14], представляется интересным изучение такой связи и на примере S. cirsii, что может быть полезным для выявления биохимических критериев качества микогербицида на его основе.
Цель работы ‒ определение патогенности и липидного профиля мицелия S. cirsii в процессе роста глубинной культуры, а также анализ изменений ЖК-состава и молекулярных видов основных липидов.
Объект исследований. В работе использовали штамм ВИЗР 1.41 гриба S. cirsii из коллекции микроорганизмов Всероссийского научно-исследовательского института защиты растений. Глубинный мицелий S. cirsii получали на жидкой сахарозо-соевой среде (СС) по описанной ранее методике [16]. Мицелий собирали в середине экспоненциальной, в начале и конце стационарной фаз роста (на 3, 6 и 9 сут соответственно) и тщательно промывали от остатков питательной среды дистиллированной водой. Прижизненную окраску липидных включений в мицелии S. cirsii проводили суданом черным [18]. Препараты исследовали при помощи микроскопа DM2500 с фотокамерой DFC420 (“Leica”, Германия) при 60-кратном увеличении.
Патогенность мицелия S. cirsii оценивали по разработанной ранее лабораторной методике [17]. Дополнительно определяли период эпифитного роста инфекционных гиф до момента внедрения в ткани листа через кутикулу. Для этого листовые высечки через 4, 5, 6, 7, 8, 12 и 24 ч после инокуляции мицелием гриба фиксировали в растворе Карнуа, окрашивали анилиновым синим и анализировали под микроскопом при 400-кратном увеличении [18].
Выделение и анализ липидов. Липиды экстрагировали из высушенного при комнатной температуре мицелия стандартным методом Фолча, как описано ранее [16]. В экстракте определяли содержание нейтральных липидов (НЛ), сфинголипидов (СЛ) и фосфолипидов (ФЛ) [16]. Для извлечения полярных липидов (ПЛ) из влажного мицелия и последующего их анализа использовали модифицированный для грибов метод Николса [19].
Липиды анализировали методом высокоэффективной тонкослойной хроматографии (ВЭТСХ) с использованием оборудования фирмы “Camag” (Швейцария), включающим автоматический аппликатор (Sampler 4), хроматографическую камеру (ADC 2), спектроденситометр (Scanner 4) и программное обеспечение winCATS. Пластины, размером 20 × 10 см, для ВЭТСХ (HPTLC Silica gel 60 F254, “Merck”, Германия) предварительно промывали смесью CHCl3-MeOH (1 : 1, об./об.) и активировали при 120°С в течение 20 мин. На одной пластине анализировали до 20 проб. Объем наносимого экстракта составлял 10 мкл (при концентрации 2 мг/мл), ширина полос нанесения – 6 мм. Хроматографическое разделение НЛ осуществляли как описано в работе [20] в режиме трех-шагового элюирования в системах : хлороформ–метанол–аммиак–бензол (65 : 30: 6 : 10, об./об.) – 2 см от старта; гексан–диэтиловый эфир–уксусная кислота (70 : 30 : 1, об./об.) – 7 см от старта; гексан–диэтиловый эфир (97 : 3, об./об.) – 8 см от старта. Для разделения ПЛ использовали оптимизированный равномерный 12‑ступенчатый градиент метанол–дихлорметан от 65 : 35 до 10 : 90 (об./об.) в атмосфере 1 н NH4ОН [16]. Полученные данные сопоставляли с результатами разделения ПЛ общепринятым методом двухмерной ТСХ на пластинах TLC Silica gel 60 (“Merck”, Германия), размером 10х10 см, в системах растворителей: хлороформ–метанол–вода (65 : 25 : 4, об./об.) – в первом направлении; хлороформ–ацетон–метанол–уксусная кислота–вода (50 : 20 : 10 : 10 : 5, об./об.) – во втором направлении [21].
Разделенные методом одномерной ТСХ липиды визуализировали реагентом (20 г CuSO4, 200 мл метанола, 8 мл H2SO4 и 8 мл Н3РО4) и последующим нагреванием пластин 5 мин при 175°С. Липиды детектировали на спектроденситометре при 550 нм в режиме поглощения. Соотношение липидов определяли по площади пиков в программе winCATS. После проведения двухмерной ТСХ липиды визуализировали обработкой пластин 5%-ым раствором серной кислоты в метаноле с последующим нагреванием. Количественное определение различных ФЛ и СЛ выполняли с помощью денситометра Денскан и программы DENS-14-12-03 (“Ленхром”, Россия).
Индивидуальные классы липидов определяли по величине Rf после сравнения со стандартными образцами ТАГ, 1,2-диацилглицеринов, 1,3-диацилглицеринов, ЭС, ФЭ, ФХ, ФС, фосфатидилинозитов (ФИ) (“Sigma”, США) и смеси цереброзидов бычьего мозга (“Larodan”, Швеция). Для их идентификации проводили реакции со специфическими реагентами на отдельные функциональные группы, включающие резорцин в метаноле для определения гликолипидов, реактив Васьковского и Латышева для – ФЛ, раствор нингидрина в ацетоне для липидов, содержащих первичные аминогруппы, и реактив Драгендорфа для липидов, имеющих триметиламмонийные группы. Концентрации рассчитывали с использованием калибровочных кривых, построенных по внешнему стандарту. Для этого на хроматографические пластины, помимо исследуемых образцов, наносили стандартные растворы липидов в двух концентрациях.
Определение жирнокислотного состава. Препаративное выделение НЛ осуществляли на пластине размером 20 × 10 см (TLC Silica gel 60, “Merk”, Германия) в системе гексан–диэтиловый эфир–уксусная кислота (70 : 30 : 1 об./об.), ПЛ – методом двумерной ТСХ как было описано выше. Пластины проявляли с помощью паров йода. Состав ЖК индивидуальных глицеролипидов определяли после их гидролиза 2.5%-ной H2SO4 в метаноле в течение 2 ч при 70°С. Отдельные структурные типы стеринов анализировали после дериватизации методом исчерпывающего силилирования. Для этого к растворенному в ацетонитриле сухому остатку общего экстракта липидов добавляли N,O-бис-(триметилсилил)-трифторацетамид и растворенный в пиридине трикозан (nС23) в качестве внутреннего стандарта. Смесь встряхивали на вортексе в течение 10 мин, а затем нагревали 15 мин при 100°С. Полученные производные ЖК и стеринов анализировали методом газовой хромато-масс-спектрометрии на хроматографе Maestro с масс-селективным детектором 5975С (“Agilent”, США). Для анализа метиловых эфиров ЖК (МЭЖК) использовали капиллярную колонку OmegaWax 250 (“Supelco”, США) длиной 30 м, внутренним диаметром 0.25 мм и толщиной пленки неподвижной фазы 0.25 мкм, для анализа стеринов – колонку HP-5MS с аналогичными параметрами. Хроматографическое разделение МЭЖК проводили в режиме линейного изменения температуры термостата от 170 до 220°С, стеринов – от 70 до 320°C со скоростью 6°C/мин. Скорость газа-носителя (гелия) составляла 1 мл/мин, температура испарителя – 250°С, температура детектора – 250°С. Сбор данных проводили с помощью программного обеспечения ChemStation (“Agilent”, США). Обработку и интерпретацию масс-спектрометрической информации осуществляли с использованием программы AMDIS (https:// www.amdis.net) и библиотеки NIST2005 (https:// chemdata.nist.gov).
Анализ молекулярных видов. Молекулярные виды ФХ и ФЭ определяли с использованием времяпролетного масс-спектрометра MicrOTOF 10223 (“Bruker”, Германия). Липиды извлекали с пластин при помощи полуавтоматического экстрактора TLC-MS Interface (“Camag”, Швейцария) смесью изопропанол–метанол–вода (5 : 3 : 2, об./об.) в 0.1%-ном аммиаке для детектирования отрицательно заряженных ионов и метанолом в 0.1%-ной муравьиной кислоте для анализа положительно заряженных ионов. Скорость подачи элюентов (70 мкл/мин) контролировали насосом System Gold 125 HPLC (“Beckman Coulter Inc.”, США). Спектры записывали при ионизации распылением в электрическом поле в режиме положительных и отрицательных ионов в диапазоне 150–3000 m/z, температуре источника ионов 40°С и капиллярном напряжении 3.5 кВ.
Молекулярные виды ГлЦер определяли с использованием времяпролетного масс-спектрометра высокого разрешения МХ5310 (Институт аналитического приборостроения РАН, Россия) с ортогональным вводом и электрораспылительным источником ионов. Образцы растворяли в смеси метанол–ацетонитрил–муравьиная кислота (49 : 49 : 2, об./об.). Объем пробы составлял 10–50 мкл при скорости подачи 1–5 мкл/мин. Распыляющий потенциал на капилляре составлял 3.3 кВ, температура десольвирующего газа 50°С. Спектры получали в режиме положительных ионов в диапазоне 150–1500 m/z.
Статистическая обработка результатов. Статистическую обработку данных проводили стандартными методами с помощью программы Statistica 8.0 (“StatSoft”, США). Исследование состава и содержания индивидуальных классов липидов, а также анализ их ЖК проводили в 3‑кратной биологической повторности. За биологическую повторность принята глубинная культура S. cirsii, выращенная в стандартных условиях в одной колбе в одном независимом эксперименте. Данные, полученные после статистической обработки результатов 3 независимых экспериментов, представлены в виде М ± σ, где М – среднее арифметическое, σ – его стандартное отклонение. Анализ молекулярных видов ФХ и ФЭ проведен в одном независимом эксперименте в 2–3 аналитических повторностях. Достоверность различий в составе и содержании липидов культуры разного возраста оценивали по критерию Стьюдента либо по критерию наименьшей существенной разности (НСР) при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физиологические особенности, патогенность и липидный состав. В глубинной культуре на среде СС гриб S. cirsii образовывал мелкие, диаметром ~5 мм розовато-кремовые пеллеты. Меланизация гиф начиналась на 6 сут и достигала максимума на 9 сут роста S. cirsii. Как было показано ранее [16, 17] и в табл. 1, на 3 сут культивирования на среде СС гриб находился в фазе экспоненциального роста, начало стационарной фазы наблюдали на 6 сут, а на 9 сут – ее завершение.
Таблица 1.
Выход биомассы, патогенные свойства, содержание и состав липидов мицелия S. cirsii на различных сроках глубинного культивирования
| Возраст культуры, сут | Выход сухой биомассы, г/л | Период эпифитного роста, ч | Площадь некроза, % | Содержание общих липидов, % от сухой биомассы | Содержание основных классов липидов, % от общих липидов* | ||
|---|---|---|---|---|---|---|---|
| НЛ | ФЛ | СЛ | |||||
| 3 | 6.7 | 4 | 100 | 4.2 | 55 ± 1.6 | 38 ± 2.0 | 7 ± 1.8 |
| 6 | 11.9 | 6 | 85 | 6.5 | 76 ± 2.1 | 16 ± 1.9 | 8 ± 1.3 |
| 9 | 10.0 | 12 | 50 | 5.7 | 75 ± 3.2 | 15 ± 2.5 | 10 ± 0.9 |
| НСР | 6.0 | 0.3 | 12.0 | 0.7 | – | – | – |
Трехсуточный мицелий S. cirsii характеризовался наибольшей патогенностью, о чем свидетельствуют короткий период (4 ч) проникновения в ткани листьев бодяка и максимальная площадь их поражения. С увеличением сроков культивирования патогенность мицелия S. cirsii снижалась, что выражалось в существенном увеличении длительности эпифитного роста и уменьшении площади некрозов на листовых дисках (табл. 1).
Липидные включения в мицелии S. cirsii окрашивались красителем в сине-черный цвет. Небольшие липидные капли в гифах были отмечены на 3 сут культивирования, а на 6 и 9 сут роста объем липидных включений в мицелии гриба был заметно больше (рис. 1). Микроскопические исследования не выявили каких-либо видоизменений мицелия: аномально утолщенных клеток, хламидоспор и микросклероциев.
Рис. 1.
Липидные включения в глубинном мицелии S. cirsii на разных стадиях роста – на 3 (а), 6 (б) и 9 (в) сут.

Максимальное накопление липидов (6.5% от массы высушенного мицелия) было отмечено в начале стационарной фазы роста S. cirsii (табл. 1). Независимо от возраста культуры доминирующими липидами мицелия S. cirsii были НЛ, доля которых составляла 55–76% от массы общего липидного экстракта. Максимальное содержание НЛ в мицелии, так же, как и липидных включений отмечено в начале и конце стационарной фазы роста гриба (табл. 1, рис. 1). При этом максимальное содержание ФЛ было обнаружено в 3-суточном мицелии, а СЛ – в 9-суточном. На 9 сут роста доля ФЛ снизилась в 2.5 раза (с 38 до 15% от суммы липидов), а доля СЛ за время наблюдений незначительно выросла (табл. 1).
Рис. 2.
Изменение относительного содержания нейтральных (а) и полярных липидов (б) на 3 (1), 6 (2) и 9 (3) сут роста глубинной культуры S. cirsii.
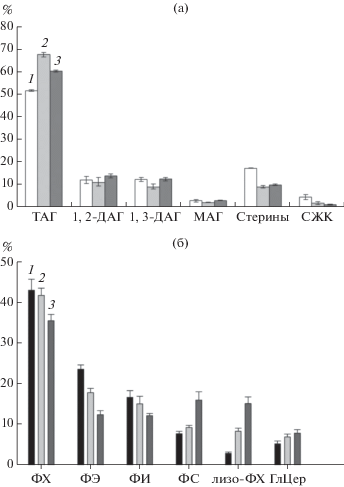
Нейтральные липиды. Независимо от возраста мицелия S. cirsii основными компонентами фракции НЛ были ацилглицериды, доля которых составляла примерно 80%. Среди них преобладали ТАГ (51–60% от пула НЛ), относительное содержание которых при переходе с фазы активного роста (3 сут) на стационарную фазу (6 сут) увеличивалось более чем на 30%, а на 9 сут культивирования незначительно (на 15%) снижалось. Доля моно- и диацилглицеридов с возрастом культуры гриба практически не менялась, находясь на уровне около 18% (рис. 2а).
При варьировании концентрации ТАГ в мицелии S. cirsii наблюдали также изменения их молекулярного состава. Молекулярные виды ТАГ, содержащие полиненасыщенные С18:2 и С18:3 кислоты (линолевую и линоленовую кислоты), частично замещались молекулярными видами, этерифицированными насыщенной С16:0 и моноеновыми С16:1 и С18:1 кислотами. Так, в 3-суточном мицелии S. cirsii фракция ТАГ содержала 38% С18:2 кислоты, а в стационарной фазе роста – 12–15% (табл. 2).
Таблица 2.
Изменения в составе жирных кислот триглицеридов в процессе роста глубинной культуры S. cirsii (% от суммы жирных кислот)
| ЖК* | ТАГ | ||
|---|---|---|---|
| 3 сут | 6 сут | 9 сут | |
| С16:0 | 16.4 ± 3.5а | 27.1 ± 2.8б | 22.5 ± 3.0б |
| С16:1 | 2.7 ± 1.1а | 11.1 ± 2.0б | 9.3 ± 0.8б |
| С18:0 | 8.8 ± 2.0 | 8.7 ± 0.9 | 8.9 ± 1.0 |
| С18:1 Δ9 | 25.7 ± 3.4а | 34.2 ± 1.4б | 37.1 ± 1.6б |
| С18:1 Δ11 | 3.0 ± 0.0 | 4.3 ± 0.6 | 4.2 ± 0.7 |
| С18:2 | 38.2 ± 3.2а | 11.8 ± 1.1б | 14.9 ± 2.7б |
| С18:3 | 3.3 ± 0.7а | 0.5 ± 0.1б | 0.7 ± 0.3б |
| ∑С20–22** | 1.2 ± 0.2 | 0.7 ± 0.2 | 0.9 ± 0.2 |
| ИДС*** | 1.2 | 0.8 | 0.8 |
* Приведены основные ЖК, относительное содержание которых превышало 1%. ** Представлена сумма изомеров полиненасыщенных ЖК С20-С22 ряда. *** ИДС – индекс двойных связей. (Приведены средние значения 3 независимых экспериментов и их стандартное отклонение; достоверно различающиеся (P ≤ 0.05) средние значения отмечены разными буквами – а и б).
Содержание стеринов в мицелии также заметно изменялось. Максимальное их накопление (17% от суммы НЛ) наблюдалось в фазе экспоненциального роста гриба, а в стационарной фазе их доля снижалась до 8%. Доля свободных ЖК была низкой – 4.8% на 3 сут роста, а на 9 сут культивирования снижалась в 6 раз (рис. 2а). Фракция стеринов, независимо от возраста культуры гриба, была представлена в основном ЭС (83–89%). Также в минорных количествах были выявлены: эргоста-5,7,9(11),22-тетраен-3-ол (около 3.5%), 5‑дегидро-эргостерин (0.4%) и холестерин (0.3%). В процессе развития культуры S. cirsii статистически значимых модификаций состава стеринов зарегистрировано не было.
Полярные липиды. Согласно данным, полученным методом ВЭТСХ и многократного элюирования, в экспоненциальной фазе роста доминирующими ПЛ в мицелии S. cirsii были ФХ и ФЭ – 43% и 23% от пула ПЛ соответственно. Остальные выявленные ФЛ (ФС, ФИ и лизо-ФХ) присутствовали в меньших количествах – 3–16%. В процессе дальнейшего развития культуры относительное содержание ФХ и ФЭ снижалось. Причем доля ФЭ к 9 сут снижалась в 2 раза, а ФХ – всего лишь в 1.2 раза. В конце стационарной фазы роста в мицелии S. cirsii существенно повысилось содержание ФС и лизо-ФХ, в 2 и 5 раз соответственно. Содержание ГлЦер в процессе роста гриба изменялась несущественно, но имело тенденцию к увеличению (рис. 2б).
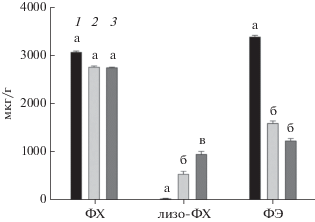
Количественный анализ доминирующих ФЛ, определенный методом двумерной ТСХ подтвердил существенное снижение концентрации ФЭ (в 2.8 раз) в мицелии, тогда как содержание ФХ снижалось незначительно (в 1.1 раз) при трехкратном увеличении концентрации лизо-ФХ в процессе роста мицелия S. cirsii (рис. 3).
Рис. 3.
Динамика содержания основных фосфолипидов в мицелии S. cirsii на 3 (1), 6 (2) и 9 (3) сут. Средние значения, отмеченные одной буквой, не различаются на уровне р = 0.05.
Анализ состава ЖК ФХ и ФЭ показал, что переход культуры S. cirsii от экспоненциальной к стационарной фазе роста сопровождался снижением относительного содержания С18:2 и С18:3 кислот и увеличением доли С18:1 кислоты. Изменения состава ЖК ФХ и ФЭ оказались схожими, отмечено постепенное снижение индекса двойных связей (табл. 3).
Таблица 3.
Изменения в составе ЖК доминирующих мембранных липидов в процессе роста глубинной культуры S. cirsii (% от суммы жирных кислот)*
| ЖК | ФХ | ФЭ | ||||
|---|---|---|---|---|---|---|
| 3 сут | 6 сут | 9 сут | 3 сут | 6 сут | 9 сут | |
| С16:0 | 11.8 ± 1.3 | 9.8 ± 4.6 | 10.0 ± 4.3 | 13.0 ± 0.3 | 14.3 ± 2.2 | 12.9 ± 2.7 |
| С16:1 | 0.8 ± 0.4 | 2.6 ± 0.9 | 1.2 ± 0.4 | 1.0 ± 0.5 | 3.1 ± 0.8 | 1.7 ± 0.8 |
| С16:1 Δ9 | 8.0 ± 3.4 | 9.1 ± 2.3 | 6.9 ± 1.2 | 5.8 ± 1.8 | 4.8 ± 0.6 | 4.8 ± 1.0 |
| С18:0 | 2.1 ± 0.1 | 3.0 ± 1.7 | 5.7 ± 1.3 | 2.4 ± 0.2 | 4.2 ± 0.7 | 3.6 ± 0.5 |
| С18:1 Δ9 | 12.5 ± 1.1а | 31.8 ± 3.4б | 39.2 ± 3.9б | 13.1 ± 2.1а | 35.1 ± 3.4б | 40.0 ± 5.0б |
| С18:1 Δ11 | 8.0 ± 0.6 | 5.9 ± 0.9 | 7.5 ± 1.5 | 6.8 ± 0.5 | 5.2 ± 0.7 | 6.2 ± 0.4 |
| С18:2 | 48.5 ± 5.1а | 33.7 ± 2.0б | 31.1 ± 1.5б | 51.1 ± 4.3а | 30.3 ± 1.9б | 28.2 ± 3.1б |
| С18:3 | 4.5 ± 1.6а | 1.0 ± 0.4б | 0.7 ± 0.3б | 3.3 ± 1.0а | 0.7 ± 0.3б | 0.5 ± 0.1б |
| ∑С20–22 | 2.3 | 1.5 | – | 1.9 | – | 1.0 |
| ИДС | 1.4 | 1.2 | 1.1 | 1.4 | 1.2 | 1.1 |
* Обозначения как в табл. 2.
Анализ молекулярных видов. По данным масс-спектрометрии ФХ и ФЭ формировали два основных кластера молекулярных видов с ацильными группами С16/С18 (С34) и С18/18 (С36). Среди них доминировали четыре молекулярных вида С34:2, С36:4, С36:3 и С36:2, которым соответствовали депротонированные [ФЭ–Н]– с m/z 714.520, 738.528, 740.543 и 742.557 и катионированные молекулы [ФХ + Na]+ с m/z 780.550, 804.552, 806.559 и 808.572. Согласно данным анализа ЖК эти молекулярные виды преимущественно содержат ацильные группы 16:0/18:2, 18:2/18:2, 18:1/18:2 и 18:1/18:1 (табл. 4). Молекулярные ионы в диапазоне m/z 846-850 и 872-876 в спектрах ФХ соответствовали кластеру аддуктов основных молекулярных видов с формиатом натрия [ФХ(С34) + + СООNa]+ и [ФХ(26) + СООNa]+ (рис. 4).
Таблица 4.
Изменения в составе основных молекулярных видов ФХ, ФЭ в процессе роста глубинной культуры S. cirsii
| ФХ | ФЭ | ||||||
|---|---|---|---|---|---|---|---|
| m/z [M + Na]+ |
молекуляр-ный вид* | содержание, %** | m/z [M–Н]– |
молекуляр-ный вид | содержание, % | ||
| 3 сут | 9 сут | 3 сут | 9 сут | ||||
| 778 | С34:3 | 11.4 | 4.4 | 712 | С34:3 | 4.6 | 4.5 |
| 780 | С34:2 | 33.5 | 9.5 | 714 | С34:2 | 14.8 | 21.9 |
| 782 | С34:1 | 11.5 | 5.2 | 716 | С34:1 | 4.2 | 8.0 |
| 784 | С34:0 | 0 | 3.2 | 738 | С36:4 | 32.7 | 18.1 |
| 804 | С36:4 | 17.2 | 24.6 | 740 | С36:3 | 27.1 | 26.8 |
| 806 | С36:3 | 15.7 | 31.8 | 742 | С36:2 | 10.5 | 16.2 |
| 808 | С36:2 | 6.3 | 13.7 | 744 | С36:1 | 1.4 | 2.3 |
Рис. 4.
Масс-спектры молекулярных видов ФХ (а, б) и ФЭ (в, г) мицелия S. cirsii, снятые соответственно в положительном и в отрицательном режимах ионизации (на 3 (а, в) и 9 сут (б, г) роста).
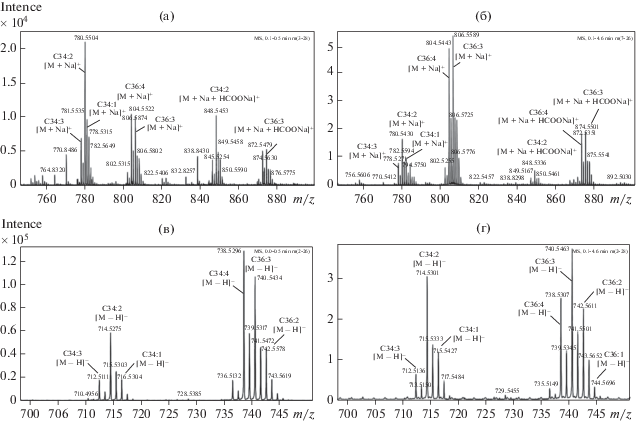
В 3-суточном мицелии S. cirsii доминировали С34 молекулярные виды ФХ, относительное содержание которых составляло 56%. В фазе замедленного роста их доля снижалось до 22%, но при этом увеличивалось содержание С36 молекулярных видов ФХ (с 33 до 78%) (рис. 4, табл. 4). Во фракции ФЭ наблюдалась обратная, но менее выраженная закономерность. Так, независимо от возраста доминировали С36 молекулярные виды ФЭ, содержание которых снижалось незначительно с 76 до 66% на 3 и 9 сут соответственно, при этом содержание ФЭ С34 увеличивалось с 24 до 35% (рис. 4, табл. 4).
Во фракции ГлЦер было выявлено 10 молекулярных видов. Сфингоидные основания ГлЦер были представлены преимущественно 9-метил-4,8-сфингадиенином (d18:2Δ4,8,9-Метил). Его окисленная форма d18:1Δ8,4-Эпокси,9-Метил обнаружена в значительно меньшем количестве. Доминирующей ЖК, входящей в состав ГлЦер, была С18:1(ОН) кислота. В значительно меньших количествах обнаружены ГлЦер с С18:0, С18:1 и 22:0(ОН) кислотами, длинноцепочечные гидрокси-кислоты С24 ряда – в следовых. Среди выявленных молекулярных форм ГлЦер независимо от возраста культуры S. cirsii, доминирующим (с долей 70–75% от пула ГлЦер) было соединение с m/z 776 [M + Na]+, соответствующее 9-метил-4,8-сфингадиенину, связанному амидной связью с 2-гидроксиоктадекановой кислотой (d18:2Δ4,8,9-Метил/18:1ОН). По мере старения культуры S. cirsii относительное содержание его окисленной формы с m/z 792 [M + + Na]+ увеличивалось в 3 раза (табл. 5).
Таблица 5.
Изменения в составе молекулярных видов ГлЦер [M + Na]+ (%) в процессе роста глубинной культуры S. сirsii*
| ЖК | m/z | d18:2Δ4,8, 9-Метил | m/z | d18:1Δ8, 4-Эпокси, 9-Метил | ||||
|---|---|---|---|---|---|---|---|---|
| 3 сут | 6 сут | 9 сут | 3 сут | 6 сут | 9 сут | |||
| 18:1 | 760 | 0.8 ± 0.2 | 0.4 ± 0.01 | 0.4 ± 0.01 | 776 | – | – | – |
| 18:0 | 762 | 5.8 ± 0.2 | 4.1 ± 1.0 | 5.2 ± 0.4 | 778 | – | – | – |
| 18:1(ОН) | 776 | 70.7 ± 3.0 | 75.8 ± 1.5 | 71.1 ± 5.9 | 792 | 3.0 ± 0.6а | 8.2 ± 1.7б | 9.1 ± 5.9аб |
| 22:0(ОН) | 834 | 1.2 ± 0.5 | 2.1 ± 0.1 | 2.3 ± 0.6 | 850 | 0.9 ± 0.3 | 0.7 ± 0.04 | 0.8 ± 0.1 |
| 24:1(ОН) | 860 | 0.3 ± 0.05а | 0.4 ± 0.2а | 0.8 ± 0.1б | 876 | 0.2 ± 0.01 | 0.2 ± 0.1 | 0.2 ± 0.1 |
| 24:0(ОН) | 862 | 0.2 ± 0.02а | 0.2 ± 0.1а | 0.6 ± 0.04б | 878 | 0.1 ± 0.03 | 0.1 ± 0.05 | 0.3 ± 0.1 |
Штамм S. cirsii ВИЗР 1.41 является продуцентом потенциального микогербицида против бодяка полевого, действующим началом которого является мицелий этого гриба [17]. Важно отметить, что помимо высокой биологической эффективности продуценты биопестицидов должны быть высокопродуктивными и устойчивыми к стресс-факторам [22]. При культивировании на среде СС быстрорастущий (находящийся в фазе экспоненциального роста) 3-сут мицелий S. cirsii был наиболее патогенным (табл. 1), при этом наибольший выход мицелия наблюдался на 6 сут. Для этого мицелия показано, что он более толерантен к высушиванию, чем 3-суточный [23]. Клетки модельного дрожжевого гриба Saccharomyces cerevisiae в фазе стационарного роста также были на несколько порядков более толерантны к высушиванию по сравнению с клетками в фазе экспоненциального роста. При этом в ответ на высушивание изменялся биохимический состав дрожжевых клеток, в том числе состав мембранных липидов [24]. С одной стороны, это свидетельствовало о предпочтительности использования мицелия S. cirsii в начале стационарной фазы роста для обработки сорных растений или стабилизации в виде подходящей препаративной формы. С другой стороны, полученные данные показали необходимость поиска биохимических критериев соответствующего качества мицелия S. cirsii, поскольку при дальнейшей оптимизации состава жидкой питательной среды продолжительность определенных фаз его роста может меняться.
Анализ общего содержания липидов показал, что глубинный мицелий S. cirsii проявлял характерную для большинства мицелиальных грибов тенденцию к их накоплению [25]. Максимальный уровень липидов, среди которых доминировали НЛ, наблюдался в начале стационарной фазы роста, что согласовывалось с их основной ролью резервных или запасных липидов.
Среди НЛ мицелия S. cirsii доминирующими оказались ТАГ. Как было показано на примере ряда модельных видов фитопатогенных микромицетов (Stagonospora nodorum, Magnaporthe grisea и Zymoseptoria tritici), способность к накоплению этих резервных липидов может быть одним из факторов вирулентности, увеличивая их толерантность к различным стресс-факторам [26–28]. Высокопатогенный 3-суточный мицелий S. cirsii отличался наименьшим относительным содержанием ТАГ, что весьма типично для активно растущих молодых культур микромицетов [25]. Можно предположить, что ТАГ играют определенную роль в патогенности 6-суточного мицелия S. cirsii, обеспечивая питание в период эпифитного роста гриба.
В высокопатогенном мицелии в экспоненциальную фазу роста S. cirsii наблюдали максимальное содержание стеринов, в частности, ЭС. Накопление ЭC в активно растущем мицелии S. cirsii согласовывалось с его важной биологической ролью, связанной с участием в процессах клеточного цикла и поддержания структуры и нормального функционирования мембран [29]. У Penicillium atrovenetum максимальное содержание ЭС в биомассе также отмечено в фазу экспоненциального роста, а в стационарную фазу наблюдали резкое снижение концентрации этого липида [30]. ЭС рассматривается также как “микроб-ассоциированный молекулярный паттерн” фитопатогенных грибов или элиситор, отвечающий за индукцию растениями неспецифического иммунного ответа [31]. Можно предположить, что S. cirsii обладает механизмами, свойственными некоторым некротрофным фитопатогенам (например, Botrytis cinerea и Sclerotinia sclerotiorum) [32], которые позволяют подавлять защитные реакции растения-хозяина.
Количество и соотношение ФХ и ФЭ имеет большое значение для поддержания функционального состояния мембран. Так, исследования методом компьютерного моделирования выявили существенные изменения латерального давления, электрического поля и дипольного потенциала мембран при различных соотношениях ФХ/ФЭ [33]. Показатель ФХ/ФЭ изменялся в процессе роста и развития грибов. Так, переход глубинной культуры S. cerevisiae из логарифмической в стационарную фазу роста сопровождался увеличением соотношения ФХ/ФЭ с 0.9 до 2.2 [34]. В высокопатогенном 3-суточном мицелии S. cirsii наблюдали максимальное содержание ФХ и ФЭ, а в процессе роста гриба соотношение ФХ/ФЭ увеличивалось (рис. 2б, 3).
Связь содержания и состава мембранных глицерофосфолипидов с патогенными свойствами грибов может быть обусловлена участием их определенных молекулярных видов в формировании необходимых свойств поверхности инфекционных гиф, а также в образовании внеклеточных везикул, обеспечивающих доставку в участки инфекции таких разнообразных факторов вирулентности, как литических ферментов и белков-эффекторов [35]. Практически ничего не известно о влиянии состава ФЛ в инфекционных структурах грибов–возбудителей болезней растений на их патогенные свойства. Однако недавно на примере мутантов Fusarium graminearum по некоторым генам, отвечающим за биосинтез ферментов (ФС-декарбоксилазы 2, ФЭ-метилтрансферазы и метилен-ацил-жирной кислоты-ФЛ-синтазы), было показано, что нарушение биосинтеза ФЛ приводит к понижению уровня вегетативного роста и патогенности этого гриба, а также к повышению чувствительности к фунгицидам [10].
Изменения во фракции ФЭ в процессе роста S. cirsii включали увеличение относительного содержания видов с m/z 714 (С34:2) и 742 (С36:2) и почти двукратное снижение (с 33 до 18%) уровня видов с m/z 738 (С36:4, преимущественно 18:2/18:2), доминирующего в мицелии S. cirsii в фазе активного роста. Предположительно, в ходе развития культуры S. cirsii, сопровождающегося снижением патогенности гриба, происходила существенная перестройка жирнокислотного состава доминирующих ФЛ: замена молекулярных видов ФХ16:0/18:2 (С34) на ФХ18:2/18:2 и ФХ18:1/18:2 (С36), а также ФЭ18:2/18:2 (С36) на ФЭ16:0/18:2 (С34). Тенденция, связанная с повышением уровня С34-форм и пониженное содержание С36-форм в составе ФХ, была обнаружена также у мутанта (Δmr LPAAT1) энтомопатогенного гриба M. robertsii по сравнению с вирулентным штаммом дикого типа [9].
С использованием мутантного штамма с нарушенным метаболизмом ГлЦер установлен вклад данного класса липидов в вирулентность возбудителя фузариоза колоса пшеницы Fusarium graminearum и выявлена особая роль метильной группы при С-9 сфингоидного основания [13]. У S. cirsii во фракции ГлЦер преобладало характерное для грибов соединение (d18:2Δ4,8,9-Метил/18:1 ОН), в котором 9-метил-4,8-сфингадиенин связан амидной связью с 2-гидроксиоктадекановой кислотой. Его окисленная форма была обнаружена в значительной меньшей концентрации, однако в процессе роста наблюдалось постепенное увеличение ее содержания одновременно с меланизацией гиф. Возрастная склеротизация мицелиальных клеток патогена человека Fonsecaea pedrosoi также сопровождалась меланизацией клеточных стенок и гидроксилированием сфингоидных оснований ГлЦер [36].
На примере мутантов Candida albicans с нарушенным синтезом сфингоидного основания показано влияние ГлЦер на морфологию и рост этого дрожжевого гриба [37, 38]. При этом биоэффекторные свойства ГлЦер в зависимости от их ЖК-состава практически не изучены. По нашим данным в мицелии S. cirsii по мере старения и снижения патогенности наблюдалась тенденция к накоплению форм ГлЦер с удлиненной цепью ЖК. Несмотря на то, что изменения весьма незначительные, они могут быть интересны для дальнейшего изучения.
В заключение следует отметить, что: 1) в процессе роста гриба S. cirsii его липидный состав существенно менялся вместе с патогенными свойствами; 2) для высокого выхода биомассы оптимальным является использование мицелия гриба в начале стационарной фазы роста при максимальном уровне накопления липидов; 3) отмечена определенная связь патогенности мицелия с относительно высоким содержанием ЭС и ФЭ; 4) с возрастом мицелия снижался индекс двойных связей жирных кислот в составе глицеролипидов, а также происходила замена молекулярных форм ФХ (34:2 на 36:4) и ФЭ (36:4 на 34:2); 5) разнообразие форм и варьирование относительных концентраций ГлЦер в мицелии S. cirsii было низким. Принимая во внимание содержание выявленных липидов в мицелии S. cirsii, маркерами его качества, по-видимому, можно считать наличие высокого уровня ЭС, ТАГ (с учетом индекса двойных связей жирных кислот, входящих в их состав), ФЭ (в частности, 36:4-форма) и ФХ (34:2-форма).
Авторы выражают признательность М.З. Мурадымову, М.А. Виноградской (Ботанический институт им. В.Л. Комарова РАН) и А.В. Рубижан (Всероссийский научно-исследователький институт защиты растений) за существенную помощь в проведении исследований.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 16-16-00085) с привлечением оборудования Центра коллективного пользования “Инновационные технологии защиты растений” ВИЗР, а также ресурсных центров “Развитие молекулярных и клеточных технологий” и “Методы анализа состава вещества” Санкт-Петербургского государственного университета.
Методическая основа протокола анализа молекулярных видов гликоцерамидов и стеринов разработана в ходе выполнения темы “Оценка изменений корреляционной структуры метаболитных сетей в процессе роста и развития грибов и растений с позиции системной биологии” БИН РАН (АААА-А18-118032390136-5).
Список литературы
Rella A., Farnoud A.M., Del Poeta M. // Prog. Lipid Res. 2016. V. 61. P. 63–67.
Kobae Y., Gutjahr C., Paszkowski U., Kojima T., Fujiwara T., Hata S. // Plant Cell Physiol. 2014. V. 55. № 11. P. 1945–1953.
Aguilar L.R., Pardo J.P., Lomelí M.M., Bocardo O.I.L., Juárez Oropeza M.A., Guerra Sánchez G. // Arch. Microbiol. 2017. V. 199. P. 1195–1209.
Keyhani N.O. // Fungal Biol. 2018. V. 122. № 6. P. 420–429.
Gao Q., Shang Y., Huang W., Wang C. // Appl. Environ. Microbiol. 2013. V. 79. № 24. P. 7646–7653.
Harayama T., Riezman H. // Nat. Rev. Mol. Cell Biol. 2018. V. 19. № 5. P. 281–296.
Siebers M., Brands M., Wewer V., Duan Y., Hölzl G., Dörmann P. // Biochim. Biophys. Acta. 2016. V. 1861. № 9. Part B. P. 1379–1395.
Chen Y.-L., Montedonico A.E., Kauffman S., Dunlap J.R., Menn F.-M., Reynolds T.B. // Mol. Microbiol. 2010. V. 75. № 5. P. 1112–1132.
Gao Q., Yuzhen L., Hongyan Y., Xu Y.-J., Huang W., Wang C. // Environ. Microbiol. 2016. V. 18. № 11. P. 3976–3990.
Wang J., Wang H., Zhang C., Wu T., Ma Z., Chen Y. // Phytopathol. Res. 2019. V. 1. № 16. https://doi.org/10.1186/s42483-019-0023-9
Kazan K., Gardiner D.M. // PLoS Pathog. 2017. V. 13. № 5. https://doi.org/10.1371/journal.ppat.1006297
Warnecke D., Heinz E. // Cell. Mol. Life Sci. 2003. V. 60. № 5. P. 919–941.
Ramamoorthy V., Cahoon E.B., Thokala M., Kaur J., Li J., Shah D.M. // Eukaryotic Cell. 2009. V. 8. № 2. P. 217–229.
Weete J.D. Lipid Biochemistry of Fungi and Other Organisms. N.Y.: Plenum Press, 1980. 398 p.
Beccaccioli M., Reverberi M., Scala V. // Front. Biosci. 2019. V. 24. № 1. P. 172–185.
Фролова Г.М., Сокорнова С.В., Берестецкий А.О. // Прикл. биохимия и микробиология. 2019. Т. 55. № 5. С. 506–512.
Сокорнова С.В., Берестецкий А.О. // Сельскохозяйственная биология. 2018. Т. 53. № 5. С. 1054–1061.
Барыкина Р. П., Веселова Т. Д., Девятов А. Г., Джалилова Х. Х., Ильина Г. М., Чубатова Н. В. Справочник по ботанической микротехнике. М.: Издательство Московского университета, 2004. 312 с.
Котлова Е.Р., Сеник С.В., Кюхер Т., Шаварда А.Л., Кияшко А.А., Псурцева Н.В., Зубарев Р.А. // Микробиология. 2009. Т. 78. № 2. С. 226–235.
Fuchs B., Suss R., Teuber K., Eibisch M., Schiller J. // J. Chromatogr. A. 2011. V. 1218. № 19. P. 2754–2774.
Benning C., Huang Z.H., Gage D.A. // Arch. Biochem. Biophys. 1995. V. 317. № 1. P. 103–111.
Berestetskiy A., Sokornova S. Biological Approaches for Controlling Weeds / Ed. R. Radhakrishnan. London: IntechOpen, 2018. https://doi.org/10.5772/intechopen.76936
Павлова Н.А., Сокорнова С.В. // Вестник защиты растений. 2018. Т. 4. № 98. С. 67–69.
Skoneczny M., Skoneczna A. Stress Response Mechanisms in Fungi. / Ed. M. Skoneczny. Cham: Springer, 2018. P. 35–85.
Akpinar-Bayizit A. // Int. J. Chem. Eng. Appl. 2014. V. 5. № 5. P. 409–414.
Solomon P.S., Lee R. C., Wilson T.J., Oliver R. P. // Mol. Microbiol. 2004. V. 53. № 4. P. 1065–1073.
Thines E., Weber R.W.S., Talbot N.J. // Plant Cell. 2000. V. 12. № 9. P. 1703–1718.
Rudd J. J., Kanyuka K., Hassani-Pak K., Derbyshire M., Andongabo A., Devonshire J. et al. // Plant Physiol. 2015. V. 167. № 3. P. 1158–1185.
Lösel D.M. // Pestic. Sci. 1991. V. 32. № 3. P. 353–362.
Van Etten J., Gottlieb D. // J. Bacteriol. 1965. V. 89. № 2. P. 409–414.
Klemptner R.L., Sherwood J.S., Tugizimana F., Dubery I.A., Piater L.A. // Mol. Plant Pathol. 2014. V. 15. № 7. P. 747–761.
Govrin E. M., Levine A. // Current Biol. 2000. V. 10. № 13. P. 751–757.
Ding W., Palaiokostas M., Wang W., Orsi M. // J. Phys. Chem. 2015. V. 119. № 49. P. 15263–15274.
Janssen M.J., Koorengevel M.C., de Kruijff B., de Kroon A.I. // Yeast. 2000. V. 16. № 7. P. 641–650.
Cassilly C.D., Reynolds T.B. // J. Fungi. 2018. V. 4. № 28. https://doi.org/10.3390/jof4010028
Nimrichter L., Cerqueira M.D., Leităo E.A., Miranda K., Nakayasu E.S., Almeida S.R., Almeida I.C., Alviano C.S., Barreto-Bergter E., Rodriges M.L. // Infect. Immun. 2005. V. 73. № 12. P. 7860–7868.
Oura T., Kajiwara S. // Microbiol. 2008. V. 154. № 12. P. 3795–3803.
Oura T., Kajiwara S. // Microbiol. 2010. V. 156. № 4. P. 1234–1243.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


