Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 77-86
Использование левана Azotobacter vinelandii в качестве компонента биосорбентов соединений тяжелых металлов и радионуклидов
В. В. Шутова 1, *, В. В. Ревин 1, Е. А. Калинкина 1, А. В. Сафонов 2, А. Г. Савченко 4, Г. В. Максимов 3, 4
1 Национальный исследовательский Мордовский государственный университет им. Н. П. Огарёва
430005 Саранск, Россия
2 Институт физической химии и электрохимии имени А. Н. Фрумкина РАН
119991 Москва, Россия
3 Московский государственный университет имени М. В. Ломоносова
119892 Москва, Россия
4 Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Россия
* E-mail: vshutova@yandex.ru
Поступила в редакцию 30.03.2020
После доработки 31.08.2020
Принята к публикации 02.09.2020
Аннотация
Показано, что культивирование Azotobacter vinelandii Д-08 на средах с мелассой и бардой увеличивало активность левансахаразы и биосинтез левана. Максимальная удельная активность левансахаразы также была получена на среде с мелассой, что коррелировало с максимальным синтезом полисахарида. Бактерии синтезировали в такой среде дополнительную фракцию высокомолекулярного левана (более 1000 кДа) с измененной молекулярной структурой (снижение вклада колебаний двойных связей и меньшей гидратированностью молекулы), что сопровождалось увеличением связывания молекулой Na, Mg, S, K, Ca, Mn, Fe из среды культивирования. Криогели на основе поливинилового спирта и левана были способны эффективно сорбировать ионы меди (максимально за 1 ч), цинка (за 24 ч) и кадмия (за 10 мин), а также радиоактивные плутоний (максимально за 4 ч) и уран (максимально за 168 ч), что свидетельствует о возможности их использования в качестве сорбентов при очистке стоков различных предприятий от тяжелых металлов и радионуклидов.
В настоящее время актуальной задачей биотехнологии является разработка новых технологий очистки сточных вод, содержащих высокотоксичные соединения тяжелых металлов и радионуклиды [1, 2]. В основе ряда технологий важное место занимают сорбционные методы, обеспечивающие максимальное извлечение соединений тяжелых металлов и радионуклидов, а в качестве сорбентов – биоматериалы с высокой эффективностью сорбции и механической прочностью [3, 4]. Для решения проблемы очистки стоков предприятий с многокомпонентными отходами, содержащими тяжелые металлы и радионуклиды (атомные станции и предприятия по добыче и обогащению урановой руды), предлагается использовать микробные экзополисахариды. Очевидно, что биоматериал, используемый для сорбции ионов тяжелых металлов и радионуклидов, должен обладать не только хелатирующими свойствами, но и стабильной гидрофильной трехмерной структурой, обеспечивающей возможность фильтрации воды в течение длительного периода времени. Существенным моментом при создании новых технологий очистки сточных вод может быть использование полисахаридов с подходящей молекулярной структурой [5], затраты на получение которых при культивировании бактерий на средах с вторичными продуктами пищевых производств могут быть минимальными.
Такому критерию могут соответствовать биоматериалы на основе полисахаридов, а также композитные гидрогели [6–8]. Технология производства данных биосорбентов (гидрогель) включает формирование комплекса биополимеров (хитозана, альгината, крахмала и др.) с синтетическими полимерами – полиакриламидом [9], поливиниловым спиртом [10, 11], поливинипирролидоном [12]. Например, гидрогели на основе хитозана обладают высокой сорбционной способностью для свинца [13] и меди [14], а гидрогель, состоящий из хитозана, желатина и полиакриламида (матрица) – высокой прочностью и сорбционной емкостью для меди и свинца [15].
Таким образом, удаление ионов тяжелых металлов из сточных вод возможно с помощью разработки адсорбента, в состав которого входит полисахарид (например альгинат или леван). Для получения такого сорбента может использоваться полисахарид Azotobacter vinelandii – грамотрицательной почвенной бактерии семейства Pseudomonadaceae [16, 17]. Известно, что внеклеточное накопление самого значимого полисахарида бактерии (альгината) выполняет барьерную функцию для проникновения к бактерии кислорода или тяжелых металлов, что особенно важно при разработке биосорбентов [16]. Другим полисахаридом бактерии, который может быть использован для создания биоадсорбента, является леван [17, 18]. Леван представляет собой разветвленный гомополисахарид, полифруктан из остатков D-фруктофуранозы с высокой молекулярной массой (103–108 Да) [20, 21]. Молекула левана состоит из остатков фруктофуранозы, соединенных β-(2, 6)-связями в цепях и α-(2, 1)-связями в местах ветвления, и имеет D-глюкозильный остаток на конце. При культивировании бактерий на средах с сахарозой синтезируется также внеклеточная левансахараза, расщепляющая сахарозу на глюкозу и фруктозу, при этом фруктоза используется для биосинтеза полисахарида, а глюкоза – в метаболизме бактерии [22].
Для бактериального синтеза полисахаридов важен состав культуральной среды (углерод, азот, микро- и макроэлементы и т.д.) [23]. Для повышения рентабельности производства биоадсорбентов были предложены субстраты − вторичные продукты пищевой промышленности, меласса (вторичный продукт сахарного производства), послеспиртовая зерновая барда (вторичный продукт производства спирта). Известно, что меласса содержит (%): сухие вещества – 82, сахароза – 48.4, не сахара – 33.6, а барда – 33–45% сухих веществ затора [24, 25].
Цель работы − исследование свойств левана, получаемого при культивировании A. vinelandii Д-08 на средах с мелассой и бардой, для его использования в качестве компонента гидрогеля, способного к сорбции высокотоксичных соединений тяжелых металлов и радионуклидов.
МЕТОДИКА
Объект исследования, условия культивирования. Объектом исследования служили бактерии Azotobacter vinelandii (Lipman) Д-08, депонированные в ВКПМ как Azotobacter chroococcum B-5787. Для поддержания культуры A. vinelandii использовали агаризованную среду (г/л): КН2РО4 – 0.2; К2НРО4 – 0.8; MgSO4 – 0.2; CaSO4 – 0.1; FeCI3 – следы; Na2MoO4 – следы; дрожжевой экстракт – 0.5; сахароза – 20.0; агар-агар – 15–20, рН 7.0–7.2. Бактерии выращивали при 28°С в течение 72 ч. Для выращивания инокулята бактерий A. vinelandii использовали жидкую питательную среду аналогичного состава. С поверхности агаризованной среды клетки смывали 10 мл питательной среды и засевали колбы на 250 мл со 100 мл среды с сахарозой. Инокулят выращивали в шейкерах Environmental shaker – Inkubator ES – 20/60 (Латвия) при 28°С и 250 об./мин 24 ч.
Для приготовления питательных сред использовали свеклосахарную мелассу с 48% сахарозы (Ромодановский сахарный завод, Россия). Для культивирования A. vinelandii с мелассой использовали контрольную среду с 4% сахарозы и среды с 5% мелассы (по сахарозе), в которые добавляли барду в количестве 2–15%.. Бактерии выращивали при тех же условиях, что и инокулят при рН 7.0–7.2.
После окончания выращивания клетки осаждали центрифугированием при 8000 g 30 мин, количество биомассы определяли взвешиванием после высушивания образца при 100°С.
Получение криогеля. Для получения криогеля 1 г сухого полисахарида и 4 г поливинилового спирта (ПВС) растворяли в 50 мл воды, выдерживали при –20°С 12 ч, оттаивали, выдерживая при 8°С. Для получения однородных гранул криогель измельчали методом экструзии через отверстия определенного диаметра (d = 2 мм). В качестве контроля использовали криогель, полученный без добавления левана [26].
Активность левансахаразы. Активность левансахаразы регистрировали по накоплению глюкозы, которую определяли с помощью глюкозооксидазно-пероксидазного метода. Реакционная смесь включала: 3 мл 50 мМ фосфатного буфера (рН 6.5) с сахарозой (100 г/л) и 1 мМ СаCl2. К смеси добавляли 0.5 мл супернатанта и инкубировали при 30°С в течение 7 мин. За единицу активности принимали количество фермента, образующее 1 мкмоль глюкозы в минуту [27]. Белок определяли методом Бредфорда.
Определение содержания левана. Осаждение полисахарида проводили из супернатанта культуральной жидкости (КЖ) 96%-ным этанолом (в соотношении 1 : 2) и высушивали при 102 ± 1.5°С. Содержание полисахарида определяли весовым методом по разнице между весом осадков, образовавшихся при добавлении этанола к культуральной жидкости и к среде после стерилизации.
Жидкостная хроматография полисахаридов. Разделение водорастворимых соединений из КЖ (20 мкл) проводили на жидкостном хроматографе Shimadzu LC-20 A Prominence (Япония) с колонкой Ultrahydrogel 6 × 40 mm Guard Column WATO11565 (Япония). В качестве подвижной фазы использовали деионизированую воду, скорость подачи растворителей не превышала 0.4 мл/мин при 25°С, длина волны оптического детектора – 190 нм. В качестве стандартов использовали декстран с молекулярной массой 12, 25, 80 и 670 кДа.
Инфракрасная спектроскопия. ИК-спектры образцов регистрировали с помощью ИК-Фурье-спектрометра IRPrestige-21 (“Shimadzu”, Япония) в диапазоне от 4000 до 400 см–1. Сухой полисахарид измельчали вместе с КВr (∼1 мг вещества + 250–300 мг КВr) и с помощью пресс-формы, получали таблетку для регистрации ИК-спектров.
Рентгенофлуоресцентный анализ (РФА). РФА полисахарида проводили для контроля элементного состава образца с помощью анализатора SciAps X_XRF (РФА) SciAps (США), оснащенного рентгеновской трубкой (напряжение 40 или 50 кэВ, ток до 200 мкА, Rh или Au-анод) и высокоскоростным кремниевым дрейфовым детектором площадью 20 мм2SDD, с разрешением 135 эВ на 5.95 Мп К-альфа линии, 250 тыс. импульсов в с. В основе принципа действия анализатора лежит метод энергетической дисперсии, который заключается в анализе смешанных спектров, полученных после возбуждения характеристического рентгеновского излучения, что позволяет оценить вклад (масса, %) различных элементов. Метод позволяет контролировать содержание анализируемых элементов: 100% ~ 0.001%, с относительной погрешностью 0.5–20% (от веса) и стабильностью ≤0.3%, время анализа 1 мин. Высушенные образцы полисахарида фиксировали в ячейке прибора в специальной подложке и проводили анализ.
Содержание ионов меди и кобальта. Содержание ионов определяли с помощью метода спектрофотометрического анализа в водном растворе [28], используя цветную реакцию с 4-(2-пиридилазо)резорцином (ПАР) при длине волны 530 нм. Адсорбент и раствор соли металла (1 : 20) инкубировали в течение: 5, 10, 30 мин, 1, 2, 3 ч, 1 и 4 сут, затем удаляли адсорбент и к раствору соли металла (0.375 мл для соли кобальта, 0.875 мл для соли меди) добавляли 2 мл ПАР, доводя объем до 20 мл водой. Оптическую плотность растворов регистрировали в 1 см кювете относительно воды.
Сорбцию радиоактивных образцов на адсорбенте. Сорбцию на сорбенте оценивали с помощью радионуклидов 233U, 239Pu. Эксперименты проводили при соотношении сорбент : раствор 1 : 50. Перед экспериментом в раствор вносили индикаторные количества - радионуклиды (моль/л): 233U – 4.5 × 10–10, 239Pu – 8.7 × 10–8, чтобы исходная концентрация активного нуклида в растворе составляла до 200 Бк/мл.
Радиоактивность. Радиоактивность регистрировали методом жидкостно-сцинтилляционного счета с помощью низкофонового альфа-бета-спектрометра Tri-Carb 3180TR/SL (“Perkin Elmer”, США) с использованием сцинтиллятора Perkin Elmer OptiphaseHisafe3 (соотношение сцинтиллятор : аликвота – 10 : 1). Степень сорбции (S, %) рассчитывали как долю радионуклида, перешедшего из воды на/в сорбент по формуле: $S = \frac{{{{C}_{0}} - C}}{{{{C}_{0}}}} \times 100\% $, где C0 и C – соответственно начальная и конечная концентрация радионуклида в растворе, Бк/мл.
Статистическая обработка результатов. Статистическую обработку результатов проводили методом вариационной статистики с использованием программы Microsoft Excell 2015.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе исследовали условия синтеза и молекулярные характеристики левана, выделяемого при культивировании A. vinelandii на средах с мелассой и бардой. Установлено, что среда культивирования (СК) с добавлением 5% мелассы (по сахарозе) и среды с 5% мелассы и добавлением 2–15% барды (комплексная среда) обеспечивали оптимальные условия для эффективного синтеза левансахаразы и левана.
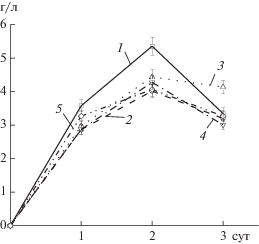
Содержание биомассы при культивировании в присутствии мелассы достигало максимума на 2 сут, добавление барды к среде не оказывало существенного влияния на рост биомассы и только на 3 сут превышало контроль в СК с 5% барды (рис. 1). Максимальное содержание внеклеточного белка в КЖ было выявлено на 4 сут роста в среде с 10% барды (0.197 мг/мл).
Рис. 1.
Динамика роста A. vinelandii на средах с мелассой и различным содержанием барды: 1 – среда с мелассой; 2 – добавление барды, 2%; 3 – добавление барды, 5%; 4 – добавление барды, 10%; 5 – добавление барды, 15%.
При культивировании A. vinelandii левансахаразная активность была максимальной на 2 сут: на среде с мелассой (6.12 ед./мл) и на той же среде с добавлением барды 5 и 10% − 5.4 и 5.25 ед./мл соответственно. Максимальная активность левансахаразы соответствовала и максимальному выходу левана (рис. 2а). Для биотехнологического производства важно контролировать изменение удельной активности левансахаразы, поскольку оно может отражать также и содержание левана в КЖ (табл. 1). Максимальное количество полисахарида накапливалось в 1 сут, максимальная удельная активность левансахаразы зафиксирована на среде с мелассой, что коррелирует с максимальным выходом экзополисахарида (ЭПС).
Рис. 2.
Изменение активности левансахаразы (а, ед. /мл) и накопления левана (б, г /л) при культивировании A. vinelandii на средах с мелассой и бардой. 1 – среда с мелассой; 2 – добавление барды 5%; 3 – добавление барды 10%; 4 – среда с сахарозой.
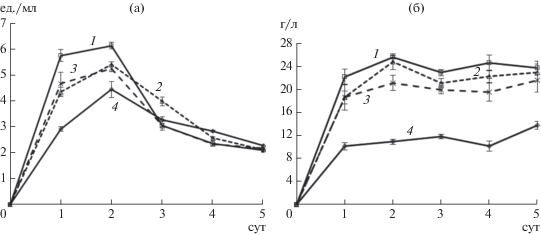
Таблица 1.
Динамика изменения удельной активности левансахаразы при культивировании A. vinelandii на средах с мелассой и бардой
| Варианты сред | Удельная активность левансахаразы, ед./мг белка | ||||
|---|---|---|---|---|---|
| 24 ч | 48 ч | 72 ч | 96 ч | 120 ч | |
| С сахарозой | 78.9 ± 4.0 | 68.3 ± 3.1 | 33.3 ± 2.1 | 28.3 ± 2.0 | 20.1 ± 1.2 |
| С мелассой | 249.6 ± 5.9 | 83.8 ± 2.1 | 27.6 ± 1.6 | 16.5 ± 1.0 | 19.0 ± 1.1 |
| С мелассой + 5% барды | 72.5 ± 3.0 | 61.4 ± 2.9 | 30.5 ± 1.7 | 20.0 ± 1.4 | 11.9 ± 0.7 |
| С мелассой +10% барды | 57.5 ± 1.4 | 58.3 ± 2.4 | 18.8 ± 1.4 | 11.8 ± 0.8 | 11.5 ± 1.4 |
При культивировании бактерий на среде с мелассой уже на 1 сут содержание левана составляло 22.2 г/л, на вторые сутки достигло максимума 25.6 г/л (рис. 2б), добавление в СК барды (комплексная среда) не способствовало увеличению синтеза левана: на 2 сут выход составил 24.8 г/л при добавлении 5% барды и при 10% барды – 21.1 г/л.
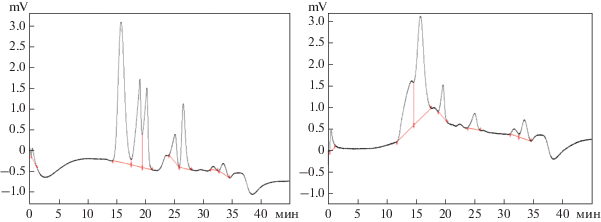
Для понимания механизма сорбции катионов леваном был исследован состав и структура полисахарида. Известно, что молекулярная масса левана зависит от штамма бактерии и может меняться от 5 до 3500 кДа [27]. Молекулярную массу синтезированных полисахаридов исследовали методом ВЭЖХ. При культивировании бактерии на среде с сахарозой было обнаружено три фракции левана с молекулярной массой 600–700, 190–210 кДа и с массой менее 25 кДа (рис. 3а). При культивировании бактерии на среде с мелассой была обнаружена дополнительная фракция левана с молекулярной массой более 1000 кДа (рис. 3б).
Рис. 3.
Распределение по молекулярной массе левана, полученного при культивировании A. vinelandii на среде с сахарозой (а) и мелассой (б). (Красная линия – базовая).
Для изучения возможности сорбции ионов важно знать особенности молекулярной структуры левана, синтезированного на среде с мелассой. С помощью ИК спектроскопии установлено, что в ИК-спектре левана наблюдались полосы, характерные для валентных колебаний гидроксильных групп (область 3700–3100 см–1), валентных колебаний С–Н-связей метиленовых групп (3000–2800 см–1) и их асимметричных валентных колебаний (около 2945 см–1).
В ИК-спектрах область 1500–900 см–1 характеризует различные колебания: С–Н-, С–О- и О‒Н-гликозидной связи и глюкофуранозного кольца левана: полосы 1450 и 1430 см–1 обусловлены деформационными плоскостными колебаниями ОН-группы, а также принадлежат колебаниям метиленовой группы (около 1429 см–1); 900 см–1 − асимметричным колебаниям кольца в противофазе и колебаниям атома С1 и 4 окружающим его атомам в β-гликозидных структурах. Полоса около 800 см–1 обусловлена СН и СН2‑маятниковыми колебаниями фруктофуранозного кольца молекулы (рис. 4) [20]. Сопоставление ИК-спектра левана данного штамма и данных ИК-спектроскопии леванов Zymomonas mobilis, Bacillus subtilis, видов Halomonas [20, 29, 30] позволяет сделать вывод о том, что образец, полученный на средах с мелассой, идентичен левану других продуцентов.
Рис. 4.
ИК-спектры левана, синтезированного на среде с сахарозой (а), мелассой (б) и с мелассой + 10% барды (в).
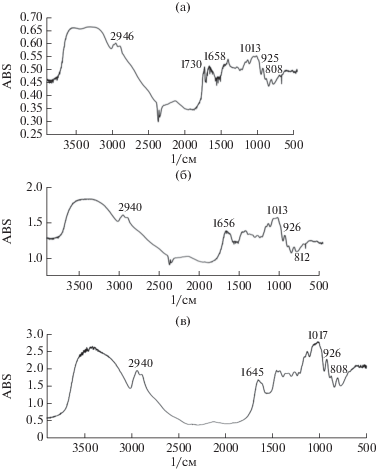
В молекуле левана, синтезированного A. vinelandii среде с мелассой, были выявлены изменения как гидратированности молекулы полимера, так и колебаний двойных связей молекулы (область 1800–1500 см–1, рис. 4). Известно, что полоса с максимумом около 1640 см–1 обусловлена деформационными колебаниями ОН-групп воды и при увеличении гидратированности левана полоса смещается в область больших волновых чисел (рис. 4а). Таким образом, молекула левана, синтезированного бактериями на СК с мелассой и бардой, менее гидратирована по сравнению с леваном, синтезированном на среде с сахарозой.
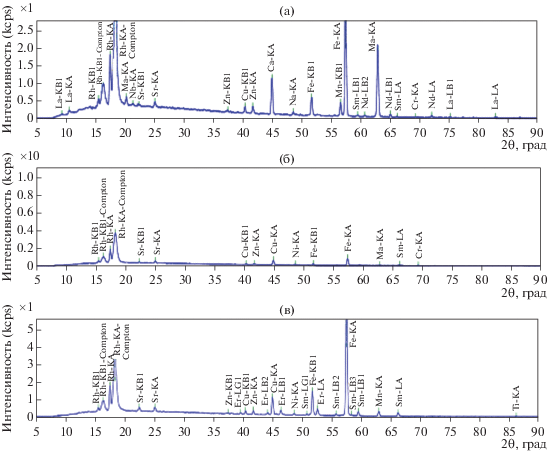
В следующей серии экспериментов, с помощью РФА исследовали изменения элементного состава левана, полученного при культивировании A. vinelandii на разных средах (табл. 2). Установлено, что содержание углерода и кислорода в образцах, полученных при культивировании на СК с мелассой и с мелассой и бардой не менялось (30.2–34.1% и 60.2–63.5% соответственно). В то же время при культивировании бактерии на СК с мелассой в молекуле леване снижалось содержание Na, Al, S, Si, P, Mn, Fe, по сравнению с леваном, полученным на среде с сахарозой, но при этом увеличивается содержание Mg, Cl, K, Ca. При культивировании бактерий на комплексной среде (меласса + 5% барды) уменьшалось содержание Na, Al, Si, P, Ca, Mn, Fe, но увеличивается содержание Mg, S, Cl, K, по сравнению с леваном, синтезированном на среде с сахарозой. При культивировании бактерий на комплексной среде (меласса + 10% барды) уменьшалось содержание Al, Si, P, Cl, но увеличивалось Na, Mg, S, K, Ca, Mn, Fe (по сравнению с леваном на среде с сахарозой. Полученные данные свидетельствуют о различном элементном составе левана, полученного при культивировании бактерий на различных сложных средах. Культивирование бактерий на комбинированной среде (особенно меласса + + 10% барды) способствовало синтезу левана с большим молекулярным весом (более 1000 кДа) и измененной молекулярной структурой: снижение вклада колебаний двойных связей и меньшая гидратированность молекулы. Вероятно, причиной этого могло быть увеличение связывания молекулой левана ионов Na, Mg, S, K, Ca, Mn, Fe из среды.
Таблица 2.
Элементный состав левана (масс %), синтезированного при культивировании A. vinelandii Д-08 на средах с мелассой и бардой
| Компоненты | Контроль | Меласса | Меласса + 5% барды | Меласса+ 10% барды |
|---|---|---|---|---|
| C | 30.7 +/–0.1 | 32.7 +/–0.1 | 34.1 +/–0.4 | 30.2 +/–0.1 |
| O | 63.5 +/–0.1 | 60.2 +/–0.1 | 60.8 +/–0.1 | 61.4 +/–0.1 |
| Na | 0.0969 +/–0.1 | 0.0174 +/–0.1 | 0.0224 +/–0.1 | 0.186 +/–0.1 |
| Mg | 0.124 +/–0.1 | 0.126 +/–0.1 | 0.20 +/–0.1 | 0.273 +/–0.1 |
| Al | 0.0457 +/–0.1 | 0.0300 +/–0.1 | 0.0300 +/–0.1 | 0.0312 +/–0.1 |
| Si | 0.216 +/–0.1 | 0.106 +/–0.1 | 0.176 +/–0.1 | 0.137 +/–0.1 |
| P | 0.526 +/–0.1 | 0.109 +/–0.1 | 0.243 +/–0.1 | 0.530 +/–0.1 |
| S | 0.102 +/–0.1 | 0.0922 +/–0.1 | 0.27 +/–0.1 | 0.182+/–0.1 |
| Cl | 0.0691 +/–0.1 | 0.0849 +/–0.1 | 1.26 +/–0.1 | 0.0538 +/–0.1 |
| K | 0.376 +/–0.1 | 1.56 +/–0.1 | 2.77 +/–0.1 | 2.21 +/–0.1 |
| Ca | 3.10 +/–0.1 | 4.40 +/–0.1 | 4.233 +/–0.1 | 3.39 +/–0.1 |
| Mn | 0.438 +/–0.1 | 0.0109 +/–0.1 | 0.0030 +/–0.1 | 0.0650 +/–0.1 |
| Fe | 0.421 +/–0.1 | 0.132 +/–0.1 | 0.0101 +/–0.1 | 1.000 0.243 +/–0.1 |
Рис. 5.
РФА-спектры левана, синтезированного на среде с сахарозой (а), мелассой (б) и среде с мелассой и 10% барды (в).
В дальнейшем исследовали сорбционные свойства криогеля с бактериальным леваном, полученным при культивировании на различных средах с вторичными продуктами производства. Известно, что гидрогели во многом аналогичны полимерным материалам и в отличие от смол с жесткой структурой характеризуются гибкой структурой и могут пропускать гораздо больше воды. Наличие специфических функциональных групп (например, OH) в гидрогелях позволяет эффективно адсорбировать частицы на наружной поверхности, а также на внутренней поверхности их трехмерной сети [31]. Для исследования процесса адсорбции ионов Cu2+, Со2+, Cd2+ и Zn2+ к растворам солей добавляли измельченный криогель, приготовленный на основе ПВС (контроль) и ПВС с леваном (опыт). В ходе исследования показано, что все образцы были способны в разной степени к сорбции исследуемых ионов. Сорбция ионов меди в контроле достигала 47.3% в течение 3 ч, а при использовании ПВС с нативным леваном уже 57% в течение 2 ч (табл. 3). В экспериментах с кобальтом максимальное значение сорбции в контроле наблюдали через 30 мин – 45.4%, образец с леваном максимально связывал катион через 1 ч – 46.7%. Максимальная сорбция ионов цинка приходилась на 24 ч и составляла 48.2%, в контроле значение было ниже – 33.4% на 18 ч. Эффективная сорбция ионов кадмия наблюдалась уже через 10 мин – 79.2% (табл. 4). В контроле процесс шел медленнее, и эффективность очистки от кадмия была меньше и составляла 60.8%.
Таблица 3.
Динамика сорбции ионов Cu и ионов Co образцами криогеля с леваном
| Время | Адсорбция ионов Cu, % | Адсорбция ионов Co, % | ||
|---|---|---|---|---|
| Контроль | С леваном | Контроль | С леваном | |
| 5 мин | 39.9 ± 1.3 | 44.8 ± 2.0 | 39.3 ± 3.4 | 34.1 ± 1.5 |
| 10 мин | 41.4 ± 1.6 | 49.4 ± 0.6 | 42.2 ± 0.5 | 34.6 ± 2.0 |
| 30 мин | 43.6 ± 1.9 | 51.7 ± 3.4 | 45.4 ± 3.1 | 35.7 ± 3.1 |
| 1 ч | 44.5 ± 1.7 | 53.1 ± 3.6 | 35.6 ± 3.1 | 46.7 ± 1.4 |
| 2 ч | 46.9 ± 3.0 | 55.4 ± 3.3 | 35.8 ± 0.9 | 35.9 ± 1.5 |
| 3 ч | 47.3 ± 1.9 | 54.9 ± 0.8 | 37.2 ± 2.1 | 36.8 ± 2.9 |
| 24 ч | 45.6 ± 4.4 | 46.9 ± 1.0 | 31.7 ± 2.2 | 37.2 ± 2.4 |
| 96 ч | 43.2 ± 1.4 | 46.3 ± 1.4 | 21.1 ± 2.2 | 28.8 ± 2.9 |
Таблица 4.
Динамика сорбции ионов Zn и ионов Cd образцами криогеля с леваном
| Время,ч | Адсорбция ионов Zn, % | Адсорбция ионов Cd, % | ||
|---|---|---|---|---|
| контроль | с леваном | контроль | с леваном | |
| 5 мин | 30.9 ± 1.7 | 31.1 ± 1.5 | 59.6 ± 3.3 | 69.9 ± 2.0 |
| 10 мин | 30.3 ± 0.3 | 31.3 ± 0.6 | 60.8 ± 1.4 | 79.2 ± 2.2 |
| 30 мин | 30.4 ± 0.4 | 31.3 ± 2.2 | 54.4 ± 2.8 | 62.7 ± 3.1 |
| 1 | 31.3 ± 0.5 | 31.9 ± 2.2 | 50.6 ± 1.1 | 51.9 ± 1.8 |
| 2 | 31.4 ± 0.1 | 41.7 ± 4.9 | 56.4 ± 1.0 | 66.8 ± 2.6 |
| 3 | 31.5 ± 0.6 | 37.8 ± 5.4 | 51.4 ± 3.3 | 73.3 ± 1.7 |
| 24 | 31.4 ± 0.2 | 48.1 ± 1.2 | 51.8 ± 2.8 | 78.8 ± 1.6 |
| 96 | 30.8 ± 1.6 | 34.5 ± 7.1 | 42.8 ± 3.9 | 70.8 ± 1.8 |
Таким образом, из полученных результатов видно, что сорбция ионов меди, цинка и кадмия криогелем с леваном происходила эффективнее, чем с ПВС. Сорбция ионов меди, кобальта, цинка и кадмия достигала максимума в определенный момент времени, а после достижения равновесия процесс постепенно выходил на равновесное плато. Сорбция разных ионов криогелем с леваном имела различную динамику и амплитуду: максимальный эффект обнаружен при сорбции Cd2+ в течение 10 мин.
Установлено, что криогели с леваном способны сорбировать радиоактивный плутоний и уран: сорбция урана достигала 55% после двух нед. эксперимента и не достигла равновесия. Такую динамику сорбции, предположительно, можно объяснить большим радиусом гидратированного радионуклида и стерическими трудностями его абсорбции, а также отрицательным зарядом иона. Сорбция плутония происходила быстрее и достигала равновесия уже через 4 ч (40.9%).
Максимальная удельная активность левансахаразы наблюдалась при культивировании бактерии на среде с мелассой, что коррелировало и с максимальным синтезом левана. В этих условиях бактерии синтезировали высокомолекулярный леван (более 1000 кДа) с измененной молекулярной структурой (снижение вклада колебаний двойных связей и меньшая гидратированность молекулы). Все это, вероятно, обусловило увеличение связывания молекулой левана ионов Na, Mg, S, K, Ca, Mn, Fe из среды культивирования. На основе поливинилового спирта и левана были получены криогели, способные эффективно сорбировать ионы меди (максимально за 1 ч), цинка (за 24 ч) и кадмия (за 10 мин), а также радиоактивные плутоний (максимально за 4 ч) и уран (максимально за 168 ч). Все это свидетельствует о возможности использования криогелей ПВС с леваном в качестве компонентов сорбентов при в очистке стоков различных предприятий от тяжелых металлов и радионуклидов. Дальнейшее обращение с сорбентами подразумевает их регенерацию с предварительной десорбцией металлов 1 н раствором соляной кислоты, поскольку известно, что леван обладает устойчивостью к нагреванию, кислотным и щелочным средам, высокой водоудерживающей способностью [21, 32]. В таком режиме возможно многократное использование биосорбентов. Окончательный этап утилизации может быть осуществлен сжиганием, что приводит к 95% сокращению объемов сорбента в виде зольного остатка.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-29-05054).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Humelnicu D., Dinu M.V., Dragan E.S. // J. Hazard. Mater. 2011. V. 185. № 1. P. 447–455.
Zhang F., Wang M., Zhou L., Ma X., Zhou Y. // Desalination and Water Treatment. 2015. V. 54. №. 9. P. 2546–2556.
Wang X., Zheng Y., Wang A. // J. Hazard. Mater. 2009. V. 168. № 2–3. P. 970–977.
Karim M.R., Aijaz M.O., Alharth N.H., Alharbi H.F., Al-Mubaddel F.S., Awual M.R. // Ecotoxicol. Environ. Saf. 2019. V. 169. P. 479–486.
Su T. Wu L., Pan X., Zhang C., Shi M., Gao R., Qi X., Dong W. // J. Colloid Interface Sci. 2019. V. 542. P. 253–262.
Bajpai A.K., Shukla S.K., Bhanu S., Kankane S. // Prog. Polym. Sci. 2008. V. 33. № 11. P. 1088–1118.
Myung D., Waters D., Wiseman M., Duhamel P.E., Noolandi J., Ta C.N., Frank C.W. // Polym. Adv. Technol. 2008. V. 19. № 6. P. 647–657.
Dragan E.S. // Chem. Eng. J. 2014. V. 243. P. 572–590.
Bonina P., Petrova T.S., Manolova N. // J. Bioact. Compat. Polym. 2004. V. 19. № 2. P. 101–116.
Liang S. Liu L., Huang Q., Yam K.L. // Carbohydr. Polym. 2009. V. 77. № 4. P. 718–724.
Liu J., Wang W., Wang A. // Polym. Adv. Technol. 2011. V. 22. № 5. P. 627–634.
Marsano E., Bianchi E., Vicini S., Compagnino L., Sionkowska A., Skopińska J., Wiśniewski M. // Polymer. 2005. V. 46. № 5. P. 1595–1600.
Huang D., Wang W., Kang Y., Wang A. // J. Macromol. Sci. Part A: Pure Appl. Chem. 2012. V. 49. № 11. P. 971–979.
Dragan E.S., Dinu M.V. // Res. J. Chem. Env. 2013. V. 17. № 10. P. 4–10.
Wang W.B., Huang D.J., Kang Y.R., Wang A.Q. // Colloid Surf. B: Biointerfaces. 2013. V. 106. P. 51–59.
Pena C., Miranda L., Segura D., Nunez C., Espin G., Galindo E. // J. Ind. Microbiol. Biotechnol. 2002. V. 29. № 5. P. 209–213.
Шутова В.В., Русяева А.Б. // Известия Саратовского университета. Новая серия. Серия: Химия. Биология. Экология. 2018. Т. 18. № 4. С. 455–461.
Ревин В.В., Шутова В.В., Новокупцев Н.В. // Фундаментальные исследования. 2016. № 1-1. С. 53–57.
Revin V.V., Shutova V.V., Novokuptsev N.V. // J. Biotechnol. 2016. V. 231 (Supplement). P. S8.
Abdel-Fattah A.F., Mahmoud D.A.R., Esawy M.A.T. // Current Microbiology. 2005. V. 51. №. 6. P. 402–407.
Kang S.A., Jang K.H., Seo J.W., Kim K.H., Kim Y.H., Rairakhwada D., Seo M.Y., Lee J.O., Ha S.D., Kim C.-H., Rhee S.K. Levan: Applications and Perspectives. Microbial Production of Biopolymers and Polymer Precursors: Applications and Perspectives / Ed. B.H.A. Rehm. Norfolk, UK: Caister Academic Press, 2009. P. 145–161.
Vijn I., Smeekens S. // Plant physiology. 1999. V. 120. № 2. P. 351–360.
Revin V.V. Kostina E.G., Revina N.V., Shutova V.V. // Braz. Arch. Biol. Techn. 2018. V. 61. P. e18160406.
Бугаенко И.Ф., Штерман С.В. Меласса (свекловичная, тростниковая, сырцовая), состав и методы анализа. М.: МГУ, 2006. 72 с.
Distillers Grains: Production, Properties, and Utilization / Eds. K.S. Liu., K.A. Rosentrater. Taylor & Francis Group, LLC, Boca Raton, CRC Press, 2012. 564 p.
Stepanov N.A., Efremenko E.N. // Catalysts. 2018. V. 8. P. 33–49.
Ortiz-Soto M.E., Rivera M., Rudiño-Piñera E., Olvera C., López-Munguía A. // Protein Eng. Des. Sel. 2008. V. 21. № 10. P. 589–595.
Коломиец Л.Л., Пилипенко Л.А., Жмудь И.М., Панфилова И.П. // Журн. аналит. химии. 1999. Т. 54. № 1. С. 34–36.
Kucukasik F., Kazak H., Guney D., Finore I., Poli A., Yenigun O., Nicolaus B., Oner E.T. // Appl. Microbiol. Biotechnol. 2011. V. 89. № 6. P. 1729–1740.
Sarilmiser H.K., Ates O., Ozdemir G., Arga K.Y., Oner E.T. // J. Bioscie. Bioeng. 2015. V. 119. № 4. P. 455–463.
Khan M., Lo I.M.C. // Water Res. 2016. V. 106. P. 259–271.
Öner E.T., Hernández L. Combie J. // Biotechnology Advances. 2016. V. 34. № 5. P. 827–844.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


