Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 87-94
Перспективный штамм бактерий Pseudomonas protegens для стимуляции роста сельскохозяйственных злаков, устойчивый к гербицидам
С. П. Четвериков 1, *, Д. В. Четверикова 1, М. Д. Бакаева 1, А. А. Кенджиева 1, С. Н. Стариков 1, З. Р. Султангазин 2
1 Уфимский институт биологии – обособленное структурное подразделение Уфимского федерального исследовательского центра РАН
450054 Уфа, Россия
2 Башкирский научно-исследовательский институт сельского хозяйства – обособленное структурное подразделение Уфимского федерального исследовательского центра РАН
450059 Уфа, Россия
* E-mail: chelab007@yandex.ru
Поступила в редакцию 20.04.2020
После доработки 08.07.2020
Принята к публикации 02.09.2020
Аннотация
Из антропогенно нарушенной почвы выделен, изучен и идентифицирован штамм бактерий Pseudomonas protegens ДА1.2. Показано, что изолят может использоваться в растениеводстве, так как синтезировал индолилуксусную кислоту, способствовал мобилизации фосфора из нерастворимых соединений, фиксировал атмосферный азот и проявлял антагонизм к микроскопическим грибам родов Alternaria, Bipolaris, Botrytis, Fusarium и Rhizoctonia. Штамм сохранял жизнеспособность в растворах ряда гербицидов, широко используемых для обработки посевов культурных злаков (Октапон экстра, Флоракс, Чисталан, Наномет, Спецназ и Дикамба), поэтому мог применяться в баковых смесях с этими гербицидами. В условиях светоплощадки одновременное опрыскивание растений пшеницы гербицидом и жидкой культурой P. protegens ДА1.2 способствовало поддержанию роста корней и побегов, нормализации содержания хлорофилла и пролина в листьях. Опыт, заложенный в 2019 г. на поле Баймакского НП БНИИСХ УФИЦ РАН, показал прибавку урожая на 19–24% после применения бактериальной культуры на фоне гербицидов Наномет и Чисталан. Полученные результаты позволяют рассматривать культуру бактерий P. protegens ДА1.2 как потенциальный стимулятор роста и агент для уменьшения гербицидного стресса у пшеницы.
Биологические препараты для борьбы с фитопатогенами и повышения урожайности ряда сельскохозяйственных культур пользуются стабильным спросом в растениеводстве. При этом биологические методы приходится интегрировать в сложившуюся культуру земледелия и сочетать с использованием минеральных удобрений и пестицидов. Большой интерес представляет одновременная обработка полей ростстимулирующими бактериями и гербицидами, поскольку существуют свидетельства того, что некоторые ризосферные бактерии могут повышать устойчивость растений к окислительному стрессу [1, 2].
Вопрос совместного использования гербицидов и биологических препаратов стал освещаться в научной литературе относительно недавно. В немногочисленных работах рассматривается, как правило, сочетание одного или двух гербицидов и ростстимулирующих бактерий. Например, мало чувствительные к глифосату штаммы Azotobacter и Bacillus [3], толерантный к норфлуразону штамм Pseudomonas putida [4], клодинафоп устойчивый штамм Mesorhizobium [5], пендиметалин толерантный Azotobacter salinestris [6] и т.д. При этом редко описывается одновременное тестирование микроорганизмов и гербицидов разных групп и не рассматриваются двухкомпонентные препараты.
В предыдущей работе [7] было показано, что среди рекомендованных для использования в растениеводстве бактериальных штаммов устойчивость к высоким дозам гербицидов не является широко распространенным свойством. В связи с этим базой для скрининга толерантных к гербицидам ростстимулирующих бактерий послужили изолированные из различных сред культуры бактерий – деструкторов гербицида 2,4-дихлорфеноксиуксусной кислоты (2,4-Д). По данным литературы [8] способность к деградации 2,4-Д может также быть одним из факторов, обеспечивающих благоприятное влияние PGPR-бактерий на растения.
После предварительного тестирования в качестве объекта исследований был выбран новый штамм бактерий ДА1.2, выделенный из антропогенно нарушенной почвы возле эксплуатируемой нефтяной скважины в Уфимском районе Республики Башкортостан (Россия). Эти бактерии, способные расти на селективной среде, содержащей 2,4-Д, благоприятно влияют на проростки пшеницы в лабораторных условиях.
Цель работы – исследование свойств штамма ДА1.2, обеспечивающих его ростстимулирующую активность, и возможность его практического применения для обработки растений пшеницы в баковых смесях с гербицидами.
МЕТОДИКА
Культурально-морфологические и физиолого-биохимические признаки штамма ДА1.2, важные для его идентификации, определяли по стандартным методикам [9]. Микробиологические посевы проводили с использованием общепринятых методик. Морфологию клеток исследовали с использованием сканирующего зондового микроскопа Solver Pro-M (“NT-MTD”, Россия). Тотальную ДНК выделяли по методике, описанной в работе [10]. Амплификацию фрагмента гена 16S рРНК проводили с использованием бактериальных праймеров 27F (5' AGAGTTTGATC(A/C)TGGCTCAG 3') и 1492R (5' АСGG(C/T)TACCTTGTTACGACTT 3') на амплификаторе “My Cycler” (“Bio-Rad Laboratories”, США). Очистку ПЦР-продуктов и последующую секвенирующую ПЦР осуществляли с применением набора реактивов Big Dye Terminator Cycle Sequencing Kit (“Applied Biosystems”, США) согласно инструкциям производителя. Филогенетический анализ полученных нуклеотидных последовательностей 16S рРНК проводили с использованием программ MEGA 7.0 (http://www.megasoftware.net) и Sequence Scanner v1.0. Поиск гомологичных последовательностей осуществляли при использовании баз данных EzBioCloud (http://www.ezbiocloud.net/eztaxon) и GenBank (http:/www.ncbi.nlm.nih.gov).
Устойчивость к гербицидам оценивали по способности штамма расти на минеральной среде Раймонда [11] с добавлением пептона (1 г/л) и препаратов на основе синтетических ауксинов: 10 мл/л Октапона экстра, 2.5 мл/л Флоракса, 5 мл/л Чисталана и 0.6 г/л Дикамба, и сульфонилмочевины (0.05 г/л Наномета и 0.13 г/л Спецназа). Концентрация гербицидов в среде соответствовала их максимальному допустимому содержанию в используемых для опрыскивания растений рабочих растворах.
Для изучения способности к продукции фитогормонов бактерии культивировали в мясопептонном бульоне в колбах Эрленмейера на термостатируемом шейкере (160 об./мин) в течение 72 ч при 28°С. Перед экстракцией диэтиловым эфиром жидкую культуру бактерий центрифугировали при 10 000 g в течение 10 мин. Продукцию фитогормонов измеряли методом иммуноферментного анализа (ИФА) [12].
Способность к мобилизации соединений фосфора оценивали по образованию прозрачных зон вокруг колоний на среде Пиковской [13], активность нитрогеназы бактерий оценивали по способности восстанавливать ацетилен, как описано в работе [14].
Антагонизм к фитопатогенам определяли методом совместного выращивания бактерий и грибов в чашках Петри на среде Чапека [15]. В качестве тест-объектов использовали микроорганизмы: Fusarium culmorum (W.G. Smith) Sacc. BKM F‑844, F. gibbosum Appel et Wollenw BKM F-848, F. graminearum Schwabe BKM F-1668, F. solani (Mart) Sacc. BKM F-142, F.oxysporum Schltdl BKM F-137, F. nivale (Fr.) Ces. Ex Sacc. BKM F-3106, Alterna-ria alternate (Fr.) Keissl. ВКМ F-3047, A. solani Sorauer ВКМ F-3048, Bipolaris sorokiniana (Sacc.) Shoemaker ИБ Г-12, Botrytis cirnea Persoon ВКМ F-1573 и Rhizoctonia solani J.G. Kuehn ВКМ F-895. Зоны подавления и угнетения роста мицелия измеряли без учета диаметра лунки.
Для постановки лабораторных экспериментов в сосуды объемом 0.5 л, заполненные смесью песка и черноземного грунта (с. Булгаково, Республика Башкортостан) в соотношении 1 : 9, высаживали по пять проростков пшеницы мягкой сорта Кинельская юбилейная. Растения выращивали на светоплощадке при плотности потока фотонов ФАР 190 мкмоль · м–2 · с–1, 14-часовом фотопериоде и 22–26°С. Влажность почвы поддерживали на уровне 60–80% от полной влагоемкости. На 7 сут после появления всходов их опрыскивали гербицидом, культурой бактерий или их смесью из расчета на один сосуд 0.455 мкл Октапона экстра, 0.455 мкл Чисталана, 6.5 мкг Наномета и 5 × 107 КОЕ штамма ДА1.2.
Полевой эксперимент был заложен в 2019 году на полях Баймакского научно-исследовательского института сельского хозяйства УФИЦ РАН (Республика Башкортостан, Россия). Обработку полей с яровой пшеницей сорта Кинельская юбилейная в фазе кущения проводили однократно в последних числах мая гербицидами Наномет (10 г/га), Чисталан (0.7 л/га), суспензией бактерий штамма ДА1.2 (2 л/га с титром 109 КОЕ/мл) или баковой смесью бактерий и гербицидов. Площадь каждой делянки 20 м2, повторность вариантов трехкратная.
Содержание свободного пролина в растениях пшеницы определяли по методу [16].
Для определения содержания хлорофилла в побегах навески массой 100 мг измельчали и экстрагировали 96%-ным спиртом в течение 24 ч без доступа света. В экстрактах измеряли оптическую плотность при 665 и 649 нм. Содержание хлорофиллов a и b рассчитывали по формулам:
где Ca и Cb – концентрация хлорофиллов a и b (мг/л), D665, D649 – значения экстинкции при соответствующей длине волны с последующим пересчетом на сырую массу образца [17]. Измерения проводили в 3 биологических и в 3 аналитических повторностях.Данные были выражены в виде средних значений, рассчитанных с использованием MS Excel. Достоверность различий между средними показателями анализировалась с помощью t-критерия.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Клетки исследуемого штамма ДА1.2 – грамотрицательные подвижные палочки, размером 0.4–0.7 и 1.0–1.6 мкм (рис. 1). При выращивании на мясопептонном агаре образовывали колонии кремового цвета диаметром 2–6 мм, которые последовательно темнели до оранжевого и коричневого цвета с выделением пигмента в среду. Оптимальная температура роста составляла 28–32°С. Метаболизм – дыхательный. Штамм ДА1.2 был каталозоположителен, гидролизовал казеин, желатин, лецитин, целлюлозу и мочевину, не обладал амилазной активностью, синтезировал липолитические ферменты, образовывал аммиак из аргинина и использовал цитрат в качестве единственного источника углерода и энергии. Реакция Фогес–Проскауэра была отрицательная. При содержании 0–5% NaCl в среде наблюдался умеренный рост культуры, при 5–10% NaCl – слабый. При культивировании на среде Кинг Б образовывался желтый флуоресцирующий пигмент.
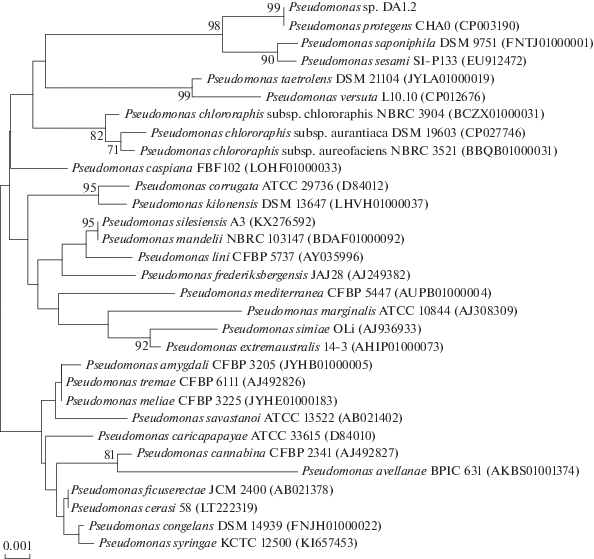
Для идентификации штамма ДА1.2 была определена нуклеотидная последовательность (1410 п.н.) гена 16S рРНК, которая депонирована в базе данных GenBank под номером MT267792. Ее сравнение с другими известными последовательностями позволило с высокой долей вероятности отнести изучаемый микроорганизм к виду P. protegens Ramette (обнаружено 100% сходства с типовым штаммом вида P. protegens CHA0(T)). Для обнаружения связей с другими видами рода Pseudomonas на основе данных о нуклеотидной последовательности гена 16S рРНК было построено филогенетическое древо (рис. 2). На рис. 2 видно, что изучаемый штамм входит в один кластер со штаммом P. protegens CHA0(T).
Рис 2.
Филогенетическое положение штамма Pseudomonas sp. ДА1.2 согласно анализу нуклеотидной последовательности гена 16S рРНК (эволюционное расстояние, соответствующее 1 замене нуклеотида на каждые 1000 показано масштабом, цифры − статистическая достоверность порядка ветвления, определенная с помощью “bootstrap”-анализа, показаны величины показателя выше 70%).
Известно, что микроорганизмы могут продуцировать вещества, являющиеся регуляторами роста растений [18]. В культуральной жидкости P. protegens ДА1.2 была обнаружена индолилуксусная кислота (ИУК) в количестве 870 ± 44 нг/мл, что свидетельствовало о способности штамма ДА1.2 синтезировать ауксин в стационарной фазе роста культуры на средах, содержащих пептон.
Исследуемый штамм являлся диазотрофом: скорость его роста на безазотной среде Эшби лишь незначительно уступала скорости роста на мясопептонном бульоне, а активность нитрогеназы составила 21.3 нмоль С2H4 ч–1 · мл–1. Полученные данные согласовывались с известными данными для других азотфиксаторов и продуцентов ИУК [19, 20].
На 5 сут роста на среде Пиковской вокруг колоний штамма P. protegens ДА1.2 формировались прозрачные зоны радиусом 18 мм, что указывало на продукцию веществ, способствующих растворению трехзамещенных фосфатов.
Изучение воздействия штамма P. protegens ДА1.2 на фитопатогенные виды грибов показало, что микроорганизм способен проявлять антагонизм по крайней мере, к 11 видам микромицетов (табл. 1). Так, в зоне диффузии бактериальных метаболитов наблюдалось полное отсутствие мицелия грибов A. solani, B. sorokiniana, F. culmorum, F. gibbosum, F. graminearum, A. alternata, B. cirnea и R. solani. При этом на газонах первых 3 видов микромицетов проявлялись зоны наибольшего диаметра, а воздействие на культуры F. solani, F. oxysporum и F. nivale выражалось, в основном, в замедлении скорости роста мицелия и угнетении спороношения.
Таблица 1.
Антагонистическая активность штамма P. protegens ДА1.2 по отношению к фитопатогенным микромицетам
| Вид фитопатогенного гриба | Диаметр зоны отсутствия роста гриба, мм | Диаметр зоны угнетения роста гриба, мм |
|---|---|---|
| Alternaria alternata | 35 ± 2 | – |
| A. solani | 42 ± 2 | – |
| Bipolaris sorokiniana* | 40 ± 1 | – |
| Botrytis cirnea | 34 ± 2 | – |
| Fusarium culmorum | 40 ± 3 | – |
| F. gibbosum | 32 ± 1 | – |
| F. graminearum | 32 ± 1 | – |
| F. nivale | 2 ± 1 | 22 ± 1 |
| F. solani | 6 ± 2 | 42 ± 2 |
| F. oxysporum | 10 ± 2 | 36 ± 2 |
| Rhizoctonia solani | 37 ± 2 | 48 ± 3 |
Таким образом, исследуемые бактерии благодаря наличию ряда характерных для PGPR свойств обладали потенциалом для использования в сельском хозяйстве в качестве биоудобрений или биофунгицидов.
Штамм P. protegens ДА1.2 сохранял высокую скорость роста достоверно (p < 0.05), не отличающуюся от контроля без гербицидов, на среде, содержащей 10 мл/л Октапона экстра, 2.5 мл/л Флоракса, 5 мл/л Чисталана, 0.6 г/л Дикамба, 0.05 г/л Наномета и 0.13 г/л Спецназа. Это указывало на возможность приготовления баковых смесей с данными гербицидами без потери жизнеспособности бактерий.
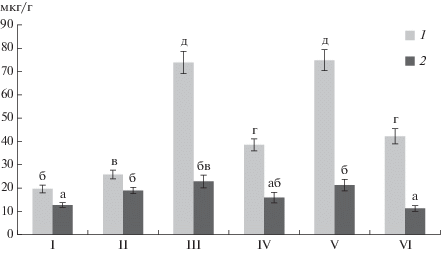
Обработка в лабораторных условиях смесью бактерий и гербицида Наномет растений пшеницы приводила к достоверному (p < 0.05) увеличению массы побегов и корней (рис. 3). Парадоксальный эффект при использовании бактерий наблюдался на фоне применения гербицида Октапон экстра. Так, в то время как гербицид стимулировал накопление массы побегов и корней, штамм ДА1.2 способствовал приближению их к контрольным показателям, тем самым нивелируя его воздействие, механизм которого заключается в нарушении нормального роста растений.
Рис. 3.
Масса побегов (1) и корней (2) пшеницы при выращивании в лабораторном эксперименте: I – без гербицидов и бактерий, II – без гербицидов с бактериями, III – Октапон экстра без бактерий, IV – Октапон экстра с бактериями, V – Наномет без бактерий, VI – Наномет с бактериями. Группы достоверно отличающихся значений (p ≤ 0.05, t-test) помечены разными буквами.

Накопление низкомолекулярных соединений, одним из которых является аминокислота пролин, представляет раннюю адаптивную реакцию растений на действие стрессоров различной природы. Повышение концентрации пролина в листьях пшеницы наблюдалось в ответ на разные абиотические стрессы [21, 22]. В работе было зафиксировано повышение содержания пролина в листьях пшеницы на 3 сут после опрыскивания гербицидами Октапон экстра и Наномет (рис. 4). Накопление пролина не было значительным в случае дополнительного введения бактерий ДА1.2. Аналогичный эффект от воздействия бактерий был отмечен при стрессе, индуцированном гербицидом паракват [23].
Рис. 4.
Содержание пролина в листьях пшеницы на 3 (1) и 11 (2) сут в условиях лабораторного эксперимента: I – без гербицидов и бактерий, II – без гербицидов с бактериями, III – Октапон экстра без бактерий, IV – Октапон экстра с бактериями, V – Наномет без бактерий, VI – Наномет с бактериями. Группы достоверно различающихся значений (p ≤ 0.05, t-test) помечены разными буквами.
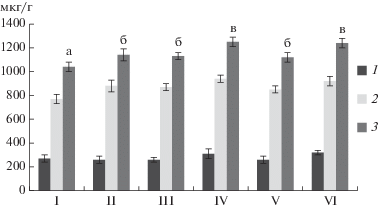
Содержание хлорофилла является другим важным показателем состояния растений в условиях стресса [24]. Высокая концентрация хлорофилла характерна для здоровых растений, поскольку связана с большей эффективностью фотосинтеза. Было показано, что обработка бактериями способствовала увеличению содержания хлорофилла в листьях пшеницы, как в случае применения гербицидов, так и в контроле, без них (рис. 5). Таким образом, взаимодействие пшеницы с ростстимулирующими бактериями носило антистрессовый характер и улучшало состояние растений по сравнению с необработанными аналогами.
Рис. 5.
Содержание хлорофилла а (1), хлорофилла b (2) и суммарного хлорофила (3) в листьях пшеницы в условиях лабораторного эксперимента: I – без гербицидов и бактерий, II – без гербицидов с бактериями, III – Октапон экстра без бактерий, IV – Октапон экстра с бактериями, V – Наномет без бактерий, VI – Наномет с бактериями. Группы достоверно различающихся значений (p ≤ 0.05, t-test) помечены разными буквами.
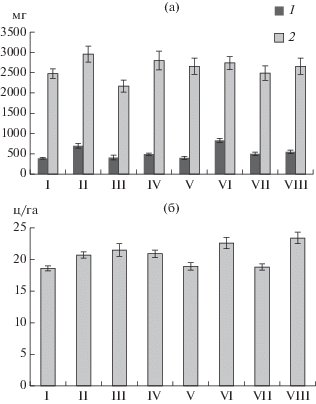
В условиях полевого эксперимента было изучено влияние однократного опрыскивания бактериями штамма ДА1.2 и гербицидами Октапон экстра, Наномет и Чисталан на накопление надземной массы и урожайность яровой пшеницы сорта Кинельская юбилейная (рис. 6). Отмечена общая тенденция к увеличению массы побегов и количества собранного зерна на делянках, обработанных культурой бактерий. При этом использование штамма ДА1.2 и гербицидов Наномет и Чисталан оказывало синергетический эффект на урожайность, по-видимому, вследствие одновременного уменьшения засоренности и снижения уровня стресса у растений пшеницы. Влияние гербицида Октапон экстра на рост пшеницы и ее урожайность было неоднозначным. Несмотря на меньшую зеленую массу, количество зерна, собранного с этих делянок, было выше, чем в контроле. Можно предположить, что это объясняется особенностями роста корневой системы и формирования колоса, которые в данном опыте не отслеживались.
Рис. 6.
Масса побегов (а) в июне (1) и июле (2) и урожайность (б) пшеницы сорта Кинельская юбилейная при выращивании в полевых условиях: I – без гербицидов и бактерий, II – без гербицидов с бактериями, III – Октапон экстра без бактерий, IV – Октапон экстра с бактериями, V – Наномет без бактерий, VI – Наномет с бактериями, VII – Чисталан без бактерий, VIII – Чисталан с бактериями.
Микробиологический посев отобранных на делянках ризосферных почвенных образцов на минеральную среду Раймонда, содержащую 2,4-Д в качестве единственного источника углерода, показал, что через 1 мес после обработки участков штаммом P. protegens ДА1.2 численность бактерий – деструкторов данного соединения увеличивалась до (1.5 ± 0.3) × 105 КОЕ/г по сравнению с участками без обработки бактериями, на которых этот показатель составил (4.2 ± 0.5) × 103 КОЕ/г. Это может служить косвенным признаком наличия живых клеток P. protegens ДА1.2 в почве и их участия в эффектах, наблюдаемых на посевах пшеницы после применения баковых смесей бактерий и гербицидов.
Таким образом, в результате проведенных исследований было доказано наличие ряда полезных признаков у штамма P. protegens ДА1.2, к которым относились биосинтез ауксинов, мобилизация неорганических фосфатов, антагонизм к фитопатогенных грибам, нитрогеназная активность, а также его ростстимулирующее и антистрессовое влияние на растения пшеницы. Показано, что одновременная обработка растений пшеницы гербицидами Октапон экстра, Наномет, Чисталан и штаммом P. protegens ДА1.2 может давать положительный эффект, отличающийся от применения отдельно бактерий и гербицидов. Использование баковых смесей гербицидов и ростстимулирующих бактерий может стать полезным приемом при возделывании злаковых культур и заслуживает детального изучения.
Авторы выражают благодарность Р.Р. Гарафутдинову (ИБГ УФИЦ РАН) за помощь при проведении сканирующей зондовой микроскопии.
Работа выполнена в рамках Гос. задания Минборнауки России (проект № 075-00326-19-00) по теме № АААА-А19-119021390081-1 с использованием оборудования РЦКП УФИЦ РАН “Агидель”.
Список литературы
Abd El-Daim I.A., Bejai S., Meijer J. // Plant Soil. 2014. V. 379. № 1–2. P. 337–350. https://doi.org/10.1007/s11104-014-2063-3
Kaushal M., Wani S.P. // Agric. Ecosyst. Environ. 2016. V. 231. P. 68–78. https://doi.org/10.1016/j.agee.2016.06.031
Ahemad M., Khan M.S. // Ann. Microbiol. 2010. V. 60. P. 735–745. https://doi.org/10.1007/s13213-010-0124-2
Bourahla M., Djebbar R., Kaci Y., Abrous-Belbachir O. // Analele Univ. din Oradea, Fasc. Biol. 2018. V. 25. № 2. P. 74–83.
Ahemad M., Khan M.S. // Pestic. Biochem. Physiol. 2010. V. 98. № 2. P. 183–190. https://doi.org/10.1016/j.pestbp.2010.06.005
Chennappa G., Sreenivasa M.Y., Nagaraja H. Microorganisms for Green Revolution. Microorganisms for Sustainability. V. 7. / Ed. D. Panpatte, Y. Jhala, H. Shelat, R. Vyas. Singapore: Springer, 2018. P. 23–43. https://doi.org/10.1007/978-981-10-7146-1_2.
Четвериков С.П. Четверикова Д.В., Кенджиева А.А., Бакаева М.Д. // Естественные и технические науки. 2019. № 11. С. 108–111. https://doi.org/10.25633/ETN.2019.11.18
Jacobsen C.S. // Plant Soil. 1997. V. 189. № 1. P. 139–144. https://doi.org/10.1023/A:1004296615446
Методы общей бактериологии / Ред. Ф.М. Герхардт. М: Мир, 1984. Т. 3. 264 с.
Wilson K. Current Protocols in Molecular Biology. / Eds. F.M. Ausubel, R. Brent, R.E. Kingston, D.D. Moore, J.G. Seidman, J.A. Smith, K. Struhl N.Y.: Green Publishing Associates, 2003. P. 241–245.
Raymond R.L. // Develop. Industr. Microbiol. 1961. V. 2. № 1. P. 23–32.
Veselov S.Y., Kudoyarova G.R., Egutkin N.L., Guili-Zade V.Z., Mustafina A.R., Kof E.M. // Physiol. Plant. 1992. V. 86. № 1. P. 93–96. https://doi.org/10.1111/j.1399-3054.1992.tb01316.x
Пиковская Р.И. // Микробиология. 1948. Т. 17. № 5. С. 362–370.
Коршунова Т.Ю., Четвериков С.П., Мухаматдьярова С.Р., Логинов О.Н. // Изв. Самарского научн. центра РАН. 2013. № 3-5. С. 1637–1640.
Четвериков С.П., Логинов О.Н. // Микробиология. 2009. Т. 78. № 4. С. 479–483. (Chetverikov S.P., Loginov O.N. // Microbiology. 2009. V. 78. № 4. P. 428–432.)
Bates L.S., Waldren R.P., Teare I.D. // Plant Soil. 1973. V. 39. № 1. P. 205–207. https://doi.org/10.1007/BF00018060
Пaтeнт PФ. 2003. № 2244916.
Tsukanova K.A., Chebotar V.K., Meyer J.J.M., Bibikova T.N. // S. Afr. J. Bot. 2017. V. 113. P. 91–102. https://doi.org/10.1016/j.sajb.2017.07.007
Samavat S., Samavat S., Mafakheri S., Shakouri M.J. // Bulg. J. Agric. Sci. 2012. V. 18. № 3. P. 387–395.
Bakaeva M., Kuzina E., Vysotskaya L., Kudoyarova G., Arkhipova T., Rafikova G., Chetverikov S., Korshunova T., Chetverikova D., Loginov O. // Plants. 2020. V. 9. № 3. Article 379. https://doi.org/10.3390/plants9030379
Mwadzingeni L., Shimelis H., Tesfay S., Tsilo T.J // Front. Plant Sci. 2016. V. 7. Article 1276. https://doi.org/10.3389/fpls.2016.01276
Kolupaev Y.E., Yastreb T.O., Oboznyi A.I., Kirichenko V.V., Ryabchun N.I. // Russian J. Plant Physiology. 2016. V. 63. № 3. P. 326–337. https://doi.org/10.1134/S1021443716030067
Agafonova N.V., Doronina N.V., Trotsenko Y.A. // Appl. Biochem. Microbiol. 2016. V. 52. № 2. P. 199–204. https://doi.org/10.1134/S0003683816020022
Ashraf M., Harris P.J.C. // Photosynthetica. 2013. V. 51. № 2. P. 163–190. https://doi.org/10.1007/s11099-013-0021-6
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


