Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 68-76
Получение комплексного ферментного препарата с увеличенной пектиназной активностью на основе нового мутантного штамма T. reesei Cо-44
Е. В. Костылева 1, *, А. С. Середа 1, И. А. Великорецкая 1, А. М. Айсина 1, Н. В. Цурикова 1, Е. А. Рубцова 2, А. Д. Сатрутдинов 2, А. П. Синицын 2, 3
1 Всероссийский научно-исследовательский институт пищевой биотехнологии (ВНИИПБТ) – филиал ФГБУН
“ФИЦ питания и биотехнологии”
111033 Москва, Россия
2 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Россия
* E-mail: ekostyleva@list.ru
Поступила в редакцию 10.04.2020
После доработки 03.07.2020
Принята к публикации 02.09.2020
Аннотация
Для создания комплексных ферментных препаратов сбалансированного состава, обеспечивающих эффективный гидролиз основных некрахмальных полисахаридов растительного сырья (целлюлозы, ксиланов, пектина) проведены исследования по оптимизации состава ферментационной среды для глубинного культивирования нового мутантного штамма Trichoderma reesei Co-44 – высокоактивного продуцента карбогидраз эндодеполимеразного действия. Показано, что концентрат низкомолекулярных веществ сои обеспечивал максимальное – более, чем в 8 раз, увеличение активности полигалактуроназы при увеличенном уровне биосинтеза эндоглюканазы и ксиланазы. Получен комплексный ферментный препарат ксилоризин К4, изучены его физико-химические свойства. С помощью масс-спектрометрического анализа подтверждено присутствие в составе ксилоризина К4 эндополигалактуроназы (GH28) T. reesei. Показана перспективность применения ксилоризина К4 для удаления основных некрахмальных полисахаридов соевого шрота в процессе получения соевых белковых концентратов.
В основе многих технологий в пищевой и кормовой промышленности лежит переработка растительного сырья с использованием ферментных препаратов (ФП) карбогидраз. Ферментативный гидролиз основных некрахмальных полисахаридов (НКП) растительных тканей – целлюлозы, гемицеллюлозы и пектиновых веществ, позволяет повышать пищевую и кормовую ценность сырья, получать специализированные продукты с требуемыми характеристиками, улучшать параметры технологических процессов и качество готовой продукции [1, 2].
Штаммы мицелиальных грибов отличаются высокой продуктивностью и способностью синтезировать широкий спектр ферментов, что дает возможность рассматривать их как перспективные источники карбогидраз для создания комплексных препаратов сбалансированного состава, обеспечивающих эффективный гидролиз основных НКП различных видов растительного сырья [2, 3]. Наиболее известным промышленным продуцентом целлюлаз и гемицеллюлаз является гриб Trichoderma reesei, секретирующий более 15 различных карбогидраз. Основные компоненты ферментного комплекса штаммов T. reesei – целлобиогидролазы, эндоглюканазы (ЭГ), ксиланазы (КС), β-глюкозидазы. В меньшем количестве T. reesei синтезирует маннаназу, арабинофуранозидазу, ксилоглюканазу и некоторые другие ферменты, участвующие в гидролизе полимеров растительного сырья [4–6]. Известно, что некоторые штаммы T. reesei при культивировании в присутствии индукторов синтезируют в небольшом количестве внеклеточную полигалактуроназу (ПГ) [7–10]. ПГ катализирует гидролиз α-1,4-гликозидных связей в полигалактуроновой кислоте и относится к ключевым ферментам при гидролизе пектиновых веществ [1, 11, 12].
В ходе ранее проведенных исследований нами был получен мутантный штамм T. reesei Co-44 с увеличенной продукцией КС и ЭГ – ключевых ферментов при гидролизе основных НКП зернового сырья в кормопроизводстве [13]. Кроме того, показано повышение уровня биосинтеза ряда сопутствующих ферментов, в том числе ПГ. На основании литературных данных, указывающих на высокое содержание пектиновых веществ в основных видах растительного сырья для пищевой и кормовой отрасли [1, 2, 14], сделано предположение, что увеличение продуктивности штамма T. reesei Co-44 по ПГ повысит эффективность получаемых на его основе ФП в различных технологических процессах.
Цель работы – получение комплексного ФП сбалансированного состава с увеличенной продукцией ПГ при высоком уровне синтеза ЭГ и КС на основе T. reesei Co-44.
МЕТОДИКА
Штамм микроорганизма. Объект исследования – штамм T. reesei Co-44 (ВКМ F-4789D), полученный с использованием гамма-мутагенеза из штамма T. reesei BCM 18.2/КК – промышленного продуцента целлюлолитических и гемицеллюлолитических ферментов [13].
Подготовка посевного материала. Для получения посевного материала использовали модифицированную среду SM следующего состава (%): KH2PO4 – 0.2, глюкоза – 1.0, дрожжевой экстракт – 0.4, пептон – 0.6, солодовое сусло – 2.0, агар-агар – 2.0. Штамм выращивали на агаризованной среде в течение 7 сут при 30°С и 7 сут при комнатной температуре на свету. Споровый посевной материал на агаризованной среде хранили при температуре 5°C не более 3 мес.
Глубинное культивирование в колбах. Продуцент выращивали на термостатируемых качалках (250 об./мин) при 30°C в течение 120 ч в колбах объемом 750 мл с 50 мл ферментационной среды следующего состава (%): лактоза – 2.0, аморфная целлюлоза – 1.0, солодовые ростки – 1.0, дрожжевой экстракт – 1.0, KH2РО4 – 0.2, (NH4)2SO4 – 0.6, CaCl2 – 0.06, водопроводная вода, рН среды 4.8–5.0. В опытные ферментационные среды вместо аморфной целлюлозы вносили различные индукторы биосинтеза карбогидраз. Среды засевали 2 мл суспензии спорового посевного материала с титром 106 спор/мл.
Биомассу гриба после выращивания отделяли центрифугированием при 10750 g в течение 5 мин. Культуральную жидкость (КЖ) использовали для определения активности целевых ферментов.
Получение сухих ФП. Продуцент выращивали в качалочных колбах объемом 750 мл с 50 мл исходной ферментационной среды или среды с выбранным индуктором синтеза карбогидраз на термостатируемых качалках (250 об./мин) при 30°C в течение 96–120 ч. Биомассу выращенной глубинно культуры отделяли центрифугированием на ЦЛС-3 с ротором РУ 8-90 (фактор разделения 6000) в течение 20 мин. Сухой ФП получали осаждением супернатанта КЖ этиловым спиртом в соотношении 1:5 с последующим центрифугированием в течение 15 мин и высушиванием образовавшегося осадка при комнатной температуре.
Определение активности ПГ, КС и ЭГ. Активность определяли по начальной скорости образования восстанавливающих сахаров (ВС) при гидролизе К-соли полигалактуроновой кислоты, ксилана из древесины березы и Na-карбоксиметилцеллюлозы (КМЦ) соответственно. ВС определяли по методу Шомоди–Нельсона. За 1 ед. активности принимали такое количество фермента, которое катализирует образование 1 мкмоль ВС эквивалентных 1 мкмолю глюкозы за 1 мин при 50°С, рН 5.0, и концентрации соответствующих субстратов в реакционной смеси 1% [15, 16]. Содержание растворимого белка определяли по методу Лоури.
Результаты получали не менее чем в трех повторностях.
Определение рН-оптимума. Оптимальный рН для действия КС, ЭГ и ПГ определяли при 30°С в диапазоне значений pH 3.0–9.0. Для получения растворов с заданным значением pH использовали 0.1 М универсальный буфер.
Определение температурного оптимума. Активности КС, ЭГ и ПГ определяли при рН 5.0 в диапазоне температур 30–80°С.
Электрофорез белков в полиакриламидном геле. Электрофорез в денатурирующих условиях проводили при концентрации геля 12% в 25 мМ трис-глициновом буфере, pH 8.3, с ДДС-Na в концентрации 1 мг/мл в ячейке для электрофореза “Mini Protein Cell system” (“Bio-Rad”, США). Гель окрашивали кумасси бриллиантовым синим G-250 (“Amresco”, США). В качестве белков-маркеров молекулярной массы использовали: β-галактозидазу (116.0 кДа), бычий сывороточный альбумин (66.2 кДа), овальбумин (45.0 кДа), лактатдегидрогеназу (35.0 кДа), REase Bsp981 E.coli (25.0 кДа), β-лактоглобулин (18.4 кДа), лизоцим (14.4 кДа)
Масс-спектрометрический анализ. Анализ проводили в ЦКП “Промышленной биотехнологии” ФИЦ “Фундаментальные основы биотехнологии” РАН на масс-спектрометре “UltraflexXtreme” (“Bruker Daltonik GmbH”, Германия). Исследуемый белок вырезали из полиакриламидного геля, обрабатывали трипсином, гидролизат анализировали методом MALDI-TOF-масс-спектрометрии. Обработку полученных данных проводили с использованием программы “Bruker Data Analysis” (“Brucker Corporation”, США). Поиск исследуемого фермента по масс-спектрам базах данных белков NCBI и SWISS-PROTT осуществляли по программе “Peptide Mass Fingerprint” (“Matrix Science Inc.”, США).
Гидролиз НКП. Для оценки эффективности гидролиза в качестве субстрата использовали тостированный соевый шрот, экструдированный с использованием двухшнекового экструдера (“Werner & Pfleiderer Continua 37”, Германия) при температуре 120–130°С. В качестве коммерческих аналогов использовали ФП Целлолюкс F (“Сиббиофарм”, Россия) и ФП Ладозим Респект Оптима (“Микробиопром”, Россия). ФП дозировали по активности ЭГ из расчета 5 ед. на 1 г сырья. Гидролиз проводили в течение 5 ч при температуре 40°С при естественном рН водной суспензии экструдированного соевого шрота (ЭСШ) в диапазоне рН 6.0–6.2, при гидромодуле 1:6. Полученный гидролизат центрифугировали в течение 20 мин, осадок высушивали до постоянной влажности и определяли содержание сырого протеина по ГОСТ 13496.4-93. Контрольный вариант инкубировали в аналогичных условиях (5 ч, 40°С, 220 об./мин) без внесения ФП.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбор индуктора биосинтеза целевых карбогидраз T. reesei. Из данных литературы известно, что при культивировании на ферментационных средах, содержащих индукторы экспрессии генов КС и ЭГ (лактозу, целлюлозу), T. reesei синтезирует ПГ конститутивно, в минимальных количествах [7–10]. Внесение различных источников пектина существенно увеличивало продукцию ПГ [8]. На первом этапе исследований был модифицирован состав исходной ферментационной среды для индукции синтеза карбогидраз в сторону увеличения пектиназной активности. Для оценки влияния различных источников углерода на уровень биосинтеза ПГ, КС и ЭГ штаммом T. reesei Co-44 в исходную среду вместо 1%-ной аморфной целлюлозы в качестве индукторов биосинтеза карбогидраз вносили 1.0% яблочного пектина с низкой степенью этерификации, пектиновые волокна, свекловичный жом, соевую шелуху, концентрат низкомолекулярных веществ сои (КНВС), соевую и овсяную муку (рис. 1).
Рис. 1.
Влияние различных добавок на синтез внеклеточных ЭГ (1), КС (2) и ПГ (3) штаммом T. reesei Co-44: I – аморфная целлюлоза (АЦ), контроль, II – яблочный пектин н/э (ЯП), III – пектиновые волокна (ПВ), IV – свекловичный жом (СЖ), V – соевая шелуха (СШ), VI – КНВС, VII – соевая мука (СМ), VIII – овсяная мука (ОМ).
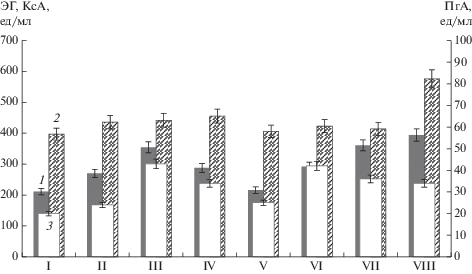
Наиболее сбалансированный состав карбогидраз (максимальная активность ПГ при высоком уровне ЭГ и КС) был получен при использовании пектиновых волокон в качестве индуктора. Активность ЭГ, КС и ПГ при этом составила 354 ± 17, 442 ± 21 и 43 ± 2 ед./мл соответственно. Почти такой же результат был получен при использовании соевой муки, активность тех же ферментов составила 361 ± 18, 414 ± 20 и 36 ± 2 ед./мл соответственно. Свекловичный жом обеспечивал высокий уровень активности КС – 455 ± 22 ед./мл, однако активность ЭГ и ПГ была ниже, чем в варианте с пектиновыми волокнами – 288 ± 15 и 34 ± 2 ед./мл соответственно. Использование овсяной муки позволяло получить высокий уровень активности ЭГ – 394 ± 19 ед./мл, повышенную активность КС – 576 ± 29 ед./мл, при несколько пониженной активности ПГ – 34 ± 2 ед./мл. Положительный эффект соевой муки и КНВС на синтез целевых ферментов штаммом T. reesei Co-44 согласуется с литературными данными об индуцирующем действии компонентов сои на биосинтез карбогидраз T. reesei [17, 18]. Внесение в ферментационную среду КНВС – побочного продукта получения соевых белковых концентратов, содержащего низкомолекулярные углеводы, растворимые азотсодержащие вещества и ростовые факторы сои (витамины, нуклеиновые кислоты и др.) [19], позволило получить высокое значение активности ПГ – 42 ± 2 ед./мл при среднем уровне активности ЭГ и КС – 292 ± 15 и 423 ± 24 ед./мл соответственно.
Далее штамм T. reesei Co-44 культивировали с добавлением компонентов, обеспечивших индукцию целевых ферментов: пектиновые волокна, КНВС, соевая и овсяная мука, в концентрации от 1 до 3% (рис. 2).
Рис. 2.
Зависимость синтеза ЭГ (1), КС (2) и ПГ (3) штаммом T. reesei Co-44 от концентрации индукторов: I – ПВ, II – СМ, III – КНВС, IV – ОМ.

Из полученных результатов (рис. 2) следует, что 2% пектиновых волокон обеспечивало повышение активности ПГ до 48 ± 2 ед./мл, добавление к среде 3% КНВС – до 61 ± 3 ед./мл. Низкомолекулярные олигосахариды, входящие в состав соевой и овсяной муки, преимущественно индуцировали биосинтез ксиланазы и эндоглюканазы. При увеличении концентрации пектиновых волокон, соевой и овсяной муки до 3% наблюдалось повышение вязкости ферментационных сред, что, по-видимому, приводило к ухудшению массообмена в среде при культивировании в колбах и снижению синтеза карбогидраз штаммом-продуцентом. При этом КНВС в концентрации 3% в меньшей степени влиял на вязкость среды и позволял получить наиболее сбалансированный комплекс ферментов: активность ЭГ, КС и ПГ составила 366 ± 18, 484 ± 23 и 61 ± 3 ед./мл соответственно.
Результаты серии последующих экспериментов с увеличением концентрации КНВС от 3 до 9% (рис. 3) позволяют окончательно показать перспективность использования этого компонента в ферментационной среде для увеличения биосинтеза комплекса карбогидраз штаммом T. reesei Co-44. При увеличении концентрации КНВС до 5% наблюдалось существенное повышение активности ПГ – практически в 6 раз по сравнению с контролем, без КНВС. Дальнейшее увеличение концентрации КНВС до 9% приводило к небольшому снижению активности ПГ. Активности КС и ЭГ возрастали более умеренно при повышении содержания в среде КНВС до 5% – на 38 и 30% соответственно по сравнению с контролем без КНВС. При дальнейшем повышении концентрации КНВС от 5 до 9% продуктивность штамма по биосинтезу КС увеличивалась на 17.5%, а ЭГ – на 7.5% по сравнению с вариантом с 5% КНВС.
Рис. 3.
Зависимость активности ЭГ (1), КС (2) и ПГ (3) от концентрации в ферментационной среде КНВС при культивировании T. reesei Co-44.
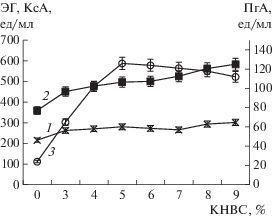
Оптимальное соотношение активностей целевых ферментов для получения ФП сбалансированного состава было достигнуто при культивировании T. reesei Co-44 на среде с 5% КНВС: активность ПГ составила 126 ± 7 ед./мл, ЭГ – 281 ± 14 ед./мл, КС – 497 ± 26 ед./мл (рис. 3).
Таким образом, оптимизация состава ферментационной среды позволила увеличить продукцию ПГ мутантным штаммом более чем в 5 раз при сохранении высокого уровня биосинтеза и сбалансированном соотношении ЭГ и КС.
На среде с 5% КНВС была изучена динамика биосинтеза целевых карбогидраз штаммом T. reesei Co-44 (рис. 4). Установлено, что максимальное накопление ЭГ и ПГ наблюдалось на 96 ч роста, КС – на 72 ч. После 96 ч культивирования резко снижалась продукция ЭГ: на 120 ч роста на 30%, на 144 ч – более чем на 50%. Снижение активности ПГ и КС к 144 ч было менее существенно – 16.3 и 7.5% соответственно.
Рис. 4.
Динамика накопления ЭГ (1), КС (2) и ПГ (3) при культивировании T. reesei Co-44 на среде с 5% КНВС.
Таким образом, выбор добавок, содержащих индукторы биосинтеза карбогидраз, и времени культивирования мутантного штамма T. reesei Co-44 позволил получить в КЖ сбалансированный комплекс карбогидраз эндодеполимеразного действия с увеличенным содержанием необходимых компонентов: активность ПГ после 96 ч культивирования на среде с 5% КНВС составила 141 ± 6 ед./мл, КС и ЭГ – 495 ± 26 и 396 ± 21 ед./мл соответственно.
Свойства ФП, полученного на основе штамма T. reesei Co-44 при культивировании в оптимизированных условиях. Сухой ФП сбалансированного состава (далее Ксилоризин К4) был получен, как описано в разделе “Методика”, осаждением этиловым спиртом из КЖ, полученной в результате выращивания мутантного штамма T. reesei Co-44 в качалочных колбах в течение 96 ч на среде с 5% КНВС. В качестве контроля аналогичным способом был получен сухой ФП1 из КЖ, полученной при культивировании T. reesei Co-44 на исходной среде в течение 120 ч. В полученных ФП были определены активности целевых карбогидраз, а также содержание белка.
Как показали результаты табл. 1 активность ПГ в препарате Ксилоризин К4 была увеличена в 7.8 раз по сравнению с контрольным ФП, полученным на исходной среде, ЭГ – почти в 2 раза; активность КС была увеличена незначительно.
Таблица 1.
Содержание белка и активность полигалактуроназы, ксиланазы и эндоглюканазы в ФП на основе штамма T. reesei Co-44
| ФП | Содержание белка, мг/г | Активность карбогидраз, ед./г | ||
|---|---|---|---|---|
| ПГ | КС | ЭГ | ||
| ФП1, контроль (120 ч на исходной среде) |
323 ± 15 | 360 ± 19 | 11 500 ± 590 | 6900 ± 350 |
| Ксилоризин К4 (96 ч на среде с 5% КНВС) |
376 ± 18 | 2800 ± 125 | 12 250 ± 620 | 13 580 ± 670 |
Известно, что в растительном сырье пектин часто может быть одним из основных компонентов клеточной стенки, связанным с волокнами целлюлозы и гемицеллюлозы [2, 20], поэтому для эффективного гидролиза требуется высокая активность всех ключевых карбогидраз: эндоглюканазы, ксиланазы, пектиназы. ФП Ксилоризин К4, полученный в оптимизированных условиях, в значительной степени соответствовал такому требованию.
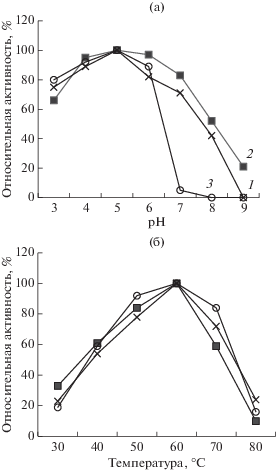
Изучение влияния рН и температуры на активность ФП, позволило найти оптимальные условия для его практического применения. Карбогидразы ФП Ксилоризин К4 проявляли высокую активность в пределах рН от 3 до 6 и температуры от 40 до 70°С (рис. 5), что позволило проводить обработку растительного сырья без предварительной коррекции рН реакционной смеси при температурах от 40 до 60°С, принятых в большинстве технологических процессов в пищевой и кормовой промышленности [1, 2].
Рис. 5.
Зависимость активности ЭГ (1), КС (2) и ПГ (3) в ФП Ксилоризин К4 от рН (а) и температуры (б).
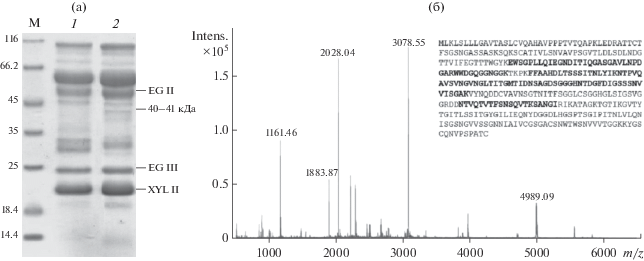
Для определения состава ФП Ксилоризин К4 был проведен электрофорез в присутствии ДДС-Na (рис. 6а), при этом была обнаружена полоса с молекулярной массой ~40–41 кДа, которая предположительно соответствовала ПГ T. reesei. В контрольном ФП1, полученном при культивировании T. reesei Co-44 на исходной среде с 1% аморфной целлюлозы, эта полоса практически не видна. Результаты масс-спектрометрического анализа трипсиновых гидролизатов этой полосы подтвердили соответствие белка эндо-полигалактуроназе (GH28) T. reesei (рис. 6б).
Рис. 6.
Электрофореграмма ФП, полученных из КЖ T. reesei Co-44 при культивировании в колбах на исходной ферментационной среде в течение 120 ч (ФП1, дорожка 1) и на среде с 5% КНВС в течение 96 ч (Ксилоризин К4, дорожка 2): а – MALDI-TOF-масс-спектр трипсинового гидролизата белковой полосы, соответствующей ЭГ T.reesei. Полужирным шрифтом выделены пептиды, совпадающие с аминокислотной последовательностью ЭГ GH28 T.reesei QM6a (б). М – белки-маркеры молекулярной массы.
Исследование эффективности использования ФП Ксилоризин К4 для получения белковых концентратов из соевого шрота. В связи с дефицитом животного белка, в качестве белковых пищевых и кормовых добавок широко используют продукты на основе сои и соевого шрота. Одним из способов повышения содержания белка в соевых продуктах является обработка экструдированных шротов ферментами, способными переводить основные НКП сои в растворимое состояние, с последующим “вымыванием” водорастворимых продуктов гидролиза. Такая технология наиболее актуальна при производстве кормов для аквакультуры, где частичное устранение углеводных компонентов позволяет получать концентраты с высоким содержанием сырого протеина. Соевые белковые продукты способны полноценно заменить в рационах плотоядных рыб наиболее дорогой и труднодоступный компонент – рыбную муку, содержание которой в кормах стараются снизить за счет использования альтернативных источников белка [21, 22].
Соя характеризуется высоким содержанием пектиновых веществ, и для ее ферментативной обработки целесообразно использовать ФП, обладающие помимо активности КС и ЭГ активностью ПГ [23]. Большинство ФП карбогидраз кормового назначения, полученных на основе одного штамма-продуцента, в качестве основных компонентов содержат целлюлазы и/или гемицеллюлазы. Препараты, обладающие дополнительно пектиназной активностью, как правило, получают смешиванием ферментов, произведенных несколькими продуцентами, что существенно повышает себестоимость конечного продукта [2].
Эффективность использования Ксилоризина К4 при получении соевых белковых концентратов определяли в сравнении с коммерческими препаратами: Целлолюксом F (“Сиббиофарм”, Россия) с высокой активностью ЭГ и КС и Ладозимом Респект Оптима (“Микробиопром”, Россия), состоящим из смеси препаратов со сбалансированным содержанием ЭГ, ПГ и КС (табл. 2). ФП дозировали, уравнивая по активности эндоглюканазы. Соевый шрот предварительно экструдировали, чтобы перевести белок сои в нерастворимое денатурированное состояние с целью снижения его потерь при последующем смешивании с водой.
Таблица 2.
Активность полигалактуроназы, ксиланазы и эндоглюканазы в ФП, использованных для обработки экструдированного соевого шрота
| ФП | Активность карбогидраз, ед/г | ||
|---|---|---|---|
| ПГ | КС | ЭГ | |
| Ксилоризин К4 | 2800 ± 125 | 12250 ± 620 | 13580 ± 670 |
| Целлолюкс F | – | 1440 ± 75 | 3500 ± 180 |
| Ладозим Респект Оптима | 340 ± 18 | 240 ± 15 | 350 ± 20 |
Критерием эффективности действия исследуемых препаратов было содержание сырого протеина в полученных белковых соевых концентратах.
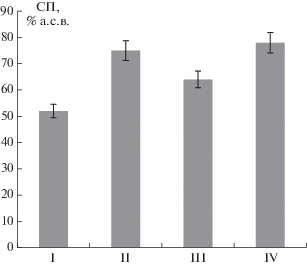
В результате обработки экструдированного соевого шрота Ксилоризином К4 содержание сырого протеина в белковом продукте увеличилось на 44% по сравнению с вариантом без применения ФП и на 17% по сравнению с обработкой Целлолюксом F, не содержащим пектиназ (рис. 7). Эффективность применения ФП на основе нового мутантного штамма была сопоставима с эффективностью препарата Ладозим Респект Оптима, полученного с использованием двух продуцентов и имеющего полный комплекс карбогидраз, необходимый для гидролиза основных НКП сои. Учитывая влияние содержания сырого протеина на стоимость кормовых продуктов, можно сделать вывод о перспективности применения Ксилоризина К4 для обработки экструдированного соевого шрота в процессе получения кормовых добавок с повышенным содержанием белка за счет разрушения и устранения антипитательных НКП. Применение комплексного ФП Ксилоризин К4 позволит ввести в кормовые рационы альтернативные источники белка и снизить себестоимость конечной продукции.
Рис. 7.
Содержание сырого протеина (СП) в соевых продуктах после обработки экструдированного соевого шрота ферментными препаратами карбогидраз: I – без ФП (контроль), II – Ксилоризин К4, III – Целлолюкс F, IV – Ладозим Респект Оптима.
Следует отметить, что в настоящее время все представленные на рынке кормовые ФП, эффективно гидролизующие НКП растительного сырья, являются смесями, полученными на основе препаратов нескольких продуцентов. Кроме того, учитывая резкое подорожание импортных ФП, применение отечественного комплексного препарата с уникальными свойствами – полным набором карбогидраз для обработки сырья с высоким содержанием целлюлозы, гемицеллюлоз и пектиновых веществ, существенно увеличит экономическую эффективность производства кормов на основе растительного сырья.
Таким образом, в результате проведенной работы синтез полигалактуроназы штаммом T. reesei Co-44 был увеличен более чем в 8 раз при высоком уровне активности КС и ЭГ, что позволило получить комплексный ФП сбалансированного состава, высокоэффективный при обработке экструдированного соевого шрота в процессе промышленного получения белковых кормовых добавок.
При проведении работы было использовано оборудование ЦКП “Промышленной биотехнологии” ФИЦ “Фундаментальные основы биотехнологии” РАН.
Работа выполнена в рамках Программы фундаментальных научных исследований государственных академий наук на 2019–2021 гг. (тема № 0529-2019-0066).
Список литературы
Михайлова Р.В. Мацерирующие ферменты мицелиальных грибов в биотехнологии. Минск: Белорусская наука, 2007. 407 с.
Bedford M.R., Partridge G.G. Enzymes in Farm Animal Nutrition. Wallingford, Oxforshire, UK: Cambridge, MA: CAB International, 2010. 319 p.
Sajith S., Priji P., Sreedevi S., Benjamin S. // J. Nutr. Food Sci. 2016. V. 6. P. 461. https://doi.org/10.4172/2155-9600.1000461
Herpoël-Gimbert I., Margeot A., Dolla A., Jan G., Mollé D., Lignon S., Mathis H., Sigoillot J.-C., Monot F., Asther M. // Biotechnol. Biofuels. 2008. V. 1. P. 18 https://doi.org/10.1186/1754-6834-1-1
Druzhinina I.S., Kubicek C.P. // Microb. Biotechnol. 2017. V. 10. № 6. P. 1485–1499. https://doi.org/10.1111/1751-7915.12726
Payne C.M., Knott B.C., Mayes H.B., Hansson H., Himmel M.E., Sandgren M., Ståhlberg J., Beckham G.T. // Chem Rev. 2015. V. 115. № 3. P. 1308–448. https://doi.org/10.1021/cr500351c
Markovič O., Slezárik A., Labudová I. // FEMS Microbiol. Letters. 1985. V. 27. № 3. P. 267–271. https://doi.org/10.1111/j.1574-6968.1985.tb00680.x
Olsson L., Christensen T.M.I.E., Hansen K.P., Palmq-vist E.A. // Enzyme Microbial Technol. 2003. V. 33. № 5. P. 612–619. https://doi.org/10.1016/S0141-0229(03)00181-9
Mohamed S.A., Christensen T.M.I.E., Mikkelsen J.D. // Carbohyd. Res. 2003. V. 338. № 6. P. 515–524.
Saloheimo M., Pakula T. // Microbiology. 2012. V. 158. № 1. 46–57. https://doi.org/10.1099/mic.0.053132-0
Pedrolli D.B., Monteiro A.P., Gomes E.L., Carmona E.C. // The Open Biotechnol. J. 2009. V. 3. P. 9–18. https://doi.org/10.2174/1874070700903010009
Tapre A., Jain R.K. // International Food Research Journal. 2014. V. 21. № 2. P. 447–453.
Kostyleva E.V., Tsurikova N.V., Sereda A.S., Velikoretskaya I.A., Veselkina T.N., Lobanov N.S., Shashkov I.A., Sinitsyn A.P. // Microbiology. 2018. V. 87. P. 652–661. https://doi.org/10.1134/S0026261718050120
Vanitha T., Khan M. Role of Pectin in Food Processing and Food Packaging. In: Pectins – Extraction, Purification, Characterization and Applications. 2019. https://doi.org/10.5772/intechopen.83677
Collmer A., Reid J., Mount M. // Methods Enzymol. 1988. V. 161. P. 329–335.
Синицын А.П., Гусаков А.В., Черноглазов В.А. Биоконверсия лигноцеллюлозных материалов. М.: МГУ, 1995. 144 с.
Hao X.-C., Yu X.-B., Yan Zh.-L. // Food Technol. Biotechnol. 2006. V. 44. № 1. P. 89–94.
Saravanan P., Muthuvelayudham R., Viruthagiri T. // Enzyme Research. 2012. V. 2012. P. 7. https://doi.org/10.1155/2012/157643
Хабибулина Н.В., Бикбов Т.М., Пономарев В.В. // Проектная культура и качество жизни. 2015. № 1. С. 473–491.
Sundarraj A.A., Ranganathan T.V. // International J. Applied Environmental Sciences. 2017. V. 12. № 10. P. 1777–1801.
Barnes M., Brown M., Rosentrater K., Sewell J. // Open J. Animal Sciences. 2012. V. 2. № 4. P. 234–243. https://doi.org/10.4236/ojas.2012.24033
Delgado E., Reyes-Jaquez D. // Extrusion of Metals, Polymers and Food Products. 2017. https://doi.org/10.5772/65577
Karr-Lilienthal L.K., Kadzere C.T., Grieshop C.M., Fahey G.C. // Livestock Production Science. V. 97. № 1. 2005. P. 1–12.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


