Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 59-67
Антимикробный потенциал алкалофильного гриба Sodiomyces alkalinus и отбор штаммов – продуцентов новых антимикотиков
А. Е. Куварина 1, *, М. Л. Георгиева 1, 2, Е. А. Рогожин 1, 4, А. Б. Кулько 3, И. А. Гаврюшина 1, В. С. Садыкова 1, **
1 Научно-исследовательский институт по изысканию новых антибиотиков имени Г.Ф. Гаузе
119021 Москва, Россия
2 Московский государственный университет имени М.В. Ломоносова, биологический факультет
119234 Москва, Россия
3 Московский городской научно-практический центр борьбы с туберкулезом
Департамента здравоохранения города Москвы
107076 Москва, Россия
4 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
117997 Москва, Россия
* E-mail: nastena.lysenko@mail.ru
** E-mail: sadykova_09@mail.ru
Поступила в редакцию 10.07.2020
После доработки 31.08.2020
Принята к публикации 02.09.2020
Аннотация
Исследована способность представителей алкалофильных штаммов микромицетов вида Sodiomyces alkalinus к продукции антимикробных соединений. В результате определения выхода антибиотических соединений и их спектра из наиболее активных штаммов отобран перспективный продуцент антимикотиков Sodiomyces alkalinus штамм 8KS17-10. Продуцент проявлял антифунгальную активность к условно-патогенным грибам и патогенным клиническим изолятам плесневых и дрожжевых грибов – возбудителей системных микозов. Выделенное активное индивидуальное соединение по совокупности выявленных структурных особенностей (молекулярная масса, характер фрагментации при ионизации, соотношение УФ-поглощения на определенных длинах волн) может быть отнесено к группе антимикробных гликопептидов.
Распространение антибиотикорезистентных штаммов патогенных микроорганизмов является одним из общепризнанных глобальных вызовов системе здравоохранения во всех странах. Широкое применение антибиотиков в последние десятилетия привело к тому, что до 30% случаев инфекционных заболеваний не поддается терапии известными препаратами, включая антибиотики последних поколений. Сдерживание экспансии резистентных штаммов, наблюдаемое по всему миру, требует применения комплексных радикальных мер, включающих поиск принципиально новых соединений с антимикробной активностью.
Грибы – одна из основных групп живых организмов, рассматриваемых в качестве продуцентов антибиотиков, тем не менее, к настоящему времени, только небольшая часть из них исследована на предмет синтеза вторичных антимикробных продуктов.
Традиционно грибы, продуцирующие антибиотики, выделяли из образцов почвы. Тем не менее, этот источник, по большей части, исчерпан и на первый план в поиске новых и более эффективных антимикробных соединений выходят нетрадиционные биотопы с недавно открытыми организмами [1]. Эти биотопы включают в себя засушливые почвы, пещеры, районы с высокими или низкими температурами, высокой соленостью и щёлочностью, глубины морей и океанов и т.д. Выживание в таких условиях связано с синтезом различных метаболитов, имеющих отличную, от ранее исследованных, структуру. За прошедшие 10–15 лет было выделено и охарактеризовано более 20 000 таких соединений, продуцируемых экстремофильными микроорганизмами [2, 3]. Несмотря на сложности обнаружения и культивирования грибов-экстремофилов, в частности, алкалофильных грибов, проводимые скрининговые исследования показывают их огромный потенциал в качестве источников новых биоактивных соединений [4].
Так, у алкалотолерантного гриба Paecilomyces lilacinus показан синтез пептидных антибиотиков 1907-II и 1907-VIII с антибактериальной и антифунгальной активностями [5]. Алкалофильный гриб Aspergillus flavus продуцирует койевую кислоту и фомалигол А, обладающие активностью в отношении грамположительных и грамотрицательных бактерий [6, 7]. У штаммов алкалофильного гриба Emericellopsis alkalina, выделенных из щелочных засоленных почв, обнаружен и описан новый липопептаибол – эмерициллипсин А, обладающий антифунгальной, антибактериальной, в том числе и по отношению к грамотрицательным бактериям, а также противоопухолевой активностями [8].
Большинство известных к настоящему времени алкалофильных и алкалотолерантных таксонов грибов принадлежит к аскомицетам из семейства Plectosphaerellaceae. Особенно интересны представители недавно описанного рода Sodiomyces (Ascomycota, Plectosphaerellaceae), для которых подтверждён облигатно-алкалофильный тип адаптации. Виды этого рода служат моделями в исследованиях экофизиологии грибов, изучении биохимических основ адаптации к фактору рН [9, 10], переносе бактериальных генов в геном грибов и эволюции ферментов [11]. Показано, что в геноме S. alkalinus есть последовательности, кодирующие основные ферменты, необходимые для биосинтеза бета-лактамных антибиотиков. При этом известно, что бета-лактамы быстро разлагаются при высоком pH [12, 13]. Остается открытым вопрос, синтезирует ли эти вещества гриб в природных условиях, где высоко разнообразие различных групп прокариот, а также обильно представлены некоторые щелочеустойчивые грибы, или в щелочных условиях продуцирует другие антимикробные соединения [11].
Цель работы – оценка антимикробной активности алкалофильных изолятов вида Sodiomyces alkalinus, отбор продуцентов пептидных антибиотиков и идентификация наиболее активных из них.
МЕТОДИКА
Объектами исследования были 25 алкалофильных штаммов недавно описанного вида Sodiomyces alkalinus (Bilanenko & M.Ivanova) A.A. Grum-Grzhim., A.J.M. Debets & Bilanenko (https://www.ncbi. nlm.nih.gov/nuccore/?term=Sodiomyces+alkalinus), выделенного из щелочных засоленных почв в различных географических регионах [14]. Культуры получены из коллекции “Грибы экстремальных местообитаний” кафедры микологии и альгологии биологического факультета МГУ им. М.В. Ломоносова (Россия). Часть изолятов депонирована во Всероссийской коллекции микроорганизмов (ВКМ, Пущино, Россия) и Центре биоразнообразия грибов (CBS, Fungal Biodiversity Centre, Утрехт, Нидерланды). Штамм F11 (= CBS 110278 = = VKM F-3762), используемый в работе, является типовым для этого вида, и его полный геном аннотирован [11].
На первых этапах работы антимикробную активность штаммов оценивали методом диффузии в агар на тест-культурах условно-патогенных микроорганизмов Aspergillus niger INA 00760 и Bacillus subtilis АТСС 6633. Высокоактивными считали культуры, у которых зона задержки роста тест-организма составляла 25 мм и более, умеренно активными культурами считались с зоной задержки роста 10–25 мм и слабоактивными с зоной менее 10 мм.
Способность к синтезу антимикробных веществ оценивали при выращивании на специализированной щелочной среде, которая, по полученным ранее данным, является оптимальной для роста и развития этого микромицета [11, 14].
Для отобранных 8 штаммов исследовали образование антимикробных веществ при культивировании в жидкой щелочной среде следующего состава (г/л): Na2CO3 – 24; NaHCO3 – 12; NaCl – 6; KNO3 – 1; K2HPO4 – 1, солодовый экстракт (15 °Баллинга) – 200 мл; дрожжевой экстракт – 1; дистиллированная вода – 800 мл [15]. Грибы выращивали стационарно в колбах на 500 мл в течение 14 сут. После окончания выращивания культуральную жидкость отделяли фильтрацией через мембранные фильтры на воронке Зейца под вакуумом.
Для трех штаммов было проведено сравнение антимикробной активности при различных способах хранения культур. Сравнивали одинаковые штаммы, одни из которых хранились в глицерине при –70°С в кельвинаторе, другие – на агаризованной щелочной среде в пробирках в холодильнике при 6°С. Оба варианта хранили в указанных условиях не менее 2 лет.
Для выделения антибиотических веществ культуральную жидкость (КЖ) продуцента экстрагировали этилацетатом в соотношении органический растворитель–КЖ 5 : 1. Полученные экстракты упаривали в вакууме на роторном испарителе Rotavapor-RBuchi (“Büchi”, Швейцария) при 42°C досуха, сухой остаток растворяли в водном 70%-ном этаноле и получали спиртовые концентраты.
Антимикробную активность определяли в исходной КЖ, в спиртовых концентратах экстрактов КЖ и мицелия, на стерильных бумажных дисках (бумага фильтровальная Ф ГОСТ 12026-76, Россия), смоченных в экстрактах и высушенных в стерильных условиях. Контролем чувствительности тест-организма служили стандартные диски с амфотерицином B для грибов 40 мкг/диск, и ампициллином для бактерий 10 мкг/диск (“НИИ Пастера”, Россия).
Спектр антимикробной активности культуральной жидкости, экстрактов и индивидуальных соединений определяли на тест-культурах мицелиальных и дрожжевых микроскопических грибов и бактерий из коллекции культур Научно-исследовательского института по изысканию новых антибиотиков имени Г.Ф. Гаузе (Москва, Россия). Использовали условно-патогенные плесневые и дрожжевые тест-культуры грибов видов Aspergillus fumigatus КПБ F-37, A. niger INA 00760, Candida albicans АТСС 2091, тест-культуры штаммов грамположительных ‒ Bacillus subtilis АТСС 6633, Staphylococcus aureus FDA 209P и грамотрицательных бактерий – Escherichia coli АТСС 25922.
Спектр антимикотического действия антимикробного пептида также оценивали на клинических изолятах плесневых и дрожжевых грибов − возбудителей оппортунистических пневмомикозов бронхов и легких у больных туберкулезом, обладающих мультирезистентностью по отношению к применяемым в клинической практике антибиотикам-азолам, из коллекции микологической лаборатории “Московского городского научно-практического центра борьбы с туберкулезом” (Россия): Candida albicans 1582м 2016, C. glabrata 1402м 2016, C. krusei 1447м 2016, C. parapsilopsis 571м, C. tropicalis 156м 2017, Cryptococcus neoformans 297м 2017, Aspergillus fumigatus 390м, A. niger 219.
Дальнейшее разделение активных фракций (после экстракции) проводили путем аналитической обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) с использованием аналитической колонки XBridge 5 мкм 130 A размером 250 × 4.6 мм (“Waters”, Ирландия) в растущем линейном градиенте концентрации ацетонитрила в качестве подвижной фазы (элюент А – 0.1%-ная трифторуксусная кислота (ТФУ) в воде MQ, элюент В – 80%-ный ацетонитрил в 0.1%-ной водной ТФУ) при скорости потока 950 мкл/мин. Для ОФ-ВЭЖХ использовали ультраградиентный ацетонитрил фирмы (“Panreac”, Испания) и ТФУ производства “Sigma-Aldrich” (США). Детектирование разделяемых веществ осуществляли при длине волны 214 нм в градиенте концентрации элюента В: 16–28% – за 12 мин; 28–55% – за 27 мин; 55–75% – за 20 мин и 75–85% – за 10 мин с последующим изократическим элюированием в течение 25 мин. С целью масштабирования получения индивидуальных компонентов спиртового концентрата экстракта культуральной жидкости продуцента было проведено его аналогичное разделение методом полупрепаративной ОФ-ВЭЖХ на колонке XBridge 10 мкм 130 A (250 × 10 мм). Поглощение (D) определяли при длине волны 214 нм и скорости потока подвижной фазы 4.4 мл/мин. Полученные в ходе ОФ-ВЭЖХ фракции, соответствующие отдельным пикам, были собраны вручную, затем избыток органического растворителя (ацетонитрила) удаляли упариванием на вакуумной центрифуге SpeedVac (“Savant”, США) и лиофилизовали (“Labconco”, США) для удаления остаточных количеств ТФУ. Спектр антимикробного действия веществ, содержащихся во фракциях, определяли диско-диффузионным методом, как описано выше.
Молекулярные массы активных соединений в выделенной фракции устанавливали на MALDI времяпролетном масс-спектрометре AutoSpeed MALDI TOF/TOF (“BrukerDaltoniсs”, Германия), оснащенном УФ лазером 355 нм (Nd : YAG) в режиме положительных ионов с использованием рефлектрона. На мишени смешивали по 1 мкл раствора образца и 1 мкл раствора 2,5-дигидроксибензойной кислоты концентрацией 10 мг/мл в 20%-ном ацетонитриле с 0.5%-ной ТФУ кислотой. Полученную смесь высушивали на воздухе.
Спектры поглощения снимали с использованием спектрофотометра UV-1800 (“Shimadzu”, Япония) в кварцевых кюветах на 2 мл с длиной оптического пути 1 см.
Минимальную подавляющую концентрацию (МПК) определяли за 24 ч для дрожжевых грибов C. albicans и 48 ч – для плесневых A. niger и A. fumigatus. МПК определяли как минимальную концентрацию вещества, полностью подавляющую рост тест-культуры.
Эксперименты проводили в 3‒5 повторностях. Статистическую обработку результатов и оценку достоверности различий средних значений проводили по критерию Стьюдента для уровня вероятности не менее 95% с использованием пакета программ Microsoft Excel 2007 и Statistica 10.0.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для изучения антимикробной активности штаммов гриба Sodiomyces alkalinus использовали щелочную среду на буферной основе. Проведенные ранее исследования особенностей экофизиологии показали, что S. alkalinus является облигатным алкалофилом, т.е. не способен к росту при кислых рН среды. При значениях рН среды 6–7 значительно снижается скорость его роста, слабо развито или отсутствует бесполое и половое спороношение, воздушный мицелий слабо выражен, а гифы часто деформированы. Специально разработанная для грибов-алкалофилов щелочная среда позволяла поддерживать высокие значения рН (10.5), тем самым имитируя условия природных щелочных биотопов, из которых были выделены изоляты этого уникального гриба. При культивировании на щелочной среде у штаммов S. alkalinus отмечена максимальная скорость роста (по сравнению со средами с кислыми и нейтральными рН) и в полной мере проявлялись все характерные морфолого-культуральные признаки [14]. При рН среды 8 и 10 оптимальна работа многих ферментов S. alkalinus (целлюлазы, гемицеллюлазы, протеазы) [11]. Для изолятов другого алкалофильного гриба (Emericellopsis alkalina), также выделенных из биотопов со щелочной средой, ранее было показано, что наибольшая антифунгальная активность у них проявлялась на среде с высоким значением рН [15, 16].
Оценка антимикробной активности 25 штаммов Sodiomyces alkalinus в отношении тест-грибов и бактерий показала, что около половины исследованных штаммов обладает умеренной или высокой активностью в отношении A. niger INA 00760 и B. subtilis ATCC 6633, при этом доля высокоактивных изолятов с антифунгальной активностью составляла 20% (табл. 1). Выявленный антимикробный спектр может быть отражением обитания в природных засоленных биотопах, где массово развиваются многочисленные бактерии, а также обильны несколько видов щелочеустойчивых микромицетов, среди которых в первую очередь стоит отметить E. alkalina, изоляты которого также показывают выраженную антифунгальную активность [15, 16].
Таблица 1.
Cоотношение исследованных штаммов Sodiomyces alkalinus с антифунгальной и антибактериальной активностью
| Тест-организм | Штаммы S. alkalinus (25 штаммов -100%) | ||
|---|---|---|---|
| слабоaктивные | умеренно активные | высокоактивные | |
| A. niger INA 00760 | 12 (52%) | 8 (28%) | 5 (20%) |
| B. subtilis ATCC 6633 | 11 (44%) | 11 (44%) | 3 (12%) |
По результатам первичного скрининга на твердых средах были отобраны 8 активных штаммов S. alkalinus, включая типовой штамм (F11) с которыми проводили дальнейшие исследования при культивировании на жидких средах.
Из 8 отобранных штаммов в отношении условно-патогенного гриба A. niger INA 00760 и дрожжей C. albicans АТСС 2091 значительная антифунгальная активность культуральной жидкости и её экстрактов при росте в жидкой среде выявлена у 4 (5KS17-8, 8KS17-10, 11KS17-1, F11) и 1 (1KS13-4) штамма соответственно (табл. 2). Высокоактивными в отношении грамположительной бактерии B. subtilis АТСС 6633 были 2 штамма из 8: 1KS13-4 и F11 (табл. 2) по отношению к грамположительной бактерии Staphylococcus aureus FDA 209P и грамотрицательной бактерии Escherichia coli АТСС 25922 активности не было выявлено.
Таблица 2.
Антимикробная активность культуральной жидкости и экстрактов КЖ штаммов Sodiomyces alkalinus (в мм зоны подавления роста тест-организмов)
| Штамм,№ | Зона подавления роста КЖ | Зона подавления роста экстрактами КЖ | ||||||
|---|---|---|---|---|---|---|---|---|
| B. subtilis ATCC 6633 | A. niger INA 00760 | C. albicans ATCC 2091 | A. fumi-gatus КПБ F-37 | B. subtilis ATCC 6633 | A. niger INA 00760 | C. albicans ATCC 2091 | A. fumi-gatus КПБ F-37 | |
| 5KS17-8 | 18 | 14 | 0 | 0 | 0 | 17 | 8 | 8 |
| 8KS17-10 | 33 | 9 | 12 | 0 | 0 | 40 | 9 | 12 |
| 9KS17-1 | 15 | 11 | 0 | 0 | 0 | 12 | 0 | 9 |
| 11KS17-1 | 17 | 12 | 0 | 0 | 13 | 40 | 17 | 12 |
| 2KS10-1 | 23 | 16 | 0 | 0 | 13 | 8 | 0 | 8 |
| 3KS11-1 | 0 | 12 | 12 | 0 | 0 | 9 | 9 | 10 |
| 1KS13-4 | 30 | 13 | 0 | 0 | 25 | 10 | 18 | 8 |
| F11 (типовой) | 10 | 13 | 0 | 0 | 22 | 18 | 0 | 13 |
Для дальнейшего изучения антибиотического комплекса, проявляющего антифунгальную активность, были отобраны три штамма 8KS17-10, 11KS17-1 и F11, активность этилацетатных экстрактов КЖ которых была выше, чем у амфотерицина В в концентрации 40 мкг/диск. Анализ антибиотической активности у этих штаммов показал, что способ хранения культуры в кельвинаторе при –70°С в глицерине или в холодильнике на агаризованной среде в пробирке при 6°С не оказывал значительного влияния на синтез антибиотиков.
В дальнейшем была разработана схема разделения антибиотического комплекса трех штаммов методом обращенно-фазовой ВЭЖХ. В результате был получен сходный профиль компонентов активного концентрата для всех исследуемых штаммов, насчитывающий три преобладающие фракции (рис. 1) с различной степенью гидрофобности.
Рис. 1.
Профиль аналитической обращенно-фазовой ВЭЖХ экстрактов КЖ трех штаммов S. alkalinus: а – 8KS17-10; б – 11KS17-1; в – F11. * – пик Sod 1.
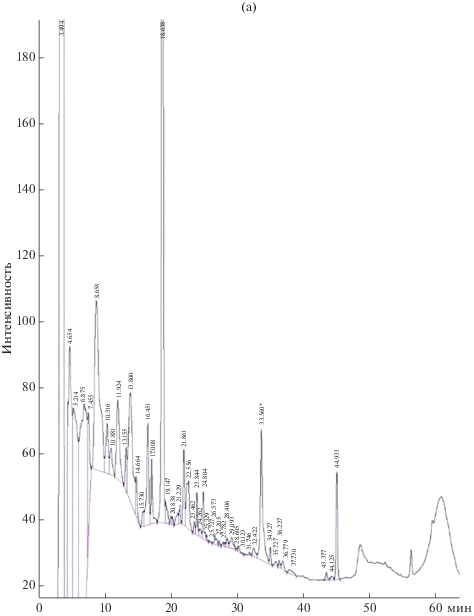
Рис. 1.
Продолжение.
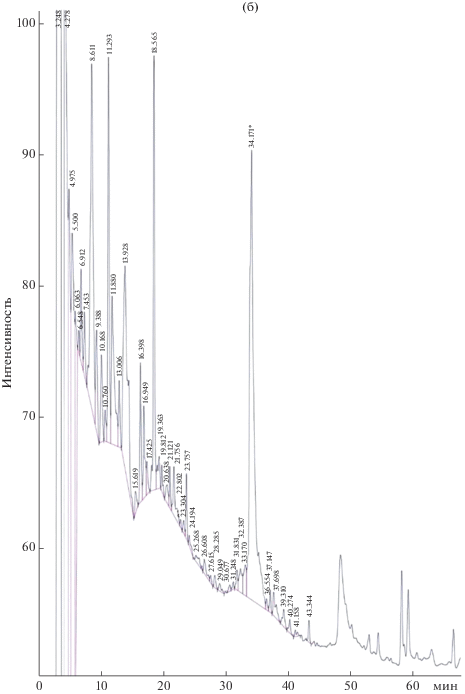
Рис. 1.
Окончание.
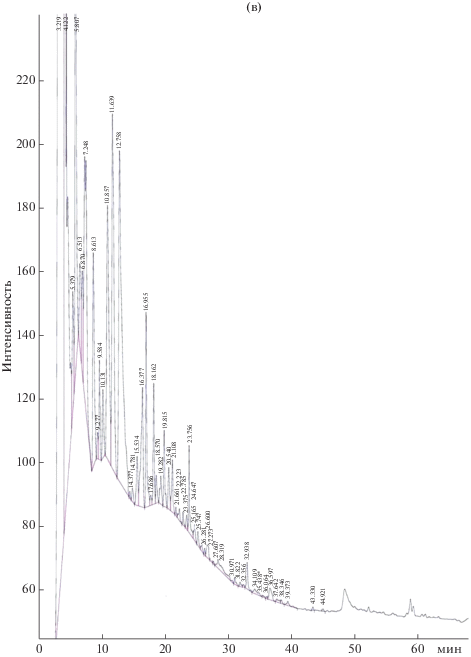
Тестирование полученных основных индивидуальных соединений комплекса на наличие антимикробных свойств позволило выявить выраженную активность лишь у одного преобладающего пика, который элюировался с колонки на 34.2 мин и был назван Sod 1. Зона задержки роста A. niger INA 00760 для соединения Sod 1 составила 22 мм.
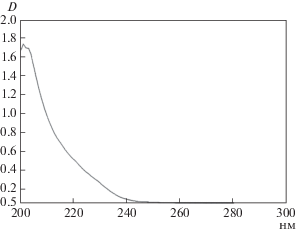
Для активного соединения был получен спектр поглощения в диапазоне длин волн 210–340 нм, который имеет лишь один характерный максимум в области коротковолнового ультрафиолета (около 205 нм), что свидетельствует о наличии в его структуре пептидных связей (рис. 2). Минимальное поглощение в диапазоне 240–280 нм, что указывает на отсутствие в структуре элементов карбо- и гетероциклической природы (рис. 2).
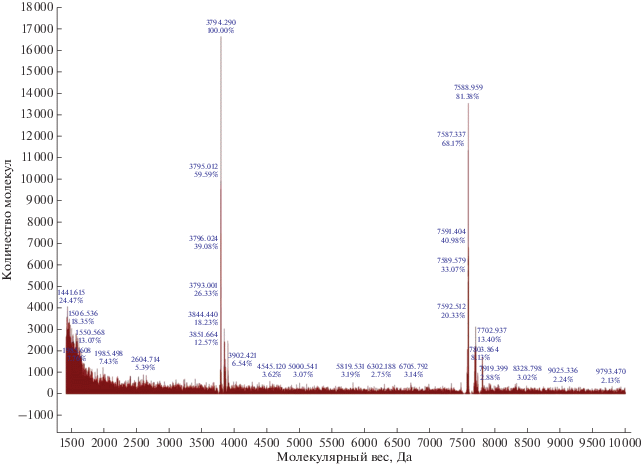
Для исследования первичной структурной характеристики был проведен МАЛДИ-масс-спектрометрический анализ активного соединения, который позволил установить среднюю молекулярную массу соединения – 7918.4 Да (рис. 3). Характер распределения сигналов m/z с шагом более чем в 100 Да свидетельствует о фрагментации молекулы посредством гидролиза гликозидных связей, что определяет разницу в молекулярной массе с агликоном (7586.34 Да) примерно в 332 Да, что предположительно соответствует наличию остатков сахаров.
Для соединения Sod 1 была определена МПК в отношении условно – патогенных плесневых и дрожжевых грибов и бактерий, а также клинических изолятов – возбудителей инвазивных аспергиллезов, кандидемии и криптококкоза (табл. 3).
Таблица 3.
Антифунгальная активность соединения Sod 1 в отношении клинических патогенных плесневых и дрожжевых грибов с множественной резистентностью к азолам
| Тест-организм | Диаметр зоны подавления, мм | |||
|---|---|---|---|---|
| Sod 1 (40 мкг/диск) | Амфотерицин В | Флуконазол | Вориконазол | |
| C. albicans 1582 м 2016 | 18 ± 0.1 | 10 ± 0.6 | 0 | 0 |
| C. glabrata 1402 м 2016 | 16 ± 0.3 | 15 ± 0.1 | 0 | 0 |
| C. krusei 1447 м 2016 | 12.5 ± 0.2 | 0 | 0 | 0 |
| C. tropicalis 156 м 2017 | 14 ± 0.1 | 0 | 0 | 0 |
| C. parapsilosis 571 м | 14 ± 0.2 | 18 ± 0.3 | 0 | 0 |
| Cryptococcus neoformans 297 м 2017 | 30 ± 0.1 | 18 ± 0.6 | 0 | 0 |
| A. fumigatus 390 м | 12 ± 0.5 | 9 ± 0.6 | 0 | 0 |
| A. niger 219 | 14 ± 0.1 | 15 ± 0.8 | 0 | 0 |
Установлено, что МПК вещества Sod 1 для Cryptococcus neoformans 297м 2017 составляет 1 мкг/мл, а в концентрации 16 мкг/мл он ингибирует C. albicans 1582м, A. niger 219 и A. fumigatus 390 м.
Таким образом, способность к продукции антимикотических соединений с высокой и умеренной активностью установлена у трети из всех проверенных экстремофильных изолятов S. alkalinus, что может свидетельствовать о перспективности поиска продуцентов антимикотиков у представителей этого вида. Предварительно были отобраны три штамма этого вида, проявляющие выраженную антифунгальную активность к дрожжевым грибам, в том числе клиническим изолятам – возбудителям инвазивных микозов, которые могут быть рекомендованы в дальнейшем как продуценты новых перспективных препаратов для лечения тяжелых микозов у онкобольных (предположительно, отсутствие нежелательных явлений и побочных токсических эффектов). Выраженное противогрибковое действие в отношении C. neoformans может иметь перспективы также для этиотропной терапии криптококкоза, для которого в терапии сейчас используют амфотерицин В с существенным побочным действием.
Выделенное активное соединение по совокупности выявленных структурных особенностей (молекулярная масса, характер фрагментации при ионизации, соотношение поглощения на определенных длинах волн) может быть предварительно отнесено к группе гликозилированных антимикробных пептидов, обладающих специфичностью действия преимущественно по отношению к грибам-микромицетам. Дальнейшая структурная идентификация будет проводиться комбинацией физико-химических методов: масс-спектрометрия высокого разрешения и спектроскопия ядерного магнитного резонанса (ЯМР).
Культивирование и идентификация изолятов выполнены при финансовой поддержке РФФИ в рамках научного проекта № 20-04-00992 (Георгиева М.Л., Куварина А.Е.). Определение спектра антибиотической активности и МПК индивидуальных соединений при финансовой поддержке РФФИ в рамках научного проекта № 19-34-90088 (Гаврюшина И.А., Садыкова В.С.). ВЭЖХ анализ, выделение индивидуальных метаболитов и первичная структурная характеристика проведена при поддержке проекта РНФ № 18-74-10073 (Рогожин Е.А.).
Список литературы
Schmitt E.K., Hoepfner D., Krastel P. // J. Ind. Microbiol. Biotechnol. 2016. V. 43. № 2. P. 249–260.
Butler M.S., Blaskovich M.A., Cooper M.A. // The J. Antibiot. 2017. V. 70. № 1. P. 3–24.
Imhoff J.F. // Marine Drugs. 2016. V. 14. № 1. P. 19–37.
Ibrar M., Ullah M.W., Manan S., Farooq U., Rafiq M., Hasan F. // Appl. Microbiol. Biotechnol. 2020. V. 104. № 7. P. 2777–2801.
Sato M., Beppu T., Arima K. // Agric. Biol. Chem. 1980. V. 44. № 12. P. 3037–3040.
Wu Y., Shi Y., Zeng L., Pan Y., Huang X., Bian L., Zhu Y., Zhang R., Zhang J. // Food Science Technology International. 2019. V. 25. № 1. P. 3–15.
Yang G., Sandjo L., Yun K., Leutou A.S., Kim G.-D., Choi H.D., Kang J.S., Hong J., Son B.W. // Chemical Pharmaceutical Bulletin. 2011. V. 59. № 9. P. 1174–1177.
Rogozhin E.A., Sadykova V.S., Baranova A.A., Vasilchenko A.S., Lushpa V.A., Mineev K.S., Georgieva M.L., Kulko A.B., Krasheninnikov M.E., Lyundup A.V., Vasilchenko A.V., Andreev Y.A. // Molecules. 2018. V. 23. № 2785. P. 1–12.
Bondarenko S.A., Ianutsevich E.A., Danilova O.A., Grum-Grzhimaylo A.A., Kotlova E.R., Kamzolkina O.V., Bilanenko E.N., Tereshina V.M. // Extremophiles. 2017. V. 21. № 4. P. 743–754.
Бондаренко С.А., Януцевич Е.А., Синицына Н.А., Георгиева М.Л., Биланенко Е.Н., Терёшина В.М. // Микробиология. 2018. Т. 87. № 1. С. 12–22.
Grum-Grzhimaylo A.A, Falkoski D.L., van den Heuvel J., Valero-Jiménez C.A., Min B., Choi I.-G., Lipzen A., Daum C.G., Aanen D.K., Tsang A., Henrissat B., Bilanenko E.N.,de Vries R.P., van Kan J.A.L., Grigoriev I.G., Debets A.J.M. // Mol. Ecol. 2018. V. 27. № 23. P. 4808–4819.
Deshpande G.R., Dhekne V.V., Kulkarni S.B., Biswas S.S., Deo M.D., Ayyangar N.R. // Hindustan Antibiot. Bull. 1986. V. 28. P. 53–62.
Deshpande A.D., Baheti K.G., Chatterjee N.R. // Current science. 2004. V. 87. № 12. P. 1684–1695.
Grum-Grzhimaylo A.A., Debets A.J.M., van Diepeningen A.D., Georgieva M.L., Bilanenko E.N. // Persoonia. 2013. V. 31. P. 147–158.
Baranova A.A., Georgieva M.L., Bilanenko E.N., Andreev Ya A., Rogozhin E.A., Sadykova V.S. // App. Biochem. Microbiol. 2017. V. 53. № 6. P. 703–710.
Baranova A.A., Rogozhin E.A., Georgieva M.L., Bilanenko E.N., Kul’ko A.B., Yakushev A.V., Alferova V.A., Sadykova V.S. // Appl. Biochem. Microbiol. 2019. V. 55. № 2. P. 145–151.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология