Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 54-58
Кинетические свойства НАДФ+-зависимой декарбоксилирующей малатдегидрогеназы из листьев кукурузы
А. Т. Епринцев 1, *, М. О. Гатауллина 1
1 Воронежский государственный университет
394006 Воронеж, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 27.01.2020
После доработки 15.05.2020
Принята к публикации 02.09.2020
Аннотация
В мезофилле листьев кукурузы была обнаружена одна изоформа НАДФ+-зависимой декарбоксилирующей малатдегидрогеназы (КФ 1.1.1.40). Очистка фермента осуществлялась в четыре этапа и включала в себя гомогенизацию, фракционирование сульфатом аммония, гель-фильтрацию на сефадексе G-25 и ионообменную хроматографию на ДЭАЭ-Sephacel. Удельная активность очищенного электрофоретически гомогенного препарата составляла 92 E/мг белка, выход – 15%, а степень очистки – 109. Относительная электрофоретическая подвижность декарбоксилирующей малатдегидрогеназы – 0.1, оптимум pH при катализе прямой и обратной реакций – 8.0. Определены значения констант Михаэлиса для прямой и обратной реакции, которые составили по малату – 5.5 мМ и пирувату – 1.3 мМ. При этом сродство к коферментам значительно различалось. Так, Км по НАДФ+ равнялась 4.5 мМ, а по НАДФН – 0.9 мМ.
Декарбоксилирующая малатдегидрогеназа – малик-энзим (НАДФ+-МЭ, КФ 1.1.1.40), является одним из важнейших ферментов, метаболизирующих малат, который важен для стабилизации величины цитоплазматического рН, контроля апертуры устьиц и повышения устойчивости к избытку алюминия и патогенам [1–3]. Другой продукт реакции НАДФ+-МЭ – пируват, участвует в синтезе таких защитных соединений, как флавоноиды и лигнин, которые определяют устойчивость к таким стрессам, как механическое повреждение и проникновение патогенов. Фермент обеспечивает также необходимым восстановительным коферментом НАДФН при биосинтезе флавоноидов и лигнина [4]. НАДФН имеет решающее значение для таких систем метаболизма активных форм кислорода (АФК), как путь аскорбат-глутатиона и НАДФ+-зависимой тиоредоксинредуктазы, он также необходим для процессов окисления при защите от микроорганизмов [5].
НАДФ+-МЭ экспрессируется небольшим количеством генов. Так, например, для кукурузы и гороха был описан всего один ген НАДФ-МЭ. По данным базы данных NCBI для арабидопсиса он также кодируется всего одним геном.
У млекопитающих были идентифицированы три изоформы: цитозольный НАДФ+-МЭ, митохондриальный НАДФ+-МЭ и митохондриальный НАД(Ф)+-МЭ, который имеет двойную специфичность, проявляющуюся при использовании в качестве кофермента НАД+ и НАДФ+, однако при нормальных условиях этот фермент предпочитает использовать кофермент НАД+ [6].
Цель работы – получение гомогенного препарата НАДФ+-МЭ и изучение его кинетических и регуляторных свойств.
МЕТОДИКА
Объектом исследования служили 10-суточные проростки кукурузы (Zea mays L., сорт Воронежская 76), выращенные гидропонным способом при 25°С. Для выделения мезофильной ткани листья кукурузы (2 г) гомогенизировали в 10 мл 0.1 М трис-HCl буфера, pH 6.5, содержащего 0.01 М MnCl2, 0.04 М ДТТ и 0.04 М ЭДТА. Гомогенат фильтровали через 4 слоя марли и центрифугировали при 3000 g в течение 5 мин. Полученный супернатант представлял собой мезофилл [7].
Активность МЭ в прямой и обратной реакции определяли спектрофотометрически на СФ-2000 (“Ломо”, Россия) по изменению оптической плотности реакционной смеси при 340 нм, свидетельствующей о скорости образования или расходования НАДФН [8, 9]. Определение скорости восстановления пирувата осуществляли в среде, содержащей 100 мМ трис-HCl буфер, рН 6.5, 1.5 мМ пируват и 0.15 мМ НАДФН. Измерение активности фермента в прямой реакции проводили в реакционной среде следующего состава: 100 мМ трис-HCl буфер, рН 6.5, 4 мМ малат и 1 мМ НАДФ+. В качестве кофермента использовали 5 мМ MnCl2. За единицу ферментативной активности НАДФ+-МЭ принимали количество фермента, которое превращало (для обратной реакции) или образовывало (для прямой реакции) 1 мкМ НАДФН за 1 мин при 25°С.
Влияние оксиредуцирующих дегидрогеназ уменьшали понижением pH cреды выделения и определения активности фермента (pH 6.5) и использования MnCl2.
Очистка изоформ фермента на первом этапе включала осаждение белковой фракции супернатанта (мезофилла) сульфатом аммония от 35 до 85% насыщения. Полученный осадок растворяли в 100 мМ трис-HCl буфера, рН 6.5, и для освобождения от низкомолекулярных примесей наносили на колонку (1.5 × 20 см) с сефадексом G-25 (“Pharmacia”, Швеция), уравновешенную тем же буфером. Собранные фракции (1.5 мл), содержащие фермент, наносили на колонку (1.5 × 12 см) с ДЭАЭ-Sephacel (“GE Healthcare”, Швеция), уравновешенную 100 мМ трис-HCl буфером, рН 6.5. Элюцию связавшихся с сорбентом белков проводили линейным градиентом NaCl от 50 до 150 мМ в том же буфере [10, 11].
Электрофорез в 7%-ном полиакриламидном геле (ПААГ) проводили по методу, описанному в работах [12, 13]. На дорожку наносили не более 120 мкг белка.
Специфическое проявление активности малатдегидрогеназы на геле осуществляли тетразолиевым методом [14, 15]. Гели инкубировали в 15 мл 0.1 М трис-НСl-буфера, рН 6.5, содержащем 0.2 мл 2 М малата натрия, 18 мг НАДФ+, 10 мг нитросинего тетразолия, предварительно растворенного в 0.5 мл этиленгликоля, и 0.6 мг феназинметасульфата (ФМС). Локализацию фермента устанавливали по накоплению диформазана.
Гели, на которые наносили 5–7 мкг белка, были также окрашены нитратом серебра [16–18].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При проведении электрофореза в ПААГ в мезофилле листьев кукурузы была обнаружена только одна изоформа НАДФ+-МЭ с относительной электрофоретической подвижностью 0.1 (рис. 1). Активность данного фермента определялась в цитоплазматической фракции мезофилла листьев кукурузы и составляла 98–99% от его общей активности в клетке. Это указывало на субклеточную локализацию НАДФ+-МЭ в цитоплазме.
Рис. 1.
Электрофорез в ПААГ НАДФ+‑МЭ из гомогената мезофилла листьев кукурузы (1), очищенного препарата НАДФ-МЭ, окрашенного нитратом серебра (2) и очищенного препарата НАДФ-МЭ, окрашенного тетразолиевым методом (3).

Для получения высокоочищенных препаратов НАДФ+-МЭ использовали многостадийную схему очистки, результаты которой представлены в табл. 1. При осаждении сульфатом аммония наблюдалось 8-кратное уменьшение содержания общего белка и значительное ингибирование активности фермента. Однако его удельная активность увеличилась до 3.2 Е/мг белка. При обессоливании на сефадексе G-25 удалялись низкомолекулярные примеси, а также сульфат аммония, оказывающий ингибирующее действие на активность фермента. Ионообменная хроматография на ДЭАЭ-Sephacel, используемая на 4 стадии очистки, позволила отделить примеси других белков. Фермент, выделенный с выходом 15% и степенью очистки 109, имел удельную активность 93 E/мг белка (табл. 1).
Таблица 1.
Очистка НАДФ+-зависимого малик-энзима (n = 4; р ≤ 0.05).
| Стадии очистки | Общий объем, мл | Общая актив-ность, Е | Белок, мг |
Удельная активность, E/мг белка | Степень очистки |
Выход, % |
|---|---|---|---|---|---|---|
| Гомогенат | 17 | 39.1 | 46.5 | 0.8 | 1 | 100 |
| Фракционирование сульфатом аммония | 2 | 17.6 | 5.5 | 3.2 | 3.8 | 44 |
| Гель-фильтрация на сефадексе G-25 | 6 | 14.5 | 5.3 | 2.7 | 3.2 | 37 |
| Ионообменная хроматография на ДЭАЭ-Sephacel | 4 | 5.8 | 0.063 | 92 | 109 | 15 |
Электрофоретический анализ полученного препарата НАДФ+-МЭ после проявления нитратом серебра показал присутствие только одного белкового компонента с Rf = 0.1, что свидетельствовало о его гомогенности (рис. 1). После специфического проявления активности НАДФ+-МЭ тетразолиевым методом было установлено, что этот белковый компонент обладал малатдегидрогеназной активностью (декарбоксилирующей).
Для изучения четвертичной структуры белковой молекулы исследуемого фермента использовали метод электрофореза в присутствии денатурирующего агента додецилсульфата натрия (ДДС-Na), который позволял выявить присутствие субъединиц белка [19]. Результаты электрофореза в денатурирующих условиях приведены на рис. 2. Молекулярная масса субъединицы равнялась 54 ± 3.2 кДа, молекулярная масса нативной молекулы НАДФ+-МЭ была определена методом гель-хроматографии на сефадексе G-200 и составила 225 ± 8.4 кДа. Таким образом, можно заключить, что исследуемый фермент (НАДФ+-МЭ) состоял из четырех одинаковых субъединиц, то есть являлся гомотетрамером.
Рис. 2.
Электрофорез в ПААГ в присутствии ДДС-Na НАДФ-МЭ (I) из мезофилла листьев кукурузы (8) и белки-маркеры (II) молекулярной массы: β-галактозидаза – 116 кДа (1), БСА– 66.2 кДа (2), овальбумин – 45 кДа (3), лактатдегидрогеназа – 35 кДа (4), рестриктаза Bsp98l – 25 кДа (5), β-лактоглобулин– 8.4 кДа (6), лизоцим – 14.4 кДа (7).

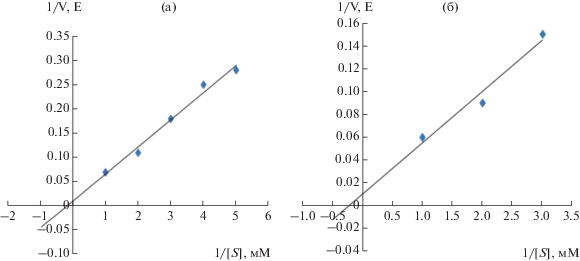
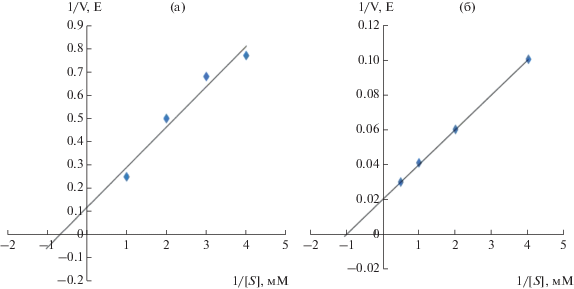
Были изучены каталитические свойства гомогенной НАДФ+-МЭ. Известно, что концентрация субстрата и его сродство с ферментом определяет скорость ферментативной реакции. Исследование процесса восстановления малата высокоочищенной НАДФ+-МЭ позволило доказать, что ферментативная реакция подчиняется закону Михаэлиса-Ментен [14]. Величины констант Михаэлиса для НАДФ+-МЭ, представленные на графиках, составили по малату – 5.5 мМ, НАДФ+ – 4.5 мМ, пирувату – 1.3 мМ и НАДФН – 0.9 мМ (рис. 3 и 4).
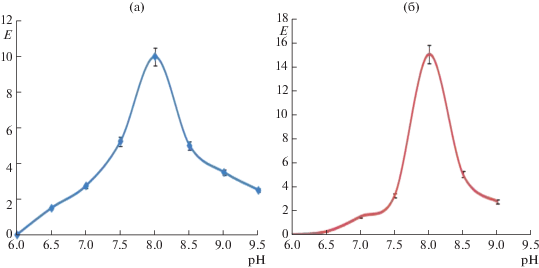
Изучение влияния рН среды на активность НАДФ+-МЭ показало, что оптимум действия фермента в прямой и обратной реакции – рН 8.0 (рис. 5). Следует отметить, что другие формы оксидоредуцирующих малатдегидрогеназ из хлоропластов, пероксисом, митохондрий и цитоплазмы характеризовались оптимальными значениями рН для прямой реакции 9.5, а обратной – 9.0 [20].
Таким образом, использование многостадийной схемы очистки позволило получить электрофоретически гомогенные препараты цитоплазматической декарбоксилирующей малатдегидрогеназы из мезофилла листьев кукурузы. Были исследованы ее физико-химические и каталитические характеристики. Установлено, что фермент представлял собой гомотетрамер, состоящий из четырех одинаковых субъединиц. Обнаружено, что фермент проявлял максимальное сродство по отношению к пировиноградной кислоте. Различные кинетические и каталитические характеристики НАДФ+-МЭ из мезофилла листьев кукурузы свидетельствовали об его участии в катализе различных метаболических процессов.
Исследования выполнены при финансовой поддержке Российского научного фонда (проект № 19-14-00150).
Список литературы
Alfonso S.U., Brüggemann W // Photosynth. Res.2012. V. 112. № 3. P. 175–191.
Vorapreeda T., Thammarongtham C., Cheevadhanarak S., Laoteng K // Microbiology. 2013. V. 159. № 12. P. 2548–2557.
Chang G.G., Tong L. // Biochemistry. 2003. V.42. № 44. P. 12721–12733.
Voll L.M., Zell M.B., Engelsdorf T., Saur A., Gerrard Wheeler M.C., Drincovich M.F., Maurino V.G // New Phytologist. 2012. V. 195. №. 1. P. 189–202.
Maier A., Zell M.B., Maurino V.G. //J. Exp. Bot. 2011. V. 62. № 9. P. 3061–3069.
The National Center for Biotechnology Information. https://www.ncbi.nlm.nih.gov/
Popov V.N., Eprintces A.T., Igamberdiev A.U. // J. Plant Physiol. 2003. V. 160. № 8. P. 851–857.
Eprintsev A.T., Fedorin D.N., Karabutova L.A., Igamberdiev A.U. // J. plant physiology. 2016. V. 205. P. 33–40.
Eprintsev A.T., Fedorin D.N., Dobychina M.A., Igamberdiev A.U. // Plant Science. 2018. V. 272. P. 157–163.
Епринцев А.Т., Попов В.Н. Ферментативная регуляция метаболизма ди- и трикарбоновых кислот в растениях. Воронеж: Изд-во Воронежcкого ун-та, 1999. 192 с.
Igamberdiev A.U., Eprintsev A.T. // Front. Plant Sci. 2016. V. 7. P. 1042. https://dx.doi.org/10.3389%2Ffpls. 2016.01042
Davis B.J., Ornstein L. A New High Resolution Electrophoresis method. N. Y.: Society for the Study at the New York Academy of Medicine, 1959. P. 112–118.
Мауэр Г. Диск-электрофорез. М.: Мир, 1971. 222 с.
Гааль Э., Медьеши Г., Верецкеи Л. Электрофорез в разделении биологических макромолекул / Ред. В.И. Розенгарт М.: Мир, 1982. 446 с.
Fieldes M.A. // Electrophoresis. 1992. V. 13. № 1–2. P. 82–86.
Nesterenko M.V., Tilley M., Upton S.J. // J. Biochem. Biol. 1994. V. 28. № 3. P. 239–242.
Shevchenko A., Wilm M., Vorm O., Mann M. // Anal. Chem. 1996. V. 68. № 5. P. 850–858.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. // J. Biol. Chem. 1951. V. 193. № 1. P. 265–275.
Eprintsev A.T., Fedorin D.N., Cherkasskikh M.V., Igamberdiev A.U. // J. Plant Physiol. 2018. V. 221. P. 81–84.
Епринцев А.Т., Гатауллина М.О. // Прикл. биохимия и микробиология. 2018. Т. 54. № 3. С. 299–303.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология