Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 46-53
Характеристика и свойства комплекса протеолитических ферментов тромболитического действия микромицета Sarocladium strictum
Е. И. Корниенко 1, А. А. Осмоловский 1, *, В. Г. Крейер 1, Н. А. Баранова 1, И. Б. Котова 1, Н. С. Егоров 2
1 Биологический факультет, Московский государственный университет имени М.В. Ломоносова
119234 Москва, Россия
2 Международный биотехнологический центр, Московский государственный университет
имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: aosmol@mail.ru
Поступила в редакцию 26.06.2020
После доработки 14.08.2020
Принята к публикации 02.09.2020
Аннотация
Получен и охарактеризован препарат тромболитических ферментов микромицета Sarocladium strictum 203. Показана выраженная урокиназная активность синтезируемых продуцентом протеиназ. В препарате обнаружено присутствие трех щелочных трипсиноподобных тиолзависимых протеиназ серинового типа с различными изоэлектрическими точками (4.5, 7.2 и 11.8) и близкими значениями молекулярных масс (~35 кДа). Одна из протеиназ (протеиназа III) оказалась негликозилированой, а остальные − гликопротеины. Протеиназы различались по спектру протеолитической активности по отношению к белкам–компонентам тромбов. Предположительно, урокиназная активность ферментов обусловила активирующее действие протеиназ на плазминоген.
В последнее время активно накапливаются сведения о разнообразии строения и функций протеолитических ферментов, а также расширении возможностей их применения, что делает их изучение одним из актуальных направлений в современной энзимологии [1, 2]. Значительный практический интерес представляют протеиназы, которые имеют перспективу применения или уже применяющиеся в медицине, в особенности для лечения или диагностики тромбоэмболических осложнений. В связи с этим активно изучаются, как правило, протеиназы микроорганизмов, особенно мицелиальных грибов, обладающие очевидными биотехнологическими преимуществами перед другими источниками [3].
В последнее время перспективные продуценты протеиназ найдены среди микромицетов, которые относятся к представителям различных эколого-трофических групп: сапротрофов, фито- и энтомопатогенов [4–7]. Однако для применения грибных протеиназ в качестве тромболитиков, как прямого, так и непрямого действия, необходимо учитывать их специфичность к компонентам тромбов и возможные патофизиологические эффекты [8], поэтому сведения о фибринолитической активности протеиназ микромицетов постоянно расширяются и дополняются. К перспективным продуцентам протеиназ направленного действия можно отнести такие новые штаммы микромицетов, как Aspergillus brasiliensis AUMC 9735 [5], A. japonicum KSS05 [9], A. niger [10], A. ochraceus L-1 [11, 12], A. oryzae КSК-3 [13], Arthrobotrys longa 1 [14], Mucor subtilissimus UCP 1262 [15, 16], Neurospora sitophila [17], Paecilomyces tenuipes [18], Sarocladium strictum 203 [19, 20] и Tolypocladium inflatum k1 [21]. Изучение свойств протеаз, продуцируемых большинством из них, показало, что они различаются как по оптимальным параметрам проявления активности, так и по субстратной специфичности.
Протеиназы штамма S. strictum 203 не были ранее изучены, однако было показано, что, наряду с прямой фибринолитической активностью, они способны проявлять активирующее плазминоген действие (непрямая фибринолитическая активность) [19]. Это свойство протеиназ оказалось необходимым для тромболитических препаратов последних поколений [22]. В связи с этим изучение свойств протеиназ этого продуцента представляется важным.
Цель работы – выделение и изучение свойств протеиназ микромицета S. strictum 203, обладающих фибринолитической и активирующей плазминоген активностью.
МЕТОДИКА
Получение препарата внеклеточных протеиназ S. strictum. Для получения препарата протеиназ продуцент культивировали в глубинных условиях в два этапа. На первом этапе культуру микромицета, выращенную на скошенной среде Чапека, переносили в посевную среду и выращивали посевной мицелий (48–72 ч). На втором этапе часть биомассы (10% по объему) переносили в ферментационную среду, выращивание проводили 96–120 ч при температуре 28°C на качалке при 220 об/мин. Среда для биосинтеза ферментов имела следующий состав (в г/л): сахароза – 40.0, К2НРО4 – 4.4, NaNO3 – 19.0 и KNO3 – 2.5, рН 6.5. Среда для посевного мицелия имела тот же состав но концентрация их была уменьшена в 2 раза.
По окончании культивирования культуральную жидкость (КЖ) микромицета отделяли от мицелия центрифугированием при 15 000 g в течение 15 мин при 4°С. Белки из КЖ осаждали двукратным объемом ацетона, охлажденным до –20°С, выдерживали в течение 1 ч при 4°С для формирования осадка, а затем фильтровали. Отфильтрованный осадок высушивали над хлористым кальцием в вакуумном эксикаторе в течение 3 сут.
Выделение внеклеточных протеиназ S. strictum. Для разделения белков, осажденных из КЖ, использовали препаративное изоэлектрофокусирование (ИЭФ) по методу Вестерберга [23]. ИЭФ проводили в колонке объемом 110 мл (“Pharmacia”, Швеция) при напряжении 800 В течение 36 ч при 4°С в широком градиенте рН амфолинов (рН 3.0–10.0) и градиенте сахарозы 0–40%. После проведения ИЭФ собирали на холоде фракции объемом 1.5–2 мл, в которых измеряли рН, содержание белка и активность протеиназ.
Электрофорез в ПААГ и определение белков. Гомогенность белков во фракциях после ИЭФ определяли с помощью электрофореза по Лэммли в 15%-ном ПААГ, в присутствии ДДС-Na [24]. Для окраски гелей использовали 0.08%-ный раствор Кумасси бриллиантового голубого G-250 в 3.5%-ной хлорной кислоте [25]. Для определения молекулярной массы протеиназ использовали набор метчиков Unstained Protein Molecular Weight Marker (“Thermoscientific”, США).
Количественное содержание белка в пробах определяли спектрофотометрически при 280 нм в кювете с длиной пути в 1 см [26]. Для расчета концентрации строили калибровочную кривую по БСА.
Определение фибринолитической (плазминоподобной) и активирующей плазминоген активности методом фибриновых пластин. Фибринолитическую и активирующую плазминоген активность определяли на фибриновых пластинках по модифицированному методу Аструпа–Мюллерца–Лассена [4]. Для приготовления фибриновых пластин смешивали 900 мкл 3%-ного раствора бычьего фибриногена и 200 мкл раствора тромбина (2 мг/мл) в физиологическом растворе. Смесь аккуратно перемешивали и переносили в чашки Петри (d = 9 см). Образование и уплотнение фибринового геля происходило в течение 1 ч при комнатной температуре. После этого часть чашек Петри прогревали в течение 30 мин при 86°С, при этом инактивировали плазминоген. Для измерения фибринолитической и активирующей плазминоген активности на пластины наносили по 30 мкл пробы и инкубировали в течение 4 ч в термостате. Затем на пластинах измеряли площадь зоны лизиса. Разность в размерах зон на непрогретых и прогретых чашках служила показателем способности фермента активировать плазминоген. Данные выражали в усл. ед./мл. За 1 усл. ед. принимали количество фермента, образующего зону гидролиза фибриновой пластины, равную 1 мм2.
Определение протеолитической активности при гидролизе белков-субстратов. В полученном препарате внеклеточных протеиназ и фракциях после ИЭФ проводили реакции казеинолиза, фибринолиза и фибриногенолиза с 1%-ными суспензиями соответствующих белков в 0.05 М трис-HCl буфере, рН 8.2.
Для проведения реакций к 200 мкл фильтрата культуральной жидкости добавляли 400 мкл 1%‑ной суспензии фибрина в 0.05 М трис-HCl буфере, рН 8.2, и инкубировали при постоянном перемешивании в течение 10–30 мин при 37°С [11, 27]. Активность выражали в мкмолях тирозина, образовавшегося в течение 1 мин в 1 мл культуральной жидкости (ЕТир).
Определение протеолитической активности с использованием хромогенных пептидных субстратов. Для определения амидолитической активности выделенных протеиназ проводили инкубацию с 0.05%-ными растворами хромогенных пептидных субстратов (“Chromogenix”, Италия) – п-нитроанилидов, расщепляемых протеиназами системы гемостаза: тромбином – Tos-Gly-Pro-Arg-pNA, плазмином – H-D-Val-Leu-Lys-pNA (S-2251), фактором Xa – Z-D-Arg-Gly-Arg-pNA (S-2765), урокиназой – pGlu-Gly-Arg-pNA (S-2444) и тканевым активатором плазминогена – H-D-Ile-Pro-Arg-pNA (S-2288).
Реакцию проводили в 200 мкл пробы при постоянном перемешивании в течение 5 мин при 37°С, как описано ранее [28]. Оптическую плотность измеряли при 405 нм на спектрофотометре Hitachi 200-20 (“Hitachi”, Япония). За 1 единицу активности (ЕpNA) принимали количество мкмоль п-нитроанилина, образовавшегося в результате гидролиза за 1 мин.
Ингибиторный анализ. В качестве ингибиторов для металлопротеиназ использовали этилендиаминтетраацетат (ЭДТА, 1.1 мг/мл) и о-фенантролин (0.5 мг/мл), цистеиновых протеиназ – п-хлормеркурийбензоат (п-ХМБ, 0.5 мг/мл) и сериновых протеиназ – фенилметилсульфонил фторид (ФМСФ, 0.3 мг/мл), а также ингибиторы химотрипсиноподобных протеиназ – тозилфенилаланилхлорметилкетон (ТФХК, 0.4 мг/мл) и трипсиноподобных протеиназ – тозиллизилаланилхлорметилкетон (ТЛХК, 0.4 мг/мл) и соевый ингибитор трипсина (1.1 мг/мл). При изучении действия ингибиторов молярное соотношение фермент-ингибитор составляло 1 : 10 и 1 : 100 [29]. Начальную и остаточную протеолитическую активность фермента определяли при 37°С после его преинкубации с ингибитором в течение 120 мин при 25°С, как описано выше, и выражали в процентах от контроля (без ингибитора).
Определение рН-оптимума, рН-стабильности, термостабильности и температурного оптимума ферментов. Для изучения рН-стабильности и оптимума рН для действия ферментов использовали 0.4 М натрий-ацетат-фосфат-боратный буфер со значениями рН 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0 и 11.0.
Для определения рН-стабильности 100 мкл пробы и 150 мкл буфера инкубировали в течение 3 ч при 25°С. Затем добавляли 100 мкл раствора хромогенного субстрата урокиназы в 0.05 М трис-HCl-буфере, рН 8.2, и инкубировали еще в течение 5 мин при 37°С. Для определения рН-оптимума 100 мкл пробы ферментов, 150 мкл буфера и 100 мкл раствора хромогенного субстрата урокиназы инкубировали в течение 5 мин при 37°С.
Для измерения термостабильности фермента 50 мкл пробы и 200 мкл 0.05 М трис-HCl-буфера, рН 8.2, инкубировали в течение 3 ч при 25, 30, 37, 45, 55 и 65°С, а затем добавляли 100 мкл раствора хромогенного субстрата урокиназы и инкубировали в течение 5 мин при 37°С. Для измерения температурного оптимума действия фермента 50 мкл пробы, 200 мкл буфера и 100 мкл раствора хромогенного субстрата урокиназы инкубировали в течение 5 мин при соответствующей температуре.
Реакцию останавливали 200 мкл 50%-ной уксусной кислоты, и измеряли поглощение при 405 нм.
Определение углеводного компонента протеиназ. Присутствие в составе выделенных протеаз углеводного компонента выявляли методом дот-блоттинга, инкубируя нанесенные на нитроцеллюлозные мембраны пробы в растворах периодной кислоты и реактива Шиффа (фуксинсернистой кислоты), как описано ранее [30]. В качестве положительного контроля использовали раствор 0.5 мг/мл внеклеточной дрожжевой инвертазы, а в качестве отрицательного – раствор 0.5 мг/мл БСА.
Тромболизис. Для приготовления тромбов во взвешенных пробирках-эппендорфах смешивали 200 мкл плазмы и 20 мкл 0.1%-ного раствора тромбина в 0.1 М трис-HCl-буфере, рН 7.0, и оставляли на 30 мин при 37°С, после чего повторно взвешивали со стабилизированным тромбом. Затем добавляли 250 мкл пробы и инкубировали при перемешивании (250 об./мин) в течение 30, 60 и 90 мин при 37°С. При этом наблюдалось частичное разжижение тромба и отделение его от стенок пробирки. Лизат аккуратно убирали при помощи фильтровальной бумаги и взвешивали остаток вместе с пробиркой. После чего рассчитывали количество, в %, не прогидролизованного тромба [5].
Ферментативные реакции, требующие постоянного перемешивания, проводили в термошейкере TS-100 (“BioSan”, Латвия). Для измерения оптической плотности использовали спектрофотометр BioSpectrometer® kinetic (“Eppendorf”, Германия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Микромицет вида S. strictum (W. Gams) Summerbell был выделен из полифилетичного рода Acremonium в 2011 г. Он принадлежит к анаморфам грибов аскомицетного аффинитета рода Sarocladium, семейства Sarocladiaceae, порядка Hypocreales, класса Sordariomycetes, отдела Ascomycota. Эти грибы занимают различные экологические ниши и выделяются из почвы и растительных остатков. Среди них встречаются фитопатогенные и ассоциированные с другими грибами формы. Штамм S. strictum 203 был выделен из культуры A. longa Mecht. 1 как микофил – перспективный продуцент фибринолитических протеиназ [20].
Изучение в культуральной жидкости S. strictum 203 активности внеклеточных протеиназ по отношению к белковым компонентам тромба и хромогенным пептидным субстратам подтвердило сделанное ранее предположение об их возможности осуществлять реакцию активации плазминогена. Как видно из табл. 1, протеиназы микромицета были способны расщеплять субстраты плазмина, тромбина и фактора Ха, а также проявляли активность активаторов плазминогена: тканевого (по субстрату D-Ile-Pro-Arg-pNA) и урокиназы (по субстрату pGlu-Gly-Arg-pNА). Важно отметить, что в среднем значение активности урокиназы в 1.7 раз превышало значение активности по отношению к другим исследованным субстратам. Можно предположить, что активация плазминогена протеазами S. strictum 203, выявленная ранее, происходила по урокиназному типу. В связи с этим субстрат урокиназы был использован в дальнейшем для определения специфической активности протеиназ продуцента.
Таблица 1.
Активность протеиназ микромицета S. strictum 203 по отношению к хромогенным пептидным субстратам
| Активность | Субстрат | Активность, ЕpNA/мг × 10–3 |
|---|---|---|
| Плазминоподобная | H-D-Val-Leu-Lys-pNA | 30.9 |
| Тромбиноподобная | Tos-Gly-Pro-Arg-pNA | 34.7 |
| Активность тканевого активатора плазминогена | D-Ile-Pro-Arg-pNA | 31.2 |
| Урокиназная | pGlu-Gly-Arg-pNА | 58.7 |
| Фактор Xa-подобная | Z-D-Arg-Gly-Arg-pNA | 32.4 |
Для изучения протеолитического комплекса S. strictum 203 был получен препарат его внеклеточных протеиназ осаждением сульфатом аммония из КЖ гриба. Препарат представлял собой гомогенный порошок желтовато-белого цвета без запаха, хорошо растворимый в воде.
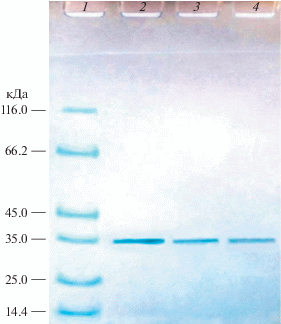
Проведение ИЭФ препарата позволило обнаружить в составе протеолитического комплекса продуцента как минимум 3 протеиназы (обозначенные как протеиназы I, II и III) с pI 4.5, 7.2 и 11.8 (рис. 1). При использовании для определения протеолитической активности во фракциях, полученных после ИЭФ, двух субстратов – казеина и хромогенного пептидного субстрата урокиназы, были отмечены различия в степени их гидролиза различными протеиназами. Так, в отличие от протеиназы III, протеиназы I и II обладали низкой казеинолитической активностью и проявляли большую урокиназную активность (рис. 1). Все выделенные ферменты при проведении электрофореза в ПААГ оказались гомогенными белками с молекулярной массой около 35 кДа (рис. 2), что могло свидетельствовать о том, что они являлись изоферментами. Подобная характеристика была также показана для протеиназ, образующих протеолитические комплексы у других микромицетов [12, 32].
Рис. 1.
Изоэлектрофокусирование препарата протеиназ S. strictum 203; 1 – A280, 2 – активность урокиназы, 3 – рН, 4 – казеинолитическая активность.
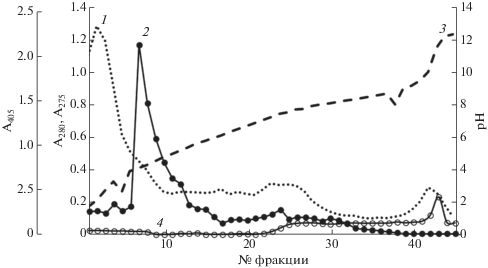
Рис. 2.
Электрофорез в ПААГ в присутствии ДДС–Na протеиназ S. strictum 203 : 1 – белки-маркеры молекулярной массы (сверху вниз : β-галактозидаза, БСА, овальбумин, лактатдегидрогеназа, эндонуклеаза рестрикции Bsp981, бета-лактоглобулин, лизоцим), 2 – протеиназа I, 3 – протеиназа II, 4 – протеиназа III.
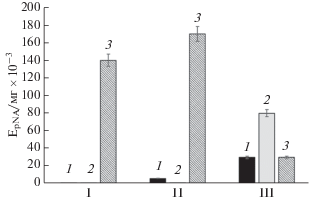
Изучение субстратной специфичности выделенных протеиназ показало, что их активность по отношению к исследуемым субстратам тканевого активатора плазминогена и плазмина различалась. Так, протеиназа I не действовала на эти субстраты, протеиназа II не обладала активностью по отношению к субстрату тканевого активатора плазминогена и слабо гидролизовала субстрат плазмина, а протеиназа III расщепляла оба субстрата (рис. 3). При этом две протеиназы проявляли выраженную урокиназную активность. Наибольшей активностью по отношению к субстрату урокиназы обладала протеиназа II (170.0 ЕpNA/мг × × 10–3). Протеиназа I обладала более узкой субстратной специфичностью с выраженной урокиназной активностью, а протеиназа III проявляла широкую субстратную специфичность. Можно предположить, что урокиназная активность и обусловливала активирующее плазминоген действие.
Рис. 3.
Амидолитическая активность протеиназ S. strictum 203 (I, II и III) по отношению к хромогенным пептидным субстратам плазмина (1), тканевого активатора плазминогена (2) и урокиназы (3).
Методом фибриновых пластин были обнаружены фибринолитическая и активирующая плазминоген активность исследуемых протеиназ (табл. 2). Первые две протеиназы характеризовались высокой фибринолитической (193.6 и 169.8 усл. ед./мг соответственно) и активирующей плазминоген активностью (443.7 и 414.2 усл. ед./мг соответственно). Протеиназа III оказалась более активной (в 3.4 и 1.6 раз соответственно) и гидролизовала субстрат с одинаковой активностью, не проявляя выраженного активирующего плазминоген действия.
Таблица 2.
Фибринолитическая, фибриногенолитическая и активирующая плазминоген активность протеиназ S. strictum 203
| Активность | Значение активности | ||
|---|---|---|---|
| протеиназа I | протеиназа II | протеиназа III | |
| Фибринолитическая, усл. ед./мг | 193.6 | 169.8 | 653.0 |
| Активаторная к плазминогену, усл. ед./мг | 443.7 | 414.2 | 676.4 |
| Фибринолитическая, ЕТир/мг | 40.8 | 30.4 | 191.6 |
| Фибриногенолитическая, ЕТир/мг | 32.6 | 34.6 | 217.7 |
Фибринолитическая и фибриногенолитическая активность у протеиназ I и II была выражена слабо (табл. 2). Протеиназа III проявляла как фибрино- так и фибриногенолитическую активность (191.6 и 217.7 ЕТир/мг).
Для установления класса изучаемых протеиназ был проведен ингибиторный анализ (табл. 3). Наиболее эффективно ингибировал протеиназы I и II соевый ингибитор трипсина в соотношениях фермент : ингибитор, равных 1 : 10 и 1 : 100. Небольшое ингибирующее действие на протеиназу I оказывали ТФХК (ингибитор химотрипсиновых протеиназ) и ФМСФ (ингибитор сериновых протеиназ), а протеиназа II только частично ингибировалась ФМСФ. Протеиназа III ингибировалась соевым ингибитором трипсина и ФМСФ в соотношениях 1 : 10 и 1 : 100. Протеиназы также незначительно ингибировались п-ХМБ, взаимодействующим с тиоловыми группами (табл. 3). Таким образом, можно предположить, что протеиназы S. strictum 203 являются трипсиноподобными тиолзависимыми протеиназами серинового типа.
Таблица 3.
Ингибиторный анализ внеклеточных протеиназ S. strictum 203
| Ингибитор | Молярное соотношение фермент : ингибитор | Остаточная активность, % | ||
|---|---|---|---|---|
| протеиназа I | протеиназа II | протеиназа III | ||
| Контроль (без ингибитора) | – | 100.0 | 100.0 | 100.0 |
| ЭДТА | 1 : 10 | 72.0 | 100.0 | 100.0 |
| 1 : 100 | 78.0 | 92.3 | 100.0 | |
| о-Фенантролин | 1 : 10 | 89.3 | 100.0 | 100.0 |
| 1 : 100 | 90.8 | 100.0 | 100.0 | |
| п-ХМБ | 1 : 10 | 88.9 | 98.1 | 97.2 |
| 1 : 100 | 90.2 | 98.9 | 73.6 | |
| ФМСФ | 1 : 10 | 72.0 | 79.1 | 39.6 |
| 1 : 100 | 60.0 | 53.9 | 32.2 | |
| Соевый ингибитор трипсина | 1 : 10 | 0.0 | 7.3 | 52.2 |
| 1 : 100 | 0.0 | 5.1 | 60.0 | |
| ТФХК | 1 : 10 | 83.6 | 100.0 | 100.0 |
| 1 : 100 | 80.0 | 100.0 | 84.6 | |
| ТЛХК | 1 : 10 | 80.0 | 92.1 | 90.3 |
| 1 : 100 | 57.8 | 100.0 | 90.1 | |
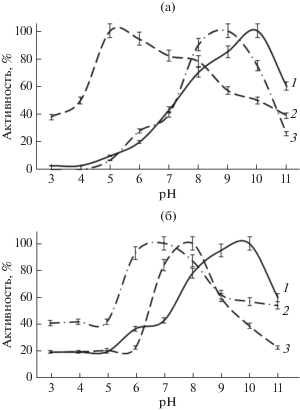
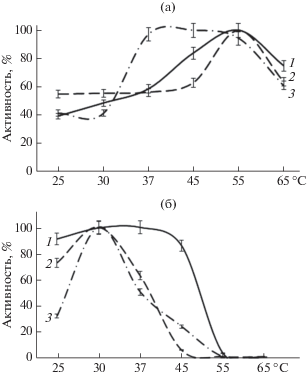
Изучение рН стабильности протеиназ, входящих в состав комплексного препарата, полученного из КЖ микромицета S. strictum 203, показало, что активность протеиназы I наиболее эффективно проявлялась в области щелочных рН (рис. 4), в то время как протеиназы II и III сохраняли высокую активность при нейтральном рН. Активность всех трех протеиназ подавлялась при низких (до 5.0) и высоких (с 11.0) рН. Оптимум рН для протеиназы I находился ~10.0, протеиназа II проявляла одинаково высокую активность в диапазоне рН от 5 до 8, оптимум рН для протеиназы III находился ~8 (рис. 3). Из полученных результатов следовало, что оптимальный рН для действия препарата ферментов нейтральный и слабо щелочной. Такие условия проявления активности ферментов совпадали со значением рН крови человека и предполагают возможность использования в дальнейшем препарата в клинике в качестве тромболитика.
Рис. 4.
Влияние рН на активность (а) и стабильность (б) протеиназы I (1), II (2) и III (3) S. strictum 203.
В результате изучения термостабильности протеиназ микромицета было показано, что протеиназа I проявляла высокую урокиназную активность и была стабильна в течение 3 ч инкубации при 30 и 37°С (рис. 5). Протеиназы II и III проявляли высокую активность после инкубации при 30°С, а после 3 ч инкубации при 55°С все протеиназы инактивировались. Температурный оптимум действия протеиназ I и II составлял 55°С (рис. 4). Протеиназа III была одинаково активна в диапазоне 37–55°С.
Рис. 5.
Влияние температуры на активность (а) и стабильность (б) протеиназы I (1), II (2) и III (3) S. strictum 203.
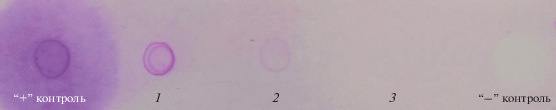
Определение методом дот-блоттинга содержания гликопротеинов реактивом Шиффа в протеиназах, синтезируемых S. strictum 203, показало, что они различались по уровню гликозилирования. На рис. 6 видно, что наиболее гликозилированной оказалась протеиназа I, чуть меньше – протеиназа II. В составе протеиназы III гликозидные компоненты не были обнаружены.
Рис. 6.
Определение углеводного компонента в молекулах протеиназ I (1), II (2) и III (3), синтезируемых S. strictum 203, а также инвертазы дрожжей (“+”, положительный контроль) и БСА (“–”, отрицательный контроль).
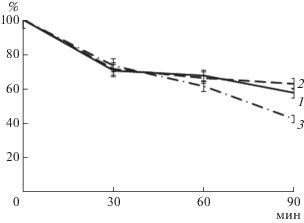
Для изучения способности протеиназ продуцента к тромболизису был изучен гидролиз свежеобразованных тромбов плазмы крови in vitro. Как видно на рис. 7, протеиназа III вносила наибольший вклад в тромболитический потенциал препарата. Так, масса нелизированного тромба после инкубации с ним в течение 90 мин составила 42.9%. Протеиназы I и II вносили меньший вклад в тромболизис, а масса нелизированного тромба при их использовании в течение того же времени составила 58.0 и 63.2% соответственно.
Рис. 7.
Лизис тромба (остаточная масса, %) протеиназами I (1), II (2) и III (3), синтезируемыми S. strictum 203.
Таким образом, установлено, что комплекс внеклеточных протеолитических ферментов S. strictum 203, обладающий тромболитической активностью, представлен тремя щелочными трипсиноподобными тиолзависимыми протеиназами серинового типа с разными изоэлектрическими точками, но близкими значениями молекулярных масс (около 35 кДа). Одна из протеиназ (протеиназа III) оказалась негликозилировановым белком, остальные были гликопротеинами. Спектр протеолитической активности по отношению к белкам – компонентам тромба также оказался различен. Так, протеиназа I обладала более узкой субстратной специфичностью с выраженной урокиназной активностью и невысокой фибрино- и фибриногенолитической активностью, а протеиназа III проявляла широкую субстратную специфичность. Предположено, что урокиназная активность протеаз обусловливала активирующее плазминоген действие. Комплекс ферментов может найти применение в медицинской практике в качестве тромболитического агента.
Список литературы
Bond J.S. // J. Biol. Chem. 2019. V. 294. № 5. P. 1643–1651.
Rani K., Rana R., Datt. S. // Int. J. Curr. Life Sci. 2012. V. 2. № 1. P. 12–18.
Kango N., Jana U.K., Choukade R. Advancing Frontiers in Mycology & Mycotechnology // Eds. T. Satyanarayana, S. Deshmukh, M. Deshpande Singapore : Springer, 2019. P. 515–538.
Шаркова Т.С., Кураков А.В., Осмоловский А.А., Матвеева Э.О., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Микробиология. 2015. Т. 84. № 3. С. 316–322.
Kotb E., Helal G.E.-D.A., Edries F.M. // Biologia. 2015. V. 70. № 12. P. 1565–1574.
Шамрайчук И.Л., Лавренова В.Н., Белозерский М.А., Кураков А.В., Белякова Г.А., Дунаевский Я.Е. // Микология и фитопатология. 2016. Т. 50. № 4. С. 250–256.
Semenova T.A., Dunaevsky Y.E., Beljakova G.A., Belozersky M.A. // Fung. Biol. 2020. V. 124. № 1. P. 65–72.
Yike I. // Mycopathologia. 2011. V. 171. № 5. P. 299–323.
Yadav S., Siddalingeshwara K.G. // J. Drug Deliv. Therap. 2015. V. 5. № 6. P. 60–62.
Aradhye P.K., Chavan M.D. // World J. Pharm. Pharm. Sci. 2015. V. 9. № 9. P. 843–851.
Осмоловский А.А., Рукавицына Е.Д., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Микробиология. 2017. Т. 86. № 4. С. 504–509.
Осмоловский А.А., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Прикл. биохимия и микробиология. 2017. Т. 53. № 4. С. 373–379.
Shirasaka N., Naitou M., Okamura K., Kusuda M., Fukuta Y., Terashita T. // Mycoscience. 2012. V. 53. № 5. P. 354–364.
Шаркова Т.С., Корниенко Е.И., Осмоловский А.А., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Микробиология. 2016. Т. 85. № 2. С. 171–176.
Nascimento T.P., Sales A.E., Porto C.S., Brandão R.M.P., Takaki G.M.C., Teixeira J.A., Porto T.S., Porto A.L.F. // Adv. Enzyme Res. 2015. V. 3. № 3. P. 81-91.
Nascimento T.P., Sales A.E., Porto T.S., Brandão Costa R.M.P., Breydo L., Uversky V.N., Porto A.L.F., Converti A. // Bioprocess. Biosyst. Eng. 2017. V. 40. № 8. P. 1209–1219.
Deng Y., Liu X., Katrolia P., Kopparapu N.K., Zheng X. // Int. J. Biol. Macromol. 2018. V. 109. № 1. P. 1338–1343.
Kim H.C., Choi B.-S., Sapkota K., Kim S., Lee H.J., Yoo J.C., Kim S.-J. // Process Biochem. 2011. V. 46. № 8. P. 1545–1553.
Лукьянова А.А., Корниенко Е.И., Виган П.А., Крейер В.Г., Кураков А.В., Осмоловский А.А. // Вестн. Моск. ун-та. Сер. 16. Биология. 2020. Т. 75. № 1. С. 37–42.
Корниенко Е.И., Кокаева Л.Ю., Биланенко Е.Н., Мокеева В.Л., Шаркова Т.С., Осмоловский А.А. // Микология и фитопатология. 2020. Т. 54. № 3. С. 206–213.
Шаркова Т.С., Матвеева Э.О., Крейер В.Г., Осмоловский А.А., Кураков А.В., Баранова Н.А., Егоров Н.С. // Прикл. биохимия и микробиология. 2016. Т. 52. № 1. С. 38–43.
Collen D., Lijnen R.H. // Thromb. Haemost. 2005. V. 93. № 4. P. 627–630.
Vesterberg O. // Methods in Enzymology. 1971. V. 22. P. 389–412.
Laemly U.K. // Nature. 1970. V. 227. № 5259. P. 680–685.
Holbrook I.B., Leaver A.G. // Anal. Biochem. 1976. V. 75. № 2. P. 634–636.
Gertler A., Trop M. // Eur. J. Biochem. 1971. V. 19. № 1. P. 90–96.
Осмоловский А.А., Попова Е.А., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Вестн. Моск. ун-та. Сер. 16. Биология. 2016. № 1. С. 71–75.
Осмоловский А.А., Звонарева Е.С., Крейер В.Г., Баранова Н.А., Егоров Н.С. // Биоорганическая химия. 2014. Т. 40. № 6. С. 688–694.
Крейер В.Г., Руденская Г.Н., Ландау Н.С., Покровская С.С., Степанов В.М., Егоров Н.С. // Биохимия. 1983. Т. 48. № 8. С. 1365–1373.
Осмоловский А.А., Крейер В.Г., Баранова Н.А., Кураков А.В., Егоров Н.С. // Прикл. биохимия и микробиология. 2015. Т. 51. № 1. С. 86–92.
Summerbell R.C., Gueidan C., Schroers H.-J., de Hoog G.S., Starink M., Arocha Rosete Y., Guarro J., Scott J.A. // Stud. Mycol. 2011. V. 68. № 1. P. 139–162.
Kunert J. // Mycoses. 2001. V. 43. № 7–8. P. 307–310.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


