Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 36-45
Влияние структурных особенностей пектина на комплексообразование с лизоцимом
Ю. А. Антонов 1, *, И. Л. Журавлёва 1
1 Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, Россия
* E-mail: chehonter@yandex.ru
Поступила в редакцию 22.06.2020
После доработки 31.08.2020
Принята к публикации 02.09.2020
Аннотация
Методами динамического светорассеяния, турбидиметрии, оптической микроскопии высокого разрешения, измерения электрофоретической подвижности изучено взаимодействие лизоцима (ЛИЗ) с пектинами, различающимися суммарными или локальными зарядами (с блочным и статистическим распределением метоксильных групп БП и СП). СП 16.2, 38.2, и БП 16.9, 33.1 образуют при pH 5.1, ионной силе I = 0.01, и q < qmах водорастворимые комплексы в диапазоне составов смесей от q ≅ 7 × 10–4 до q = 3.0 × 10–3, где q-соотношение весовых концентраций пектин : ЛИЗ, и водонерастворимые комплексы при q выше 3 × 10–3. Для СП 66.5 и БП 68.2 соответствующие показатели были выше, и составляли от q ≅ 3 × 10–3 до q ≅ 0.01, и q выше 0.01. Комплексы ЛИЗ с БП имели большие размеры (15–20 мкм) при всех изученных степенях метоксилирования (СМ), в то время как средние размеры комплексов с СП существенно меньше (от 0.6 до 3 мкм) и зависели от СМ. Комплексы на основе БП имели гелеобразную морфологию независимо от СМ, тогда как частицы комплекса с СП были как в виде коацерватных капель, так и в виде гелеобразных частиц в зависимости от СМ. Критическое значение ионной силы Iset, выше которого комплексы ЛИЗ с СП и БП не образовывались, составляло 0.11. При этом значения Iset и pHset для систем БП/ЛИЗ не зависело от СМ пектина, для систем СП/ЛИЗ они уменьшались значительно с ростом СМ. Зависимость комплексообразования ЛИЗ с пектином от I носило немонотонный характер с максимумом при I равным 0.03 для СП и 0.06 для БП. Понимание влияния суммарного заряда молекул пектина и его распределения вдоль цепи на его комплексообразование с белком является важным для предсказания стабильности структуры пищевых продуктов.
Пектины и их смеси с другими биополимерами находят широкое применение в фармацевтике, биотехнологии и пищевой индустрии [1]. Являясь полиэлектролитами, они могут взаимодействовать в водных растворах с белками с образованием комплексов белок-пектин [2–4] или подвергаться фазовому разделению концентрированием белка и пектина в разных фазах [5–8]. Термодинамическая совместимость пектина с белками (желатина и рубиско) увеличивается с возрастанием степени метоксилирования (СМ) и локальной плотности заряда пектина [9, 10]. Использование пектина с высокой СМ в качестве флокулянта для таких природных биологических жидкостей, как обезжиренное молоко, молочная сыворотка и клеточный сок листьев зеленых растений, позволяет фракционировать белки молока и зеленых листьев [8], а также получать жидкие концентраты мицелярного казеина [7]. Оказалось, что взаимодействие пектина с белками влияет на фазовое поведение, стабильность и структуру пищевых систем. В связи с этим в последние 20 лет интенсивно исследуется комплексообразование пектинов с белками [11–15]. В частности было установлено, что агрегация этих комплексов, не растворимых в воде, максимальна в условиях стехиометрии зарядов, равной 1, которая соответствует их нейтрализации [12]. В некоторых системах не электростатические взаимодействия пектин/белок усиливают связывание биополимеров в комплекс [16]. В случае пектинов с низкой СМ образующиеся водородные межмолекулярные связи вносят определенный вклад в образование комплексных коацерватов [11]. Гидрофобные взаимодействия между цепями пектина, как правило, незначительны вследствие гидрофильного характера молекулы пектина [11].
Лизоцим (ЛИЗ) относится к хорошо изученным малым глобулярным основным белкам (с молекулярной массой 14.3 kDa) и обладает положительным зарядом в растворах с pH ≤ 10.5. Анализ поверхности его молекулы показал отсутствие на ней областей специфического связывания с полисахаридами [17]. Поскольку системы пектин/ЛИЗ применяются в пищевой промышленности, то изучение образования таких комплексов становится весьма актуальным.
Цель работы – изучение комплексообразования ЛИЗ с пектинами, различающимися суммарными или локальными зарядами, но имеющими близкие молекулярные массы.
МЕТОДИКА
Препараты и приготовление растворов. Лизоцим куриного белка (диализованный и лиофилизованный, “Sigma-Aldrich”, США) использован без дополнительной очистки. В работе использовали пектин с молекулярной массой 56.1 kDa и СМ 95.1% (“Sigma-Aldrich”, Бельгия). Пектины со статистическим распределением метоксильных групп (СП) и разной СМ: 16.2% (СП 16.2), 38.2% (СП 38.2), 66.5% (СП 66.5) и 77.7% (СП 77.7), получены химической модификацией из цитрусового пектина (СМ95.1%) путем титрования 0.1 М NaOH при 4°С до рН 11, как описано ранее [18]. Пектины с блочным распределением метоксильных групп (БП) и разной СМ: 16.9% (БП 16.9), 33.1% (БП 33.1) и 68.2% (БП 68.2), получены энзиматически с применением метилэстеразы. Энзиматическая деэтерификация включала инкубацию пектина (СМ 95.1%) с метилэстеразой при 30°С. Детальная процедура получения СП и БП пектинов описана ранее [18]. Их конечные растворы были оттитрованы до pH 6.0, диализованы(Spectra/Por®, MWCO = 12–14 kDa) против деминерализованной воды в течение 48 ч и высушены лиофильно. Полученные пектины каждой партии были охарактеризованы на содержание СМ, используя ИК-Фурье спектроскопии (FT-IR, “Shimadzu FTIR-8400S”, Япония), как описано ранее [18]. Профиль молекулярно-массового распределения, полученный с помощью эксклюзионной хроматографии, не выявил наличия деполимеризации. Полученная средняя величина молекулярной массы всех образцов пектина была 44.6 ± 3.5 kDa [18]. Во всех экспериментах использовался способ очистки воды на установке Milli-Q. Для получения растворов ЛИЗ и пектина с требуемыми концентрациями навеску биополимеров постепенно добавляли в буфер на основе 0.0079 М уксусной кислоты и 0.1 М NaOH (pH 5.1 и ионная сила I = 0.01) при 23°С и перемешивали в течение 1 ч. Для удаления не растворившихся частиц растворы центрифугировали при 50 000 g в течение 1 ч при 23°C. Концентрацию ЛИЗ определяли по оптическому поглощению растворов, используя коэффициент экстинкции при 281.5 нм, равный 2.64 мл мг−1 см−1 [19], а концентрацию пектина – после высушивания раствора до постоянного веса при 104°C. Для получения смесей пектин/ЛИЗ с различным весовым соотношением (q) полимеров расчитанное количество раствора пектина добавляли к раствору ЛИЗ известной концентрации при 23°С. Изучение влияния pH на комплексообразование пектин/ЛИЗ осуществляли в области значений от 5.0 до 11.0, изменяя рН 0.1–0.5 M NaOH, а влияния I на комплексообразование - изменяя его от 0.01 до 0.5 добавлением 3.5 М NaCl.
Измерение дзета (ς) -потенциала. Измерение ς‑потенциала пектина, ЛИЗ и комплексов пектин/ЛИЗ при разных значениях q, было проведено в прямоугольных кварцевых кюветах на анализаторе 90 Plus particle (“Brookhaven Instruments Inc.”, США) при 23°C. Для каждого образца проводили 10 измерений с последующим определением среднего значения.
Турбидиметрия. Зависимости мутности систем от весового отношения пектин/ЛИЗ (q) получены при 500 нм на спектрометре UV/VIS (“Unico 2800”, США). Погрешность измерения составляла 2–3%. В течение роста q определяли точки, характеризующие процесс комплексообразования и определяющие переходы от отсутствия к образованию водорастворимых комплексов (qOnset), от водорастворимых комплексов к водонерастворимым комплексам (qϕ) и их фазовому разделению, а также точку максимального выхода комплекса (qmax) [16].
Динамическое светорассеяние. Функции “интенсивность светорассеяния – распределение по размерам” для ЛИЗ, пектина и смесей пектин/ЛИЗ определяли в прямоугольных кюветах (1 см) на “MalvernZetasizerNano-ZS” (“Malvern”, Англия), повторяя измерения семь раз. Растворы ЛИЗ перед измерением очищали, пропуская через фильтры DISMIC-25cs (ацетат целлюлозы) c размером пор 0.22 мкм (“Jonsonscientific”, Сингапур). Пектины и их смеси с ЛИЗ использовали без предварительной очистки. Данные по интенсивности светорассеяния обрабатывали по программе, установленной в “Malvern Zetasizer Nano”.
Микроскопия. Микроскопические наблюдения проводили на микроскопе “BX51W1 Olympus” (“Olympus”, Япония), оборудованном видеокамерой высокого разрешения C-8800-21 (1000 × 1000 пиксель, C-8800-21, “Hamamatsu”, Япония).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Величины ς-потенциалов и параметры комплексообразования qOnset, qϕ и qmax. Предварительные эксперименты показали, что абсолютная величина ς-потенциалов пектинов уменьшались линейно с ростом СМ: от –34.1 мВ для CП 16.2 до – 2.8 мВ для СП 95.1 (данные не представлены). При pH 5.1 ЛИЗ имел положительное значение ς = +7.7 мВ, которое практически совпадало с данными литературы [20]. Поэтому логично было полагать, что при смешивании растворов ЛИЗ и пектина может осуществляться комплексообразование этих биополимеров. Зависимость ς-потенциало в системах СП/ЛИЗ от q для различных значений СМ пектина показана на рис. 1. Положительная величина ς для ЛИЗ быстро падала до нулевого значения с добавлением пектина, и поверхностный заряд образовавшихся комплексов становился отрицательным при дальнейшем увеличении q. Полная нейтрализация заряда ЛИЗ наблюдалась при значениях q, равных 0.21, 0.24, 0.3 или 0.51 для систем с СП 16.2, СП 27.8, СП 38.2, СП 66.5 или СП 77.7 соответственно. Полученные результаты свидетельствовали о том, что электростатические взаимодействия представляли основные движущие силы комплексообразования. Смешивание прозрачных растворов пектина и ЛИЗ приводило к быстрому возникновению мутности, если значение q превышало критическую величину qOnset. Зависимость мутности при 500 нм (τ500) от q для систем СП/ЛИЗ и БП/ЛИЗ представлены на рис. 2а–2в. Предварительные эксперименты показали что системы, содержащие пектин с СМ 95.1%, оставались прозрачными во всем изученном интервале q (от 10–4 до 100).
Рис. 1.
Зависимости ζ-потенциала от q смесей СП/ЛИЗ при разных значениях СМ, (1–6), pH 5.1, I = = 0.01, 23°C. Концентрации биополимеров до смешения − 0.3%; 1 – СП 16.2; 2 – СП 27.8; 3 – СП 38.2; 4 – СП 66.5; 5 – СП 77.7; 6 – СП 95.1
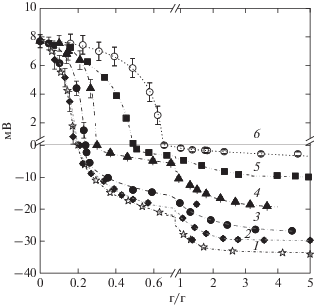
Рис. 2.
Зависимость мутности при 500 нм (τ500) от весового соотношения биополимеров (q) для систем СП16.2/ЛИЗ (2) и БП16.9/ЛИЗ (1, a, a', a''), СП38.2/ЛИЗ (2) и БП33.1/ЛИЗ (1, б, б', б''), и СП66.5/ЛИЗ (2) и БП68.2/ЛИЗ (1, в, в', в'') при pH 5.1, I = 0.01, 23°C. I – область отсутствия комплексообразования. II – область наличия растворимых комплексов. III – область фазового расслоения. IV – область растворимых комплексов. V – область отсутствия комплексообразования. Концентрации биополимеров до смешения = 0.04%.
Основываясь на данных турбидиметрии, можно было выделить несколько областей q, характеризующих различные состояния комплексных систем (рис. 2a', 2a'', 2б', 2б'', 2в', 2в''). Область I характеризовалась отсутствием комплексообразования, а “qOnset” [16] – значение q, начиная с которого образуются растворимые комплексы В области II существовали растворимые комплексы, а точка “qϕ” [16] свидетельствовала о начале образования нерастворимых комплексов. Область III соответствовала фазовому расслоению нерастворимых комплексов. Следующая область IV характеризовалась наличием растворимых комплексов с точкой “$q_{\phi }^{*}$” перехода от нерастворимых комплексов к растворимым. В последней области V комплексообразование отсутствовало, а точка “qset” указывала то значение q, выше которого оно прекращалось.
Поведение смесей напрямую зависело от значений СМ и q и, следовательно, от заряда обоих биополимеров. Зависимости τ500 от q носили экстремальный характер с максимумами τ500, наблюдавшимися для систем БП 16.9/ЛИЗ, БП 33.1/ЛИЗ и БП 68.2/ЛИЗ при qmax = 0.208, 0.246 и 0.369 соответственно, и для систем СП 16.2/ЛИЗ, СП 38.2/ЛИЗ и СП 66.5/ЛИЗ при qmax = 0.206, 0.240 и 0.30 соответственно. Принимая во внимание, что средневесовой молекулярный вес ЛИЗ 14.3 кДа [20] и пектина 44.6 кДа, можно было грубо оценить молярное соотношение ЛИЗ/пектин в комплексной фазе систем СП/ЛИЗ при qmax. Это соотношение составляло ~18 : 1 моль ЛИЗ/моль пектина для системы СП 16.2/ЛИЗ, 15:1 для системы СП 38.2/ЛИЗ и 12:1 для систем СП 66.5/ЛИЗ соответственно. Величина qmax для системы БП 68.2/ЛИЗ, характеризующая в первом приближении стехиометрический состав, оказалась заметно выше (qmax = 0.37), чем для системы СП 66.5/ЛИЗ (qmax = 0.30). Другими словами в составе первых систем содержалось большее количество пектина. Расчет показал, что для ЛИЗ/БП 68.2 молярное отношение составляло 8 : 1 по сравнению с 12 : 1 для системы СП 66.5/ЛИЗ.
Было проведено сравнение величины qmax для систем СП 16.2/ЛИЗ и СП 66.5/ЛИЗ, полученных из данных турбидиметрии, с величинами, определенными на основе отношения зарядов катионных групп ЛИЗ и анионных групп пектина в комплексных смесях. Молекулярный вес образцов пектина составлял 44 600 Да, молекулярный вес галактуроновой кислоты – 194 Да. Образование гликозидных связей сопряженное с образованием молекулы воды, уменьшающей массу на 18 Да, и конверсией незаряженной COOH группы в заряженную карбоксилатную форму, приводящую к дальнейшей потере 1 Да, а у этерифицированных остатков масса метильных групп увеличивалась на 15 Да. Таким образом, эффективное значение молекулярной массы становилось равным 175 Да для заряженных остатков галактуроната и 190 Да для этерифицированной формы. Количество галактуроновых единиц равно 254.8 (44 600 : : 175) для заряженного пектина и 234.7 (44 600 : 190) для этерифицированной формы пектина. С одной стороны, принимая во внимание, что содержание галактуроновой кислоты в образцах пектина составляло 85% [21], а степень ее диссоциации в данных условиях – 0.97 [22], можно получить 176.0 отрицательных зарядов на моль СП 16.2 и 64.8 на моль СП 66.5. С другой стороны, один моль 100% ЛИЗ содержал 129 аминокислотных остатков (или 116.1 аминокислотных остатков в используемом образце, содержащем 90% белка) и включал 3.97 положительных зарядов лизина, 8.86 – аргинина, и 0.75 – гистидина [23], то есть 13.5 положительных зарядов на моль. Таким образом, расчетное молярное отношение компонентов в комплексе в случае чистого электростатического взаимодействия составляло бы 18.8 для системы СП 16.2/ЛИЗ. Расчетное молярное соотношение оказалось равным тому, которое было получено из данных турбидиметрии – 18 моль ЛИЗ/моль пектина. Расчетное молярное соотношение ЛИЗ/пектин для системы СП 66.5/ЛИЗ составило 4.8, что оказалось заметно ниже, чем определенное на основе данных турбидиметрии (12 моль/моль). Можно предположить, что это могло быть вызвано некоторой агрегацией ЛИЗ в частицах СП 66.5/ЛИЗ.
Системы БП 16.9/ЛИЗ и СП 16.2/ЛИЗ характеризовались весьма низкими значениями qОnset и qϕ, равными 7 × 10–4 и 3 × 10–3 для первой системы (рис. 2a, 2a') и 6 × 10–4 и 2.5 × 10–3 для системы СП 16.2/ЛИЗ (данные не показаны). Эти значения возрастали с увеличением СМ пектина и особенно значительно для пектинов с максимальной СМ, которые оказались 3 × 10–3 и 14 × 10–3 для системы БП 68.2/ЛИЗ (рис. 2в, 2в') и 6 × 10–3 и 35 × 10–3 для системы СП 66.5/ЛИЗ (данные не показаны).Полученные данные указывали на то, что ЛИЗ взаимодействовал с пектинами, образуя водорастворимые и водонерастворимые комплексы при очень низких концентрациях последнего. Как следует из приведенных данных, основное различие между системами с СП и БП проявлялось для пектинов с высокой СМ = 66.5–68.1. Величина qmax для системы БП 68.2/ЛИЗ, характеризующая в первом приближении стехиометрический состав комплексов, оказалась заметно выше (qmax = 0.37), чем для системы СП 66.5/ЛИЗ (qmax = 0.30). Другими словами стехиометрический состав первых систем содержит большее количество пектина. Простой расчет показал, что ЛИЗ/БП68.2 молярное отношение составляло 8 : 1 по сравнению с 12 :1 для системы ЛИЗ/СП 66.5.
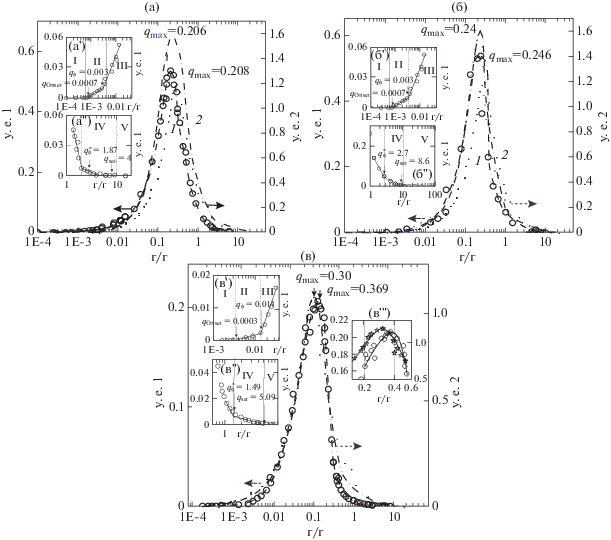
Размеры комплексных частиц. Размер частиц комплекса при разных СМ пектина определяли методом динамического светорассеяния (ДС). Все измерения были проведены при постоянной концентрации биополимеров 0.04 вес. % в области значений q от 0.05 до 1.0. На рис. 3а представлентипичные функции интенсивности светорассеяния от распределения частиц по размерам для раствора СП 16.2 и смесей СП 16.2/ЛИЗ при трех значениях q. Cредний радиус молекулы ЛИЗ составлял 1.9 нм, как было показано в нашей предыдущей публикации [24], что соответствовало литературным данным [25].
Рис. 3.
Зависимость интенсивности светорассеяния в условных единицах (у. е.) от радиуса частиц в нанометрах (нм) для раствора пектина СП16.2 (1) и смесей c СП16.2/ЛИЗ при q 0.05 (2), q 0.1 (3) и q 0.22 (4) и концентрации ЛИЗ = = 0.04%, pH 5.1, 23°C, I = 0.01 (а). Зависимости средних размеров радиусов комплексных частиц в нанометрах (нм) от СМ пектина (%) для систем: СП/ЛИЗ (1) и БП/ЛИЗ (2); радиусы определены для соответствующих данной системе значений qmax.
В бинарных растворах молекулы пектина присутствовали в виде ассоциатов, размеры которых составляли в зависимости от СМ полимера от 104 до 114 нм (рис. 3a, кривая 1). Данные ДС, полученные для смесей СП/ЛИЗ и БП/ЛИЗ с пектином с различной степенью СМ, показали наличие как общих закономерностей, так и значительных различий. Так, в присутствии даже незначительного количества пектина в растворе ЛИЗ (например, при q = 0.05) во всех изученных системах образовывались частицы комплекса большего размера, чем частицы пектина (рис. 3а). При этом средние размеры комплексных частиц зависели как от СМ пектина в смеси, так и от характера распределения метоксильных групп (рис. 3б).
Системы СП/ЛИЗ. Наибольший средний размер частиц комплекса (2030 нм) наблюдался для системы СП 16.2/ЛИЗ. Размеры комплексов уменьшались с возрастанием СМ до 419 нм для системы СП 66.5/ЛИЗ (рис. 3а, 3б). Зависимость интенсивности светорассеяния от q носила экстремальный характер для всех изученных систем с максимальным значением qmax, соответствующим тому, который был найден методом турбидиметрии (рис. 2). С дальнейшим увеличением q размеры частиц комплекса уменьшались и при q $ \gg $ qmax становились равными размерам частиц пектина (данные не представлены). Средние размеры частиц смесей СП 95.1/ЛИЗ были идентичны размерам частиц СП 95.1 (данные не представлены). Это позволило утверждать, что ЛИЗ не взаимодействовал с СП 95.1 с образованием комплексных частиц.
Системы БП/ЛИЗ. При одинаковых степенях СМ частицы комплекса систем БП/ЛИЗ оказались значительно больше, чем систем СП/ЛИЗ (рис. 3б). Можно предположить, что в этом случае комплексы на основе БП более агрегированы, чем комплексы на основе СП. Это могло быть следствием более высокой способности БП к агрегации в кислой среде в присутствии моновалентных ионов, которые индуцируют агрегацию их жестких цепей. Такая агрегация может возникать, например, вследствие кооперативного взаимодействия [26] между блоками в БП, которое более кооперативное, чем в случае СП. Следует отметить, что при одинаковых СМ растворимость БП всегда была меньше, чем СП (данные не приведены).
Морфология комплексных систем. Для анализа морфологии комплексных систем пектин/ЛИЗ была применена микроскопия высокого разрешения. Частицы комплексной фазы систем, содержащих БП, представляли собой гель и имели нерегулярную форму при всех изученных значениях СМ. Морфология типичной комплексной системы БП 68.2/ЛИЗ представлена на рис. 4а. При фиксированном значении q средние размеры таких комплексов значительно возрастали при увеличении концентрации ЛИЗ от 0.04 до 0.4 вес. % (рис. 4в). Морфологии систем СП 16.2/ЛИЗ и СП 38.2/ЛИЗ и БП/ЛИЗ оказалась близкими, но различалась только средними размерами частиц.
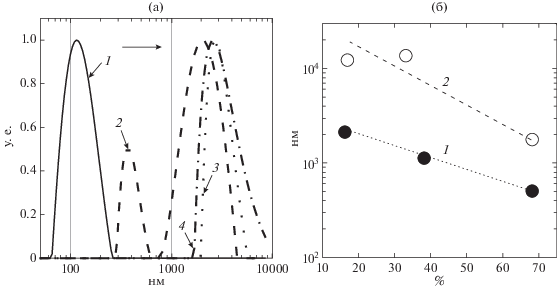
Рис. 4.
Микрофотографии комплексов смесей БП 68.2/ЛИЗ (а, в) и СП 66.5/ЛИЗ (б, г) при значениях q = qmax, pH 5.1, 23°C и I = 0.01; ЛИЗ: (а, б) – 0.04%, а (в, г) – 0.4%. Полная длина изображения – 120 мкм.

Система СП66.5/ЛИЗ, содержащая пектин с высокой степенью метоксилирования, имела жидкие капли комплексного соацервата, то есть морфология ее комплексной фазы, отличалась от других систем (рис. 4б, 4г). Можно предположить, что при низких значениях СМ переход комплексной фазы систем СП/ЛИЗ из гелеобразного состояния к жидкому состоянию при высоких СМ вызывался значительным уменьшением суммарного заряда пектина, которое в значительной степени подавляло межмолекулярные взаимодействия, приводящие к увеличению мобильности в комплексах. Следует отметить, что комплексная коацервация обычно наблюдается в системах белок/слабый полиэлектролит [27].
На рис. 5 в обобщенном виде наглядно показано влияние структурных особенностей СП (а) и БП (б) на их комплексообразование с ЛИЗ.
Рис. 5.
Зависимости qOnset (1) и qϕ (2) от СМ пектина в системе СП/ЛИЗ 90 (а) и qOnset (1) и qϕ (2) от СМ пектина в системе БП/ЛИЗ (б) при pH 5.1, 23°C и I = 0.01.
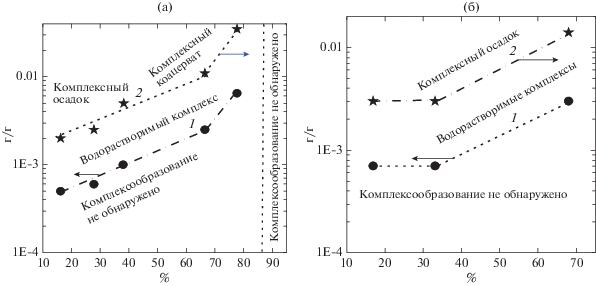
Влияние ионной силы и pH на комплексообразование. Системы СП/ЛИЗ. Зависимость τ500 систем СП/ЛИЗ от pH для разных значений СМ показаны на рис. 6a. Измерения осуществляли при значениях q = qmax, ионной силе I = 0.01 и pH 5.1. Из представленных данных видно, что в области pH от 6.5 до 10.0 мутность систем, содержащих сильно заряженные пектины, изменялась слабо при изменении pH, в то время как мутность систем, содержащих слабо заряженные пектины, значительно уменьшалась с возрастанием pH (рис. 6а). Принимая во внимание, что в данной области значений pH карбоксильные группы пектина полностью ионизированы [22] и положительный заряд ЛИЗ уменьшался монотонно до pH 9–10 [28], можно утверждать, что в этих условиях комплексообразование СП 16.2 с ЛИЗ зависело слабо от заряда ЛИЗ, в то время как комплексообразование высокометоксилированного СП 66.5 – существенно. Другая ситуация наблюдалась при изменении pH от 5.2 до 6.2. В этой области pH ≥ 6.0 молекулы пектина и ЛИЗ становились полностью ионизироваными [22]. Как видно на рис. 6а, комплексообразование пектина с ЛИЗ сильно зависело от степени диссоциации молекул пектина и почти не зависело от его СМ. При возрастании pH от 10.0 до 10.5 заряд ЛИЗ резко падал к нулевому значению [28]. В связи с этим комплексообразование подавлялось даже в случае высокозаряженных пектинов. Минимальное значение pH, при котором величина τ500 становилась равной нулю (pHset), уменьшалось линейно с СМ пектина (рис. 6а'). Это подтверждало электростатический характер межмолекулярного взаимодействия пектина с ЛИЗ и отсутствие заметного влияния на него водородных связей.
Рис. 6.
Зависимость мутности при 500 нм (τ500) смесей СП/ЛИЗ от pH при ионной силе I = 0.01 (a) и при I = 0.01 и pH 5.1(б) для пектинов с СМ от 16.1 (линия 1) до 77.7 (линия 4). Концентрация ЛИЗ = 0.04%, q = qmax. б' – зависимость Iset от СМ пектина.
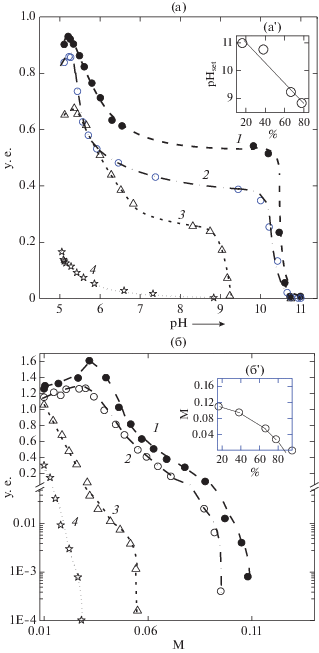
Зависимость τ500 системы СП/ЛИЗ от I при разных значениях СМ пектина представлены на рис. 6б. Для высокозаряженных СП 16.2 и СП 38.2 эта зависимость имела немонотонный характер с максимумом комплексообразования при I ≈ 0.03. Сходная немонотонная зависимость наблюдалась и в случае других белок/полисахарид и белок/полиэлектролит систем, в которых белок характеризовался неравномерным распределением заряда в некоторых участках его поверхности. Такая немонотонная зависимость объяснялась эффектами противоионов солей при экранирующем отталкивании, ослабляющем взаимодействие [29]. Минимальное значение I, выше которого комплексообразование подавлялось (Iset), зависело от общего заряда пектина, что подтверждало электростатический характер комплексообразования. Монотонное изменение зависимости τ500 от I для систем с высокометоксилированными пектинами СП 66.5 и СП 77.7 могло являться следствием действия очень слабых близких сил притяжения, которые экранировали отталкивание между макроионами. Зависимость Iset систем СП/ЛИЗ от СМ пектина представлена во вставке к рис. 6б'. Величина Iset уменьшалась с увеличением СМ, особенно значительно при СМ выше 60%. Отклонение зависимости от линейной при высоких степенях СМ могло быть результатом приближения константы связывания к критической величине, при которой комплексы не образовывались. Можно предположить, что на значение Iset для систем с низко метоксилированными пектинами степень СМ влияла так же, как на qOnset и qф (рис. 5а). Полное подавление комплексообразования при определенных значениях I даже в случае высокометоксилированных пектинов доказывало, что роль образования водородных взаимодействий в комплексообразовании незначительна.
Системы БП/ЛИЗ. Зависимость τ500 систем БП/ЛИЗ от pH для разных значений СМ показаны на рис. 7а. Сравнение полученных данных для систем БП/ЛИЗ и СП/ЛИЗ показало одно принципиально значимое различие между двумя типами систем. Минимальное значение pH, при котором величина τ500 систем БП/ЛИЗ становилась равной нулю (pHset) не зависело от СМ пектина, то есть от суммарного заряда его молекулы, в то время как для систем СП/ЛИЗ значение pHset уменьшалось с ростом СМ. Это позволило констатировать, что основным фактором, определяющим комплексообразование в системах БП/ЛИЗ в щелочной области pH, являлся не суммарный заряд, а агрегация частиц комплекса, управляемая вторичными физическими связями-гидрофобными взаимодействиями и водородными связями. В области значений pH от 5 до 9.5 положительный заряд ЛИЗ уменьшался монотонно с ростом pH [27], при этом карбоксильные группы пектина полностью ионизированы [22]. В связи с этим ожидаемым результатом было бы уменьшение τ500 с увеличением pH. Однако сильная агрегация частиц комплекса в данных условиях увеличивала стабильность комплексов при более высоком значении pH. Природа сил, ответственных за агрегацию частиц комплекса, не вполне ясна.
Рис. 7.
Зависимость мутности при 500 нм (τ500) смесей БП/ЛИЗ от pH при ионной силе I = 0.01 (a) и I = = 0.01 и pH 5.1 (б) для пектинов с СМ (%) от 16.9 до 68.2. Концентрация ЛИЗ = 0.04%, q = qmax. (б) – зависимость Iset от СМ пектина.
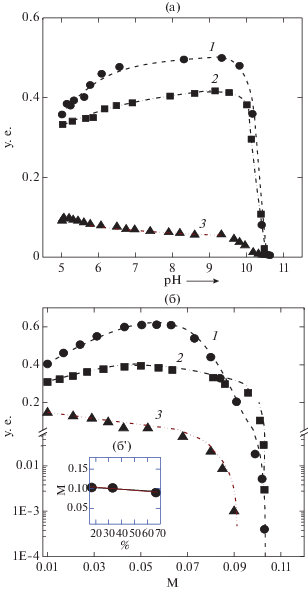
Зависимость τ500 системы БП/ЛИЗ от I при разных значениях СМ пектина представлены на рис. 7б. Одна общая особенность в поведении систем, содержащих СП и БП, заключалась в том, что минимальное значение I, при котором τ500 достигало нулевого значения (Iset = 0.1), было одинаковым для сильно заряженных СП и БП. Для сильно заряженных БП 16.9 and БП 33.1 зависимость τ500 от I носила немонотонный характер с максимумом при I ≈ 0.06. Возможной причиной для небольшого сдвига Imax от 0.03 до 0.06 в случае этих систем БП16.9/ЛИЗ и БП33.1/ЛИЗ могло быть более выраженное экранирование отталкивания вследствие более сильной агрегации в системах БП/ЛИЗ по сравнению с системами СП/ЛИЗ. Такое поведение согласовывалось с образованием больших по размеру частиц комплекса по сравнению с системами на основе СП (рис. 3 и 4).
Таким образом, полученные данные позволили установить общие закономерности и различия во взаимодействии молекул ЛИЗ с пектинами, различающимися суммарной (СП) и локальной (БП) плотностью заряда. Показано, что СП и БП образовывали водорастворимые комплексы в очень узком диапазоне составов смесей (при q от 7 × 10–4 до 1.4 × 10–2) в зависимости от СМ пектина, и водонерастворимые комплексы (при q выше 7 × 10–3 и меньше 1.5–3.8). Оптическая микроскопия показала, что комплексы ЛИЗ с БП имели большие размеры (15–20 мкм) при всех изученных СМ, в то время как средние размеры комплексов с СП оказались существенно меньше (от 0.6 до 3 мкм) и зависели от СМ. Фазовый анализ систем показал, что БП образовывали гелеобразые частицы комплекса независимо от СМ, тогда как СП образовывал как жидкие, так и гелеобразные частицы комплекса в зависимости от СМ. Критическое значение Iset, выше которого комплексы ЛИЗ с СП и БП не образовывались, оказалось равным 0.11. При этом значения Iset и pHset для систем БП/ЛИЗ не зависели от СМ пектина, в то время как для систем СП/ЛИЗ эти значения уменьшались значительно с ростом СМ. Влияние I на комплексообразование ЛИЗ с пектинами имеет немонотонный характер с максимумом при I = 0.03–0.06, соответствующим длине Дебая 1.7 нм, сравнимой с размером молекулы ЛИЗ. Полученные результаты могут быть использованы в процессах переработки белка. Так, при низкой ионной силе молекулы ЛИЗ могут обратимо связывать пектины и высвобождаться из комплекса при добавлении соли. Это позволит использовать данные смеси в биотехнологии в качестве переносчиков ферментов.
Список литературы
May C.D. // Carbohydr. Polym. 1990. V. 12. № 1. P. 79–99.
Serov A.V., Antonov Y.A., Tolstoguzov V.B. // Die Nahrung.1985. V. 29. № 1. P. 19–30.
Tolstoguzov V.B. Functional Properties of Food Macromolecules / Eds. J.R. Mitchell, D. A. Ledward. N, Y.: Elsevier, 1986. P. 385–415.
Tolstoguzov V.B. // Food Hydrocolloids. 1991. V. 4. № 6 P. 429–468.
Antonov Y.A., Grinberg W.Y., Tolstoguzov V.B. // Die Starke. 1975. V. 27. № 12 P. 424–431.
Antonov Y.A., Lozinskaya N.V., Grinberg V.Y., Dianova V.T., Tolstoguzov V.B. // Colloid Polym. Sci. 1979. V. 257. № 11. P. 1159–1171.
Antonov Y.A., Grinberg V.Y., Zhuravskaya N.A., Tolstoguzov V.B. // Carbohydr. Polym. 1982. V. 2. № 1. P. 81–90.
Antonov Y.A., Kiknadze E.V. // Die Nahrung. 1987. V. 31. № 1 P. 57–61.
Antonov Y.A., Lashko N.P., Glotova Y.K., Malovikova A., Markovich O. // Food Hydrocoll. 1996. V. 10. № 1. P. 1–9.
Antonov Y.A., Soshinsky A.A. // Int. J. Biol. Macromol. 2000. V. 27. № 4. P. 279–285.
Girard M., Turgeon S.L., Gauthier S.F. // J. Agric. Food Chem. 2003. V. 51. № 20. P. 6043–6049.
Gummel J., Boue´ F., Deme´ B., Cousin F. // J. Phys. Chem. B. 2006. V. 110. № 49. P. 24837–24846.
Girard M., Sanchez C., Laneuville S.I., Turgeon S.L., Gauthier S.F. // Colloids Surface B: Biointerfaces. 2004. V. 35. № 1. P. 15–22.
Gilsenan P.M., Richardson R.K., Morris E.R. // Food Hydrocoll. 2003. V. 17. № 6. P. 723–737.
Maroziene A., De KruifC.G. // Food Hydrocoll. 2000. V. 14. № 4. P. 391–394.
Carlsson F., Lines P., Malmsten M. // J. Phys. Chem. B. 2001. V. 105. № 38. P. 9040–9049.
van de Weert M., Andersen M.B, Frokjaer S. // Pharm. Res. 2004. V. 21. № 12. P. 2354–2359.
Celus M., Kyomugasho C., Kermani Z.J., Roggen K., Van Loey A.M., Grauwet T., Hendrickx M.E. // Food Hydrocoll. 2017. V. 73. № 1. P. 101–109.
Aune K.C., Tanford C. // Biochemistry. 1969. V. 8. № 11. P. 4579–4585.
Kuehner D.E., Engmann J., Fergg F., Wernick M., Blanch H.W., Prausnitz M. // J. Phys. Chem. B. 1999. V. 103. № 8. P. 1368–1374.
Ngouemazong D.E., Tengweh F.E., Duvetter T., Fraeye I., Van Loey A.,Moldenaers P., Hendrickx M. // Food Hydrocoll. 2011. V. 25. № 4. P. 434–443.
Kohn R. // Carbohydr. Res. 1987. V. 160. № 4. P. 343–353.
Levis J.C., Snell N.S., Hirschmann D.J., Fraenkel-Konrat H. // J. Biol. Chem. 1950. V. 186. № 1. P. 23–36.
Антонов Ю.А., Журавлева И.Л. // Прикл. Биохимия и микробиология. 2019. Т. 55. № 3. Р. 222–230.
Parmar A.S., Muschol M. // Biophys. J. 2009. V. 97. № 2. P. 590–598.
Strȍm A., Schuster E., MengGoh S. // Carbohydr. Polym. 2014. V. 113. № 3. P. 336–343.
De Kruif C.G., Tuinier R. // Food Hydrocoll. 2001. V. 15. № 4. P. 555–563.
Bharti B. // Adsorption, Aggregation and Structure Formation in Systems of Charged Particles: From Colloidal to Supracolloidal Assembly Heidelberg, N.Y., London, Dorfrecht: Springer, 2014. 150 p.
Seyrek E., Dubin P.L., Tribet C., Gamble E.A. // Biomacromolecules. 2003. V. 4. № 2. P. 273–282.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


