Прикладная биохимия и микробиология, 2021, T. 57, № 1, стр. 95-104
Биосенсор на основе послойно иммобилизованных микроорганизмов для определения биохимического потребления кислорода
В. А. Арляпов 1, Н. Ю. Юдина 1, А. В. Мачулин 2, В. А. Алферов 1, О. Н. Понаморева 1, А. Н. Решетилов 2, *
1 Тульский государственный университет
300012 Тула, Россия
2 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук –
обособленное подразделение ФИЦ ПНЦБИ РАН
142290 Московская обл., Пущино, Россия
* E-mail: anatol@ibpm.pushchino.ru
Поступила в редакцию 28.05.2020
После доработки 28.08.2020
Принята к публикации 02.09.2020
Аннотация
Разработан новый подход к формированию рецепторных элементов биосенсоров для определения биохимического потребления кислорода (БПК) путем послойной иммобилизации микроорганизмов. Созданы биорецепторные элементы БПК-биосенсоров на основе выделенных из активного ила бактериальных микроорганизмов Paracoccus yeei, Pseudomonas veronii и Bacillus proteolyticus. Рецепторный элемент был представлен слоями, каждый из которых содержал клетки одного вида. Аналогичный послойный элемент формировали из дрожжевых клеток Ogataea angusta, Blastobotrys adeninivorans, Debaryomyces hansenii. В обоих случаях клетки иммобилизовали в гидрогель поливинилового спирта, модифицированного N-винилпирролидоном. Послойная иммобилизация приводила к повышению чувствительности как дрожжевых, так и бактериальных биосенсоров, что по-видимому, объяснялось отсутствием конкуренции за субстрат внутри слоя и его большей доступностью к каждому из них. Изучено влияние рН, ионной силы, соединений тяжелых металлов в анализируемых пробах на окислительную активность разработанных рецепторных элементов. Определены аналитические и метрологические характеристики биосенсоров. Нижняя граница определяемых значений БПК5 для биосенсора на основе микроорганизмов активного ила составила 0.5 мгО2/дм3, а для биосенсора на основе дрожжей – 0.7 мгО2/дм3. Проведено определение БПК5 образцов воды с использованием разработанных рецепторных элементов. Использование обоих рецепторных элементов позволяло получать результаты с высокой степенью совпадения со стандартным методом. Такие биосенсорные анализаторы могут рассматриваться как прототипы опытных образцов приборов.
В условиях современного интенсивного промышленного производства значительно возросла нагрузка на объекты окружающей среды, что выразилось существенным её загрязнением органическими соединениями. В этой связи возрастающее внимание уделяется экспресс-методам контроля, ориентированным на оценку совокупного воздействия токсикантов на окружающую среду [1]. Одним из параметров, определяющим интегральную загрязненность воды, является индекс биохимического потребления кислорода (БПК). Стандартная методика определения БПК требует инкубирования насыщенной кислородом пробы в течение 5 или 20 сут (БПК5 или БПК20) [2]. В соответствии с мировой практикой эффективным подходом для экспресс-оценки БПК является разработка биосенсоров на основе микроорганизмов, окисляющих широкий круг органических веществ [3]. Для создания биораспознающих элементов БПК-сенсоров используют либо чистые культуры микроорганизмов с определенными потребительскими свойствами (широкий спектр окисляемых субстратов, устойчивость к воздействию негативных факторов окружающей среды), либо ассоциации микроорганизмов (искусственные ассоциации, активный ил) [1, 4].
Использование ассоциаций микроорганизмов позволяет существенно расширить спектр окисляемых субстратов и, соответственно, правильность определения БПК. В то же время БПК-биосенсоры на основе ассоциаций микроорганизмов могут иметь недостаточную стабильность, причиной которой является изменение состава ассоциации с течением времени [5]. Для увеличения числа окисляемых субстратов при сохранении воспроизводимости ответов биосенсора могут быть использованы искусственные ассоциации микроорганизмов, состоящие чаше всего не более чем из 2 или 3 штаммов [3]. Это приводит к расширению субстратной специфичности и стабилизации функционирования сенсора в течение длительного периода времени. Так, в работе [6] для создания БПК-биосенсора использована ассоциация микроорганизмов Trichosporon cutaneum и Bacillus subtilis. Биосенсор был применен для определения БПК в озерной воде и коммунальных стоках и имел время жизни более 40 сут. В работах [7, 8] использованы микроорганизмы Bacillus licheniformis, Dietzia maris и Marinobacter marinus, выделенные из морской воды. Описанный биосенсор мог устойчиво функционировать до 10 мес. и был успешно использован для анализа образцов морской воды. В работе [9] описан микробный биотопливный элемент (БТЭ) для экспресс-определения БПК на основе ассоциации шести культур: Thermincola carboxydiphila, Pseudomonas aeruginosa, Ochrobactrum intermedium, Shewanella frigidimarina, Citrobacter freundii и Clostridium acetobutylicum. БТЭ позволял проводить определение БПК5 в диапазоне 8–240 мг/дм3, что непригодно для анализа поверхностных вод, БПК5 в которых колеблется от 1 до 4 мг/дм3.
БПК – биосенсоры, основанные на сложной микробной популяции, такой, например, которая имеется в активном иле, имеют наилучшую способность к детекции широкого спектра субстратов, однако из-за нестабильности консорциума в течение времени такие биосенсоры дают наименее воспроизводимые результаты. Предложено несколько решений данной проблемы. Так, возможно проведение периодической калибровки биосенсора [1], использование убитого прогреванием препарата активного ила [10] или применение биопленок на основе активного ила или других естественных сообществ [11–13]. Однако, неудобство в работе и техническая сложность данных методов заставляют отказаться от таких подходов.
Несмотря на имеющееся описание БПК-биосенсоров на основе искусственных и природных ассоциаций микроорганизмов в подавляющем большинстве исследований отмечается их невысокая стабильность, а также недостаточная воспроизводимость и чувствительность анализа. В настоящей работе для решения данной проблемы предложена послойная иммобилизация микробных клеток, которая позволяет уменьшить конкуренцию микроорганизмов за субстраты, что приведет к повышению стабильности и чувствительности биораспознающих элементов. Ранее аналогичный подход был эффективно использован для иммобилизации ферментов [14, 15]. Предполагается, что такой способ может быть эффективен и в случае микроорганизмов.
Цель работы − разработка и определение характеристик амперометрического БПК-биосенсора кюветного типа на основе послойно иммобилизованных искусственных и природных ассоциаций микроорганизмов.
МЕТОДИКА
Получение поливинилового спирта, модифицированного N-винилпирролидоном. Для получения поливинилового спирта (ПВС), модифицированного N-винилпирролидоном, использовали 5% водной раствор ПВС марки № 16/1 (“Прайм Кемикалс Групп”, Россия), водный раствор аммоний-церий (IV) нитрата (NH4)2Ce(NO3)6 (ТУ 6-09-4762-84, Россия) в качестве инициатора и N-винилпирролидон (99%, “Acros Organics”, США) в качестве сшивающего агента. Модификацию проводили при постоянном перемешивании в атмосфере азота при температуре 40°С [16].
Изучение структуры геля сканирующей электронной микроскопией. Анализ образцов ПВС, модифицированного N-винилпирролидоном, содержащих клетки микроорганизмов, проводили с помощью сканирующего электронного микроскопа JSM-6510 LV (“JEOL”, Япония) в режиме высокого вакуума при регистрации вторичных электронов.
Культивирование клеток микроорганизмов. Штаммы дрожжей Ogataea angusta ВКМ Y-1397, Debaryomyces hansenii BKM Y-2482 и Blastobotrys adeninivorans ВКМ Y-2677 были получены во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов РАН. Клетки бактерий Paracoccus yeei ВКМ B-3302, Bacillus proteolyticus TD42T и Pseudomonas veronii DSM 11331T были выделены из активного ила очистных сооружений города Тулы [17].
Бактерии культивировали на жидкой глюкозо-пептонной питательной среде, следующего состава (г/л): глюкоза – 10, пептон – 5, дрожжевой экстракт – 0.5 (“Диаэм”, Россия). Дрожжи O. angusta ВКМ Y-1397 культивировали на жидкой дрожжевой питательной среде, следующего состава (г/л): дрожжевой экстракт – 0.1, лейцин – 0.034, глицерин – 1.66, микроэлементы – 0.2 (“Sigma”, США).
Клетки культивировали аэробно 18–20 ч в качалочных колбах объемом 750 см3 при температуре 29°С. Полученную биомассу отделяли центрифугированием при комнатной температуре при 10 000 g 10 мин (центрифуга TG16WS, “Поликом”, Россия). Осадок промывали 20 мМ фосфатным буферным раствором, рН 6.8 (или 7.6 для дрожжей O. angusta ВКМ Y-1397), ресуспендировали в буферном растворе и распределяли по микропробиркам типа Eppendorf, центрифугировали на центрифуге “Eppendorf” (Германия) 5 мин при 10 000 g. Промытую биомассу хранили при температуре – 25°С в микропробирках.
Иммобилизация микроорганизмов в гидрогель модифицированного поливинилового спирта. Для создания биочувствительных элементов на основе бактериальных и дрожжевых штаммов проводили послойную иммобилизацию микроорганизмов в гидрогеле ПВС, модифицированном N-винилпирролидоном. Для получения биокатализатора к 100 мкл гидрогеля добавляли 20 мг клеток микроорганизмов. Равномерного распределения клеток в гидрогеле добивались встряхиванием смеси на центрифуге Sky line Elmi Centrifuge & Vortex CM70M (“ELMI”, Латвия) в течение 5 мин. Полученную суспензию переносили в планшет (d = = 5 мм) и оставляли на 2 ч при 18–22°С. Далее аналогично готовили гидрогель с другими микроорганизмами и наносили полученную суспензию вторым слоем. После нанесения трех слоев геля с клетками рецепторный элемент оставляли на воздухе до полного высыхания. Толщина полученного рецепторного элемента составляла 0.1 мм, а толщина каждого отдельного слоя – около 0.03 мм. Высохший биорецепторный элемент фиксировали на поверхности электрода Кларка с помощью нейлоновой сетки.
Проведение биосенсорных измерений. Электрохимические измерения проводили с использованием анализатора “ЭКСПЕРТ-009" ("Эконикс-Эксперт”, Россия), сопряженного с персональным компьютером, работающим под управлением специализированного программного обеспечения EXP2PR (“Эконикс-Эксперт”, Россия). Измеряемым параметром (ответом биосенсора) являлась максимальная скорость изменения концентрации кислорода при добавлении субстратов (мг/дм3 · с). Преобразователями являлись кислородные электроды типа Кларка, содержащие иммобилизованные клетки микроорганизмов. Измерения выполнялись в кювете объемом 5 мл. Для измерений использовали натрий-калиевый фосфатный буферный раствор (рН = 6.8), суммарная концентрация солей в котором составляла 20 мМ. Раствор перемешивали магнитной мешалкой (200 об./мин). В качестве модельной использовали смесь глюкозы и глутаминовой кислоты в массовом соотношении 1 : 1 (ГГС), которую применяют как стандарт в определении БПК5 в России [18] и международной практике (ISO 5815-1:2019). В соответствии с нормативной документацией принимали, что БПК5, равное 205 мг/дм3, соответствует раствору, содержащему 150 мг/дм3 глюкозы и 150 мг/дм3 глутаминовой кислоты (БПК5 = 0.68 × Сггс).
Определение параметров роста микроорганизмов. Интенсивность роста оценивали по оптической плотности среды. Измерения оптической плотности (ОП) каждые 2 ч в течение 3 сут проводили на фотометре Эксперт-003 (“Эконикс-Эксперт”, Россия) при длине волны 590 нм и толщине кюветы 1 см относительно кюветы с дистиллированной водой. По полученным зависимостям ОП от времени были построены кривые роста микроорганизмов.
Определение БПК5 стандартным методом разбавления. В качестве референтного метода для определения БПК5 был использован метод разбавления. Анализ проводили в соответствии с методикой, указанной в ПНДФ 14. 1:2:3:4. 123-97 [18]. Определение содержания растворенного кислорода в исследуемых пробах выполняли амперометрическим методом в соответствии со стандартной методикой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Разработка рецепторных элементов БПК-биосенсора на основе послойной иммобилизации микроорганизмов в химически модифицированный ПВС. Ранее нами была показана принципиальная возможность создания рецепторного элемента БПК-биосенсора включением ассоциации дрожжевых микроорганизмов в гель ПВС, модифицированного N-винилпирролидоном [19]. Биосенсор на основе ассоциации дрожжей O. angusta, B. adeninivorans и D. hansenii обладал широким спектром окисляемых субстратов и был успешно использован при создании БПК-биосенсора. Однако микробный состав данной ассоциации начинал существенно изменяться после 20 сут функционирования, что существенно затрудняло практическое использование биосенсора на такой основе. Предположили, что решением данной проблемы может быть послойная иммобилизация используемых микроорганизмов, которая позволит снизить конкурентные взаимодействия между микроорганизмами и замедлить вытеснение медленно растущих штаммов со временем (рис. 1). В работе [17] было произведено выделение и идентификация микроорганизмов активного ила очистных сооружений. Отдельные штаммы микроорганизмов были успешно использованы для формирования медиаторного БПК-биосенсора. Возможно, что использование нескольких микроорганизмов активного ила, иммобилизованных послойно, позволит создать биокатализатор, моделирующий окислительные свойства активного ила, используемого в стандартном методе анализа БПК, но обладающего высокой стабильностью состава во времени.
Рис. 1.
Схема послойной иммобилизации дрожжевых микроорганизмов Ogataea angusta, Blastobotrys adeninivorans, D-ebaryomyces hansenii в гель ПВС, модифицированный N-винилпирролидоном.

В качестве носителя для иммобилизации клеток в настоящей работе был использован гидрогель ПВС, модифицированного N-винилпирролидоном. Носитель обладает высокой химической и микробиологической стабильностью, нетоксичен, биосовместим и может быть эффективно использован для иммобилизации как дрожжевых [16, 19] так и бактериальных микроорганизмов [20].
Для разработки рецепторного элемента биосенсора, обладающего высокой чувствительностью, необходимо использовать микроорганизмы с максимальной окислительной активностью. Важным фактором, влияющим на активность микроорганизмов, является время культивирования. Для выбора оптимального времени культивирования используемых бактерий и дрожжей была проанализирована зависимость окислительной активности клеток, составляющих рецепторный элемент, от времени роста (рис. 2). В табл. 1 представлены сводные данные по ростовым параметрам используемых микроорганизмов и оптимальному времени их культивирования.
Рис. 2.
Кривая роста бактерий Bacillus proteolyticus (ОП, 1), полученная фотометрическим методом и зависимость окислительной активности бактерий (мг О2/дм3 c, 2) от времени роста (в качестве субстрата использован раствор ГГС в концентрации 500 мг/дм3).
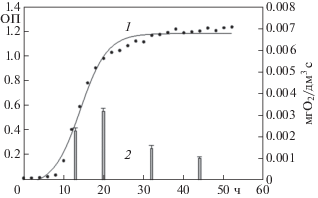
Таблица 1.
Фазы роста и время достижения максимальной окислительной активности исследуемых микроорганизмов
| Штамм | Лаг-фаза, ч | Экспонен-циальная фаза, ч | Фаза линейного роста, ч | Фаза замедления роста, ч | Стационарная фаза, ч | Время максимальной активности, ч |
|---|---|---|---|---|---|---|
| O. angusta BKM Y-1397 |
0–12 | 12–16 | 16–30 | 30–38 | 38–50 | 20 |
| B. adeninivorans BKM Y-2677 | 0–10 | 10–14 | 14–28 | 28–34 | 34–50 | 16 |
| D. hansenii BKM Y-2482 |
0–18 | 18–24 | 24–26 | 26–30 | 30–50 | 24 |
| P. yeei ВКМ B-3302 | 0–16 | 16–22 | 22–26 | 26–32 | 32–52 | 26 |
| P. veronii DSM 11331T | 0–6 | 6–12 | 12–20 | 20–36 | 36–52 | 28 |
| B. proteolyticus TD42T | 0–6 | 6–12 | 12–20 | 20–32 | 32–52 | 20 |
Сравнивая кривые роста, можно отметить, что бактерии P. yeei и дрожжи D. hansenii имели наиболее длительную лаг-фазу (16 и 18 ч соответственно), в отличие от штаммов P. veronii и B. proteolyticus, для которых лаг-фаза составила всего 6 ч. Бактерии имели непродолжительные фазы экспоненциального и линейного роста и уже к 20–26 ч после посева достигали фазы замедления роста. У дрожжей фазы роста более длительны. Наибольшую окислительную активность, измеренную с использованием биосенсорного подхода, бактерий P. yeei, P. veronii и B. proteolyticus наблюдали в начале фазы замедления роста на 26, 28 и 20 ч соответственно. У дрожжей наибольшая активность по отношению к ГГС наблюдали в начале и середине фазы линейного роста. Для дальнейшей работы были отобраны микроорганизмы, культивируемые до времени наибольшей окислительной активности (табл. 1).
Структуры полученных послойной иммобилизацией рецепторных элементов исследовали методом сканирующей электронной микроскопии (рис. 3).
Рис. 3.
СЭМ фотографии рецепторных элементов, полученных послойной иммобилизацией дрожжевых микроорганизмов в гидрогель поливинилового спирта, модифицированного N-винилпирролидоном. а – рецепторный элемент до нанесения на электрод в разрезе; б – матрица модифицированного ПВС с иммобилизованными микроорганизмами после набухания в буферном растворе (показан слой с дрожжами D. hansenii).

В результате модификации поливинилового спирта N-винилпирролидоном формируется гидрогель сетчатой структуры, размер пор которого варьировался от 1 до 3 мкм (рис. 3). При включении в матрицу бактериальных клеток (диаметр бактерий активного ила 0.5–1.0 мкм) или дрожжей (диаметр 2–4 мкм) происходило их равномерное распределение по всему объему носителя. На рис. 3б показано, что после проведения процесса иммобилизации дрожжи D. hansenii включены в состав матрицы, а сама матрица имела достаточно пористую структуру, что способствовало доступу кислорода и органических веществ к клеткам и выведению продуктов метаболизма. Таким образом, полученная матрица с послойно иммобилизованными с микроорганизмами могла быть эффективно использована для создания БПК-биосенсора.
Определение влияния негативных факторов на окислительную способность созданных послойных биокатализаторов. Сточные воды промышленных предприятий могут содержать не только органические соединения, окисляемые микроорганизмами в составе биорецептора, но и неорганические вещества, оказывающие негативное влияние на окислительную активность микроорганизмов. Поэтому при разработке биосенсора для определения БПК важным является изучение влияния негативных факторов окружающей среды на его работу. Для биорецепторов на основе двух послойно иммобилизованных ассоциаций микроорганизмов было исследовано влияние pH среды, ионной силы и ионов тяжелых металлов на окислительную активность.
Показано, что максимальный ответ биосенсоров на основе всех сформированных биорецепторных элементов наблюдался в интервале рН 6.6–7.2, что было приемлемым для анализа большинства образцов воды (рис. 4). Влияние ионной силы среды и некоторых ионов тяжелых металлов на выбранные микроорганизмы представлено в табл. 2.
Рис. 4.
Зависимость окислительной активности биокатализаторов (мг О2/дм3 c) на основе послойно иммобилизованных микроорганизмов от pH среды: а – рецепторный элемент на основе дрожжей O. angusta, B. adeninivorans, D. hansenii; б – рецепторный элемент на основе бактерий P. yeei, P. veronii и B. proteolyticus.
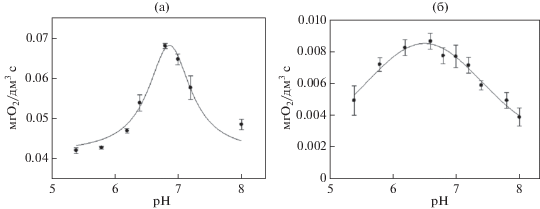
Таблица 2.
Влияние состава исследуемых проб на окислительную способность иммобилизованных микроорганизмов
| Ион металла (ПДК) |
Снижение ответа биосенсора, % | |||
|---|---|---|---|---|
| на основе ассоциации бактерий активного ила | на основе ассоциации дрожжей | |||
| 10 ПДК | 100 ПДК | 10 ПДК | 100 ПДК | |
| Cu2+ (0.001 мг/дм3 ) | 45 ± 3 | 48 ± 7 | 6 ± 1 | 51 ± 4 |
| Pb2+ (0.006 мг/дм3) | 36 ± 2 | 41 ± 6 | 51 ± 3 | 88 ± 7 |
| Zn2+ (0.01 мг/дм3 ) | 31 ± 2 | 59 ± 8 | 3 ± 1 | 64 ± 5 |
| Ni2+ (0.01 мг/дм3 ) | 24 ± 2 | 48 ± 5 | 26 ± 2 | 88 ± 6 |
| Fe3+ (0.1 мг/дм3 ) | 33 ± 3 | 73 ± 8 | 24 ± 1 | 75 ± 7 |
| ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }}$ (0.02 мг/дм3) | 54 ± 4 | 71 ± 8 | 15 ± 1 | 74 ± 8 |
| Bi3+ (0.1 мг/дм3) | 43 ± 3 | 56 ± 5 | 24 ± 1 | 75 ± 5 |
| Co2+ (0.1 мг/дм3) | 39 ± 3 | 47 ± 5 | 19 ± 2 | 66 ± 3 |
| Массовая доля NaCl, % | Влияние NaCl на окислительную активность биоматериала | |||
| 5 | 64 ± 7 | 39 ± 2 | ||
| 10 | 100 | 61 ± 3 | ||
| 20 | 100 | 67 ± 4 | ||
В ходе эксперимента была исследована способность клеток окислять ГГС при различных концентрациях NaCl (от 0.5 до 25%). Из данных литературы известно, что дрожжи D. hansenii и B. adeninivorans относятся к галотолерантным видам дрожжей, что подтверждается полученными результатами. Снижение окислительной активности ассоциации дрожжей на 61% при солености среды, составляющей 10%, по-видимому, связано с чувствительностью дрожжей O. angusta к присутствию соли. Бактерии активного ила не обладают эффективной системой регуляции внутриклеточного осмотического давления. Использование полученного рецепторного элемента для определения БПК воды с повышенным содержанием солей нежелательно. Ассоциация дрожжей подвержена более сильному влиянию ионов тяжелых металлов, чем отдельный штамм D. hansenii [16], что может быть связано с наблюдаемым резким снижением дыхательной активности дрожжей O. angusta и B. adeninivorans. Наибольшее влияние на дыхательную активность иммобилизованных бактерий активного ила оказывало присутствие ионов ${\text{C}}{{{\text{r}}}_{2}}{\text{O}}_{7}^{{2 - }}$ и Fe3+. Необходимо отметить, что бактерии активного ила гораздо сильнее подвержены влиянию условий окружающей среды, чем ассоциация дрожжей, что необходимо учитывать при практической реализации экспресс-анализатора БПК. Рецепторный элемент на основе бактерий активного ила не подойдет для практического использования, например, при анализе морской воды или сточных вод металлургических комбинатов.
Определение характеристик БПК-биосенсора на основе разработанного рецепторного элемента. При разработке рецепторного элемента биосенсора для определения БПК предпочтительно использовать клетки микроорганизмов, обладающие широкой субстратной специфичностью. Широкая субстратная специфичность при этом является преимуществом, так как приводит к повышению точности результатов анализа БПК.
В работе была проведена оценка субстратной специфичности созданных послойной иммобилизацией рецепторных элементов по 35 субстратам, относящимся к различным классам органических соединений. В качестве субстратов были выбраны преимущественно легкоокисляемые органические вещества, попадание которых в водоемы приводит к существенному снижению уровня растворенного кислорода и дальнейшей эвтрофикации водных экосистем. На рис. 5 приведены результаты исследования субстратной специфичности биосенсора на основе созданных рецепторных элементов.
Рис. 5.
Субстратная специфичность биосенсоров на основе ассоциации дрожжей (I), микроорганизмов активного ила (II), иммобилизованных в матрицу ПВС, модифицированного N-винилпирролидоном (концентрация субстратов 0.04 моль/дм3): 1 – метанол, 2 – этанол, 3 – пропанол-1, 4 – бутанол-1, 5 – 2-метилпропанол-1, 6 – 2-метилпропанол-2, 7 – 3-метилбутанол-1, 8 – пропантриол-1,2,3, 9 – сорбит, 10 – ксилоза, 11 – глюкоза, 12 – галактоза, 13 – манноза, 14 – фруктоза, 15 – сахароза, 16 – лактоза, 17 – метаналь, 18 – метановая кислота, 19 – этановая кислота, 20 – этандиовая кислота, 21 – пропандиовая кислота, 22 – лимонная кислота, 23 – ЭДТА, 24 – бензоат калия, 25 – 4-нитрофенол, 26 – 2,4-динитрофенол, 27 – глицин, 28 – серин, 29 – глутамин, 30 – тирозин, 31 – аспаргиновая кислота, 32 – глутаминовая кислота, 33 – аргинин (солянокислый), 34 – ДДС натрия, 35 – ДДБС натрия.

Оба рецепторных элемента созданных послойной иммобилизацией окисляли вещества всех представленных классов органических соединений: спирты, углеводы, карбоновые кислоты, аминокислоты, нитрофенолы и поверхностно-активные вещества, которые могут быть обнаружены в сточных водах. Ценным с практической точки зрения был факт наличия ответов на додецилсульфат натрия, додецилбензосульфат натрия (компоненты моющих средств) и нитрофенолы (распространенные промышленные токсиканты), а также отсутствие токсического действия данных субстратов при кратковременном воздействии на иммобилизованные бактерии и дрожжи. Ассоциация дрожжевых микроорганизмов не способна окислять метаналь и трет-бутанол, в отличие от ассоциации бактерий активного ила, которая окисляла все протестированные субстраты. Однако, в целом спектр окисляемых субстратов обоих используемых биорецепторов намного шире аналогов (10 субстратов) [21] и сопоставим с ранее разработанным рецепторным элементом на основе смеси микроорганизмов (33 субстрата) [19]. Полученные результаты позволяют предположить, что при определении БПК5 в образцах воды различного происхождения (промышленные, бытовые, синтетические сточные воды) можно получить высокую степень корреляции между показаниями созданных биосенсоров и стандартным методом.
Для разработанных биосенсоров были получены градуировочные зависимости отклика биосенсора от БПК5 в измерительной кювете (рис. 6).
Рис. 6.
Зависимость ответов (мг О2/дм3 c) разработанных биосенсоров от БПК5: 1 – ассоциация дрожжей, 2 – микроорганизмы активного ила.
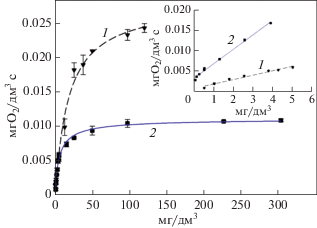
Биорецепторы на основе целых клеток микроорганизмов являются рецепторами каталитического типа, так как биологический ответ в таких системах обеспечивается ферментативными реакциями микроорганизмов. В связи с этим зависимости, приведенные на рис. 6, хорошо аппроксимируются уравнением типа Михаэлиса-Ментен:
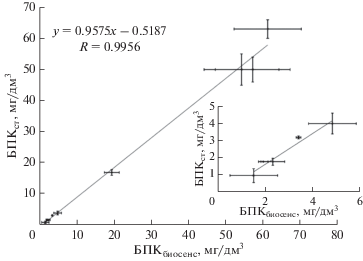
где Rmax – максимальная скорость потребления кислорода иммобилизованными микроорганизмами, достигаемая при [S] → ∞, KM – эффективная константа Михаэлиса, то есть концентрация субстрата, при которой R = Rmax/2.Рис. 7.
Корреляция данных, полученных стандартным методом (БПКст, мг/дм3) и с помощью биосенсора на основе бактерий активного ила (БПКбиосенс, мг/дм3), послойно иммобилизованных в гидрогель модифицированного ПВС (на врезке – начальный участок корреляционной зависимости).
Для снижения ошибок анализа, как правило, ограничиваются использованием линейного участка градуировочной зависимости, ограниченного сверху константой KM. Нижняя граница линейного участка соответствует нижней границе определяемых значений БПК5. Она рассчитывалась статистическим методом, исходя из критерия значения относительного стандартного отклонения результатов измерения (Sr(C)) < 0.33. В табл. 3 представлены основные аналитические и метрологические характеристики созданных биосенсоров в сравнении с аналогами. Определение характеристик разработанного биосенсора проводили с использованием модельной смеси ГГС.
Таблица 3.
Основные характеристики БПК-биосенсоров на основе разработанных послойной иммобилизацией рецепторных элементов
| Характеристика | Микроорга-низмы активного ила (послойно) |
Ассоциация дрожжей (послойно) |
Ассоциация дрожжей [19] | Активный ил [22] | Активный ил [23] |
|---|---|---|---|---|---|
| Диапазон определяемых значений БПК5, мг О2/дм3 | 0.51–3.80 | 0.7–21 | 2.4–80 | 25–200 | 2–64 |
| Коэффициент чувствительности × 10–5, с–1 | 120 ± 20 | 70 ± 4 | 10 ± 2 | – | – |
| Долговременная стабильность, сут | 52 | 34 | 17 | 30 | 60 |
| Операционная стабильность, % (n = 15) | 9.5 | 6.6 | 8.9 | 5.0 | 2.1 |
| Время анализа, мин | 5–12 | 5–12 | 5–7 | 5–15 | – |
Таким образом, использование подхода послойной иммобилизации для дрожжей O. angusta, B. adeninivorans, D. hansenii позволило улучшить основные характеристики биосенсора, по сравнению с аналогом на основе смешанных культур [19]. Так, нижняя граница определяемых величин БПК5 снизилась в 3.5 раз, а стабильность во времени выросла с 17 сут до 34. Некоторое снижение верхней границы определяемых концентраций БПК5 в данном случае не является серьезным недостатком, так как БПК анализируемой пробы всегда может быть снижено путем ее разбавления. Разработанный БПК-биосенсор на основе послойно иммобилизованных микроорганизмов активного ила превосходит известные аналоги [22, 23] на порядки по чувствительности, не уступает по времени определения и операционной стабильности, но отличается более узким диапазоном определяемых содержаний БПК.
Анализ образцов воды. Проведен анализ образцов воды с использованием разработанных биосенсоров и стандартным методом разбавления. В качестве проб были взяты сточные воды городских очистных сооружений, отобранные на разных стадиях очистки, сточные воды пищевого комбината, природные воды, в том числе вода из прудов и реки в пределах городской зоны. Отбор проб и определение БПК5 стандартным методом разбавления проводили согласно действующим в РФ нормативным документам [18]. При определении БПК5 образцов сточных вод с использованием разработанного биосенсора пробы предварительно разбавляли. Величина разбавления подбиралась таким образом, чтобы ответ сенсора находился внутри линейного участка калибровочной зависимости (табл. 3). На рис. 7 показана корреляция между значениями БПК, определенными с помощью биосенсора на основе послойно иммобилизованных бактерий активного ила и значениями БПК, определенными стандартным методом разбавления.
Таким образом, значения БПК5, определенные с помощью созданных биосенсоров совпадали со значениями БПК5, полученными по стандартной методике с учетом доверительного интервала. Для биосенсора на основе послойно иммобилизованных дрожжей коэффициент корреляции составил R = 0.9992, для послойно иммобилизованных микроорганизмов активного ила R = 0.9956. Корреляция со стандартным методом для созданных биосенсоров выше, чем для большинства описанных ранее аналогов [1, 24, 25].
Таким образом, разработан новый подход к формированию рецепторных элементов БПК-биосенсоров, состоящий в послойной иммобилизации микроорганизмов в биорецепторе. Показано, что использование такого подхода и для дрожжей O. angusta, B. adeninivorans, D. hansenii позволило улучшить основные характеристики биосенсора, по сравнению с аналогом на основе смешанных культур. Эффект улучшения основных характеристик биосенсора может объясняться отсутствием внутрислоевой конкуренции за субстрат и облегченной доступности к каждому из клеточных слоев. Разработанный БПК-биосенсор на основе послойно иммобилизованных микроорганизмов активного ила P. yeei, P. veronii и B. proteolyticus превосходил известные аналоги на порядки по чувствительности, не уступал по скорости анализа и операционной стабильности. Биосенсоры на основе обоих рецепторных элементов обладали высокой чувствительностью и позволяют анализировать образцы воды категории “чистая”. Полученные результаты свидетельствуют о возможности использования разработанных биосенсорных анализаторов как прототипов опытных образцов приборов для серийного применения.
Исследование выполнено в рамках Государственного задания Министерства образования и науки РФ № FEWG-2020-008.
Список литературы
Jouanneau S., Recoules L., Durand M.J., Boukabache A., Picot V., Primault Y., Lakel A., Sengelin M., Barillon B. // Water Res. 2014. № 49. P. 62–82.
Готовцев А.В., Данилов-Данильян В.И., Никаноров А.М. // Водные ресурсы. 2012. Т. 39. № 5. С. 510–520.
Понаморева О.Н., Арляпов В.А., Алферов В.А., Решетилов А.Н. // Прикл. биохимия и микробиология. 2011. Т. 47. № 1. С. 5–15.
Abrevaya X.C., Sacco N.J., Bonetto M.C., Hilding-Ohlsson A., Cortón E. // Biosen. Bioelectron. 2014. V. 63. P. 580–590.
Rodriguez-Mozaz S.L., López de Alda M.J., Barcelo D. // Analyt. Bioanalytical. Chem. 2006. V. 386. № 4. P. 1025–1041.
Jianbo J., Tang M., Chen X., Qi L., Dong S. // Biosen. Bioelectron. 2003. V. 18. № 8. P. 1023–1029.
Lin L., Xiao L.-L., Huang S., Zhao L., Cui J.-S., Wang X.-H., Chen X. N. // Biosen. Bioelectron. 2006. V. 21. № 9. P. 1703–1709.
Jiang Y., Xiao L.-L., Zhao L., Chen X., Wang X., Wong K.-Y. // Talanta. 2006. V. 70. № 1. P. 97–103.
Hsieh M-C, Chung Y-C. // Environ. Technol. 2014. V. 35. № 17. P. 2204–2211.
Tan T.C., Lim E.W.C. // Sens. Act. B. 2005. V. 107. № 2. P. 546–551.
Bonetto M.C., Sacco N.J., Ohlsson A.H., Cortón E. // Talanta. 2011. V. 85. № 1. P. 455–462.
Liu C., Li Z., Jiang D., Jia J., Zhang Y., Chai Y., Cheng X., Dong S. // Sensing and Bio-Sensing Research. 2016. V. 8. P. 8–13.
Jordan M.A., Welsh D.T., Peter R. // Water Res. 2010. V. 44. № 20. P. 5981–5988.
Liu D-M., Dong C. // Process Biochem. 2020. V. 92. P. 464–475.
Guedidi S., Yurekli Y., Deratani A., Déjardin P., Innocent C., Altinkaya S. A., Yemenicioglu A. //J. Membr. Sci. 2010. V. 365. №. 1-2. P. 59-67.
Arlyapov V.A., Yudina N. Yu., Asulyan L.D., Alferov S.V., Alferov V.A., Reshetilov A.N. // Enzyme Microb. Technol. 2013. № 53. P. 257–262.
Харькова А.С., Арляпов В.А., Туровкая А.Д., Автух А.Н., Стародумова И.П., Решетилов А.Н. // Прикл. биохимия и микробиология. 2019. Т. 55. № 2. С. 199–209.
Количественный химический анализ вод. Методика выполнения измерений биохимической потребности в кислороде после n-дней инкубации (БПКполн) в поверхностных пресных, подземных (грунтовых), питьевых, сточных и очищенных сточных водах. ПНДФ 14. 1:2:3:4. 123-97. М.: 1997. 25 с.
Yudina N.Yu., Arlyapov V.A., Chepurnova M.A., Alferov S.V., Reshetilov A.N. // Enzyme Microb. Technol. 2015. V. 78. P. 46–53.
Алферов С.В., Арляпов В.А., Алферов В.А., Решетилов А.Н. // Прикл. биохимия и микробиология. 2018. Т. 54. № 6. С. 637–643.
Commault A.S., Lear G., Bouvier S., Feiler L., Karacs J., Weld R.J. // Biochem. Eng. J. 2016. V. 109. P. 88–95.
Chen J., Zhang L., Wang J. // Biomed. Environment. Scie. 2007. V. 20. № 1. P. 78.
Liu L., Zhai J., Zhu C., Gao Y., Wang Y., Han Y., Dong S. // Biosens. Bioelectron. 2015. V. 63. P 483–489.
Zaitseva A.S., Arlyapov V.A., Yudina N.Yu., Alferov S.V., Reshetilov A.N. // Enzyme Microb. Technol. 2017. V. 98. P. 43–51.
Raud M., Tenno T., Jogi E., Kikas T. // Enzyme Microb. Technol. 2012. V. 4–5. № 50. P. 221–226.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


