Прикладная биохимия и микробиология, 2020, T. 56, № 5, стр. 428-435
Полимерные гидрогели для контролируемого выделения инсулина
И. Л. Валуев 1, Л. В. Ванчугова 1, Л. И. Валуев 1, *
1 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Россия
* E-mail: ivaluev@ips.ac.ru
Поступила в редакцию 14.02.2020
После доработки 12.03.2020
Принята к публикации 22.04.2020
Аннотация
На примере опубликованных и новых экспериментальных данных показано, что инсулинсодержащие гидрогели на основе сополимеров N-(2-D-глюкоз)акриламида с акриламидом, сшитых Конканавалином А, могут моделировать одну из функций поджелудочной железы – выделять инсулин при повышении концентрации глюкозы в окружающей среде, в том числе по двухстадийному механизму с максимальной скоростью на первом этапе.
Хорошо известно, что секреция любого биологически активного вещества в живом организме происходит при изменении его внутренней среды. При этом организм сам определяет когда, где и в каком количестве это вещество должно появиться. Изучение биохимических реакций, лежащих в основе этого процесса, с целью создания наиболее физиологичных терапевтических систем, способных его моделировать, можно отнести к одной из наиболее интересных и практически важных задач современной прикладной биохимии и фармакологии. Очевидно, что определяющая роль в таких системах должна принадлежать, так называемым, “умным” макромолекулярным носителям, которые способны изменять свои характеристики при изменении температуры окружающей среды, рН или при появлении в ней нового химического соединения, обеспечивая тем самым выделение предварительно введеннного в него лекарства.
Одними из первых такие системы были созданы применительно к секреции инсулина – важнейшего гормона поджелудочной железы, определяющего характер протекания таких процессов, как транспорт глюкозы через мембрану клеток и ее утилизация, метаболизм липидов и белков, активация ферментов гликолиза и т.д. Интерес к этой проблеме был обусловлен широким распространением сахарного диабета – заболевания, обусловленного дефицитом инсулина и получившего название “неинфекционная эпидемия XX и XXI вв.”, а также существующими методами его лечения.
По данным ВОЗ сейчас около 300 миллионов человек в мире страдают этим заболеванием, а по прогнозам к 2025 г количество больных диабетом вырастет до 435 миллионов. Лечение сахарного диабета, в основном, сводится к периодическим (несколько раз в сутки) инъекциям инсулина и, хотя инъекционный способ введения гормона позволяет сохранить жизни большинству больным диабетом, он имеет принципиальный недостаток. В физиологических условиях выделяемый поджелудочной железой инсулин попадает в кровоток через печень, которая и осуществляет контроль за его распределением в организме [1]. При инъекционном введении печень теряет такой контроль и физиологическое соотношение между концентрациями инсулина и глюкозы нарушается, что может приводить к ряду серьезных осложнений, часто наблюдаемых у больных сахарным диабетом [2].
Поскольку повышение концентрации глюкозы в крови − главный стимул секреции инсулина поджелудочной железой, то создание систем контролируемого выделения инсулина сводится, главным образом, к синтезу глюкозочувствительных полимеров, изменяющих свою проницаемость при появлении глюкозы и выделяющих при этом предварительно введенный в них гормон.
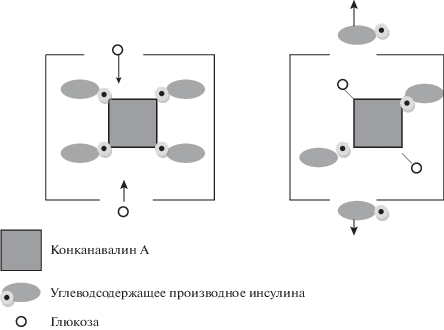
Впервые принцип создания подобных систем был сформулирован еще в 1979 г., и основан он был на использовании конканавалина-А (Кон А) – белка с молекулярной массой 102 000 Да, имеющего четыре участка связывания углеводов [3].
В полимерную мембрану, проницаемую для глюкозы и инсулина, но не проницаемую для Кон А, помещали комплекс Кон А и специально синтезированного угдеводсодержащего производного инсулина. При появлении глюкозы в окружающей среде она проникала через мембрану и вытесняла производное инсулина из его комплекса с Кон А (рис. 1).
Исследования в этом направлении свелись к выбору углеводов, константы взаимодействия которых с Кон А обеспечивали бы необходимые скорость и количество выделяющегося инсулина; синтезу десятков различных углеводсодержащих производных инсулина с минимальным изменением физиологической активности гормона; созданию биосовместимой полимерной мембраны с требуемыми транспортными характеристиками и высокой механической прочностью, гарантирующей от разрушения всей системы, с выбросом большого количества инсулина. Были синтезированы производные инсулина, активность которых находилась на уровне 90% от активности нативного гормона, и созданы системы, показывающие неплохие результаты в опытах in vitro и in vivo. Однако работы в этом направлении не получили дальнейшего развития, в основном, из-за технологических трудностей конструирования подобных систем, а главное, из-за невозможности строгого контроля зависимости количества выделяющегося инсулина от концентрации глюкозы в растворе. В то время как контролирование такой зависимости является необходимым условием при лечении сахарного диабета [4–6].
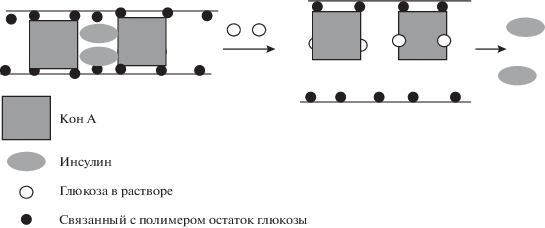
Существенно большее распространение получил близкий по смыслу подход, основанный на использовании немодифицированного инсулина и глюкозосодержащих полимерных гидрогелей [7]. Принцип действия таких систем иллюстрирует рис. 2. При обработке раствором глюкозы гидрогеля, полученного сшиванием полимера, содержащего химически связанные с ним конканавалином А остатки глюкозы, эти остатки замещаются молекулами глюкозы. При этом межмакромолекулярное взаимодействие между полимерными цепями нарушается, степень набухания гидрогеля увеличивается и предварительно введенный в гидрогель инсулин выделяется в раствор.
В качестве глюкозосодержащего компонента гидрогелей были использованы полисахариды, например гликоген [8] или декстран с молекулярной массой (ММ) от 102 до 106 Да [9], а также ненасыщенные производные полисахаридов, например, декстран-метакрилат [10–12], декстран-акрилат [13, 14] или хитозан-гликозилоксиэтилакрилат [15, 16], образующие с Кон А комплексы состава 4 : 1. Испытания этих комплексов показали, что они достаточно биосовместимы (по крайней мере, не обладают цитотоксичностью) и способны к обратимой сорбции и десорбции инсулина в отсутствии или присутствии глюкозы. К недостаткам подобных систем следует отнести сложность регулирования количества выделяющегося инсулина. Из некоторых систем инсулин выделялся даже при низкой, физиологически приемлемой, концентрации глюкозы.
Для решения этой проблемы гораздо более широкие возможности открывает использование полимеров, полученных полимеризацией ненасыщенных производных глюкозы, например, N-(2-D-глюкоз)акриламида (ГАА) [17, 18]. Преимущества использования таких мономеров заключаются в том, что, используя известные закономерности реакции полимеризации, можно в широких пределах изменять химический состав и строение глюкозосодержащего полимера, а следовательно параметры взаимодействия полимера с Кон А и кинетику выделения инсулина из комплексов полимер-Кон А.
В настоящем обзоре будут проанализированы возможности использования полимера ГАА для создания макромолекулярных систем, моделирующих одну из функций поджелудочной железы, а именно выделение инсулина.
ГАА синтезировали проводя реакцию глюкозамина с ангидридом акриловой кислоты [19]. Сополимеризацией ГАА с другим водорастворимым мономером, например, акриламидом (константы сополимеризации для акриламида и ГАА равны 1.12 ± 0.11 и 0.024 ± 0.012 соответственно), были получены линейные сополимеры, цепи которых состояли из достаточно длинных полиакриламидных блоков, разделенных отдельными звеньями ГАА. Такое распределение звеньев ГАА в сополимере является наиболее благоприятным для взаимодействия с Кон А, поскольку в этом случае исключаются стерические препятствия для реакции остатков глюкозы с одним из четырех центров связывания на молекуле Кон А.
При смешивании водных растворов синтезированных сополимеров и раствора Кон А практически мгновенно происходит образование гидрогеля. Степень набухания гидрогелей зависела от исходного соотношения ГАА (в сополимере) : Кон А (табл. 1)
Таблица 1.
Зависимость степени набухания гидрогелей от мольного соотношения ГАА : Кон А (содержание звеньев ГАА в сополимере 10.14%)
| Показатель | ГАА/Кон А | |||||||
|---|---|---|---|---|---|---|---|---|
| 8 : 1 | 7 : 1 | 6 : 1 | 5 : 1 | 4 : 1 | 3 : 1 | 2 : 1 | 1 : 1 | |
| Степень набухания, г/г вода/полимер | 29.7 | 25.4 | 22.1 | 19.3 | 15.6 | 15.9 | 15.2 | 15.5 |
Из таблицы видно, что с увеличением количества Кон А, выполняющего роль четырехфункционального сшивающего агента, степень набухания гирогелей сначала уменьшалась, а затем при мольном отношни ГАА : Кон А = 4 : 1 прекращала изменяться. Причина этого, вероятно, заключается в том, что при таком соотношении происходило насыщение лектина остатками глюкозы и избыток Кон А не вступал в реакцию с сополимером. При этом плотность сетки гидрогеля при мольных соотношениях ГАА : Кон А ≤ 4 : 1 не зависела от концентрации Кон А, а определялась только содержанием звеньев ГАА в сополимере. Так, при содержании звеньев ГАА 3.92, 10.14 и 14.5% (мол.) степень набухания составляла 34.9, 15.6 и 11.2 г воды на 1 г полимера при мольном отношении ГАА : Кон А = 4 : 1.
При добавлении глюкозы в водный раствор, окружающий гидрогель, сначала никаких видимых изменений с гидрогелем не происходило (степень набухания гидрогеля не изменялась). Однако, при достижении некоторого порогового значения концентрации глюкозы происходил довольно быстрый переход гидрогеля в растворимое состояние, то есть комплекс [Кон А–звено ГАА сополимера] распадался с образованием комплекса [Кон А–глюкоза] и водорастворимых макромолекул сополимера ГАА и акриламида.
Как и следовало ожидать, значение пороговой концентрации было функцией количества остатков глюкозы в сополимере: чем выше содержание звеньев ГАА в сополимере, тем выше значение пороговой концентрации. Для сополимеров с содержанием ГАА 3.92, 10.14 и 14.45 мол. % значение пороговой концентрации глюкозы составляла 180, 380 и 565 мг/100 мл раствора.
Следует отметить, что пороговая концентрация глюкозы оказалась даже несколько выше, чем можно было ожидать, исходя из значений констант связывания Кон А с глюкозой и ГАА, равных 3.7 × 103 и 1.1 × 102 М–1 соответственно [18].
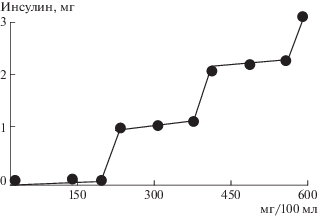
Разрушение гидрогеля естественнно приводило к выделению в раствор предварительно введенного в гидрогель инсулина. С точки зрения выделения требуемого количества инсулина при достижении определенной концентрации глюкозы представляют интерес смеси сополимеров с различным содержанием звеньев ГАА. Можно привести следующий пример. В сосуд объемом 3 мл, имеющий отверстия диаметром 2 мм, помещали смесь гидрогелей на основе сополимеров различного состава, предварительно насыщенных раствором инсулина. Использованы сополимеры с содержанием ГАА 3.92, 10.14 и 14.45 мол. %. Количество гидрогеля каждого типа составляло 1 м, в каждый из них было введено 1.3 мг инсулина. Затем сосуд помещали в стакан с 10 мл буферного раствора, рН 3.5. Диффузия инсулина из сосуда в отсутствие глюкозы не превышала 15 мкг за 10 ч. При добавлении глюкозы к буферному раствору начиналась ее диффузия в сосуд с гидрогелем, а при концентрации выше пороговой гидрогель каждого типа растворялся с выделением содержащегося в нем инсулина. Динамика выделения инсулина приведена на рис. 3, на котором видно, что, чем выше концентрация глюкозы в окружающей среде, тем большее количество инсулина выделяется из системы.
Рис. 3.
Зависимость количества выделившегося инсулина (мг) от концентрации глюкозы (мг/100 мл) в окружающей среде.
Для предотвращения побочного выделения в окружающую среду одновременно с инсулином водорастворимых компонентов гидрогеля (Кон А и сополимера) использовали два приема. Первый из них заключался в применении для изоляции гидрогеля от окружающей среды диализной мембраны, проницаемой для глюкозы и инсулина, но непроницаемой для Кон А и сополимера [20], второй – в использовании дополнительно сшивающего агента – N,N'-метилен-бис-акриламида (БИС) [21].
При сополимеризации ГАА с акриламидом в присутствии Кон А добавление БИС существенно уменьшало степень набухания синтезируемых гидрогелей (табл. 2). При этом часть сшивок в гидрогеле образуется за счет биоспецифического взаимодействия углевод-лектин, а часть − за счет ковалентного связывания цепей БИС [21].
Таблица 2.
Зависимость степени набухания гидрогелей на основе сополимеров акриламида, ГАА и БИС, полученных в присутствии 0.1%-ного Кон А (по массе) от состава исходной мономерной смеси
| Состав мономерной смеси, г/100 г раствора | Степень набухания, г/г вода/полимер | Пороговая концентрация глюкозы, мг/100 мл | |||
|---|---|---|---|---|---|
| Акрил-амид | ГАА | БИС | вода | 1%-ный раствор глюкозы | |
| 3.0 | 0 | 0.015 | 31.5 | 31.4 | – |
| 0.03 | 27.7 | 27.3 | – | ||
| 0.06 | 20.1 | 20.5 | – | ||
| 2.85 | 0.15 | 0.015 | 18.6 | 33.1 | 97 |
| 0.03 | 13.7 | 28.2 | 92 | ||
| 0.06 | 9.2 | 20.0 | 95 | ||
| 5.0 | 0 | 0.025 | 15.3 | 15.0 | – |
| 0.1 | 6.1 | 6.4 | – | ||
| 4.75 | 0.25 | 0.025 | 9.6 | 15.3 | 96 |
| 0.1 | 4.0 | 6.6 | 91 | ||
При изучении взаимодействия синтезированных гидрогелей с растворами глюкозы было установлено, что, как и следовало ожидать, для гидрогелей, полученных в отсутствии ГАА, добавление глюкозы не приводит к изменению их степени набухания. Для гидрогелей, которые наряду с ковалентными содержали еще сшивки, образованные взаимодействием Кон А со звеньями ГАА полимера, добавление глюкозы резко увеличивало степень набухания. При этом разрушение комплекса ГАА-Кон А в каждом конкретном случае происходило по принципу “все или ничего”, то есть только при достижении пороговой концентрации глюкозы, определяемой содержанием ГАА в полимере.
Электронно-микроскопические исследования лиофилизованных образцов гидрогелей показали, что участие макромолекулярного сшивающего агента [(ГАА)4-Кон А] в процессе синтеза приводило к формированию однородной пористой структуры со средним размером макропор 4.0 мкм при среднеквадратичном отклонении 1.1 мкм.
Такая однородная структура гидрогеля обеспечивала равномерное выделение инсулина при строго определенной “пороговой” концентрации глюкозы. Чем больше содержание звеньев ГАА в сополимере, тем выше была эта концентрация. Однако именно такое равномерное выделение инсулина принципиально отличало эту систему от поджелудочной железы.
Известно, что для секреции инсулина поджелудочной железой пороговой является концентрация глюкозы в крови порядка 80–100 мг/100 мл, а максимальная скорость достигается при концентрации 300–500 мг/100 мл. К особенностям этого процесса относится его неравномерность. Немедленный ответ или первая фаза реакции начинается в пределах 1 мин после повышения концентрации глюкозы и продолжается первые 8–10 мин. Затем скорость выделения инсулина резко замедляется и наступает вторая, более медленная и продолжительная фаза практически равномерного выделения инсулина в течение 55–60 мин, резко обрывающаяся после удаления глюкозы [2].
Поскольку скорость выделения инсулина из гидрогелей определяется скоростью диффузии глюкозы в объем гидрогеля и доступностью для нее молекул сшивающего агента – Кон А, то очевидно, что реализация физиологического пути секреции инсулина возможна только при условии двухуровневой структурной организации этого носителя. С этой точки зрения интерес представляют гидрогели, синтезированные радикальной сополимеризацией акриламида с БИС в присутствии соединения, ограничивающего рост цепи полимера – меркаптоуксусной кислоты (МУК) [22]. В отличие от обычных гидрогелей эти гидрогели имеют повышенную степень набухания (до 20 г воды на 1 г сухого полимера), а до 70% их микропор имеют относительно небольшие размеры и поэтому недоступны для макромолекул белков с ММ выше 100 000 Да. Аналогичные особенности структуры были обнаружены и при дополнительном введении ГАА в исходную мономерную смесь [23].
В этом случае использование соединения, ограничивающего рост полимерных цепей на первой стадии формирования полимерного гидрогеля, приводило к заметному (примерно в полтора раза) увеличению степени набухания гидрогеля, а также изменению характера распределения микропор по размерам (табл. 3).
Таблица 3.
Влияние концентрации меркаптоуксусной кислоты на свойства гидрогелей. Приведены минимальные и максимальные значения для пяти гидрогелей
| МУК, % | Степень набухания, г/г | Доступность гидрогеля для белков с ММ, % | ||||
|---|---|---|---|---|---|---|
| 6500 | 40 000 | 80 000 | 96 000 | 140 000 | ||
| – | 12.7–14.5 | 97–99 | 87–93 | 79–84 | 71–76 | 66–71 |
| 0.029 | 14.4–16.0 | 95–97 | 84–88 | 75–80 | 44–50 | 39–43 |
| 0.058 | 16.5–19.0 | 96–100 | 78–83 | 66–71 | 44–51 | 36–42 |
| 0.10 | 20.3–22.2 | 94–98 | 79–82 | 62–67 | 49–52 | 38–43 |
Видно, что, если доступность микропор гидрогелей для белков с ММ до 80 000 Да мало зависела от присутствия передатчика цепи, то для белков с ММ выше 960 000 Да доля недоступных для них микропор при использовании МУК повышалась с 30 до 60%. Следовательно, можно сделать вывод, что в таких гидрогелях существуют два уровня структурной организации микропор: наряду с обычным, характерным для радикальной полимеризации широким распределением микропор по размерам, имеется значительное количество микропор уменьшенного размера. При этом, как показано в работе [20], проведение реакции сополимеризации в присутствии высокомолекулярных белков (в данном случае Кон А) приводило к тому, что большая часть макромолекул белка (до 90%) иммобилизуется на поверхности стенок, разделяющих поры гидрогеля, и доступна для соответствующих субстратов. Естественно, что величина такой поверхности тем больше, чем меньше размеры микропор.
Такой уровень структурной организации и определяет скорость взаимодействия Кон А с глюкозой, а следовательно и скорость выделения предварительно введенного в гидрогель инсулина (табл. 4). Видно, что выделение инсулина из синтезированных гидрогелей в раствор глюкозы происходит неравномерно. Наличие повышенного количества мелких пор с развитой поверхностью приводит к быстрой диффузии инсулина с поверхности этих пор. Максимальная скорость достигается на 8 мин и составляет 5.6–6.0 Ед./мин, а затем, по мере исчерпания инсулина в гидрогеле, скорость его выделения равномерно снижается до 1.9–0.7 Ед./мин [23]. В данном случае кинетика выделения инсулина из гидрогеля в ответ на появление глюкозы полностью аналогична секреции этого гормона поджелудочной железой, когда ударная доза инсулина появляется в течение первых 5–10 мин [2] и отличает синтезированные гидрогели от гдрогелей с более гомогенным распределением пор по размерам. Выделение инсулина из гидрогелей, полученных в отсутствии передатчика цепи, на начальном этапе происходит со скоростью 2.5–3.0 Ед./мин, а затем равномерно снижается до 1.5–0.6 Ед./мин.
Таблица 4.
Кинетика выделения инсулина из гидрогелей
| МУК, % | Скорость выделения инсулина (Ед./мин) в период, мин | |||||||
|---|---|---|---|---|---|---|---|---|
| 0–5 | 5–8 | 8–10 | 10–15 | 15–20 | 20–30 | 30–40 | 40–60 | |
| – | 2.5 | 3.0 | 3.1 | 2.7 | 2.9 | 2.1 | 1.5 | 0.6 |
| 0.029 | 4.8 | 6.0 | 4.2 | 1.8 | 1.6 | 1.4 | 1.0 | 0.6 |
| 0.058 | 5.2 | 5.6 | 4.3 | 1.9 | 1.7 | 1.4 | 1.1 | 0.7 |
| 0.10 | 5.6 | 5.8 | 4.6 | 1.9 | 1.8 | 1.5 | 1.2 | 0.5 |
Практическое использование, таких гидрогелей подразумевает их длительное пребывание в контакте с тканями живого организма и, в первую очередь, с кровью. Гидрогели сами по себе являются достаточно гемосовместимыми, но необходимо выяснить в какой степени введение в состав гидрогеля остатков глюкозы может изменять состояние белков крови. В оценке гемосовместимости важная, если не определяющая, роль принадлежит степени изменения нативной конформации белков крови в результате их контакта с поверхностью полимера. В настоящее время индикатором конформационных изменений белков принято считать систему комплемента [24]. У человека она состоит из 21 белка глобулиновой природы. Компоненты этой системы свободно циркулируют в крови в форме неактивных предшественников, которые активируются, в том числе и в результате взаимодействия с чужеродным материалом, и приобретают свойства ферментов. Ферментативную активность оценивают, измеряя время полулизиса эритроцитов барана плазмой крови. Для гидрогелей с содержанием звеньев ГАА − 0, 0.3, 1.0 и 2.0% мол. значения константы скорости активации системы комплемента составляли 3.3, 2.7, 2.4 и 1.9 ± 0.29 × 106 с–1 cм–2. То есть введение в состав гидрогеля остатков глюкозы приводит к некоторому уменьшению константы скорости активации системы комплемента, т.е. способствует сохранению белками нативной конформации [25].
Отсутствие драматических конформационных изменений белков крови обеспечивает неизменность биологической активности инсулина, выделяющегося из гидрогеля (табл. 5). Видно, что инъекционное введение раствора исходного и выделившегося из гидрогеля инсулина приводит к практически одинаковому снижению уровня глюкозы в крови подопытных животных.
Таблица 5.
Зависимость концентрации глюкозы в крови животных после подкожного введения инсулина (0.2 или 0.6 мг/кг массы кролика или крысы соответственно)*
| Животное | Препарат | Глюкоза в крови (мг/100 мл) через время, мин | |||||
|---|---|---|---|---|---|---|---|
| 0 | 15 | 30 | 60 | 90 | 120 | ||
| Кролики | Исходный | 124 | 96 | 65 | 60 | 44 | 42 |
| Выделившийся | 116 | 102 | 58 | 56 | 40 | 40 | |
| Крысы | Исходный | 145 | 126 | 84 | 62 | 51 | 56 |
| Выделившийся | 132 | 112 | 78 | 56 | 50 | 50 | |
Как и ожидалось, инсулин, прошедший стадии введения в гидрогель и выделение из гидрогеля, не подвергается денатурции и полностью сохраняет биологическую активность [21].
Таким образом, рассмотренные результаты работ однозначно свидетельствуют о том, что синтезированный полимерный гидрогель на основе ГАА можно рассматривать как макромолекулярную систему, имитирующую одну из важнейших функций поджелудочной железы, связанную с выделением определенного количества инсулина в ответ на повышение концентрации глюкозы в окружающей среде. Обнаруженные закономерности, в свою очередь, могут открыть достаточно интересные перспективы для разработки новой стратегии лечения сахарного диабета. Очевидно, что полученные результаты являются иллюстрацией широких возможностей биохимии и химии высокомолекулярных соединений.
Работа выполнена в рамках Государственного задания ИНХС РАН.
Список литературы
Saffran M. Targeting of Drugs: The Challenge of Peptides and Proteins / Ed. G. Gregoriadis. N.Y.: Plenum Press, 1992. P. 89–95.
Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W. Harper’s Biochemistry. Norwalk. Connecticut/San Mateo. California: Appleton & Lange, 385 p.
Brownlee M., Cerami A. // Science. 1979. V. 206. № 4423. P. 1190–1191.
Kim S.W., Pai C.M., Makino K., Semionoff L.A., Holmberg D.L., Gleeson Y.M., Wilson D.E., Mack E.Y. // J. Control Release. 1990. V. 11. P. 193–201.
Валуев Л.И., Старосельцева Л.К., Валуев И.Л., Ванчугова Л.В. // Хим. фарм. журн. 2019. Т. 53. № 4. С. 20–23.
Liu F., Song S.C., Mix D., Baudys M., Kim S.W. // Bioconjug. Chem. 1997. V. 8. № 5. P. 664–672.
Yin R., Bai M., He J., Nie J., Zhang W. // Int. J. Biol. Macromol. 2019. V. 124. P. 724–732.
Sato K., Kodama D., Endo Y., Anzai J. // J. Nanosci. Nanotechnol. 2009. V. 9. № 1. P. 386–390.
Benzeval I., Bowyer A., Hubble J. // J. Eur. Pharm. Biopharm. 2012. V. 80. № 1. P. 143–148.
Taylor M.J., Tanna S., Sahota T.S. // Drug. Dev. Ind. Pharm. 2008. V. 34. № 1. P. 73–82.
Taylor M.J., Tanna S., Sahota T.S. // Pharm. Dev. Technol. 2010. V. 15. № 1. P. 80–88.
Yin R., Tong Z., Yang D., Nie J. // Carbohydr. Polym. 2012. V. 89. № 1. P. 117–123.
Tanna S., Taylor M.J., Sahota T.S., Sawicka K. // Biomaterials. 2006. V. 27. № 8. P. 1586–1597.
Tanna S., Sahota T.S., Sawicka K., Taylor M.J. // Biomaterials. 2006. V. 27. № 25. P. 4498–4507.
Yin R., Wang K., Du S., Chen L., Nie J., Zhang W. // Carbohydr. Polym. 2014. V. 103. P. 369–376.
Bai M., He J., Kang L., Nie J., Yin R. // Int. J. Biol. Macromol. 2018. V. 113. P. 889–899.
Валуев И.Л., Валуев Л.И., Ванчугова Л.В., Обыденнова И.В. // Высокомолекулярные соединения. 2015. Т. 57 Б. № 5. С. 334–337.
Валуев И.Л., Чупов В.В., Валуев Л.И., Сытов Г.А., Платэ Н.А. // Высокомолекулярные соединения. 1997. Т. 39 Б. № 4. С. 751–754.
Ivakura Y., Imai Y., Vagu Y. // J. Polym. Sci. A-1. 1968. V. 6. № 6. P. 1625–1632.
Obaidat A.A., Park K. // Biomaterials. 1997. V. 18. № 11. P. 801–806.
Валуев И.Л., Ванчугова Л.В., Валуев Л.И. // Высокомолекулярные соединения. 2011. Т. 53 А. № 5. С. 691–695.
Ванчугова Л.И., Валуев Л.И., Валуев И.Л., Талызенков Ю.А. // Высокомолекулярные соединения. 2013. Т. 55 Б. № 2. С. 225–228.
Валуев И.Л., Валуев Л.И., Ванчугова Л.В., Обыденнова И.В. // Высокомолекулярные соединения. 2018. Т. 60 А. № 4. С. 308–311
Биосовместимость / Ред. В.И. Севастьянов М.: ГУП “Информационный центр ВНИИгеосистем”, 1999. 367 с.
Валуев И.Л., Валуев Л.И., Ванчугова Л.В., Валуева Т.А. // Прикл. биохимия и микробиология. 2013. Т. 49. № 3. С. 319–322.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология