Прикладная биохимия и микробиология, 2020, T. 56, № 5, стр. 465-471
Конструирование метанотрофа I типа с пониженной способностью аккумулировать гликоген и сахарозу
С. Ю. Бут 1, С. Н. Дедыш 2, В. О. Попов 3, Н. В. Пименов 2, В. Н. Хмеленина 1, *
1 ФИЦ Пущинский научный центр биологических исследований РАН, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук
Пущино, Россия
2 Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
3 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: khmelenina@ibpm.pushchino.ru
Поступила в редакцию 09.03.2020
После доработки 07.04.2020
Принята к публикации 22.04.2020
Аннотация
Получены мутантные штаммы галотолерантного метанотрофа I типа Methylotuvimicrobium alcaliphilum 20Z с инактивированным геном sps, кодирующим сахарозофосфатсинтазу, и делецией кластера генов синтеза и распада гликогена. Блокирование путей синтеза сахарозы и гликогена приводило к увеличению содержания белка в клетках, но при этом несколько снижалась скорость роста метанотрофа на метане. В работе показана принципиальная возможность относительно стабильного роста метанотрофа в отсутствие синтеза запасных соединений углерода.
Аэробные метанотрофы – бактерии, использующие метан в качестве единственного источника углерода и энергии, могут быть использованы в биотехнологиях получения разнообразных метаболитов с добавленной стоимостью из метана, включая кормовой белок “гаприн” [1, 2]. Среди продуцентов гаприна наиболее изучены представители рода Methylococcus, обладающие высокой скоростью роста и высокой метаболической гибкостью [3, 4]. Изучение метанотрофов в отношении их способности продуцировать биомассу, пригодную для использования в качестве эффективной белковой добавки в корм сельскохозяйственных животных, получило новый импульс в связи с увеличением числа новых таксонов этих бактерий и секвенированием геномов типовых представителей. Расшифровка последовательностей геномов метанотрофов позволила проводить направленную генетическую модификацию их метаболизма с целью расширения их биотехнологического потенциала. Активно идущие в настоящее время работы по метаболической инженерии метанотрофов в основном направлены на получение продуктов с высокой добавленной стоимостью [5–7], тогда как работы по улучшению качества кормовых добавок перспективных штаммов пока отсутствуют.
Одним из примеров метанотрофов с высокой скоростью роста является галотолерантный метанотроф Methylomicrobium alcaliphilum 20Z, выделенный из содового озера Шара-Нур (Тыва, Россия) [8, 9]. Полная последовательность генома штамма 20Z представлена в GeneBank (NC_016112.1) являясь основой для детальной характеристики основных путей метаболизма и реакций на осмотические стрессы [10]. В геноме метанотрофа выявлены три копии оперона рибосомальной РНК. Как известно, количество оперонов рРНК определяет важные физиологические свойства бактерий, такие как скорость и эффективность роста, а также быструю адаптацию к повышенной температуре и доступным ростовым субстратам [11, 12]. На основании сравнительного геномного анализа метанотрофов I типа, эта бактерия была недавно ре-классифицирована как представитель нового рода Methylotuvimicrobium [13]. Способность M. alcaliphilum 20Z к быстрому и устойчивому росту в широком диапазоне солености среды (0.5–10% NaCl) и рН (7.5–10), позволила использовать штамм в качестве модельного организма при изучении феномена метанотрофии и оценки метаболического потенциала этих бактерий [14]. Эти же характеристики ставят M. alcaliphilum 20Z в ряд потенциально перспективных продуцентов гаприна. Изучение метаболизма M. alcaliphilum 20Z показало, что штамм накапливает запасные углеводы – сахарозу и гликоген [8, 15, 16]. Накопление запасных углеводов сопровождается расходованием значительной доли углерода и энергии ростового субстрата, снижая содержание белка в конечном продукте. Показано, что у метанотрофов, аналогично растениям и цианобактериям, синтез сахарозы происходит с участием двух ферментов – сахарозофосфатсинтазы (SPS) и сахарозофосфатфосфатазы (SPP). В предыдущих исследованиях было обнаружено, что мутант M. alcaliphilum с делецией гена sps не накапливал сахарозу и не отличался по скорости роста на метаноле от исходного штамма [15]. Влияние накопления внутриклеточных полисахаридов на ростовые характеристики штамма 20Z практически не изучено, но показано, что уровень гликогена в лимитированных по азоту условиях может достигать 35% от веса сухих клеток [8].
Цель работы – получение модифицированных штаммов M. alcaliphilum 20Z с нарушениями в биохимических путях синтеза сахарозы и гликогена и изучение влияния этих метаболических дефектов на относительное содержание белка в клетках.
МЕТОДИКА
Бактерии и условия культивирования. Культуру Methylotuvimicrobium alcaliphilum 20Z (VKM B-2133T = NCIMB 14 124T) и модифицированные штаммы этого метанотрофа выращивали при 30°С в минеральной среде “2П”, являющейся модификацией среды “П” [17] и содержащей (г/л): Na2HPO4 · 12H2O – 1.5; KH2PO4 – 0.7; KNO3 – 2.0; MgSO4 · 7H2O – 0.4; CaCl2 – 0.04 и 2 мл/л раствора микроэлементов (в мг/л): ЭДТА-Na2 – 5000; FeSO4 · 7H2O – 2; ZnSO4 · 7H2O – 0.1; MnCl2 · · 4H2O – 0.03; CuCl2 · 5H2O – 0.04; CoCl2 · 6H2O – 0.2; NiCl2 · 6H2O – 0.2; Na2MoO4 – 0.03. В среду вносили 3% NaCl (оптимальная концентрация для штамма 20Z), перед засевом добавляли NaHCO3 в конечной концентрации 0.1 М. При определении удельной скорости роста, культуры выращивали в герметично закрытых флаконах объемом 200 мл, содержавших 30 мл среды. Во флаконы шприцем добавляли по 50 мл СН4 или 0.5% метанола (об./об.). Штаммы Escherichia coli Top10 и S-17-1 выращивали при 37°С в жидкой или на агаризованной (1.5% агара “Difco”, США) среде ЛБ [18] с добавлением при необходимости 100 мкг/мл канамицина (Км).
Конструирование мутантных штаммов. Для элиминации гена sps (MALCv4_0614), кодирующего сахарозофосфатсинтазу (СФС, КФ 2.4.1.14), а также генного кластера (MALCv4_3499–MALCv4_3508), содержащего два гена гликогенсинтаз (рис. 1), фрагменты ДНК, фланкирующие данные локусы, амплифицировали с использованием праймеров (табл. 1) и клонировали в вектор pCM433Kan [19] по сайтам BglII и NdeI, SacII и SacI. Полученным вектором pCMsps трансформировали клетки E. coli S-17-1, затем плазмиду переносили в клетки метанотрофа с помощью конъюгации, как описано ранее в работе [20]. Культуры M. alcaliphilum 20Z и E. coli S-17-1 выращивали на соответствующих агаризованных средах, затем суспендированные клетки двух бактерий смешивали на чашках с агаризованной средой “2П”, содержащей 0.75% NaCl и 2.5% среды LB. Чашки выдерживали в атмосфере смеси метана и воздуха (1 : 1) в течение 2 сут, затем клетки высевали на агаризованную среду “2П”, содержащую 3% NaCl и 100 мкг/мл Км. Устойчивые к канамицину колонии выращивали в жидкой среде с Км, затем суспензию клеток (около 100 мкл) высевали на агаризованную среду “2П”, содержащую 2.5% сахарозы. Выросшие в результате, устойчивые к сахарозе колонии, представляли собой дикий тип или мутант с желаемой делецией [21]. Генотип устойчивых к сахарозе колоний проверяли с помощью ПЦР, отбирая колонии, не содержащие гена sps. В результате был получен делеционный мутант Δspsum, не несущий маркеров устойчивости к антибиотикам. Для получения двойного мутанта Δspsglgum вышеуказанную процедуру повторяли, внося в клетки штамма Δspsum плазмиду pCMglg, полученную клонированием в вектор pCM433Kan фрагментов ДНК, фланкирующих кластер метаболизма гликогена, по сайтам AatII, BglII и ApaI, SacI.
Рис. 1.
Кластер генов, ответственных за метаболизм гликогена у M. alcaliphilum 20Z: glgA1, glgA2 – гены гликогенсинтаз; glgB1, glgB2 – гены ферментов ветвления гликогена; glgС – ген АДФ-глюкопирофосфорилазы; manB – ген α‑маннозидазы; malQ – ген 4-α-глюкантрансферазы; amyА, amyC – гены α-амилаз; ? – ген белка с неизвестной функцией.
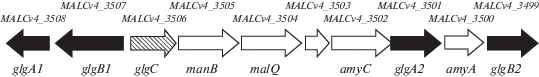
Таблица 1.
Праймеры, использованные в работе
| Праймер | Мишень | Последовательность (5'-3') |
|---|---|---|
| sps-up-F | Участок ДНК, фланкирующий ген sps с 5'-конца | TTAGATCTGTTTGATTTTTAAGAGTCGAGGATT |
| sps-up-R | TACATATGCGATTTGCCGAAGGCTATTT | |
| sps-dw-F | Участок ДНК, фланкирующий ген sps с 3'-конца | TTCCGCGGCATGATATCGTTGCAGGGGATTCC |
| sps-dw-R | TTGAGCTCCAGGAAATTCGCGTTGTTGC | |
| glg-up-F | Участок ДНК, фланкирующий ген glgA1 с 5'-конца | GAGACGTCGCTCAACCGACTCATTGACG |
| glg-up-R | GTGATCTGGGATGAATCGGCCTCATTCG | |
| glg-dw-F | Участок ДНК, фланкирующий ген glgB2 с 3'-конца | GAGGGCCCGTGGAATAGTAGCGCTAAAC |
| glg-dw-R | GAGAGCTCGATCAAAATCCGGCGTCGGGGGTCG |
Олигонуклеотиды синтезировали в фирме “Евроген” (Россия), ДНК секвенировали в фирме “Генотех” (Россия).
Количественный анализ сахарозы и гликогена. Для количественного анализа метаболитов клетки дикого и мутантных штаммов M. alcaliphilum выращивали до начала стационарной фазы (ОП 1.0–1.2) в качалочных колбах объемом 750 мл с 200 мл среды “2П”. Газовую фазу в колбах заменяли смесью метана и воздуха в соотношении 1 : 1, или в качестве углеродного субстрата использовали метанол (0.5% вес/об.) Клетки собирали центрифугированием при 6000 g в течение 10 мин, полученную биомассу лиофилизировали. Для измерения содержания сахарозы навески сухих клеток (~30 мг) суспендировали в 80%-ном метаноле, обрабатывали ультразвуком 3 раза по 10 с с перерывами по 1 мин на дезинтеграторе “MSE” (Фирма, Англия), а затем центрифугировали 5 мин при 14 500 g. Супернатант переносили в чистые пробирки и упаривали, сухой остаток растворяли в 200 мкл деионизованой воды и дважды экстрагировали хлороформом. Водную фракцию использовали для измерения сахарозы методом ВЭЖХ на колонке “Repro-Gel H + column” (9 мкм, 250 × 8 мм, “Dr.Maisch”, Германия) с использованием рефрактометрического детектора. В качестве подвижной фазы использовали 1.0 мМ Н2SO4 со скоростью протока 0.5 мл/мин, температура колонки составляла 50°С.
Для экстракции гликогена 10 мг сухих клеток суспендировали в 30%-ном КОН, выдерживали при 95°С в течение 30 мин. Полученный лизат охлаждали во льду, добавляли два объема этанола, выдерживали при –20°С в течение 1 ч, центрифугировали при 14 500 g 10 мин. Осадок растворяли в деионизованой воде, доводя рН до 3.0 5 М HCl и вновь осаждали этанолом в соотношении 1 : 1 (об./об.). Образцы инкубировали 1 ч при –20°С, центрифугировали 10 мин при 14 500 g, осадок высушивали и растворяли в деионизованой Н2О. Концентрацию гликогена определяли с помощью набора “Glycogen Assay kit” (“Sigma”, США) согласно рекомендациям производителя. Для определения содержания белка в биомассе навески лиофилизированных клеток (около 10 мг) суспендировали в 1 M NaOH, прогревали в микроволновой печи 3 раза по 10 с с мощностью 600 кВт. Образцы центрифугировали 10 мин при 14 500 g, надосадочную жидкость переносили в чистые пробирки. Концентрацию белка определяли методом Лоури.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение мутантных штаммов и анализ их ростовых характеристик. Ранее инсерцией канамициновой кассеты в последовательность гена sps нами был получен штамм M. alcaliphilum, который не накапливал сахарозу [15]. Поскольку культивирование таких штаммов предполагает применение антибиотика, а для объединения в одном штамме ряда мутаций требуется нескольких антибиотиков, в работе использовали методологию получения безмаркерных мутаций контрселекцией с геном sacB [21], ранее применявшуюся для получения мутаций у галотолерантного метанотрофа M. buryatense 5GB1 [19]. Ген sacB кодирует периплазматическую левансахаразу, его экспрессия у грамотрицательных бактерий, инкубируемых в присутствии экзогенной сахарозы, вызывает летальный эффект, предположительно обусловленный синтезом фруктозильного полимера, левана, который полностью заполняет периплазматическое пространство клетки [22]. Сначала был получен безмаркерный штамм Δspsum с делецией гена sps. Далее из хромосомы этого штамма был удален кластер, содержащий гомологичные гены glgA1 и glgA2, кодирующие гликогенсинтазы (с 19%-ной идентичностью транслированных аминокислотных последовательностей), включающий также гены glgB1 и glgB2, кодирующие ферменты ветвления гликогена (рис. 1). В результате получен штамм Δspsglgum.
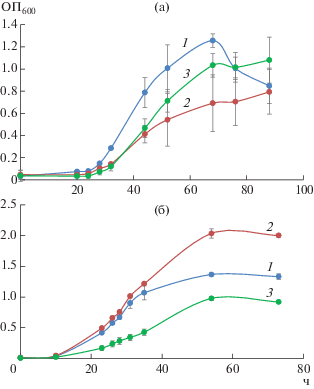
Скорость роста полученного мутанта Δspsum (0.05 ± 0.02 ч–1) на метане оказалась ниже, чем штамма дикого типа (0.094 ± 0.006 ч–1) и штамма Δspsglgum (0.089 ± 0.03 ч–1), снижался также выход биомассы у мутантов (рис. 2). Однако начальная скорость роста штамма Δspsum на метаноле не отличалась от скорости роста штамма дикого типа, а оптическая плотность культуры к началу стационарной фазы была примерно на 30% выше.
Рис. 2.
Динамика роста M. alcaliphilum 20Z (1), штамма Δspsum с делецией гена синтеза сахарозы (2) и двойного мутанта Δspsglgum (3) на метане (а) и метаноле (б).
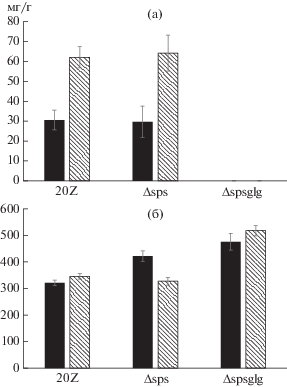
Накопление сахарозы и гликогена клетками мутантных штаммов. Штаммы Δspsum и Δspsglgum не накапливали сахарозу, в то время как содержание этого дисахарида в клетках штамма дикого типа, растущего на метане, составило 25 ± 10 мг/г сухой биомассы и 45 ± 3 мг/г выращенных на метаноле клеток.
Уровень гликогена в клетках штаммов 20Z и Δspsum, выращенных на метаноле, был в 2 раза выше, чем при выращивании на метане, но существенных различий в содержании гликогена между штаммами 20Z и Δspsum не выявлено. У штамма Δspsglgum гликоген не обнаружен (рис. 3а). В клетках штамма Δspsum, выросших на метане, содержание белка было на 30% больше по сравнению с клетками дикого типа, а в клетках штамма Δspsglgum выше на 50% (рис. 3б). Однако видимых различий в содержании белка у выращенных на метаноле штаммов 20Z и Δspsum не выявлено.
Рис. 3.
Содержание гликогена (а, мг/г сухой биомассы) и белка (б, мг/г сухой биомассы) в клетках штамма M. alcaliphilum дикого типа (20Z) и штамма с делецией гена синтеза сахарозы (Δspsum) и двойного мутанта (Δspsglgum) при росте на метане (черные столбцы) и метаноле (штрихованые столбцы).
Таким образом, получены модифицированные штаммы облигатного метанотрофа I типа M. alcaliphilum 20Z с нарушенным синтезом запасных углеродных соединений – сахарозы и гликогена. Данные метаболические дефекты по-разному влияли на физиологические свойства метанотрофа при его выращивании на метане или метаноле. Гликоген закономерно не обнаружен при элиминации кластера генов, который кроме ферментов синтеза гликогена, гликогенсинтаз, кодирует также сопутствующие ферменты ветвления и распада гликогена (АДФ-глюкопирофосфорилазу, α-маннозидазу, 4-α-глюкантрансферазу и две α-амилазы) (рис. 1). В работе показана принципиальная возможность относительно стабильного роста метанотрофа в отсутствие синтеза запасных соединений углерода и энергии.
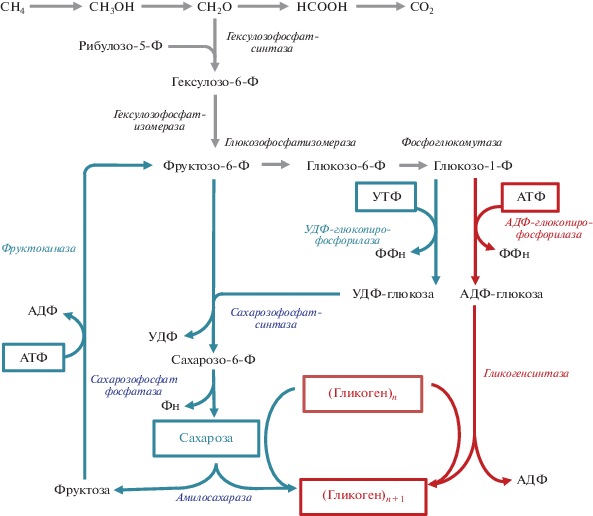
У M. alcaliphilum 20Z функционирует два механизма синтеза гликогена из первичных метаболитов рибулозомонофосфатного пути ассимиляции С1 соединений (рис. 4). Метанотрофы синтезируют сахарозу с участием сахарозофосфатсинтазы (Sps, КФ 2.4.1.14) и сахарозофосфатфосфатазы (Spp, КФ 3.1.3.24), конденсируя фруктозо-6-фосфат и УДФ-глюкозу, выделяя при этом неорганический фосфат. На следующем этапе амилосахараза (Ams, КФ 2.41.4) осуществляет перенос гликозильного остатка сахарозы на гликоген с образованием свободной фруктозы. Фруктоза может быть преобразована обратно во фруктозо-6-фосфат АТФ-зависимой фруктокиназой (FruK, КФ. 2.7.1.4) [16]. Гены, кодирующие ферменты синтеза и последующего метаболизма сахарозы у метанотрофов I типа расположены в одном опероне sps–spp–fruK–ams и детерминируют так называемый “цикл сахарозы” [16]. Для синтеза гликогена через цикл сахарозы требуются две молекулы нуклеотидтрифосфата (НТФ). Этот путь является более энергозатратным по сравнению с путем, осуществлямым при участии АДФ-глюкопирофосфорилазы и гликогенсинтазы, в котором для присоединения гликозильного остатка к праймеру гликогена тратится только одна молекула НТФ (рис. 4). При этом негативное влияние элиминации Sps на скорость роста на метане весьма оказалось неожиданным. Известно, что монооксигенирование СН4 происходит с потреблением восстановленных эквивалентов, потому блокирование энергетически затратного пути синтеза гликогена через сахарозу в качестве промежуточного продукта должно оказывать стимулирующий эффект на рост бактерии. С другой стороны, окисление СН4 сопровождается образованием активных форм кислорода [23]. Значительное замедление роста на метане, но не метаноле, штамма с нарушенным синтезом сахарозы позволяет предположить, что сахароза у метанотрофов может участвовать в защите клеточных мембран в процессе монооксигенирования.
Рис. 4.
Пути синтеза гликогена у M. alcaliphilum 20Z: через сахарозу в качестве промежуточного метаболита (синие стрелки) или прямой путь с участием гликогенсинтаз (красные стрелки).
Таким образом, элиминация путей биосинтеза запасных углеводов привела к значительному (~50%) увеличению содержанию белка в клетках M. alcaliphilum 20Z, что демонстрирует целесообразность генной модификации метанотрофов с целью повышения качества биомассы как кормовой добавки. Полученные в работе значения относительного содержания белка (32–34% для дикого типа и 48–51% для мутанта) ниже достигнутых ранее показателей для другого метанотрофа, Methylococcus capsulatus (70%) [4]. Необходимо принять во внимание, что выше приведенные показатели для M. alcaliphilum были получены в условиях периодического культивирования. При этом оптимизация условий культивирования не входила в задачи данной работы. Дальнейшее улучшение характеристик потенциальных штаммов-продуцентов гаприна может быть достигнуто путем оптимизации состава среды и условий ферментации.
Работа выполнена при поддержке гранта ФЦП № 075-15-2019-1830 Минобрнауки России, уникальный идентификатор проекта RFMEFI60719X0297.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов: Все авторы участвовали в концептуализации задач исследования и оформлении экспериментальных результатов.
Список литературы
Григорян А.Н., Горская Л. Использование природного газа для микробиологического синтеза. М.: ОНТИ Микробиопром, 1970. 90 с.
Hamer G., Harrison D.E.F. // Hydrocarbons in Biotechnology / Eds. D.E.F. Harrison, I.J. Higgins. London W.R.: Heyden Institute of Petroleum, 1980. P. 59–73.
Zhivotchenko A.G., Nikonova E.S., Jorgensen M.H. // Biotechnology Techniques. 1995. V. 9. № 3. P. 163–168.
Nunes J.J., Aufderheide B., Ramjattan D.M., Dass R. // J. Microbiol. Biotech. Food Sci. 2016. V. 6. № 3. P. 894–899.
Henard C.A., Smith H., Dowe N., Kalyuzhnaya M.G., Pienkos P.T., Guarnieri M.T. // Sci. Rep. 2016. V. 6. Article 21 585.
Gilman A., Fu Y., Hendershott M., Chu F., Puri A.W., Smith A.L., Pesesky M., Lieberman R., Beck D.A.C., Lidstrom M.E. // Peer J. 2017. V. 5. Article e3945. https://doi.org/10.7717/peerj.3945
Garg S., Wu H., Clomburg J.M., Bennett G.N. // Metab. Eng. 2018. V. 48. P. 175–183.
Khmelenina V.N., Kalyuzhnaya M.G., Sakharovsky V.G., Suzina N.E., Trotsenko Y.A., Gottschalk G. // Arch. M-icrobiol. 1999. V. 172. № 3. P. 321–329.
Kalyuzhnaya M.G., Khmelenina V.N., Eshinimaev B., Sorokin D., Fuse H., Lidstrom M., Trotsenko Y. // Int. J. Syst. Evol. Microbiol. 2008. V. 58. № 3. P. 591–596.
Vuilleumier S., Khmelenina V.N., Bringel F., Reshetnikov A.S., Lajus A., Mangenot S. et al. // J. Bacteriol. 2012. V. 194. № 2. P. 551–552.
Espejo R.T., Plaza N. //. Front Microbiol. 2018. V. 9. Article 1232.
Roller B.R.K., Stoddard S.F., Schmidt T.M. // Nat. M-icrobiol. 2016. V. 1. Article 16 160.
Orata F.D., Meier-Kolthoff J.P., Sauvageau D., Stein L.Y. // Front. Microbiol. 2018. V. 9. Article 3162.
Kalyuzhnaya M.G., Yang S., Rozova O.N., Smalley N.E., Clubb J., Lamb A., Gowda G.A., Raftery D., Fu Y., Bringel F., Vuilleumier S., Beck D.A., Trotsenko Y.A., Khmelenina V.N., Lidstrom M.E. // Nat. Commun. 2013. V. 4. Article 2785.
Бут С.Ю., Решетников А.С., Хмеленина В.Н., Мустахимов И.И., Троценко Ю.А. // Микробиология. 2013. Т. 82. № 2. С. 251–253.
But S.Y., Khmelenina V.N., Reshetnikov A.S., Mustakhimov I.I., Kalyuzhnaya M.G., Trotsenko Y.A. // Arch. Microbiol. 2015. V. 197. № 3. P. 471–480.
Гальченко В.Ф. Метанотрофные бактерии. М.: ГЕОС, 2001. 500 с.
Sambrook J., Russell D.W. Molecular Cloning: a Laboratory Manual, 3 Ed. N.-Y.: Cold Spring Harbor Laboratory, 2001. 2100 p.
Puri A.W., Owen S., Chu F., Chavkin T., Beck D.A., Kalyuzhnaya M.G., Lidstrom M.E. // Appl. Environ. Microbiol. 2015. V. 81. № 5. P. 1775–1781.
Mustakhimov I.I., Reshetnikov A.S., Glukhov A.S., Khmelenina V.N., Kalyuzhnaya M.G., Trotsenko Y.A. // J. Bacteriol. 2010. V. 192. № 2. P. 410–417.
Marx C. // BMC Res. Notes. 2008. V. 1. Article 1.
Bramucci M.G., Nagarajan V. // Appl. Environ. Microbiol. 1996. V. 62. № 11. P. 3948–3953.
Murrell J.C., McDonald I.R., Gilbert B. // Trends Microbi-ol. 2000. V. 8. P. 221–225.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


