Прикладная биохимия и микробиология, 2020, T. 56, № 5, стр. 472-482
Оценка пробиотического потенциала и функциональных свойств Lactobacillus reuteri LR1 in vitro
А. В. Бегунова 1, О. С. Савинова 2, И. В. Рожкова 1, Ю. И. Крысанова 1, Т. В. Фёдорова 2, *
1 Всероссийский научно-исследовательский институт молочной промышленности
115093 Москва, Россия
2 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: fedorova_tv@mail.ru
Поступила в редакцию 01.04.2020
После доработки 17.04.2020
Принята к публикации 22.04.2020
Аннотация
Изучение влияния различных антимикробных препаратов на штамм Lactobacillus reuteri LR1 показало его чувствительность к линкомицину, амоксициллину и левомицетину и устойчивость к остальным исследованным антибиотикам. Установлено, что при ферментации молока штаммом L. reuteri LR1 в течение 24 ч происходило достоверное повышение антиоксидантной и АПФ-ингибирующей активностей на фоне снижения количества L-лейциновых эквивалентов по сравнению с исходным молоком. В процессе дальнейшего культивирования увеличивались протеолитическая, антиоксидантная и ингибирующая активность ангиотензинпревращающего фермента (АПФ), достигая наибольшего значения через 96 ч. ВЭЖХ-МС/МС анализ пептидного профиля ферментированного лактобактерией молока показал наличие пептидов, обладающих АПФ-ингибирующей, антимикробной, антиоксидантной и иммуномодуляторной активностями. Анализ субстратной специфичности CEP-протеиназы L. reuteri LR1 в отношении фрагмента (f1-23) αs1-казеина показал его уникальную специфичность, что может указывать на его принадлежность к PI/PIII типу.
Современная наука определяет микробиоценоз как единую систему организма человека и его микробиома. При этом микробиом представляет собой разнообразные ассоциации микроорганизмов и продукты их метаболизма, обитающие в определенном биотопе [1].
Появляется все больше доказательств того, что различные диеты и факторы окружающей среды оказывают значительное влияние на метаболизм, иммунный ответ и восприимчивость человека к болезни в результате изменения видового состава микробных ассоциаций в его желудочно-кишечном тракте [2–4].
С 2001 г. термин “пробиотики” означает живые микроорганизмы, прием которых в адекватных количествах оказывает благоприятное воздействие на организм хозяина [5]. Поэтому очень важно понимать механизм воздействия пробиотического микроорганизма на макроорганизм, что постоянно исследуется в экспериментах in vitro.
Полезные для здоровья человека свойства молочнокислых бактерий (МКБ) интенсивно изучаются. В настоящее время проводятся исследования и накапливаются данные о более широкой пробиотический активности микроорганизмов, которые способны нормализовать функции микрофлоры желудочно-кишечного тракта (ЖКТ), усиливать иммунитет, снижать проявления пищевой аллергии, облегчать симптомы непереносимости лактозы, оказывать гипохолестеринемическое, антиканцерогенное и антимутагенное действие [6, 7]. В нижних отделах кишечника пробиотические микроорганизмы способны продуцировать антиоксиданты, гормоноподобные вещества и ферменты, которые участвуют в метаболических процессах макроорганизма [8].
Применение пробиотических, в том числе молочнокислых микроорганизмов при производстве кисломолочных продуктов направленного действия позволит добавить продукту ряд функциональных свойств [9, 10]. Доказано, что введение в организм пробиотических штаммов в составе кисломолочных продуктов более эффективно по сравнению с приемом пробиотических штаммов в виде лекарственных форм [11]. В настоящее время представители рода Lactobacillus являются наиболее широко изученными пробиотическими микроорганизмами в группе молочнокислых бактерий [12]. Известно, что род Lactobacillus включает виды с различным спектром физиологических и биохимических свойств. Интерес к Lactobacillus reuteri, одному из уникальных микроорганизмов семейства Lactobacillaceae с различными механизмами действия, возрастает. В связи с тем, что пробиотические свойства лактобактерий являются штамм-специфичными, исследование свойств конкретного штамма с целью его дальнейшего применения в качестве заквасочной или пробиотической заквасочной культуры является актуальным.
Исследуемый в данной работе штамм Lactobacillus reuteri LR1, был выделен в 2014 г. в Центральной лаборатории микробиологии Всероссийского научно-исследовательского института молочной промышленности (ВНИМИ, Россия) из фецес (каловые массы) здорового человека и идентифицирован современными биохимическими и молекулярно-генетическими методами [13]. Ранее было показано, что штамм L. reuteri LR1 обладает антимикробной активностью в отношении грамположительных и грамотрицательных бактерий и синтезирует в присутствии глицерина бактериоциноподобное соединение – реутерин [13, 14].
Цель работы – исследование пробиотического потенциала и функциональных свойств штамма L. reuteri LR1.
МЕТОДИКА
Культуры. В работе использовался штамм молочнокислых бактерий L. reuteri LR1 из фонда Коллекции микроорганизмов Всероссийского научно-исследовательского института молочной промышленности (ВНИМИ, Москва, Россия). Для культивирования лактобактерий использовали стерильное обезжиренное молоко.
Определение количества клеток. Количество клеток L. reuteri LR1 определяли методом посева на питательную среду MRS-агар (“НПЦ Биокомпас-С”, Россия). Культивирование проводили в анаэробных условиях при 37 ± 1°С в анаэростате OXOID и газ-пакетах GasPak (“BD Biosciences”, США). Подсчитывали все выросшие на среде колонии в течении 72 ч.
Устойчивость к антибиотикам. Устойчивость штамма L. reuteri LR1 к антибиотикам in vitro определяли диско-диффузионным методом, который основан на способности антимикробных препаратов диффундировать из пропитанных ими бумажных дисков в питательную среду, угнетая рост микроорганизмов на поверхности агаризованной среды. Интерпретацию результатов по оценке чувствительности лактобактерий проводили по МУ 2.3.2.2789-10 “Методические указания по санитарно-эпидемиологической оценке безопасности и функционального потенциала пробиотических микроорганизмов, используемых для производства пищевых продуктов” (https://ohranatruda.ru/upload/iblock/846/4293757373.pdf).
Получение белково-пептидных фракций. Аликвоту (15 мл) образца ферментированного молока центрифугировали при температуре 4°С в течение 30 мин при 10 000 g на центрифуге 5702R (“Eppendorf”, Германия), фильтровали надосадочную жидкость вместе с жировым слоем через складчатый бумажный фильтр (MN 640W, “Macherey-Nagel”, Германия). рН фильтрата доводили до 4.6 добавлением 0.1 М раствора гидроксида натрия с последующим центрифугированием полученной смеси при 4°С в течение 30 мин при 10 000 g на центрифуге 5702R (“Eppendorf”, Германия) и фильтрацией надосадочной жидкости через шприцевые фильтры с гидрофильной мембраной с диаметром пор 0.2 мкм (“Sartorius”, Германия). Полученные белково-пептидные фракции замораживали и хранили при температуре –73°С до проведения анализа.
Перед проведением анализа образцы белково-пептидных фракций ферментированного молока размораживали и дополнительно фильтровали с помощью шприцевых фильтров с гидрофильной PVDF-мембраной с диаметром пор 0.45 мкм (“Carl Roth”, Германия).
В полученных таким образом образцах белково-пептидных фракций ферментированного молока определяли протеолитическую, антиоксидантную и АПФ-ингибирующую (гипотензивную) активности, а также содержание органических кислот.
Протеолитическая активность. Протеолитическую активность определяли количественно путем измерения количества высвобождаемых аминогрупп в супернатантах с использованием метода, описанного в работе [15] с 2,4,6-тринитробензолсульфоновой кислотой (TNBS) (“Sigma-Aldrich”, США). Оптическую плотность растворов определяли на микропланшетном фотометре-флуориметре Synergy2 (“BioTek”, США) при длине волны 340 нм. В качестве стандарта для определения протеолитической активности использовали L-лейцин (“Sigma-Aldrich”, США). Результаты измерений выражали в ммоль/л-эквивалентов лейцина.
Антиоксидантная активность. Антиоксидантную активность in vitro определяли флуоресцентным методом ORAC (Oxygen Radical Absorbance Capacity) с генерацией пероксильного радикала в реакционной среде с помощью микропланшетного фотометра-флуориметра BioTek Synergy 2, как описано [16, 17]. Пероксильный радикал генерировался непосредственно в реакционной среде при термическом распаде азосоединения 2,2'-азобис(2-иетилпропионамидина) дигидрохлорида (ААРН) (“Sigma”, США), при инкубации в течение 10 мин при 37°С. Кинетику уменьшения флуоресценции регистрировали в течение 1 ч с интервалом измерений 60 с при температуре 37°С на фотометре-флуориметре Synergy 2 в режиме регистрации интенсивности флуоресценции (длина волны возбуждения – 485 нм, длина волны испускания – 528 нм). Величину антиоксидантной активности образцов ферментированного молока по отношению к пероксильному радикалу рассчитывали в мМ эквивалентов тролокса (ТЭ).
АПФ-ингибирующая активность. Анализ АПФ-ингибирующей активности проводили в 96-луночных полипропиленовых черных несорбирующих микропланшетах (“Greiner Bio One”, Германия). Кинетику увеличения интенсивности флуоресценции исследовали в течение 15 мин с интервалом в 20 с на микропланшетном фотометре-флуориметре Synergy 2 при температуре (37 ± 1)°С и длине волны возбуждения и регистрации флуоресценции – 320 и 420 нм соответственно.
С помощью графика зависимости ингибирования АПФ (%) от десятичного логарифма фактора разбавления исходного образца ферментированного молока методом линейной интерполяции определяли фактор разбавления образца, при котором наблюдалось 50%-ное ингибирование активности АПФ (IC50). Величину IC50 для образцов ферментированного молока, выраженную в мг белка/мл, рассчитывали путем деления концентрации белка в образце (в мг/мл) на величину фактора разбавления, при котором наблюдалось 50%-ное ингибирование активности АПФ.
Содержание органических кислот. Определение содержания органических кислот (молочной и уксусной) в процессе ферментации молока штаммом L. reuteri LR1 проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на приборе Agilent 1290 Infinity (“Agilent Technologies”, США) с детекцией на диодно-матричном детекторе при длине волны 210 нм с использованием колонки Zorbax SB-C8 (4.6 × 50 мм, 1.8 мкм).
Определение пептидного профиля. Анализ пептидного профиля был выполнен в системе, состоящей из хроматографа Agilent 1100 (“Agilent Technologies”, США) и тандемного масс-спектрометра LTQ-FT Ultra (“Thermo”, Германия). Для разделения пептидов использовали обращенно-фазовую градиентную хроматографию [18]. Контроль результатов ВЭЖХ-МС проводили с помощью программы QualBrowser. С помощью программы Raw2msm из масс-хроматограмм были получены списки точных масс пептидов и масс их фрагментов и использованы для поиска и идентификации белков по базе данных при помощи программы Peaks Studio (“Bioinformatics Solutions Inc.”, США, version 8.5). Для идентификации пептидов использовали аминокислотные последовательность белка согласно базе данных UniprotKB. Для идентификации использовали следующие параметры поиска: фермент – None (нативные пептиды); точность масс для родительского иона – 15 ppm; точность масс для MS/MS фрагментов – 0.50 Да. De novo секвенирование выполнено при помощи программы Peaks Studio.
Концентрацию белка в препаратах определяли с использованием набора BCA Assay kit (“ThermoFisher”, США) в соответствии с инструкцией производителя.
Все экспериментальные работы проводились в 3–5 кратной повторности. Построение графиков диаграмм, таблиц и статистическую обработку полученных экспериментальных данных проводили с использованием программ Microsoft Office и Statistica 10.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Многочисленные исследования доказали, что биологические эффекты и, как следствие, пробиотический потенциал разных штаммов лактобактерий одного вида могут достаточно сильно варьировать и являться штаммоспецифичной характеристикой [19–21]. Для повышения эффективности применения пробиотических микроорганизмов необходимо также понимать механизмы, обуславливающие биологическое действие конкретного штамма.
Проведенные ранее исследования показали выраженные антимикробные свойства у штамма L. reuteri LR1 при сокультивировании с условно-патогенными микроорганизмами, возбудителями нозокомиальных и пищевых токсикоинфекций, что является одним из основных показателей пробиотической активности данного штамма [13, 22].
Устойчивость к антибиотикам. Поскольку при использовании пробиотиков немаловажную роль играет их резистентность к антибиотикам, была изучена чувствительность штамма L. reuteri LR1 к 15 антимикробным препаратам, относящихся к различным группам: пенициллины, тетрациклины, аминогликозиды, фторхинолоны, макролиды и др. (табл. 1). Используемые препараты применяются в клинической практике для лечения различных кишечных инфекций, инфекций дыхательных и мочевыводящих путей и др. В результате проведенных исследований показано, что штамм L. reuteri LR1 был чувствителен к линкомицину, амоксициллину и левомицетину, проявлял промежуточную устойчивость к ампициллину и неомицину, и обладал устойчивостью к остальным тестируемым антимикробным препаратам. Полученные результаты свидетельствуют о том, что штамм L. reuteri LR1 является относительно устойчивым к антибиотикам и может быть рекомендован для применения в виде бактериального препарата или в составе кисломолочного продукта для нормализации микрофлоры ЖКТ при антибактериальной терапии различных инфекций.
Таблица 1.
Устойчивость Lactobacillus reuteri LR1 к антимикробным препаратам
| № п/п | Препарат | Содержание вещества в диске, мкг |
Диаметр зоны ингибирования роста, мм | Оценка чувствительности лактобактерий |
|---|---|---|---|---|
| Группа аминогликозидов | ||||
| 1 | Гентамицин | 120 мкг | 12 | Устойчивый |
| 2 | Канамицин | 30 мкг | 8–10 | Устойчивый |
| 3 | Неомицин | 30 мкг | 12–14 | Промежуточно-устойчивый |
| Группа пенициллинов | ||||
| 4 | Амоксициллин | 20 мкг | 25–26 | Чувствительный |
| 5 | Ампициллин | 10 мкг | 15–16 | Промежуточно-устойчивый |
| 6 | Бензилпенициллин | 10 Ед. | 10 | Устойчивый |
| 7 | Оксациллин | 1 мкг | 9–10 | Устойчивый |
| Группа тетрациклинов | ||||
| 8 | Доксициклин | 30 мкг | 8 | Устойчивый |
| 9 | Тетрациклин | 30 мкг | – | Устойчивый |
| Группа фторхинолонов | ||||
| 10 | Левофлоксацин | 5 мкг | 8–10 | Устойчивый |
| 11 | Пефлоксацин | 5 мкг | – | Устойчивый |
| Группа макролидов-азалидов | ||||
| 12 | Азитромицин | 15 мкг | 9 | Устойчивый |
| Другие | ||||
| 13 | Линкомицин | 15 мкг | 27 | Чувствительный |
| 14 | Левомицетин | 30 мкг | 30–32 | Чувствительный |
| 15 | Фосфомицин | 200 мкг | 10 | Устойчивый |
Биологическая и протеолитическая активность in vitro. В процессе ферментации молока штаммом L. reuteri LR1 происходило снижение активной кислотности в результате сбраживания углеводов молока с образованием органических кислот, в первую очередь молочной кислоты, а также ферментативный гидролиз белков молока, преимущественно различных фракций казеина, синтезируемыми L. reuteri LR1 протеазами с образованием пептидов. Данные по изменению содержания количества органических кислот при культивировании L. reuteri LR1 в стерильном обезжиренном молоке представлены на рис. 1. При этом в течение 24 ч ферментации молока происходило достоверное повышение антиоксидантной и АПФ-ингибирующей активности на фоне снижения количества эквивалентов L-лейцина по сравнению с исходным молоком (табл. 2). Это обусловлено достаточно низкой протеолитической активностью штамма L. reuteri LR1 в отношении казеиновых белков молока, в связи с чем, наблюдался медленный рост клеточной биомассы, количество клеток L. reuteri LR1 увеличивалось незначительно с 1.2 × 107 КОЕ/мл до 1.9 × 107 КОЕ/мл. В последующие 24 ч культивирования количество клеток L. reuteri LR1 увеличивалось с большей скоростью и достигало наибольшего значения 3 × 109 КОЕ/мл, при этом наблюдалось незначительное снижение антиоксидантной и АПФ-ингибирующей активностей на фоне неизменяющегося количества эквивалентов L-лейцина. При дальнейшем культивировании наблюдали увеличение протеолитической, антиоксидантной и АПФ-ингибирующей активностей, наибольшее значение которых достигалось на 96 ч культивирования (табл. 2). При этом количество жизнеспособных клеток L. reuteri LR1 практически не изменялось с 72 ч культивирования (табл. 2), что может быть объяснено достижением культуры стационарной фазы роста и возможным ингибированием роста из-за накопления в среде молочной и уксусной кислот (рис. 1).
Рис. 1.
Динамика изменения содержания органических кислот (мг/мл) при культивирования штамма L. reuteri LR1 на молоке: 1 – молочная кислота, 2 – уксусная кислота.
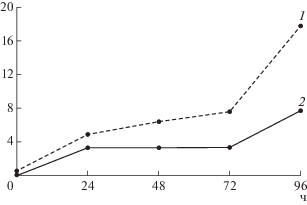
Таблица 2.
Динамика изменения протеолитической, антиоксидантной и АПФ-ингибирующей активностей в процессе культивирования штамма Lactobacillus reuteri LR1 на молоке
| Продолжительность культивирования, ч | Количество клеток L. reuteri LR1, КОЕ/мл | Антиоксидантная активность (ORAC), мкM TЭ/мг белка | АПФ-ингиби-рующая активность, (IC50) мг белка/мл | Протеолитическая активность, (эквиваленты L-лейцина), мМоль |
|---|---|---|---|---|
| 0 | 1.2 × 107 | 205.6 | 26.2 | 8.1 |
| 24 | 1.9 × 107 | 374.9 | 12.6 | 6.2 |
| 48 | 3 × 109 | 295.1 | 11.2 | 6.0 |
| 72 | 9.4 × 108 | 361.5 | 7.1 | 8.5 |
| 96 | 9.3 × 108 | 453.6 | 1.6 | 10.4 |
Пептидный профиль и субстратная специфичность протеаз. В результате ВЭЖХ-МС/МС анализа пептидных фракций образцов не ферментированного (контроль) и ферментированного штаммом L. reuteri LR1 молока идентифицировано 277 пептидов (табл. 3). В основном пептиды принадлежали казеиновым белкам, среди неказеиновых белков в наибольшем количестве были идентифицированы α-лактальбумин и β-лактоглобулин, лактоферин, остеопонтин и др.
Таблица 3.
Количество идентифицированных уникальных пептидов казеиновых и неказеиновых белков в образцах исходного и ферментированного штаммом Lactobacillus reuteri LR1 молока
| Образцы | Идентифицировано (всего) | Казеин β | Казеин αs1 | Казеин κ | Казеин αs2 | Неказеиновые белки |
|---|---|---|---|---|---|---|
| Контроль (молоко) | 126 | 39 | 61 | 6 | 12 | 8 |
| Ферментированное молоко | 151 | 54 | 75 | 10 | 3 | 9 |
В ферментированном молоке через 24 ч культивирования L. reuteri LR1 было идентифицировано порядка 150 олигопептидов, содержащих от 5 до 52 аминокислотных остатков (табл. 3, рис. 2 и 3). Анализ аминокислотных последовательностей олигопептидов показал, что большая часть из них, также присутствовала в исходном молоке до внесения закваски, а другая часть являлась фрагментами этих пептидов (рис. 2 и 3). Из всех уникальных олигопептидов, идентифицированных в ферментированном L. reuteri LR1 молоке, только 7 образовались в результате гидролиза непосредственно β-казеина, а не олигопептидов, присутствующих в исходном молоке (рис. 2). Наличие пептидов в исходном неферментированном молоке указывало на активность эндогенных молочных протеаз, в основном, таких как плазмин, эластаза и катепсин D, B и G (рис. 2) [23]. При этом плазмин мало или совсем не активен в отношении κ-казеина и сывороточных белков, которых обнаружено значительно меньше, по сравнению с пептидами из β- и αs1-казеинов (табл. 2, рис. 3). Отсутствие некоторых пептидов после ферментация молока, вероятно, обусловлено либо их гидролизом под действием внеклеточных протеаз L. reuteri LR1, или их потреблением клетками.
Рис. 2.
Пептиды αs1-казеина (а) и β-казеина (б), идентифицированные в составе образцов не ферментированного (контроль) и ферментированного штаммом L. reuteri LR1 молока. Сплошная линия – пептиды, обнаруженные как в контрольном образце молока, так и в ферментированном L. reuteri LR1; пунктиром обозначены уникальные пептиды, обнаруженные только в образце ферментированного молока, звездочкой – пептиды, образовавшиеся в результате гидролиза β-казеина, а не его олигопептидов, присутствующих в исходном молоке. Сайты расщепления эндогенных молочных протеаз: 1 – плазмин; 2 – катепсин B; 3 – катепсин D; 4 – катепсин G [23].

Рис. 3.
Пептиды αs2-казеина (а) и κ-казеина (б), идентифицированные в составе образцов не ферментированного (контроль) и ферментированного штаммом L. reuteri LR1 молока. Сплошная линия – пептиды, обнаруженные как в контрольном образце молока, так и в ферментированном лактобациллой, пунктирные – пептиды, обнаруженные только в образце ферментированного молока.

Полученные данные пептидного профиля согласуются с результатами определения протеолитической активности. Так в течение 48 ч культивирования L. reuteri LR1 наблюдали снижение количества эквивалентов L-лейцина с 8.1 мМ в исходном молоке до 6.0–6.2 мМ (табл. 2), что свидетельствовало об уменьшении суммарного количества пептидов, присутствовавших в молоке. Таким образом, в качестве источника азотного питания клетки L. reuteri LR1 использовали пептиды, исходно содержащиеся в молоке. Причем в течение ферментации молока штаммом L. reuteri LR1 сгусток не образовывался. Аналогичные результаты были получены ранее в работе [24]. Авторы показали, что рост и развитие штаммов лактобацилл L. reuteri JCM 1112 и Lactobacillus gasseri JCM 1131 значительно улучшалось в предварительно гидролизованном молоке по сравнению с цельным обезжиренным. В качестве источника азота для роста в молоке этим штаммам требовались именно олигопептиды, а не белки или свободные аминокислоты.
Лактобактерии содержат различные протеиназы клеточной стенки (ПКС, CEP – Cell Envelope Proteinase), ответственные за гидролиз преимущественно казеиновых белков и высвобождение различных биоактивных пептидов. В настоящее время охарактеризованы пять различных типов ПКС (CEP) лактобактерий: PrtP из Lactococcus lactis и Lactobacillus paracasei, PrtH из Lactobacillus helveticus, PrtR из Lactobacillus rhamnosus, PrtS из Streptococcus thermophilus и PrtB из Lactobacillus bulgaricus [25]. ПКС обычно классифицируются в соответствии с их спецификой гидролиза фрагмента αs1-казеина, содержащего остатки от 1 до 23 [26]. Как правило, определяют два типа ПКС: PI и PIII тип. Предпочтительным субстратом протеиназ типа PI является β-казеин и, в меньшей степени, κ-казеин, в то время как тип PIII способен гидролизовать αs1-, β- и κ-казеины в равной степени. Для лактобацилл были показаны типы протеиназ: PI- и PIII-типов, а также промежуточного PI/PIII с новым типом субстратной специфичности [27].
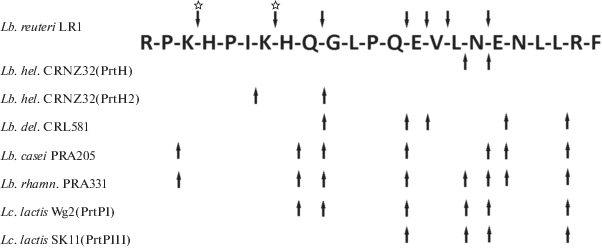
L. reuteri LR1 гидролизует (f1–23) фрагмент αs1-казеина в следующих положениях: K3-H4, K7-H8, Q9-G10, Q13-E14, E14-V15, V15-L16, N17-E18 (рис. 4). Большинство из данных сайтов расщепления типичны для ПКС смешанного типа PI/PIII, выделенных из лактобактерий, таких как S. thermophilus CNRZ385, Lactobacillus delbrueckii subsp. lactis CRL581 и L. helveticus L89, L. casei PRA205 и L. rhamnosus PRA331 [25, 28, 29]. Для ПКС L. reuteri LR1 не характерны сайты рестрикции в положениях H8-Q9, L16-N17 и E18-N19, описанные для протеиназ других лактобактерий (рис. 4). Однако обнаружено 3 дополнительных сайта в позициях K3-H4, K7-H8 и V15-L16. Известно, что (f1–9) последовательность аминоконцевой области αs1-казеина гидролизуется только внутриклеточными эндопептидазами PepO2 и PepO3 из Lactobacillus helveticus CNRZ32 по связи P5-I6 [30]. Кроме того, эти же авторы показали, что связи K3-H4 и K7-H8 чувствительны к действию эндопептидазы PepE L. helveticus CNRZ32. Однако рост бактериальной биомассы и отсутствие лизиса клеток (табл. 2, рис. 1) в процессе ферментации в первые 24 ч исключает вероятность влияния внутриклеточных протеаз на наблюдаемый гидролиз казеина штаммом L. reuteri LR1. Более того ранее было показано наличие субстратной специфичности в отношении K3-H4 сайта у ПКС L. helveticus Zuc2 [31]. Сайты рестрикции K7-H8 и V15-L16 показаны впервые для ПКС лактобацилл, что подчеркивает уникальную специфичность данной протеиназы L. reuteri LR1, которая может быть отнесена к PI/PIII типу, демонстрируя более высокую активность в отношении β-, αs1-казеинов, по сравнению с κ- и αs2-казеинами коровьего молока.
Рис. 4.
Специфичность протеиназ клеточной стенки (ПКС) различных лактобактерий, в том числе штамма L. reuteri LR1 в отношении αs1-казеина (f1–23). Сайты расщепления обозначены стрелками; сайты расщепления, не характерные для ПКС лактобактерий, отмечены звездочками. Lb.hel. – L. helveticus CRNZ32 [30]; Lb.del. – L. delbrueckii subsp. lactis CRL581 [28]; Lb.casei – L. casei PRA205 [29]; Lb.rhamn. – L. rhamnosus PRA331 [29]; Lc. lactis Wg2 – Lactococcus lactis Wg2 [28]; Lc. lactis SK11 – Lactococcus lactis subsp. cremoris SK11 [32].
Биологически активные пептиды. При сравнении идентифицированных пептидов с базой данных Milk Bioactive Peptide Database были обнаружены пептиды, функциональные свойства которых ранее были описаны в научной литературе [33]. Например, такие как β-казеиновые пептиды: YQEPVLGPVRGPFPIIV (f193–209), YQEPVLGPVRGPFP (f193–206) и QEPVLGPVRGPFPIIV (f194–209), обладающие АПФ-ингибирующей, антимикробной и иммуномодуляторной активностями; κ-казеиновый пептид VQVTSTAV (f162–169) – антимикробной и β-казеиновый YPFPGPIPN (f60–68) – АПФ-ингибирующей активностями. Для обнаруженного αs1-казеинового пептида EVLNENLLRF (f14–23) в работе [34] было показано наличие АПФ-ингибирующей активности, пептидная фракция, содержащая данный пептид, имела значение IC50 < < 10 мкг/мл.
Среди идентифицированных обнаружены пептиды, содержащие остатки редокс-активных аминокислот (тирозина, триптофана, метионина, цистеина и гистидина), определяющих наличие у данных пептидов антиоксидантных свойств. Так в ферментированном молоке идентифицирован β‑казеиновый октапептид VKEAMAPK (f98–104), для которого показано наличие антиоксидантной активности.
Анализ идентифицированных пептидов показал, что в состав ферментированного L. reuteri LR1 молока также входят пептиды, содержащие в своем составе фрагменты, для которых по литературным данным показано наличие гипотензивных свойств, обусловленных их АПФ-ингибирующим действием (табл. 4). В отличие от пептидов, обладающих АПФ-ингибирующей активностью, иммуномодулирующие пептиды, высвобождаемые из β-казеина, описаны реже. Однако те пептиды, которые были описаны как многофункциональные пептиды, такие как β-казеиновый пептид (f59–68), проявляющий антиоксидантную, опиоидную и AПФ-ингибирующую активности, и пептид (f193–209), проявляющий антимикробную, иммуномодулирующую, антитромботическую, АПФ-ингибирующую и антиоксидантную активности, происходят из С-концевой области β-казеина [33]. Недавно был охарактеризован β-казеиновый пептид DMPIQAFLLYQEPVLGPVR (f184–202), обладающий противовоспалительным действием [33]. В ферментированном L. reuteri LR1 молоке были также обнаружены пептиды из С-концевой области β-казеина, такие как MPIQAFLLYQEPVLGPVRGPFPIIV (f185–209), VPYPQRDMPIQ (f178–188), VPYPQRDMPIQA (f178–189) и VPYPQRDMPIQAF (f178–190). Все эти пептиды образовались в результате гидролиза белковой последовательности β-казеина, а не его олигопептидов, присутствующих в исходном молоке, на рис. 2 обозначены звездочкой. Можно предположить, что пептиды, высвобождаемые из этой части β-казеина, могут быть ответственны за возможное противовоспалительное и/или иммуномодулирующее действие ферментированного штаммом L. reuteri LR1 молока.
Таблица 4.
Предсказанные гипотензивные пептиды с АПФ-ингибирующей активностью, идентифицированные в составе ферментированного штаммом L. reuteri LR1 молока
| Идентифицированный пептид* | Пептид с гипотензивной активностью | IC50, мкМ | Ссылка |
|---|---|---|---|
| SLPQNIPPLTQTPVVVPPFLQPEVMGV CASB (f69–95) | LVYPFPGPIPNSLPQNIPP | 5.3 | [35] |
| NIPPLTQTPV | 173 | [36] | |
| TPVVVPPFLQP | 749 | [37] | |
| YPFPGPIPN CASB (f60–68) | VYPFPGPI | 500 | [36] |
| SKVYPFPGPI | 1.7 | [38] | |
| YPFPGPIPN | 15 | [39] | |
| NIPPLTQTPVVVPPFLQPEVM CASB (f73–93) |
TPVVVPPFLQP | 749 | [37] |
| IPPLTQTPVVVPP | 9.0 | [40] | |
| ELQDKIHPFAQTQ CASB (f44–56) ELQDKIHPFAQTQS CASB (f44–57) LQDKIHPF CASB (f45–55) |
FAQTQSLVYP | 25 | [41] |
| DKIHPF | 257 | [36] | |
| KIHPFAQTQSLVYP | 39 | [41] | |
| ELQDKIHPF | – | [42] | |
| VAPFPEVFGK CASA1 (f25–34) VAPFPEVFGKEKV CASA1 (f25–37) APFPEVFGK CASA1 (f26–34) APFPEVFGKEKV CASA1 (f26–37) APFPEVFG CASA1 (f26–33) PFPEVFGKEKV CASA1 (f27–37) EVFGKEKV CASA1 (f30–37) |
VAPFPEVF | 363 | [43] |
| FVAPFPEV | 476 | ||
| FFVAPFPEVFGK | 18 | [44] | |
| VLNENLLR CASA1 (f30–37) VLNENLLRF CASA1 (f30–38) LNENLLR CASA1 (f31–37) |
NENLLRFFVAPFPEVFG ENLLRFFVAPFPEVFG LNENLLRFFVAPFPEVFG |
55 | [42] |
Таким образом, в результате детальной характеристики пептидного профиля белково-пептидной фракции молока, ферментированного штаммом L. reuteri LR1, в его составе идентифицированы пептиды, отвечающие за антиоксидантные, гипотензивные и антимикробные свойства, что подтверждается наличием соответствующих активностей ферментированного молока в тестах in vitro (табл. 2). Полученные значения протеолитической и антиоксидантной активности для штамма L. reuteri LR1 соответствуют имеющимся в литературе данным для других пробиотических штаммов лактобацилл. Так ферментированное лактобациллой L. plantarum молоко через 48 ч культивирования имело сопоставимую с полученными в данной работе для штамма L. reuteri LR1 антиоксидантную активность – 250–350 мкМ эквивалентов тролокса (ORAC) [45]. Протеолитическая активность штамма L. reuteri LR1 через 72 ч ферментации на молоке составляла 8.5 мМоль L-лейциновых эквивалентов, что сопоставимо с активностью штаммов L. rhamnosus PRA331 и L. casei PRA205 через 72 ч ферментации молока – 6.4 и 10.9 мМоль L‑лейциновых эквивалентов соответственно [29]. По величине АПФ-ингибирующей активности ферментированное штаммом L. reuteri LR1 молоко (IC50 = 7–11 мг/мл) по диапазону величин IC50 не отличается от описанных в литературе для ферментированных молочных напитков [46]. Однако АПФ-ингибирующая активность ферментированного штаммом L. reuteri LR1 молока на порядок ниже, чем показана для штамма L. acidophilus ATCC 4356 и которая через 24 ч ферментации молока составляла IC50 = 0.42 мг/мл [47], что связано с более низкой протеолитической активностью L. reuteri LR1 по сравнению с L. acidophilus ATCC 4356. У последнего уже через 24 ч роста протеолитическая активность составляла 10 мМоль L‑лейциновых эквивалентов (рН 5.6), а количество жизнеспособных клеток 6.4 × 108 КОЕ, в то время как у L. reuteri LR1 – 6.2 мМоль L-лейциновых эквивалентов и 1.9 × 107 КОЕ.
Проведенные in vitro исследования позволяют сделать вывод, что штамм L. reuteri LR1 обладает выраженными антиоксидантными, гипотензивными и антимикробными свойствами и может быть использован как заквасочная культура с пробиотическими свойствами.
При проведении исследований использовалось оборудование Центра коллективного пользования “Промышленные биотехнологии” Федерального государственного учреждения “Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук”.
Работа выполнена при финансовой поддержке Российского научного фонда в части определения протеолитической, антиоксидантной, АПФ-ингибирующей активностей штамма L. reuteri LR1 и определения его пептидного профиля (проект № 16-16-00094).
Список литературы
Kundu P., Blacher E., Elinav E., Pettersson S. // Cell. Elsevier Inc. 2017. V. 171. № 7. P. 1481–1493.
Ly N.P., Litonjua A., Gold D.R., Celedon J.C. // Allergy Clin. Immunol. 2011. V. 127. № 5. P. 1087–1094.
Zoumpopoulou G., Pot B., Tsakalidou E., Papadimitriou K. // Int. Dairy J. 2017. V. 67. P. 46–60.
Marco M.L., Heeney D., Binda S., Cifelli C.J., Cotter P.D., Foligné B., Gänzle M., Kort R., Pasin G., Pihlanto A., Smid E.J., Hutkins R. // Curr. Opin. Biotech. 2017. V. 44. P. 94–102.
Probiotics in Food. Health and Nutritional Properties and Guidelines for Evaluation. World Health Organization. FAO Food and Nutritional Paper 85. Rome: FAO/WHO working group, 2006. P. 56
Freeman H.J. // Cancer Research. 1986. V. 46. № 11. P. 5529–5532.
Le-Blanc J.G., Garro M.S., Savoy de Giori G. // Appl. Microbiol. Biotechnol. 2004. V. 65. № 1. P. 119–123.
Ahotupa M., Saxelin M., Korpela R. // Nutr. Today Suppl. 1996. V. 31. P. S51–S52.
Ström K., Sjögren J., Broberg A., Schnürer J. // Appl. Environ. Microbiol. 2002. V. 68. № 9. P. 4322–4327.
O’Connor P.M., Ross R.P., Hill C., Cotter P.D. // Curr. Opin. Food Sci. Elsevier Ltd. 2015. V. 2. P. 51–57.
Буланова Е.М., Буланова У.М., Богданова Н.М., Лобанова Е.А., Габрусская Т.В. // Педиатрия. 2010. Т. 89. № 3. С. 84–90.
Naghmouchi K., Belguesmia Y., Bendali F., Spano G., Seal B.S., Drider D. // Crit. Rev. Food Sci. Nutr. 2019. https://doi.org/10.1080/10408398.2019.1688250
Фёдорова Т.В., Васина Д.В., Бегунова А.В., Рожкова И.В., Раскошная Т.А., Габриэлян Н.И. // Прикл. биохимия и микробиология. 2018. Т. 54. № 3. С. 1.
Бегунова А.В., Рожкова И.В., Ширшова Т.И., Глазунова О.А., Фёдорова Т.В. // Биотехнология. 2019. Т. 35. № 5. С. 58–69.
Adler-Nissen J. // J. Agric. Food Chem. 1979. V. 27. № 6. P. 1256–1979.
Ou B., Hampsch-Woodill M., Prior R.L. // J. Agric. Food Chem. 2001. V. 49. P. 4619–4626.
Moore J., Cheng Z., Su L., Yu L. // J. Agric. Food Chem. 2006. V. 54. P. 9032–9045.
Торкова А.А., Рязанцева К.А., Агаркова Е.Ю., Кручинин А.Г., Центалович М.Ю., Фёдорова Т.В. // Прикладная биохимия и микробиология. 2017. Т. 53. № 6. С. 580–591.
Owusu-Kwarteng J., Tano-Debrah K., Akabanda F., Jespersen L. // BMC Microbiology. 2015. 15:261. https://doi.org/10.1186/s12866-015-0602-6
Fontana A., Falasconi I., Molinari P., Treu L., Basile A., Vezzi A., Campanaro S., Morelli L. // Front. Microbiol. 2019. 10:1380. https://doi.org/10.3389/fmicb.2019.01380
Pino A., Bartolo E., Caggia C., Cianci A., Randazzo C.L. // Scientific Reports. 2019. 9:3355. https://doi.org/10.1038/s41598-019-40304-3
Семенихина В.Ф., Рожкова И.В., Бегунова А.В., Федорова Т.В., Ширшова Т.И. // Вопросы питания. 2018. Т. 87. № 5. С. 54–61.
Baum F., Fedorova M., Ebner J., Hoffmann R., Pischetsrieder M. // J. Proteome Res. 2013. V. 12. P. 5447–5462. https://doi.org/10.1021/pr4003273
Arakawa K., Matsunaga K., Takihiro S., Moritoki A., Ryuto S., Kawai Y., Masuda T., Miyamoto T. // J. Dairy Sci. 2015. V. 98. P. 1593–1603. https://doi.org/10.3168/jds.2014-8860
Sadat-Mekmene L., Genay M., Atlan D., Lortal S., Gagnaire V. // Int. J. Food Microbiol. 2011. V. 146. P. 1–13.
Exterkate F.A. // Int. Dairy J. 1995. V. 5. P. 995–1018.
Villegas J.M., Brown L., Savoy de Giori G., Hebert E.M. // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 4277–4286.
Hebert E.M., Mamone G., Picariello G., Raya R.R., De Giori G.S., Ferranti P., Addeo F. // Appl. Environ. Microbiol. 2008. V. 74. P. 3682–3689.
Solieri L., De Vero L., Tagliazucchi D. // Int. Dairy J. 2018. V. 85. P. 237–246.
Sridhar V.R., Hughes J.E., Welker D.L., Broadbent J.R., Steele J.L. // Appl. Environ. Microbiol. 2005. V. 71. № 6. P. 3025–303.
Scolari G., Vescovo M., Zacconi C., Vescovi F. // J. Dairy Sci. 2006. V. 89. P. 3800–3809.
Reid J.R., Moore C.H., Midwinter G.G., Pritchard G.G. // Appl. Microbiol. Biot. 1991. V. 35. P. 222–227.
Nielsen S.D., Beverly R.L., Qu Y., Dallas D.C. // Food Chem. 2017. V. 232. P. 673–682.
Torres-Llanez M.J., González-Córdova F., Hernandez-Mendoza A., Garcia H.S., Vallejo-Cordoba B. // J. Dairy Sci. 2011. V. 94. P. 3794–3800. https://doi.org/10.3168/jds.2011-4237
Miguel M., Recio I., Ramos M., Delgado M.A., Aleixandre M.A. // J. Dairy Sci. 2006. V. 89. P. 3352–3359.
Van der Ven C., Gruppen H., de Bont D.B., Voragen A.G. // J. Agric. Food Chem. 2002. V. 50. № 10. P. 2938–46.
Abubakar A., Saito T., Kitazawa H., Kawai Y., Itoh T. // J. Dairy Sci. 1998. V. 81. P. 3131–3138.
Korhonen H., Pihlanto A. // Curr. Pharm. Des. 2007. V. 13. P. 829–843.
FitzGerald R.J., Murray B.A., Walsh D.J. // J. Nutr. 2004. V. 134. P. 980S–988S.
Ali E., Nielsen S.D., Abd-El Aal S., El-Leboudy A., Saleh E., LaPointe G. // Front. Nutr. 2019. V. 6. P. 152. https://doi.org/10.3389/fnut.2019.00152
Kohmura M., Nio N., Ariyoshi Y. // Agric. Biol. Chem. 1990. V. 54. P. 1101–1102.
Robert M.C., Razaname A., Mutter M., Juillerat M.A. // J. Agric. Food Chem. 2004. V. 52. P. 6923–6931. https://doi.org/10.1021/jf049510t
Del Mar Contreras M., Carrón R., Montero M.J., Ramos M., Recio I. // Int. Dairy J. 2009. V. 19. P. 566–573. https://doi.org/10.1016/j.idairyj.2009.05.004
Tauzin J., Miclo L., Gaillard J.-L. // FEBS Lett. 2002. V. 531. P. 369–374.
Aguilar-Toalá J.E., Santiago-López L., Peres C.M., Peres C., Garcia H.S., Vallejo-Cordoba B., González-Córdova A.F., Hernández-Mendoza A. // J. Dairy Sci. 2017. V. 100. № 1. P. 65–75.
Nejati. F., Rizzello C.G., DiCagno R., Sheikh-Zeinoddin M., Diviccaro A., Minervini F., Gobbetti M. // LWT – Food Sci. Technol. 2012. V. 51. P. 183–189.
Pihlanto A., Virtanen T., Korhonen H. // Int. Dairy J. 2010. V. 20. P. 3–10.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


