Прикладная биохимия и микробиология, 2020, T. 56, № 5, стр. 483-496
Анализ и выделение вторичных метаболитов гриба Bipolaris sorokiniana различными методами хроматографии и спектр их биологической активности
А. О. Берестецкий 1, *, А. А. Далинова 1, В. Р. Дубовик 1, Е. Н. Григорьева 1, Д. М. Кочура 2, И. В. Сендерский 1, С. Н. Смирнов 3, Е. А. Степанычева 1, С. М. Тураева 4
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
2 НИИ гигиены, профпатологии и экологии человека
188663 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
4 Институт химии растительных веществ АН РУз
100170 Ташкент, Узбекистан
* E-mail: aberestetskiy@vizr.spb.ru
Поступила в редакцию 30.12.2019
После доработки 14.04.2020
Принята к публикации 22.04.2020
Аннотация
Выделены и охарактеризованы вторичные метаболиты четырех изолятов космополитного гриба B-ipolaris sorokiniana различного географического происхождения. Анализ экстрактов культуральной жидкости и твердофазных культур методами ТСХ и ВЭЖХ-МС показал высокое сходство качественного состава метаболитов у изученных изолятов B. sorokiniana. С использованием колоночной хроматографии и препаративной ВЭЖХ из экстрактов твердофазных культур очищено 14 соединений (терпенов, ксантонов, хинонов и др.), 12 из которых было идентифицировано. Максимальную фитотоксическую активность на листьях пшеницы проявляла хлоромонилиниковая кислота В (ХМКВ). Выделенные соединения в различной степени ингибировали рост Bacillus subtilis, наиболее сильно – метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилат (МГМХК). Впервые у некоторых метаболитов B. sorokiniana (ХМКВ, МГМХК) обнаружена инсектицидная активность в отношении злаковой тли. Все выделенные метаболиты (особенно кохлиохиноны и фузапролиферин) были токсичны в отношении культуры клеток Sf9. Изученные вещества не проявляли острой токсичности в отношении инфузории-туфельки. Широкий набор синтезируемых биологически активных метаболитов может определять высокую токсигенность и конкурентоспособность B. sorokiniana в различных экологических нишах.
Космополитный гриб Bipolaris sorokiniana поражает различные органы травянистых, преимущественно злаковых, растений и способен развиваться эндофитно, эпифитно и в почве. Этот микромицет является широко распространенным возбудителем корневой гнили и листовой пятнистости злаковых культур, нанося значительный экономический урон. Инфицирование зерна злаков этим фитопатогеном приводит к снижению их качества и всхожести, а также накоплению в них микотоксинов (например, стеригматоцистина) [1–4].
Начатые в середине 20 века исследования биологически активных метаболитов B. sorokiniana продолжаются до настоящего времени, позволяя обнаруживать все новые и новые соединения. Среди них встречаются вещества различной биологической активности (фитотоксической, антимикробной, нематицидной, цитотоксической и др.) и химической структуры (рис. 1, табл. 1). Возможно, метаболиты B. sorokiniana могут обладать и инсектицидными свойствами [5].
Рис. 1.
Вторичные метаболиты, выделенные из B. sorokiniana: 1 – кохлиохинон А, 2 – кохлиохинон В, 3 – кохлиохинон D, 4 – ангидрокохлиохинон А, 5,6 – α,β-диверсолоновые эфиры, 7 – метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилат, 8 – монилифенон, 9 – хлоромонилиниковая кислота В, 10 – хлоромонилиниковая кислота D, 11 – фузапролиферин, 12 – терпестацин, 13 – гельминтоспорол, 14 – виктоксинин, 15 – спиростафилотрихин R, 16 – спиростафилотрихин U, 17 – стеригматоцистин, 18 – биполароксин.
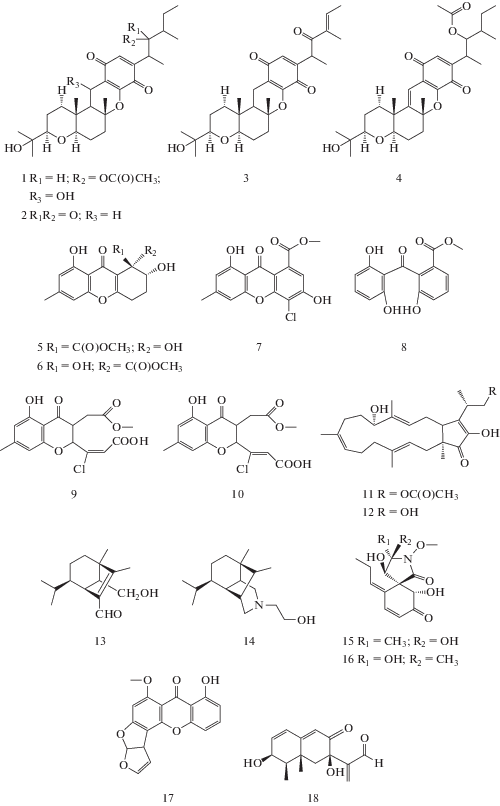
Таблица 1.
Биологически активные вторичные метаболиты B. sorokiniana и их характеристика
| Название | M, Да | УФ λ макс, нм | Активность* | Ссылка |
|---|---|---|---|---|
| Стеригматоцистин | 324 | 240, 282, 321 | ЦА | [6, 7] |
| Хлоромониликовая кислота B | 352 | 205, 247, 333 | ФА | [8, 9] |
| Метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилат | 334 | 242, 309, 353 | АМ | [9] |
| Цинодонтин | 286 | 241, 295, 471, 483, 503, 514, 539, 552 | АМ | [10] |
| Гельминтоспорин | 270 | 252, 256, 287, 475, 490, 512, 526 | АМ | |
| Прегельминтоспорол | 236 | Нет | ФА, АМ | [11] |
| Виктоксинин | 263 | Нет | ФА | [12] |
| Гельминтоспораловая кислота | 250 | Нет | ФА | [13] |
| Гельминтоспорол | 236 | 266 | ФА | |
| Гельминтоспорал | 234 | 266 | ФА | [14] |
| Сорокианин | 308 | Нет | ФА | [15] |
| Биполароксин | 262 | 216, 279 | ФА | [16] |
| Сорокиниол | 374 | Нет | ИФ | [17] |
| BZR котоксин-I | 967 | Нет | ФА, ИФ | |
| 11-эпитерпестацин (терпестацин, сикканол) |
402 | 264 | ФА, АМ | [18, 19] |
| Кохлиохинон А | 532 | 245, 280, 390, 270, 399 | НА, ФА | [20, 21] |
| Кохлиохинон B | 472 | 260,395 | ЦА, ФА | [22] |
| Кохлиохинон H | 470 | 203, 268 | ЦА | |
| Кохлиохинон C | 488 | 240, 280 | ЦА, ФА | [23] |
| Кохлиохинон D | 470 | 260, 400 | ЦА | |
| Кохлиохинон E | 488 | 257 | ЦА, ФА | |
| Биполарсеринол | 302 | 264, 340 | ИФ | [24] |
Исследования по выделению и характеристике метаболитов B. sorokiniana проводились рядом научных групп с использованием различных подходов и в разные годы. Это не позволяет представить общую картину разнообразия вторичных метаболитов этого гриба и спектр их биологической активности.
Цель работы – сравнение хроматографических профилей экстрактов из культур различных по географическому происхождению изолятов B. sorokiniana, идентификация биологически активных веществ (БАВ) экстрактов гриба и определение спектра биологической активности хроматографических фракций и полученных индивидуальных соединений.
МЕТОДИКА
Культивирование грибов и получение экстрактов. Изоляты B. sorokiniana были предоставлены сотрудником лаборатории иммунитета растений к болезням Всероссийского института защиты растений А.В. Анисимовой (Россия). Изоляты были выделены из образцов злаков, собранных в различных природно-климатических зонах России и Республики Беларусь: ЛО (листья ячменя, Ленинградская область, Россия), Бр20 (листья пшеницы, Республика Беларусь), К7 (листья пшеницы, Курганская обл., Россия), ПК (листья пшеницы, Приморский край, Россия). Культуры грибов хранили в пробирках на стандартной среде картофельно-глюкозном агаре (КГА) при температуре 5°С.
Экстракты B. sorokiniana получали согласно разработанному нами протоколу [5]. Для этого грибы культивировали в культуральных матрацах на 2 л с 400 мл жидкой питательной среды ДМГ, содержащей (г/л): дрожжевой экстракт – 4, мальтозный экстракт – 10, глюкоза – 10, а также в конических колбах объемом 500 мл на твердой среде, содержащей 60 г перловой крупы и 40 мл воды. Субстраты стерилизовали автоклавированием в течение 20 мин при 121°С. В качестве посевного материала использовали блоки диаметром 5 мм из края недельных колоний B. sorokiniana, полученных на КГА при 24°С. Культуры грибов инкубировали в темноте в течение 3 нед при постоянной температуре 24°С. Для улучшения аэрации и предотвращения комкования твердофазных культур колбы ежедневно тщательно встряхивали. Культивирование грибов выполняли в 4 повторностях.
Метаболиты B. sorokiniana экстрагировали из культуральной жидкости (400 мл) этилацетатом (двумя порциями по 200 мл). Для извлечения метаболитов из твердофазных культур B. sorokiniana 10 г высушенного и грубоизмельченного биоматериала экстрагировали 50%-ным водным ацетоном (двумя порциями по 100 мл). Из экстракта, полученного 50%-ным ацетоном, упаривали органический растворитель на ротационном испарителе при 40°С, а затем метаболиты гриба переэкстрагировали из оставшейся водной вытяжки этилацетатом (двумя порциями по 50 мл). Остатки воды в этилацетатных экстрактах удаляли с помощью безводного сульфата натрия, после чего растворитель отгоняли на ротационном испарителе при 40°С. Сухой остаток взвешивали.
Биологическая активность. Для оценки фитотоксической и инсектицидной активности сухой остаток экстрактов или хроматографических компонентов растворяли в этаноле и объем раствора доводили водой, чтобы конечная концентрация спирта составляла 5%, а остатков или компонентов – 0.5% (чистых веществ – 0.1%).
Для определения фитотоксической активности экстрактов во влажную камеру (контейнер с фильтровальной бумагой, смоченной водой) помещали отрезки листьев пшеницы длиной ~2 см. Каждый вариант включал 12 отрезков, в шести из которых в центре листа при помощи препарировальной иглы делали надкол. В центр каждого листового сегмента наносили 10 мкл 0.5%-го экстракта. Инкубацию проводили при переменном 12-часовом искусственном освещении и постоянной температуре 24°С. Через 48 ч измеряли длину некротического пятна.
Лабораторную популяцию обыкновенной злаковой тли (Schizaphis graminum) содержали на проростках пшеницы в термостатированном помещении при 22 ± 2°С и длительности светового дня 16 ч. Для оценки инсектицидной активности полученными спиртовыми растворами пропитывали диски фильтровальной бумаги (по 250 мкл на диск), которые помещали на дно и крышку чашки Петри диаметром 4 см. Там же размещали отрезок листа пшеницы 2 см (сорт Саратовская 29), смоченный указанными выше спиртовыми растворами, и выпускали на него по 20 особей тли. Смертность насекомых и эффективность обработок учитывали через 1 сут инкубирования при температуре 24°С.
Цитотоксическую активность экстрактов метаболитов изучали по отношению к клеточной линии Sf9 (ECACC 89070101) кукурузной лиственной совки (Spodoptera frugiperda), которая поддерживается в лаборатории микробиологической защиты ВИЗР (Санкт-Петербург, Россия). В лунки 48-луночного планшета вносили по 100 мкл 1%-ного экстракта, разведенного ацетоном, растворитель выпаривали. Сухой остаток растворяли в 20 мкл диметилсульфоксида, после чего в каждую лунку вносили 880 мкл питательной среды SF900II (“Thermo Fisher Scientific”, США) и 100 мкл суспензии активно растущих клеток (жизнеспособность не ниже 90%) в концентрации 3 × 105 кл./лунку. В результате концентрация экстракта была 100 мкг/мл, растворителя – 2%. Клетки инкубировали 24 ч при 27°С, окрашивали трипановым синим и определяли долю погибших (окрашенных) клеток по отношению к общему количеству (не менее 50) в нескольких полях зрения.
Оценку токсичности экстрактов проводили также и по отношению к клеткам инфузории-туфельки (Paramecium caudatum). Культуру инфузории, которая была предоставлена Д.О. Виноходовым (Санкт-Петербургский технологический университет, Россия), поддерживали на среде Лозина-Лозинского. В лунки 24-луночного планшета вносили по 0.5 мл суспензии клеток инфузории (примерно 100 кл./мл). К суспензии добавляли 5 мкл 1%-ного экстракта в ацетоне. Таким образом, конечная концентрация экстракта составила 100 мкг/мл, а ацетона – 1%. Каждый вариант включал 3 повторности. Выживаемость инфузорий анализировали через 3, 30 и 180 мин после начала эксперимента.
Антимикробную активность выделенных соединений определяли методом бумажных дисков (50 мкг/диск) на культуре Bacillus subtilis CIAM 106.
Хроматографический анализ экстрактов. Тонкослойная хроматография (ТСХ). Для анализа экстрактов методом ТСХ использовали нормально-фазовые пластины (TLC Silica gel 60 F254, 20 × 10 см, “Merck”, Германия) и хроматографическую систему (“Camag”, Швейцария), состоящую из автосамплера (ATS4) и УФ/ВИД-детектора (TLC Scanner). Сухой остаток экстрактов растворяли в ацетоне до концентрации 10 мг/мл и наносили распылением на пластины полосой, шириной 5 мм. Объем анализируемых проб составлял 10 мкл. Элюирование экстрактов осуществляли в камере 22 × 12 × 6 см (“Camag”, Швейцария) в системе растворителей толуол–этилацетат–уксусная кислота (60 : 40 : 1, об./об.). Предварительно были испытаны также системы толуол–этилацетат–уксусная кислота (70 : 30 : 1) и хлористый метилен–метанол (95 : 5). Компоненты экстрактов детектировали тремя способами: 1) с помощью УФ/ВИД-детектора при 200, 254, 270 и 340 нм; 2) визуально с помощью УФ-лампы на 254 нм (“Vilber-Lourmat”, Франция), 3) после дериватизации реагентом (серная кислота : анисовый альдегид : этанол в соотношении 1 : 1 : 8, по объему) с последующим нагреванием до 100°С 5 мин. Оценивали Rf веществ, их количество и площадь пиков или интенсивность полос, а также их окраску после дериватизации.
Высокоэффективная жидкостная хроматография (ВЭЖХ-МС). Для растворения сухих остатков экстрактов и хроматографических фракций использовался ацетонитрил. Их анализировали с использованием системы ВЭЖХ Acella с трехквадрупольным масс-спектрометрическим детектором TSQ Quantum Access™ (“Thermo Scientific”, США). Хроматографию осуществляли на колонке Acquity UPLC BEH C18 2.1 × 100 мм с зернением 1.7 мкм (“Waters”, США). Разделение экстрактов (объем вводимой пробы – 2 мкл) проводили при потоке элюента 250 мкл/мин при температуре колонки 40°С в системе ацетонитрил–0.1%‑ная муравьиная кислота в градиентном режиме: концентрация ацетонитрила повышалась от 10 до 100% в течение первых 10 мин, 100%-ный ацетонитрил в течение 5 мин, а с 15 до 16 мин концентрация ацетонитрила понижалась до 10% и поддерживалась на этом уровне еще 4 мин. Тип ионизации масс-детектора – термоэлектрораспыление, диапазон сканирования 50–1000 m/z в режиме положительно заряженных ионов. Детектирование веществ в экстрактах проводили сканированием в диапазоне 200–800 нм. Для сравнения метаболитных профилей экстрактов на хроматограммах анализировали время удерживания и УФ-спектры метаболитов, полученные с помощью диодно-матричного детектора. Хроматограммы анализировали с помощью программы MZmine 2 [25].
Препаративное разделение экстрактов и их анализ. Поскольку метаболитные профили экстрактов различных изолятов B. sorokiniana были качественно схожими, экстракты из культур, полученных на одинаковых субстратах, были объединены. Всего при помощи описанной методики извлечения было получено 3.7 г маслянистого экстракта из 1200 г сухого зернового субстрата, колонизированного B. sorokiniana. Из 1.6 л фильтрата жидкой культуры B. sorokiniana на ДМГ получено 335 мг экстракта. Компоненты экстракта были разделены колоночной хроматографией на силикагеле (диаметр частиц 60–200 мкм, “Merck”, Германия). Стеклянные колонки с соответствующим содержанием силикагеля (500 и 30 г) уравновешивали этилацетатом и гексаном, экстракт наносили на него методом сухой загрузки. Компоненты элюировали следующими системами растворителей: гексан–этилацетат 75 : 25 (элюент А), гексан–этилацетат 60 : 40 (элюент Б), этилацетат (элюент В) и метанол (элюент Г). Собранные фракции анализировали методом ТСХ в системах толуол-этилацетат-уксусная кислота (60 : 40 : 1, об./об.), а также хлористый метилен–метанол (9 : 1). Близкие по метаболитному составу фракции объединяли.
Из экстракта твердофазных культур B. sorokiniana получено 11 гомогенных фракций (ПФ 1–11), жидких культур – 6 фракций (ЖФ 1–6). Фракцию ПФ 11, проявившую широкий спектр биологической активности, дополнительно разделяли гель-фильтрацией на гидрофобном полимере Sephadex LH-20 (“GE”, США) в метаноле. Собранные фракции анализировали методом ТСХ в системе хлористый метилен–метанол (9 : 1) в результате чего было получено 6 гомогенных субфракций (ПФ 11.1–11.6). Все фракции анализировали при помощи ВЭЖХ-МС, их инсектицидную, цитотоксическую и фитотоксическую активность определяли, как описано выше.
Очистка и идентификация метаболитов. Для предварительной очистки метаболитов B. sorokiniana фракции, проявившие биологическую активность, разделяли при помощи обращенно-фазовой хроматографии на колонке Chromabond С18ес (масса сорбента 10 г, “Macherey–Nagel”, Германия). Сорбент кондиционировали 40 мл метанола и 40 мл воды. Фракции вносили в колонку методом сухой загрузки. Метаболиты элюировали водой, смесями вода–метанол с содержанием метанола 10, 25, 50 и 75% (об./об.), а также метанолом (по 100 мл). Элюаты упаривали на ротационном вакуумном испарителе при 40°С. Индивидуальные соединения из полученных субфракций очищали препаративной ВЭЖХ в системе ацетонитрил–0.1%-ная муравьиная кислота на колонках XBridge Prep С8 10 × 150 мм и Symmetry Shield RP18 19 × 150 мм, обе с зернением 5 мкм (“Waters”, США) в условиях, приведенных в табл. 2. Для этого использовали хроматографическую систему фирмы “Waters” (США), состоящую из насоса (Quaternaty Gradient Module 2545), детектора (UV/Visible Detector 2489) и коллектора фракций (Fraction Collector III).
Таблица 2.
Условия очистки и физико-химическая характеристика выделенных метаболитов Bipolaris sorokiniana
| Вещество | Объем модификатора в подвижной фазе, % | Скорость потока, мл/мин | Колонка* | tR, мин | λmax, нм | Характеристичные ионы в масс-спектрах, m/z | 1Н ЯМР |
|---|---|---|---|---|---|---|---|
| Сесквитерпен-1 | 55 | 6 | 1 | 4.3 | 265.2 | 237.07 [M + H]+ | 0.78 м, 0.90 м, 1.04 с, 1.05 м, 1.06 с, 1.45 дд, 1.76 м, 1.85 дд, 2.01 с, 3.17 м, 3.78 дд, 4.25 дд, 10.04 с |
| Метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилат | 45 | 24 | 2 | 5.4 | 241.5, 309.3, 353.0 | 334.93 [M + H]+, 302.91 [M + H–CH3OH]+ |
2.46 с, 4.04 с, 6.68 с, 6.87 с, 7.03 с, 12.10 с |
| Ангидрокохлиохинон А | 55 | 6 | 1 | 8.4 | 275.9, 493.2 | 515.21 [M + H]+ | 0.89 д, 0.90 т, 1.14 м, 1.16 м, 1.21 с, 1.22 с, 1.37 м, 1.56 с, 1.59 м, 1.60 м, 1.62 м, 1.71 м, 1.73 м, 1.82 м, 2.05 м, 2.06 с, 2.13 м, 2.32 м, 3.20 м, 5.04 дд, 6.33 с, 6.56 с, 6.6 ушс |
| Гельминтоспорол | 45 | 24 | 2 | 6.0 | 268.8 | 237.10 [M + H]+ | 0.77 д, 0.88 м, 0.98 ушс, 0.99 м, 1.04 с, 1.08 д, 1.41 м, 1.68 дд, 1.75 м, 2.02 с, 3.19 ушс, 3.33 дд, 3.65 дд, 10.0 с |
| Фузапролиферин | 50 | 6.6 | 1 | 5.2 | 196.7, 261.7 | 445.12 [M + H]+ | 1.02 с, 1.33 с, 1.59 м, 1.64 с, 1.66 м, 1.70 м, 1.72 м, 1.80 м, 1.95 м, 2.05 с, 2.04 м, 2.10 м, 2.12 м, 2.29 м, 2.40 м, 2.70 м, 4.08 дд, 4.28 м, 5.15 дд, 5.27 дд, 5.40 т, 5.51 с, 6.53 с |
| Кохлиохинон В | 50 | 6.6 | 1 | 6.2 | 203.8, 260.5, 402.3 | 473.21 [M + H]+, 455.21 [M + H–H2O]+ |
0.87 т, 0.89 с, 1.15 д, 1.17 с, 1.19 с, 1.20 м, 1.28 с, 1.29 д, 1.39 м, 1.46 дд, 1.50 м, 1.63 м, 1.80 м, 1.90 м, 2.14 дд, 2.18 м, 2.70 секс, 2.54 дд, 3.22 дд, 3.33 дд, 4.10 дкв, 6.50 д |
| Монилифенон | 45 | 24 | 2 | 3.5 | 199.1, 284.2 | 303.05 [M + H]+ | 2.21 с, 3.70 с, 6.21 с, 7.14 д, 7.29 т, 7.48 д |
| Сесквитерпен-2 | 45 | 24 | 2 | 5.3 | 248.6 | 235.10 [M + H]+ | 0.81 д, 0.99 м, 1.00 с, 1.04 м, 1.05 д, 1.22 м, 1.37 м, 1.66 м, 1.75 м, 2.04 с, 3.19 с, 3.44 м, 3.69 м |
| Кохлиохинон D | 55 | 6 | 1 | 4.1 | 199.1, 233.3, 401.1 | 471.16 [M + H]+, 453.09 [M + H–H2O]+ |
0.89 с, 1.17 с, 1.19 с, 1.20 м, 1.27 с, 1.27 д, 1.44 дд, 1.48 м, 1.77 ушс, 1.80 м, 1.87 д, 1.92 м, 2.13 м, 2.13 дд, 2.52 дд, 3.12 дд, 3.22 дд, 4.62 кв, 6.51 д, 6.86 кв |
| Кохлиохинон А | 55 | 6 | 1 | 4.9 | 196.7, 270.0, 397.5 | 533.13 [M + H]+, 515.15 [M + H–H2O]+ |
0.88 т, 0.89 д, 1.02 с, 1.15 д, 1.18 с, 1.19 с, 1.44 м, 1.56 м, 1.64 м, 1.74 м, 1.80 м, 1.92 м, 1.99 с, 2.09 м, 3.19 м, 3.27 м, 3.80 ушс, 5.00 м, 5.06 дд, 6.59 с |
| Диверсолоновые эфиры | 30 | 22 | 2 | 7.7 | 239.2, 327.2 | 320.94 [M + H]+, 302.94 [M + H–H2O]+ 270.94 [M + H–H2O–CH3OH]+ |
2.18 м, 2.39 с, 2.84 м, 2.94 м, 3.78 д, 4.01 м, 6.58 с, 6.75 д |
| Терпестацин | 40 | 6.6 | 1 | 7.6 | 190.9, 262.9 | 403.18 [M + H]+, 385.18 [M + H–H2O]+ |
0.99 с, 1.29 с, 1.57 с, 1.64 с, 1.63 с, 1.70 м, 1.72 м, 1.78 м, 1.92 м, 2.00 м, 2.09 м, 2.16 м, 2.26 м, 2.27 м, 2.37 м, 2.44 м, 2.68 м, 2.70 м, 3.80 дд, 3.89 дд, 4.06 дд, 5.13 м, 5.24 дд, 5.40 м, 6.90 ушс |
| Хлоромониликовая кислота B | 40 | 20 | 2 | 10.6 | 205.0, 247.4, 333.2 | 352.93 [M + H]+, 320.91 [M + H–CH3OH]+ |
2.42 с, 3.52 с, 3.69 с, 6.66 с, 6.71 с, 6.82 с |
| Хлоромониликовая кислота D | 40 | 20 | 2 | 11.4 | 203.8, 261.7, 335.5 | 352.91 [M + H]+, 320.90 [M + H–CH3OH]+ |
2.44 с, 3.65 с, 3.75 с, 6.68 с, 6.78 с, 6.86 с |
Для идентификации выделенных соединений были получены 1H и 13C спектры ЯМР на спектрометре Bruker AVANCE III 400 Ultrashield Plus (“Bruker”, Германия) с рабочей частотой 400.1 и 100.6 МГц соответственно. Для снятия спектров вещества были растворены в дейтерированном хлороформе (CDCl3). ВЭЖХ-МС индивидуальных соединений проводили в условиях, описанных выше. Соединения идентифицировали на основании УФ- и масс-спектров, 1Н- и 13С-спектров ЯМР, известных по литературе, и биологической активности метаболитов, выделенных из культур B. sorokiniana (табл. 1) и других видов рода Bipolaris. Инсектицидную, цитотоксическую и фитотоксическую активность индивидуальных соединений определяли, как было описано выше.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ метаболитных профилей экстрактов. Предварительные исследования с экстрактами из твердофазных культур B. sorokiniana позволили подобрать систему растворителей для разделения экстрактов методом ТСХ (толуол–этилацетат–уксусная кислота в соотношении 60 : 40 : 1, об./об.) и способ проявления хроматограмм реактивом на основе анисового альдегида и серной кислоты.
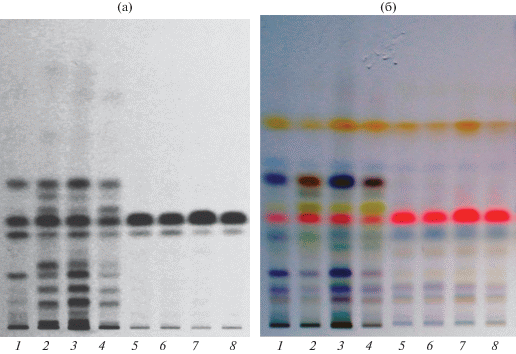
Визуальный анализ полученных хроматограмм показал, что экстракты из твердофазных культур характеризовались более сложным составом компонентов, чем экстракты из культуральной жидкости. При этом в зависимости от происхождения изолята гриба в них при УФ-детектировании было обнаружено от 8 до 11 полос при 254 нм и от 9 до 13 – при окрашивании реагентом. В экстрактах из культуральной жидкости этим методом выявлено всего 2 компонента при 254 нм и существенно больше – от 3 до 9 полос – после окрашивания. На рис. 2 приведена ТСХ-хроматограмма, которая хорошо иллюстрирует общее сходство составов метаболитов экстрактов из культур различных изолятов гриба и влияние на них субстрата.
Рис. 2.
Нормально-фазовые ТСХ-хроматограммы экстрактов B. sorokiniana в зависимости от происхождения изолята и состава субстрата, при использовании различных методик визуализации: а – визуализация при 254 нм, б – окрашивание реактивом на основе серной кислоты и анисового альдегида: 1 и 5 – изолят ЛО, 2 и 6 – Бр20, 3 и 7 – К7, 4 и 8 – ПК. 1–4 – экстракты из твердофазной культуры, 5–8 – из культуральной жидкости.
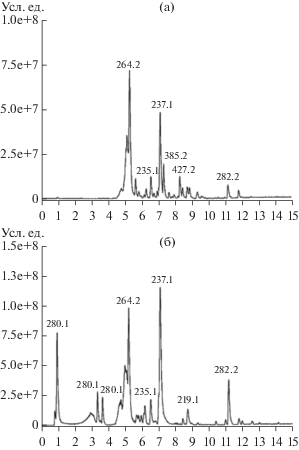
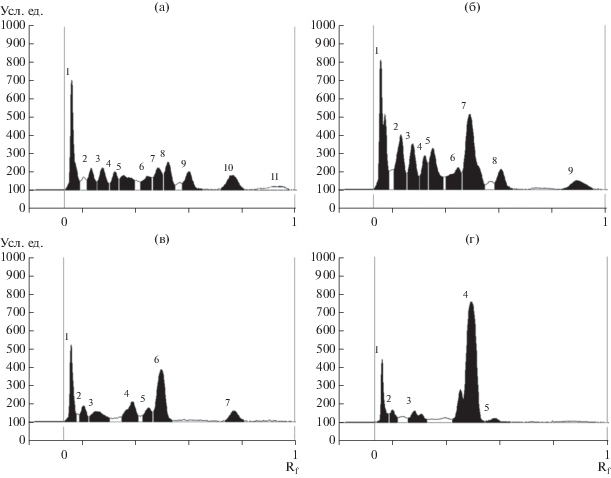
Эти же пластины были проанализированы при помощи УФ/ВИД-детектора при 200 нм (для выявления не поглощающих УФ сесквитерпенов) и 270 нм (для обнаружения поглощающих УФ терпенов и кохлиохинонов) (см. табл. 1). Сравнительный анализ полученных хроматограмм позволил дифференцировать экстракты по качественному составу метаболитов, образованных B. sorokiniana на жидком и твердом субстратах. В экстрактах из твердофазных культур различных изолятов B. sorokiniana при 200 нм было обнаружено до 11 компонентов и при 270 нм – до 9. Это оказалось несколько меньше, чем при визуальной оценке пластин, проявленных неспецифическим реактивом. В экстрактах из культуральной жидкости B. sorokiniana на среде ДМГ было детектировано до 7 компонентов при 200 нм и 5 – при 270 нм. При 270 нм мажорным во всех экстрактах было соединение с хроматографической подвижностью Rf 0.50, доминирующих пиков при λ 200 нм не было выявлено (рис. 3). Изучение состава экстрактов при других длинах волн было менее информативным.
Рис. 3.
Хроматограммы экстрактов твердых (а, б, перловая крупа) и жидких (в, г, КЖ, среда ДМГ) культур B. sorokiniana, полученные методом нормально-фазовой ТСХ при 200 (а, в) и 270 нм (б, г).
Анализ экстрактов из культур различных изолятов B. sorokiniana, полученных на одних и тех же субстратах, методом ВЭЖХ-МС, показал их высокое сходство по качественному составу мажорных метаболитов (рис. 4). Так, в экстрактах были обнаружены по 11 мажорных компонентов, которые различались временем удерживания и массами молекулярных ионов. В экстрактах из культуральной жидкости гриба на ДМГ и твердофазных культур на перловой крупе обнаружено 5 одинаковых компонентов, которые характеризовались временем удерживания (tR) 5.1 мин (m/z 262 Да), 5.4 мин (m/z 264 Да), 6.5 мин (m/z 235 Да), 7.1 мин (m/z 237 Да) и 8.7 мин (m/z 219 Да).
Мажорным метаболитом в экстрактах из культур гриба оказалось соединение с tR 7.1 мин, m/z 237 Да (рис. 4) и УФ-спектром с максимумом при 266 нм [26] (табл. 1). По данным работы [27] имеющий такую молекулярную массу, но не поглощающий УФ прегельминтоспорол при ионизации термоэлектрораспылением образует основной пик m/z 219 Да [М + H–Н2O]+, по-видимому, являясь менее стабильным, чем гельминтоспорол. Вещество с m/z 219 Да (tR 8.7 мин) было также обнаружено как минорный компонент экстрактов из культуральной жидкости (КЖ) гриба на среде ДМГ. Другой мажорный компонент, который можно было предварительно идентифицировать как виктоксинин, характеризовался tR около 5.4 мин и m/z 264 Да (рис. 4). Это соединение встречается у различных штаммов B. sorokiniana и обладает высокой фитотоксической активностью [12, 28].
В экстракте КЖ на ДМГ выявлен мажорный компонент с tR 1.0 мин и несколько минорных компонентов (tR 3.4 мин и 3.7 мин) с m/z 280 (рис. 4). По литературным данным таким зарядом может обладать осколочный ион [М + H–Н2O]+ некоторых спиростафилотрихинов (например, спиростафилотрихинов R и U) с молекулярной массой 297 Да [29]. Следует отметить, что соединения из группы спиростафилотрихинов ранее не обнаруживались у B. sorokiniana. Остальные соединения в экстрактах B. sorokiniana идентифицировать не удалось.
Биологическая активность и состав фракций. Из экстракта культуральной жидкости B. sorokiniana на ДМГ путем разделения на нормально-фазовой колонке получено 6 гомогенных фракций (ЖФ 1–6). Фитотоксическая активность была обнаружена во фракциях ЖФ 3, ЖФ 4 и ЖФ 6. Под воздействием соединений из фракций ЖФ 3 и 4 развивались поражения не только на поврежденных, но и на неповрежденных листовых отрезках пшеницы. Относительно слабую цитотоксическую активность продемонстрировали фракции ЖФ 4 и 5 в концентрации 50 мкг/мл. Остальные фракции не проявляли цитотоксическую активность даже при увеличении концентрации до 100 мкг/мл. Умеренную инсектицидную активность продемонстрировали фракции ЖФ 3 и 6 (табл. 2).
Во фракции ЖФ 3 основным метаболитом было не идентифицированное соединение с tR 5.1 мин и m/z 262 Да, а также три соединения с одной и той же молекулярной массой (m/z 468 Да), но с разными временами удерживания (7.5, 9.1 и 9.8 мин). Предположительно, эти соединения представляли собой кохлиохинон G (молекулярная масса 485 Да) и его изомеры, если осколочный ион 468 Да соответствовал [М + H–Н2O]+. Во фракции Ж4 основным было неизвестное соединение с m/z 332, а во фракции ЖФ 6 – соединение (предположительно виктоксинин) с tR 5.4 мин (m/z 264). Пять мажорных соединений остались не идентифицированными (табл. 3).
Таблица 3.
Спектр биологической активности хроматографических фракций, полученных из экстрактов B. sorokiniana, и обнаруженных в них соединений
| Номер фракции | Масса, мг | ЦА1 | ФА2 | ИА3 | Идентифицированные соединения или m/z мажорных компонентов | |
|---|---|---|---|---|---|---|
| БП | П | |||||
| Экстракт из культуральной жидкости культур на ДМГ | ||||||
| ЖФ3 | 14 | – | + | ++ | + | 262, 468, 468, 468 |
| ЖФ4 | 5 | + | + | ++ | – | 332 |
| ЖФ5 | 143 | – | – | + | – | Гельминтоспорол |
| ЖФ6 | 113 | + | – | ++ | + | Виктоксинин |
| Экстракт из твердофазных культур | ||||||
| ПФ2 | 162 | – | – | – | – | Не определено |
| ПФ3 | 560 | – | – | – | – | 237 |
| ПФ4 | 285 | – | + | + | – | Не определено |
| ПФ5 | 505 | – | – | + | ++ | Ангидрокохлиохинон А, метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилат |
| ПФ6 | 939 | ++ | – | + | + | Гельминтоспорол, фузапролиферин, кохлиохинон В, 731 |
| ПФ7 | 410 | ++ | – | + | ++ | Монилифенон, кохлиохинон А, кохлиохинон D, 335 |
| ПФ8 | 74 | ++ | – | – | ++ | |
| ПФ9 | 252 | – | – | + | + | α,β-диверсолоновые эфиры, терпестацин |
| ПФ10 | 359 | – | – | ++ | ++ | |
| ПФ11 | 2034 | ++ | – | + | ++ | Терпестацин, хлоромонилиниковая кислота В, хлоромонилиниковая кислота D |
| ПФ11.1 | 302 | ++ | – | + | – | |
| ПФ11.2 | 287 | ++ | – | + | + | |
| ПФ11.3 | 290 | ++ | – | ++ | + | |
| ПФ11.4 | 360 | ++ | – | + | – | |
| ПФ11.5 | 150 | ++ | – | – | – | |
| ПФ11.6 | 7 | ++ | – | ++ | + | |
* ЦА – цитотоксическая активность, “–” – от 0 до 25%, “+” – от 25 до 75%, “++” – от 75 до 100% погибших клеток линии Sf9 через 24 ч после обработки 50 мкг/мл экстракта из КЖ или 10 мкг/мл экстракта из твердофазной культуры; ** ФА – фитотоксическая активность, (длина некротического пятна, мм) через 48 ч после обработки, “–” – от 0–1 мм, “+” – от 1–3 мм, “++” от 4 –5 мм, БП – отрезки листьев пшеницы без повреждений, П – с повреждением. *** ИА – инсектицидная активность (% гибели злаковой тли относительно контроля через 24 ч после обработки), “–” – от 0– 25%, “+” – от 25– 75%, “++” – от 75–100%.
К фитотоксинам гриба, образующимся на зерновом субстрате, были чувствительны только поврежденные отрезки листьев пшеницы. Наиболее высокой фитотоксичностью на них обладали фракции ПФ 10 и 11.3. Фракции ПФ 6–8 и ПФ 11, а также все субфракции последней продемонстрировали относительно высокий уровень цитотоксической активности при концентрации 10 мкг/мл. Инсектицидную активность проявляли фракции ПФ 5, 7, 8, 10 и ПФ 11, а также ПФ 11.2, 11.3 и 11.6. При этом инсектицидная активность фракций ПФ 5, 9 и 10 не была связана с их цитотоксической активностью, а фракций ПФ 8 – фитотоксической активностью (табл. 3).
Из хроматографических фракций, проявивших заметную биологическую активность, было очищено 14 индивидуальных соединений (табл. 3). Их структура была установлена спектральными методами путем сравнения с данными литературы (табл. 1). Однако значительная часть соединений осталась не идентифицированной. Так, из фракции ПФ 3 были выделены неидентифицированные сесквитерпен-1 (молекулярная масса 236 Да, УФ максимум при 265 нм) и сесквитерпен-2 (молекулярная масса 234 Да, УФ максимум при 249 нм). Во фракциях ПФ 5–8 были обнаружены виктоксинин и гельминтоспорол, однако при этом отмечено высокое содержание соединений с молекулярными массами от 400 до 600 Да, которые предположительно можно было отнести к группе кохлиохинонов. Из них удалось выделить и идентифицировать 4 соединения этой группы. Во фракции ПФ 6 в качестве доминирующего оказалось неизвестное соединение, характеризующееся m/z 731 (табл. 3).
Выделенные и идентифицированные в работе метаболиты B. sorokiniana относились к таким группам природных соединений, как сесквитерпены (гельминтоспорол, виктоксинин и родственные им соединения), сестертерпеноиды (фузапролиферин и терпестацин), хиноны (кохлиохиноны A, B и D, ангидрокохлиохинон А), хромоны (диверсолоновые эфиры и монилифенон) и хлорированные ксантоны (метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилат) и их производные (хлоромонилиниковые кислоты B и D). Следует отметить, что ангидрокохлиохинон А [30], монилифенон [31] и диверсолоновые эфиры [32], обнаруженные ранее у B. oryzae, Monilinia fructicola и Penicillium diversum соответственно, были найдены у B. sorokiniana впервые.
В результате анализа ВЭЖХ-МС и препаративного разделения экстрактов не удалось обнаружить и выделить биполароксин, который по данным работы [16] является доминирующим фитотоксином в экстрактах B. sorokiniana. Можно предположить, что это соединение, как и структурно близкие к нему эремофиланы, является крайне нестабильным и быстро разрушается в воде и на силикагеле [33]. Несмотря на наличие у некоторых компонентов экстрактов характерных для ксантонов УФ-спектров, основной микотоксин этого гриба – стеригматоцистин в анализируемых экстрактах различных изолятов гриба выявлен не был (табл. 2). Можно предположить, что этот микотоксин следует детектировать на начальных фазах роста гриба, как было показано ранее в работе [34].
Спектр биологической активности метаболитов B. sorokiniana. Большинство соединений, которые ранее выделялись из B. sorokiniana, были оценены по 1 или 2 типам биологической активности, преимущественно, фитотоксической или цитотоксической (табл. 1). В данной работе показано, что все 14 выделенных и идентифицированных соединений показали более широкий спектр действия.
Так, относительно высокой фитотоксической активностью на листьях пшеницы в концентрации 1 мг/мл обладали кохлиохинон А, терпестацин и хлоромониликовая кислота В, что подтверждало полученные ранее данные об их высокой фитотоксичности (табл. 1, 3). Фитотоксичными для пшеницы были также гельминтоспорол, не идентифицированный сесквитерпен 2 и фузапролиферин (табл. 3).
Большинство выделенных соединений (исключение составляли лишь хлоромонилиниковые кислоты) в различной степени ингибировало рост грамположительной бактерии B. subtilis в концентрации 50 мкг/диск. Подтверждена также относительно высокая антимикробная активность кохлиохинона А и метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилата (МГМХК), а также умеренная – гельминтоспорола (табл. 1) и ангидрокохлиохинона А [35]. Впервые была обнаружена антибактериальная активность у кохлиохинонов В и D, а также диверсолоновых эфиров. Оба не идентифицированных сесквитерпена также обладали высокой антибактериальной активностью (зона лизиса около 8 мм), в связи с этим идентификация их структуры представляет интерес для дальнейших исследований.
Можно предположить, что столь богатый набор веществ, проявляющих антимикробные свойства, одновременно образуемых B. sorokiniana, необходим для выживания в почве и на растительных остатках, а также для конкуренции с другим фитопатогенами. Библиотека выделенных веществ может представлять интерес для изучения их аддитивного и синергетического эффектов на широком круге микроорганизмов почвы и филлосферы, а также для определения их экологической роли в развитии B. sorokiniana.
В работе впервые изучена инсектицидная активность метаболитов B. sorokiniana. Относительно высокую активность при концентрации 1 мг/мл (0.2 мг/дм2) по отношению к злаковой тле с эффективностью на уровне 80% показали МГМХК и хлоромонилиниковая кислота В. Примерно в 2 раза ниже была инсектицидная активность у кохлиохинонов А и В, а также у монилифенона (табл. 4). По данным работы [36] стеригматоцистин оказывал ларвицидные свойства по отношению к личинкам малярийного комара Anopheles gambiae с ЛД90 100 мкг/мл.
Таблица 4.
Спектр биологической активности метаболитов Bipolaris sorokiniana6
| Метаболит | Активность | |||||
|---|---|---|---|---|---|---|
| фитотоксическая1 | антимикробная2 | инсектицидная3 | цитотоксическая | |||
| инфузории4 | Sf95 | |||||
| 50 мкг/мл | 5 мкг/мл | |||||
| Гельминтоспорол | 1.5 ± 0.5 | 4.3 ± 1.5 | 8.6 ± 2.4 | – | 79.1 ± 13.3 | 0 |
| Сесквитерпен-1 | 0.7 ± 0.5 | 8.0 ± 1.0 | 10.0 ± 1.1 | – | 85.9 ± 9.2 | 0 |
| Сесквитерпен-2 | 1.8 ± 1.0 | 7.7 ± 1.2 | 17.2 ± 8.3 | – | 52.8 ± 28.4 | 0 |
| Кохлиохинон А | 2.0 ± 0.6 | 7.7 ± 0.6 | 45.0 ± 20.2 | + | 98.7 ± 1.6 | 100 ± 0 |
| Ангидрокохлиохинон А | 0 | 3.7 ± 0.6 | 26.3 ± 11.0 | ++ | 98.7 ± 0.9 | 100 ± 0 |
| Кохлиохинон В | 1.0 ± 0 | 5.0 ± 0.0 | 32.3 ± 12.6 | + | 100 ± 0 | 100 ± 0 |
| Кохлиохинон D | 1.3 ± 0.8 | 7.3 ± 1.5 | 27.3 ± 12.1 | + | 99.2 ± 0.5 | 99.6 ± 0.4 |
| Фузапролиферин | 1.7 ± 0.5 | 6.0 ± 1.0 | 17.3 ± 6.3 | – | 98.7 ± 0.9 | 99.3 ± 0.9 |
| Терпестацин | 2.2 ± 0.4 | 5.0 ± 0 | 14.8 ± 5.9 | ++ | 100 ± 0 | 0 |
| Метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилат | 0.5 ± 0.5 | 12.0 ± 0 | 80.0 ± 8.5 | ++ | 100 ± 0 | 0 |
| Монилифенон | 1.5 ± 0.5 | 3.0 ± 1.0 | 42.5 ± 23.6 | – | 64.2 ± 8.2 | 0 |
| Диверсолоновые эфиры | 0 | 6.7 ± 0.6 | 14.5 ± 9.4 | – | 82.3 ± 12.2 | 0 |
| Хлоромонилиниковая кислота В | 2.8 ± 0.8 | 0 | 73.8 ± 9.1 | – | 46.3 ± 8.1 | 0 |
| Хлоромонилиниковая кислота D | 1.2 ± 0.8 | 0 | 5.0 ± 4.8 | – | 53.0 ± 16.5 | 0 |
1 Длина некротического пятна на отрезках листьев пшеницы, мм (концентрация тестируемых веществ 1 мг/мл). 2Радиус зоны ингибирования роста Bacillus subtilis, мм (50 мкг/диск). 3Смертность злаковой тли относительно контроля, % (1 мг/мл, 0.2 мг/дм2). 4“+”, “++”, “+++” – гибель инфузорий наступала через 180, 30 и 3 мин соответственно (50 мкг/мл), “–” – клетки не гибли. 5Смертность клеток в тестовых лунках относительно контрольных, %. 6Указаны средние значения и стандартные отклонения.
Все выделенные соединения обладали выраженной в различной степени цитотоксической активностью. Высокую цитотоксическую активность либо по отношению к клеткам инфузорий, либо линии клеток Sf9 продемонстрировали соединения из группы кохлиохинонов, фузапролиферин, терпестацин и МГМХК. Остальные соединения продемонстрировали умеренную токсичность для клеток насекомых в относительно высокой концентрации 50 мкг/мл (табл. 4). Высокая цитотоксическая активность кохлиохинонов [22] и терпестацина [37] хорошо известна, и они рассматриваются как перспективные соединения для лечения различных онкологических заболеваний. Фузапролиферин оценивается как микотоксин также и у некоторых грибов рода Fusarium [38].
Таким образом, исследование показало высокое сходство состава метаболитов у изученных изолятов B. sorokiniana различного географического происхождения. Подтверждена продукция ими широкого спектра вторичных метаболитов различных групп: терпенов, ксантонов, хинонов, алкалоидов и других. При этом, образование в культурах B. sorokiniana таких метаболитов, как биполароксин и стеригматоцистин, требуют уточнения с учетом нестабильности первого и времени продукции второго. Биосинтез вторичных метаболитов широкого спектра действия, по-видимому, определяет способность гриба к отличной выживаемости и высокой конкурентоспособности в различных экологических нишах – почве, растениях и семенах. Многие из выявленных метаболитов перспективны для разработки лекарственных средств или пестицидов, поэтому B. sorokiniana можно считать их возможным продуцентом для использования в биотехнологии. Продукция грибом таких высокотоксичных веществ, как стеригматоцистин, кохлиохиноны, фузапролиферин, терпестацин и метил-8,3-гидрокси-3-метил-4-хлорксантон-1-карбоксилат, свидетельствует о необходимости оценки их накопления в пораженном им зерне.
Работа выполнена при финансовой поддержке РФФИ (проект № 17-04-01445), государственной программы “Провести фундаментальные исследования по химической экологии грибов филлосферы и оценить их биотехнологический потенциал как продуцентов новых биорациональных пестицидов” № 0665-2019-0025 (AAAA-A16-116080510099-8), а также при частичной поддержке Фонда Ель-Юрт (El-Yurt Umidi Foundation, Узбекистан).
Работа выполнена в Центре коллективного пользования “Инновационные технологии защиты растений” ФГБНУ ВИЗР и ресурсном центре “Магнитно-резонансные методы исследования” научного парка СПбГУ.
Список литературы
Семынина Т.В. // Защита и карантин растений. 2008. № 9. С. 24–25.
Niessen L. // Brewing Microbiology: Current Research, Omics and Microbial Ecology / Eds. N.A. Bokulich, C.W. Bamforth. Poole (U.K.): Caister Academic Press, 2017. P. 197–244.
Cegiełko M., Kiecana I., Mielniczuk E., Waśkiewicz A., Bocianowski J. // Acta Sci. Pol. Hortorum Cultu. 2018. V. 17. № 2. P. 149–166.
Gupta P.K., Chand R., Vasistha N.K., Pandey S.P., Kumar U., Mishra V.K., Joshi A.K. // Plant Pathol. 2018. V. 67. № 3. P. 508–531.
Берестецкий А.О., Григорьева Е.Н., Петрова М.О., Степанычева Е.А. // Микол. и фитопатол. 2018. Т. 52. № 6. С. 408–419.
Maes C.M., Steyn P.S. // J. Chem. Soc. Perkin Trans. I. 1984. P. 1137–1140.
Nieto C.H.D., Granero A.M., Zon M.A., Fernández H. // Food Chem. Toxicol. 2018. V. 118. P. 460–470.
Masi M., Meyer S., Clement S., Pescitelli G., Cimmino A., Cristofaro M., Evidente A. // J. Nat. Prod. 2017. V. 80. № 10. P. 2771–2777.
Han J., Zhang J., Song Z., Liu M., Hu J., Hou C., Zhu G., Jiang L., Xia X., Quinn R.J., Feng Y., Zhang L., Hsiang T., Liu X. // Appl. Microbiol. Biotechnol. 2019. V. 103. № 13. P. 5167–5181.
Engstrom K., Brishammar S., Svensson C., Bengtsson M., Andersson R. // Mycol. Res. 1993. V. 97. № 3. P. 381–384.
Åkesson H., Jansson H.-B. Monitoring Antagonistic Fungi Deliberately Released into the Environment. / Eds. D.F. Jensen, H.B. Jansson, A. Tronsmo. Dordrecht: Springer, 1996. P. 99–104.
Pena-Rodriguez L.M., Chilton W.S. // J. Nat. Prod. 1989. V. 52. № 4. P. 899–901.
Qader M.M., Kumar N.S., Jayasinghe L., Araya H., Fujimoto Y. // Mycology. 2017. V. 8. № 1. P. 17–20.
Mayo de P., Spencer E.Y., White R.W. // Can. J. Chem. 1961. V. 39. № 8. P. 1608–1612.
Nakajima H., Isomi K., Hamasaki T. // Tetrahedron Lett. 1994. V. 35. № 51. P. 9597–9600.
Jahani M., Aggarwal R., Gupta S., Sharma S., Dureja P. // Cereal Res. Comm. 2014. V. 42. № 2. P. 252–261.
Ali L., Khan A.L., Hussain J., Al-Harrasi A., Waqas M., Kang S.-M., Al-Rawahi A., Lee I.-J. // BMC Microbiology. 2016. V. 16. Article № 103. https://doi.org/10.1186/s12866-016-0722-7
Nihashi Y., Lim C.-H., Tanaka C., Miyagawa H., Ueno T. // Biosci. Biotechnol. Biochem. 2002. V. 66. № 3. P. 685–688.
Cimmino A., Sarrocco S., Masi M., Diquattro S., Evidente M., Vannacci G., Evidente A. // Chemistry & Biodiversity. 2016. V. 13. № 11. P. 1593–1600.
Schaeffer J.M., Frazier E.G., Bergstrom A.R., Williamson J.M., Liesch J.M., Goetz M.A. // J. Antibiotics. 1990. V. 43. № 9. P. 1179–1182.
Miyagawa H., Nagai S., Tsurushima T., Sato M., Ueno T., Fukami H. // Biosci., Biotechnol., Biochem. 1994. V. 58. № 6. P. 1143–1145.
Wang M., Sun Z.-H., Chen Y.-C., Liu H.-X., Li H.-H., Tan G.-H., Li S.-N., Guo X.-L., Zhang W.-M. // Fitoterapia. 2016. V. 110. P. 77–82.
Lim C.-H., Miyagawa H., Akamatsu M., Nakagawa Y., Ueno T. // J. Pesticide Sci. 1998. V. 23. № 3. P. 281–288.
Khan A. L., Ali L., Hussain J., Rizvi T.S., Al-Harrasi A., Lee I.-J. // Molecules. 2015. V. 20. № 7. P. 12 198–12 208.
Pluskal T., Castillo S., Villar-Briones A., Orešič M. // BMC Bioinformatics. 2010. V. 11. Article № 395. https://doi.org/10.1186/1471-2105-11-395
Abdel-Lateff A., Okino T., Alarif W.M., Al-Lihaibi S.S. // J. Saudi Chem. Society. 2013. V. 17. № 2. P. 161–165.
Carlson H., Nilsson P., Jansson H.-B., Odham G. // J. Microbiol. Methods. 1991. V. 13. № 4. P. 259–269.
Pringle R.B. // Can. J. Biochem. 1976. V.54. № 9. P. 783–787.
De Almeida T.T., Ribeiro M.A. dos S., Polonio J.C., Garcia F.P., Nakamura C.V., Meurer E.C., Sarragiotto M.H., Baldoqui D.C., Azevedo J.L., Pamphile J.A. // Nat. Prod. Res. 2018. V. 32. № 23. P. 2783–2790.
Phuwapraisirisan P., Sawanga K., Siripong P., Tip-pyang S. // Tetrahedron Lett. 2007. V. 48. № 30. P. 5193–5195.
Kachi H., Sassa T. // Agric. Biol. Chem. 1986. V. 50. № 6. P. 1669–1671.
Holker J.S.E., O’Brien E., Simpson T.J. // J. Chem. Soc. Perkin Trans. 1983. № 1. P. 1365–1368.
Wang L., Li M., Tang J., Li X. // Molecules. 2016. V. 21. № 4. Article 473. https://doi.org/10.3390/molecules21040473
Rabie C.J., Lubben A.L., Steyn M. // App. Environ. Microbiol. 1976. V. 32. № 2. P. 206–208.
Campos F.F., Ramos J.P., de Oliveira D.M., Alves T.M.A., de Souza-Fagundes E.M., Zani C.L., Sampaio F.C., Converti A., Cota B.B. // J. Biosci. 2017. V. 42. № 4. P. 657–664.
Matasyoh J.C., Dittrich B., Schueffler A., Laatsch H. // Parasitol. Res. 2011. V. 108. № 3. P. 561–566.
Jung H.J., Shim J.S., Lee J., Song Y.M., Park K.C., Choi S.H., Kim N.D., Yoon J.H., Mungai P.T., Schumacker P.T., Kwon H.J. // J. Biol. Chem. 2010. V. 285. № 15. P. 11584–11595.
Stanković S., Levic J., Petrovic T., Logrieco A., Moretti A. // European J. Plant Pathol. 2007. V. 118. № 2. P. 165–172.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология