Прикладная биохимия и микробиология, 2020, T. 56, № 5, стр. 497-502
Синтез и антибактериальная активность наночастиц серебра, стабилизированных сукцинамидом хитозана
В. А. Александрова 1, *, А. М. Футорянская 1, **, В. С. Садыкова 2
1 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Россия
2 Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, Россия
* E-mail: alexandrova@ips.ac.ru
** E-mail: futoraynskaya@ips.ac.ru
Поступила в редакцию 12.03.2020
После доработки 06.04.2020
Принята к публикации 22.04.2020
Аннотация
Методом восстановления из ионов при действии микроволнового облучения в присутствии восстановителя D-глюкозы получены наночастицы серебра с использованием в качестве полимерной матрицы водорастворимого производного хитозана – сукцинамид хитозана. Присутствие наночастиц серебра в синтезируемом коллоидном растворе подтверждено методом УФ-спектроскопии. Согласно данным просвечивающей электронной микроскопии синтезированные наночастицы серебра имели сферическую форму, при этом размер частиц составлял 10–34 нм. Полученные дифрактограммы подтвердили наличие рефлексов, характерных для кристаллической решетки металлического серебра. Синтезированный коллоидный раствор наночастиц серебра in vitro проявлял выраженную антибактериальную активность по отношению к штаммам грамположительных бактерий Bacillus subtilis ATCC 6633 и B. coagulans 429.
В настоящее время разработка новых нанокомпозитов является стремительно развивающимся направлением в науке и технике. В связи с этим становится актуальной проблема создания нанокомпозитных материалов медицинского назначения на основе нетоксичных биодеградируемых полимеров природного происхождения. В качестве таких полимеров могут быть использованы полисахариды, в частности хитозан и его производные. Такие материалы могут найти применение при разработке ранозаживляющих лекарственных средств, имплантов для регенерации костной ткани, матриксов для тканевой инженерии, а также систем контролируемой доставки лекарственных веществ. С этой точки зрения большой интерес представляют металлополимерные нанокомпозиты, поскольку включение различных металлов, в частности серебра, в их состав позволяет получать материалы с заданными свойствами, в том числе с антимикробной активностью [1].
Хитозан не растворим в воде и получение его водорастворимых производных, синтезируемых путем введения различных функциональных групп в макромолекулу, позволяет значительно расширить возможности применения такого полимера в биологии и медицине. К числу таких производных относиться сукцинамид хитозана [2].
В настоящее время достаточно широко исследуется биологическая активность сукцинамида хитозана и возможность его использования для иммобилизации лекарственных веществ. Важно отметить, что N-сукцинил хитозан безопасен при внутривенном введении [3, 4], что позволяет использовать данный полимер в системах доставки противоопухолевых препаратов [5]. Помимо этого, N-сукцинил хитозан проявляет антиагрегативную и антиоксидантную активность [6].
Синтез наночастиц серебра можно осуществлять непосредственно в растворе полимера. При этом сам полимер служит матрицей, контролирующей размер и форму наночастиц металла, а также является стабилизатором образующихся наночастиц, предотвращая их агрегацию [7].
Для синтеза наночастиц серебра в полимерной матрице могут быть использованы различные методы, такие как химическое, фотохимическое и радиационно-химическое восстановление [8–10]. В данном исследовании для синтеза наночастиц серебра из ионов в матрице сукцинамида хитозана было использовано микроволновое облучение. К преимуществам этого метода следует отнести быстрый нагрев рабочего раствора по всему объему, что позволяет снизить термическое напряжение в системе и обеспечить однородность микроструктуры композитного материала.
Цель работы – разработка метода синтеза наночастиц серебра из ионов в матрице водорастворимого сукцинамида хитозана при действии микроволнового облучения в присутствии восстановителя – D-глюкозы, а также исследование антибактериальной активности полученного коллоидного раствора наночастиц серебра, стабилизированных сукцинамидом хитозана.
МЕТОДИКА
Материалы. В качестве полимерной матрицы-стабилизатора в работе использовали сукцинамид хитозана (СХТЗ) с молекулярной массой (ММ) 200 кДА производства ЗАО “Биопрогресс” (Россия). Степень дезацетилирования хитозана, из которого был получен СХТЗ составляла 85%. Для проведения реакции в гомогенных условиях в качестве растворителя использовали бидистиллированную воду (18 МОм × см–1), азотнокислое серебро, D-глюкозу и аммиачный раствор (NH4OH) марки х. ч.
Синтез наночастиц серебра из ионов в матрице сукцинамида хитозана. Для подбора условий синтеза наночастиц серебра (НЧAg) в матрице СХТЗ были проведены предварительные исследования. При этом концентрация полимера была подобрана таким образом, чтобы реакция протекала в гомогенных условиях. Подобранное время СВЧ-экспозиции (20 с) позволяло избегать интенсивного испарения воды из рабочего раствора. Концентрации AgNO3 и D-глюкозы были выбраны в соответствии с данными приведенными в статье [11].
Сукцинамид хитозана растворяли в бидистиллированной воде при комнатной температуре на магнитной мешалке. К 10 мл раствора полимера в воде (концентрация 0.25% по массе) при перемешивании добавляли водный раствор AgNO3, с таким рассчетом, чтобы его концентрация в растворе полимера составляла 0.0018 М.. Затем в реакционную смесь добавляли восстановитель D-глюкозу, ее концентрация в рабочем растворе составляла 0.05 М. Полученную реакционную смесь доводили 10%-ным раствором NH4OH до рН 7.0–7.5. Микроволновое восстановление ионов серебра проводили с использованием микроволновой печи “Midea” (MI 9252 RGI-B, Китай) мощностью 700 Вт. Время облучения рабочего раствора составляло 20 с.
УФ-спектроскопия. Электронные спектры полученных растворов регистрировали на УФ-спектрофотометре “SPECORD M–40” (“Carl Zeiss”, Германия) в кварцевой кювете с длиной оптического пути 0.1 см при 25°С, раствор сравнения – бидистилированная вода.
Просвечивающая электронная микроскопия (ПЭМ). Размеры наночастиц серебра в водном растворе на основе СХТЗ изучали при помощи ПЭМ (“LEO – 912 ABOMEGA”, Германия).
Микробные штаммы, питательные среды, условия культивирования. Спектр антимикробной активности определяли на тест-культурах условно патогенных бактерий из коллекции культур научно-исследовательского института по изысканию новых антибиотиков им. Г.Ф. Гаузе (Россия) методом диффузии в агар. Для определения антимикробной активности препаратов были использованы следующие культуры бактерий: Bacillus subtilis ATCC 6633 и Bacillus сoagulans 429. Для выращивания микроорганизмов и постановки экспериментов по выявлению биологической активности полученных наночастиц использовали следующие жидкие и плотные питательные среды, такие как триптиказо-соевый агар, среда Гаузе 2, следующего состава (г/л): глюкоза – 10, пептон – 5.0, триптон – 5.0, NaCl – 5.0, CaCO3 – 2.5, агар – 20, pH 7.0–7.2. Для определения антибактериального действия использовали также жидкую среду Мюллер–Хинтона (“Acumedia”, США) и раствор Хенкса (“ПанЭко”, Россия), содержащий индикатор феноловый красный.
Определение минимальной подавляющей концентрации тестируемых соединений in vitro. Определение минимальной подавляющей концентрации (МПК) тестируемых соединений in vitro производили методом двукратных серийных разведений в жидкой питательной среде в 96-луночных стерильных планшетах в соответствии с требованиями клинических лабораторных стандартов [12]. Для экспериментов по определению антимикробной активности тестируемых соединений готовили инокулят бактериальных тест-культур, для чего использовали чистые суточные культуры бактерий, выращенные на соответствующих плотных питательных средах при температуре 35°C. Суспезию бактерий готовили в стерильном физиологическом растворе (0.85% NaCl), доводя ее до определенной плотности. Плотность бактериальных суспензий составляла 0.5 по стандарту Мак Фарланда (1.5 × × 108 КОЕ/мл) и при дальнейшем разведении бульоном Мюллера–Хинтон в 100 раз концентрация микробных клеток снижалась до 5 × 105 КОЕ/мл.
Тестируемый полимер растворяли в стерильной воде, получая начальную концентрацию 84 мкг/мл. Затем готовили серии двукратных разведений от 84 до 5.25 мкг/мл в растворе Хенкса с феноловым красным. Эксперименты проводили в стерильных 96-луночных плоскодонных планшетах. В лунки каждого планшета вносили сначала по 100 мкл растворов серийных разведений тестируемого соединения в растворе Хенкса, а затем по 100 мкл раствора инокулята тест-культуры в среде Мюллера–Хинтон. Эксперимент с одной концентрацией тест-образца повторяли не менее трех раз. В качестве контроля использовали варианты опыта без тестируемого соединения. Планшеты инкубировали при температуре 35°С. Оценку роста культур проводили визуально через 24 ч по изменению цвета индикатора. МПК определяли как минимальную концентрацию препарата, полностью ингибирующую рост тест-организма.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
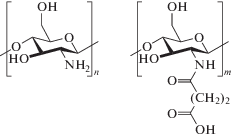
В работе исследовали возможность получения нанокомпозитов серебра с использованием в качестве матрицы-стабилизатора водорастворимого сукцинамида хитозана. Выбор в качестве матрицы СХТЗ обусловлен рядом его уникальных свойств, а также особенностью структуры этого полимера. Структура элементарного звена СХТЗ приведена на рис. 1.
Для синтеза наночастиц серебра из ионов использовали СХТЗ (ЗАО “Биопрогресс”, Россия), который получают путем взаимодействия хитозана с янтарным ангидридом, при этом степень замещения первичных аминогрупп в конечном продукте достигала 75%.
Этот полимер является полиэлектролитом, в структуре которого присутствуют как катионогенные (первичные аминогруппы-NH2), так и анионогенные (карбоксильные –COOH) группы. При этом мольное соотношение этих групп составляло: n-0.25 и m-0.75 соответственно (рис. 1). Известно, что наличие карбоксильных групп в структуре полимера определяет его способность образовывать комплексы с ионами металлов, которые в дальнейшем отвечают за формирование кластеров и наночастиц металлов [13].
Была исследована возможность применения микроволнового облучения для синтеза наночастиц серебра в матрице СХТЗ. Использование такого метода воздействия способствовало быстрому и равномерному нагреву всего объема реакционного раствора, что обеспечивало однородность протекания нуклеации и рост числа зародышей наночастиц. Действие СВЧ-облучения в сочетании с высокой восстанавливающей способностью глюкозы приводил к образованию на начальном этапе превращений большого количества мелких кластеров, из которых в дальнейшем формировались НЧAg. В ходе окислительно-восстановительных процессов глюкоза превращается в глюконовую кислоту. После окончания микроволнового облучения наблюдали изменение окраски рабочего раствора от бледно-желтой до коричневой.
Образование наночастиц серебра в макромолекулярной системе подтверждали данными УФ-спектрофотометрии. Измерение оптического поглощения (ОП) растворов позволило выявить полосу в диапазоне 380–440 нм, с λмакс. = 420 нм, характерную для наночастиц серебра (рис. 2).
Рис. 2.
Спектр оптического поглощения раствора НЧAg в матрице СХТЗ (разбавление 1 : 1), полученный при воздействии микроволнового облучения (время облучения 20 с).
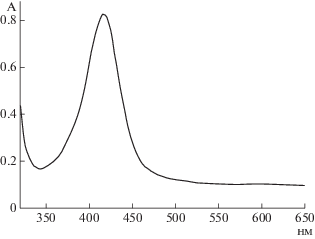
Стабильность наночастиц серебра в полимерной матрице СХТЗ оценивали путем выдержки полученного коллоидного раствора в темноте при комнатной температуре в течение месяца. После чего проводили измерения ОП исследуемого раствора. Отсутствие уменьшения ОП коллоидного раствора по истечении контрольного периода подтвердило стабильность синтезированных НЧAg в матрице СХТЗ.
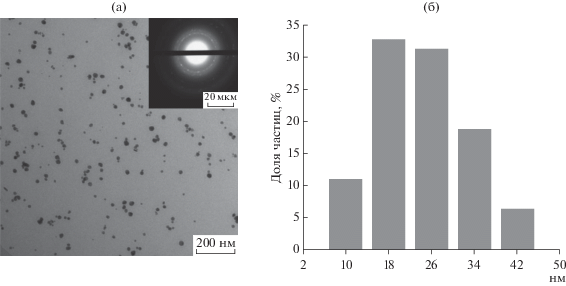
Оценку формы и размеров, синтезированных НЧAg в коллоидном растворе полимера СХТЗ проводили с использованием метода ПЭМ. На основании представленных данных ПЭМ (рис. 3а) и соответствующей гистограммы (рис. 3), построенной с применением компьютерного приложения “DEAM” [14], можно заключить, что в результате микроволнового облучения образуются наночастицы серебра сферической формы. При этом содержание НЧAg, имеющих размер 10–34 нм составляло 94% от их общего числа. На врезке к рис. 3а представлена микродифрактограмма, на основании которой определены межплоскостные расстояния – 2.36, 2.04, 1.23, 1.17 Å, характерные для кристаллической решетки металлического серебра.
Результаты исследований морфологии и стабильности, полученных НЧ Ag подтверждают, что СХТЗ может быть использован в качестве матрицы и стабилизатора при микроволновом восстановлении ионов серебра в наночастицы.
При обсуждении возможного механизма стабилизирующего действия СХТЗ следует отметить, что особое место среди полимеров, используемых в качестве матрицы, занимают полиэлектролиты, в частности, содержащие карбоксильные группы. Такие группы способны образовывать комплексы с катионами серебра, а также взаимодействовать с положительно заряженными кластерами и атомами на поверхности образовавшихся НЧAg, обеспечивая их стабилизацию [15].
Было проведено исследование антибактериальной активности синтезированного коллоидного раствора НЧAg в матрице СХТЗ. Антимикробную активность макромолекулярной системы НЧAg–СХТЗ оценивали методом диффузии в агар на тест-культурах условно-патогенных бактерий. В качестве тест-культуры использовали штаммы грамположительных бактерий B. subtilis ATCC 6633 и B. сoagulans 429. Полученные результаты представлены в табл. 1. Из результатов, приведенных в табл. 1, видно, что полученный коллоидный раствор НЧAg в матрице СХТЗ проявлял выраженную антибактериальную активность в отношении штаммов грамположительных бактерий B. subtilis ATCC 6633 и B. coagulans 429.
Таблица 1.
Антибактериальная активность (зона угнетения роста, мм) СХТЗ с НЧ серебра в отношении условно-патогенных бактерий*
| Тест-организм | НЧ серебра–СХТЗ, мкг/мл | Контроль (СХТЗ) |
Амоксиклав (амоксициллин 20 мкг + + клавулановая кислотата 10 мкг) |
||
|---|---|---|---|---|---|
| 84 | 42 | 21 | |||
| B. subtilis ATCC 6633 | 23 ± 0.09 | 20 ± 0.1 | 16 ± 0.2 | Н/а | 31 ± 0.1 |
| B. coagulans 429 | 20 ± 0.7 | 17 ± 0.1 | 10 ± 0.3 | Н/а | 23 ± 0.1 |
Важной характеристикой антимикробной активности препарата является его минимальная подавляющая концентрация (МПК). Определение МПК тестируемой системы in vitro проводили методом двукратных серийных разведений в жидкой питательной среде (табл. 2). Из результатов, приведенных в табл. 2, минимальная ингибирующая концентрация для кислотоустойчивого штамма B. coagulans 429 и B. subtilis ATCC 6633 составляла 5.25 мкг/мл. Следует отметить, что исходный полимер-СХТЗ (контроль) не проявлял антибактериальной активности в условиях тестирования.
Таким образом, проведенные исследования позволяют сделать вывод, что синтезированные НЧAg в матрице СХТЗ проявляют антибактериальную активность в отношении грамположительных бактерий B. coagulans 429 и B. subtilis ATCC 6633.
Актуальность проблемы связана с резко возросшей в последнее время резистентностью различных микроорганизмов к антибиотикам. В связи с этим, возникает необходимость поиска новых антибактериальных средств с иным механизмом действия.
В результате проведенных исследований показано, что водорастворимое производное хитозана – сукцинамид хитозана может служить матрицей-стабилизатором в процессе синтеза наночастиц серебра из ионов при действии микроволнового облучения в присутствии восстановителя – D-глюкозы.
Присутствие наночастиц серебра в системе было подтверждено данными УФ-спектроскопии, а именно – наличием полосы поглощения с λмакс. = 420 нм. По данным ПЭМ синтезированные наночастицы серебра имели сферическую форму, при этом, частицы размером 10–34 нм составляли 94% от общего количества.
В опытах in vitro подтверждена антибактериальная активность полученного коллоидного раствора наночастиц серебра в матрице сукцинамида хитозана по отношению к штаммам грамположительных бактерий B. subtilis ATCC 6633 и B. coagulans 429.
Рис. 3.
Электронная микрофотография НЧAg–СХТЗ (а), дифракционная картина пленки (на врезке) и соответствующая гистограмма (б).
Работа выполнена в рамках Госзадания ИНХС РАН.
Список литературы
Базунова М.В., Шарафутдинова Л.А., Лаздин Р.Ю., Чернова В.В., Миксонов Д.Н., Захаров В.П. // Прикл. биология и микробиология. 2018. Т. 54. № 5. С. 472–476.
Галина А.Р., Зидиханова Л.Ф., Шуршина А.С., Кулиш Е.И. // Вестник Башкирского университета. 2017. Т. 22. № 4. С. 985–1585.
Kato Y., Onishi H., Machida Y. // Biomaterials. 2000. V. 21. № 15. P. 1579–1585.
Panevin A.A., Golyshev A.A., Skorik Y.A., Zhuravskii S.G., Sonin D.L. // Pharm. Chem. J. 2017. V. 50. № 11. P. 711–714.
Колесов С.В., Гурина М.С., Мударисова Р.Х. // ВМС. Сер. В. 2019. Т. 61. № 3. С. 195–202.
Skorik Y.A., Kritchenkov A.S., Moskalenko Y.E., Golyshev A.A., Raik S.V., Whaley A.K., Vasina L.V., Sonin D.L. // Carbonhydr. Polymers. 2017. V. 166. P. 166–172.
Kiryukhin M.V., Sergeev B.M., Sergeyev V.G., Prusov A.N. // Polym. Sci. Ser. B. 2000. V. 42. № 5–6. P. 158–162.
Barrera N., Guerrero L., Debut A., Santa-Cruz P. // PLoS One. 2018. V. 13. № 7. P. 1–18.
Le Thi An Nhien, Nguyen Duc Luong, Le Thi Thuy Tien, Le Quang Luan // J. Nanomaterials. 2018. P. 1–9. DOI 10.1155/2018/7121549
Milad Torabfam, Hoda Jafarizadeh-Malmiri // Green Process Synthesis. 2018. № 7. P. 530–537.
Александрова В.А., Ревина А.А., Бусев С.А., Садыкова В.С. // Известия Академии наук. Сер. химическая. 2018. № 4. С. 757–761.
Balouiri M., Sadiki M., Ibnsouda S.K. // J. Pharm. Anal. 2016. V. 6. № 2. P. 71–79.
Помогайло А.Д., Джардималиева Г.И. Металлполимерные гибридные нанокомпозиты. М.: Наука, 2015. 494 с.
Васильев А.А., Карпачева Г.П., Дзидзигури З.Л., Сидорова Е.Н. Свидетельство 2019660702 № 2019616119 РФ. 2019. Реестр программ для ЭВМ. 1 с.
Cергеев Б.М., Кирюхин М.В., Бахов Ф.Н., Сергеев В.Г. // Вестник МГУ. Сер. 2. Химия. 2001. Т. 42. № 5. С. 308–314.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология