Прикладная биохимия и микробиология, 2020, T. 56, № 5, стр. 503-513
Разработка бессывороточных сред на основе оптимальной комбинации рекомбинантных белков-добавок и гидролизатов неживотного происхождения для получения иммуноглобулинов
Д. С. Балабашин 1, *, Е. Н. Калиберда 1, И. В. Смирнов 1, Ю. А. Мокрушина 1, Т. В. Бобик 1, Т. К. Алиев 1, 2, Д. А. Долгих 1, 3, М. П. Кирпичников 1, 3
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова, биологическмй факультет
119991 Москва, Россия
* E-mail: dbalabashin@mail.ru
Поступила в редакцию 30.12.2019
После доработки 14.04.2020
Принята к публикации 22.04.2020
Аннотация
Изучена возможность культивирования линии-продуцента рекомбинантных иммуноглобулинов (IgG1) в базовой среде культивирования IMDM (Iscove’s Modified Dulbecco Medium) с внесением рекомбинантных белков и гидролизатов белков неживотного происхождения. Для обогащения среды использовали рекомбинантные инсулин, сывороточный альбумин человека, продуцируемые бактериями E. coli, трансферрин – дрожжами Pichia pastoris. Комбинация белков-добавок, входящая в состав разработанной среды, позволила повысить продуктивность стабильной культуры-продуцента рекомбинантных гуманизированных антител на основе клеток линии CHO на 44% по сравнению с используемой комплексной коммерческой добавкой ITS (Insulin-transferrin-selenium). Внесение в измененную среду IMDM гидролизатов белков гороха и риса, содержащих пептиды с молекулярной массой ниже 5 кДа, способствовало увеличению продуктивности линии в 3.9 и 4.5 раза соответственно.
Рекомбинантные терапевтические белки расширили возможности современной медицины, позволяя разрабатывать новые и эффективные методы лечения для многих заболеваний, начиная от рака и заканчивая бесплодием [1]. Около 60–70% всех рекомбинантных фармацевтических белков получают в клетках млекопитающих. Многие из этих белков экспрессируются в иммортализованных клетках яичника китайского хомячка (CHO), что позволяет максимально сохранить не только их структуру, но и функцию, позволяя применять их во многих областях медицины, биотехнологии и сельского хозяйства. Другие клеточные линии эукариот такие, как миелома мыши (NSO), клетки почки хомячка (BHK) и клетки эмбриональной почки человека (HEK-293) также используются в производстве для получения рекомбинантных белков. Однако они обладают узкой специфичностью и направленностью действия, в связи с этим их использование строго ограничено областью применения [2]. Клетки линии СНО становятся все более важным инструментом для производства рекомбинантных терапевтических белков вследствие их быстрого роста, стабильности экспрессии в них чужеродных генов и высокого выхода рекомбинантных белков [3]. Увеличение выхода рекомбинантного белка и, следовательно, снижение издержек производства относится к основной биотехнологической цели [4]. Поскольку производительность клеток млекопитающих гораздо более низкая, по сравнению с прокариотическими, существует стратегия увеличения производства рекомбинантного белка в клетках СНО, включающая регулирование температуры культуры [5, 6], добавление различных химических веществ [6], контроль параметров в биореакторе [7] и ингибирование клеточного апоптоза [8, 9]. Температура культивирования линии-продуцента является одним из наиболее важных параметров, при этом такие клетки животных, как СНО, для имитации окружающей среды организма наиболее часто культивируются при 37°C. Температура, рН среды культивирования [10–12] и содержание в ней растворенного кислорода (DO) [11, 12] влияют на некоторые важные клеточные характеристики (рост, жизнеспособность и синтез белка), которые были изучены для определения подходящих условий процесса производства белка [13]. Для выращивания клеток традиционно использовали смеси компонентов, включающие растворы основных питательных веществ для обеспечения метаболизма клеток, которые получили название базовых (MEM, DMEM, IMDM, RPMI-1640, 199 и др.). Базовые питательные среды имеют различный состав, но для получения клеточной массы к ним необходимо добавлять сыворотку крови. Ее традиционно вносят в культуры клеток, чтобы обеспечить их гормонами, факторами роста, связывающими и транспортными белками, а также другими дополнительными питательными веществами. Однако сывороточные композиции не постоянны, к тому же их состав, как правило, не известен. Кроме того для жизнедеятельности культуры клеток необходима лишь небольшая часть входящих в сыворотку компонентов.
Соединения, входящие в состав сыворотки, при культивировании могут влиять на жизнеспособность и пролиферацию клеточной массы, тем самым внося существенные погрешности при экспрессии целевого белка в линиях этих клеток [14, 15]. Содержание белка в сыворотке обычно намного больше, чем уровень его экспрессии клеточной линией-продуцентом. При этом сывороточные белки могут легко маскировать присутствие продукта специфической экспрессии линии-продуцента при анализе в том случае, если они схожи с ними по размеру. Таким образом, развитие биотехнологии и точного воспроизведения результатов экспрессии требуемых белков, а также облегчения процедуры очистки наработанного препарата остро нуждается в питательных средах, которые соответствовали этим требованиям. Удаление сыворотки из среды культивирования позволит исключить сывороточные гормоны, антитела и другие регуляторы, а также унифицировать состав питательной среды, что позволит достоверно изучить клеточную физиологию и иммунологию, межклеточные взаимодействия и кинетику накопления продукта линии-продуцента. Использование свободной от сыворотки среды значительно снижает также риск контаминации культуры. Следовательно, продукты, полученные из культуры клеток-продуцентов рекомбинантных белков, не содержащей сыворотку, становятся пригодными для применения во многих областях экспериментальной ммедицины, особенно in vivo при лечении человека.
Основными белками, необходимыми клеткам культуры CHO для успешного роста, являются альбумин, инсулин и трансферрин, а из неорганических добавок – селенит натрия. Данные вещества входят в состав среды, свободной от сыворотки, и выполняют ряд специализированных функций. Так, альбумин служит в качестве носителя не только для незаменимых жирных кислот и некоторых минералов (например, ионов цинка), но и гормонов, а также пептидов и факторов роста. Он осуществляет детоксикацию H2O2 [15] и избыточных количеств микроэлементов [16, 17], а также обеспечивает механическую защиту клеток при перемешивании [18]. Концентрация альбумина в разных средах, свободных от сыворотки, составляет от 0.5 до 5.0 мг/мл. Для приготовления сред используют две различные формы альбумина, первая – представляет собой экстракт нативного сывороточного альбумина, ассоциированного с жирными кислотами неопределенной природы, а вторая – делипидированный альбумин (более очищенные среды), связанный с линолевой и олеиновой кислотами. Однако такие препараты являются дорогостоящими, поэтому для крупномасштабных производств моноклональных антител (мАт) их использование нецелесообразно. Все большее число исследователей культивируют клетки в отсутствие альбумина, но этот подход возможен не для всех линий клеток и гибридом.
Инсулин служит фактором роста и поддержания оптимального метаболического уровня клетки и считается важным компонентом в культуре гибридом, свободных от сыворотки. Он способствует стимуляции поглощения аминокислот (особенно лейцина и валина) клетками культуры, а также уридина и глюкозы, ответственных за синтез РНК, белка и липидов. Инсулин включается в большинство бессывороточных сред в концентрациях от 5 до 10 мкг/мл.
Трансферрин считается одной из основных добавок, стимулирующих рост клеток гибридом в бессывороточной среде [19, 20], но в некоторых случаях его отсутствие приводит к сильному ингибированию их роста. Трансферрин является гликопротеином, который связывает железо и облегчает его транспорт через плазматическую мембрану [21, 22]. Он используется в бессывороточной среде в концентрации 1–30 мкг/мл. При этом трансферрин взаимодействует с определенными рецепторами клеточной поверхности и может обладать in vitro такими дополнительными функциями как хелатирование токсичных металлов, содержащихся в малых и следовых количествах [21–23]. В зависимости от производителя и состава коммерческие добавки инсулина и трансферрина их обозначают insulin-trasferrin-selenium-ethanolamine (ITSE), selenium-insulin-transferrin-ethanolamine (SITE), insulin-trasferrin-selenium-sodium pyruvate (ITS-A), insulin-trasferrin-selenium-ethanolamine (ITS-G) или insulin-trasferrin-selenium (ITS). Другие их различия включают сведения, является ли продукт рекомбинантным, не содержащим животных экстрактов, или полученным из тканей животных или донорской крови. Большинство продуктов, называемых на инсулин-трансферрин-селенит натрия, содержат белки, полученные из крови, включающие бычий трансферрин или трансферрин из плазмы человека, а также свиной инсулин. Однако существует несколько композиций рекомбинантных инсулина и трансферрина, полностью не содержащих животных добавок, которые предлагают компании “InVitria” и “Fisher Scientific” (США). Остальные композиции содержат нативные белки и не свободны от продуктов животного происхождения (https://cellculturedish.com/combining-insulin-and-transferrin-in-cell-culture-supplements/). Их цена, часто основанная на стоимости других составляющих, может различаться. Разработка концентрата, состоящего из растворов белков, имеющих рекомбинантную природу и структуру, полностью сходную с белками человека, позволит добиться высокого уровня безопасности. Следует отметить, что при терапии препаратами, полученными на основе бессывороточных сред с рекомбинантными белками-добавками, исключается вероятность заражения больного вирусами животных. В свою очередь замена коммерческой среды позволит снизить затраты на получение целевого IgG1, и таким образом снизить себестоимость фармацевтических препаратов, получаемых в результате биосинтеза в клеточных линиях-продуцентах.
В настоящее время успешно применяется несколько композиций и добавок для бессывороточных сред культивирования широкого спектра эукариотических клеток, и, в частности, клеток линий СНО. Однако необходимо отметить, что различные клеточные линии, полученные из исходной линии CHO, имеют специфический метаболизм и особенности использования питательных элементов. Известно, что при высокой плотности клеток продукция рекомбинантных антител может снижаться из-за истощения среды культивирования, и вследствие этого рост культуры замедляется и останавливается, а культура погибает. С гибелью культуры останавливается специфическая продукция. В фармацевтической индустрии особую трудность промышленного культивирования представляет оптимизация уровня экспрессии иммуноглобулинов в СНО клетках. Данная особенность связана со сложностью синтеза длинных аминокислотных последовательностей легкой и тяжелой цепей, входящих в состав полноразмерного антитела, и последующей за этим его сборки из отдельных цепей полноразмерных молекул антитела. Поэтому клеточные линии, продуцирующие IgG1 из-за сложностей в сборке полноценных молекул показывают более низкую продукцию по сравнению с клетками-продуцентами других рекомбинантных белков. Для улучшения роста клеток и увеличения продукции ими терапевтических белков использовали внесение в бессывороточную среду добавок, содержащих гидролизаты белков растительного происхождения [24]. Такой подход позволил разработать стратегию добавления этого гидролизата в бессывороточную среду для культивирования [25].
Согласно литературным данным гидролизаты дрожжей способствуют значительному увеличению продуктивности клеток линии CHO в культуре [26]. Ряд других исследований подтверждает способность таких гидролизатов увеличивать плотность клеток CHO в процессе культивирования и специфическую продуктивность их линий [27, 28].
При выборе источника сырья широко используются гидролизаты растений и дрожжей, поскольку они исключают применение в биофармацевтике в качестве добавок к среде продуктов животного происхождения [29–31]. Было показано, что источник этих гидролизатов влиял на рост клеток и продукцию ими целевого белка [32]. Известен также ряд коммерческих добавок, включающих гидролизаты растительного происхождения. Данные добавки являются комплексными, однако состав таких композиций относится к коммерческой тайне.
Рекомбинантная низкобелковая среда позволила бы заменить дорогостоящие питательные среды и добавки, а применение компонентов неживотного происхождения избежать контаминации вирусами и иными опасными агентами при получении рекомбинантного IgG1 в клетках СНО.
Цель работы – создание композиции бессывороточной среды культивирования клеток-продуцентов СНО для эффективной экспрессии целевого белка в виде иммуноглобулинов IgG1, а также других рекомбинантных белков.
МЕТОДИКА
Материалы. В работе использовали белковый порошок гороха (Pisiva, “Hill Pharma Inc.”, США), клейковину, глютен из пшеницы (“Roquette”, Франция), соевый белковый изолят (Sunsoy, “Sunhide Impeks”, КНР), рисовый белок (“Beneo”, Германия), белок из подсолнечника (“Biotechnologies”, Россия), экстракт дрожжей (“BD Bioscience”, Бельгия).
Клеточная культура и адаптация. Для проведения экспериментов использовалась стабильная клеточная культура на основе линии CHO DG44 (“Invitrogen”, США), стабильно экспрессирующая растворимые рекомбинантные антитела в среду культивирования. Культивирование проводили в колбах Эрленмейера объемом 100 мл в 30 мл культуральной среды при постоянном перемешивании на орбитальном шейкере S3.20L (“ELMI”, Латвия) при 150 об./мин, 37°С и 95%-ной влажности. Была получена культура клеток, которая культивировалась на среде OptiCHO (“Invitrogen”, США) с добавлением 8 мМ L-глутамина. Адаптацию культуры для проведения экспериментов осуществляли ступенчато, переводя клетки в среду, основанную на среде Iscove’s Modified Dulbecco Medium, (IMDM, “Biolot”, Россия), содержащую 8 мМ L-глутамин, 0.1% Pluronic F-68 и 1% ростовой добавки Insulin-transferrin-selenium (ITS, “Gibco”, США). Перевод клеток осуществляли постепенно, изменяя содержание среды с 50, 75, 90, 95 и до 100%. Окончанием этого процесса считали увеличение времени удвоения популяции клеток, равным 24 ч. При последующих изменениях состава питательной среды клеточную массу осаждали при 450 g в течение 5 мин и переводили на экспериментальную среду для исследования продуктивности.
Проведение ИФА. Оценку уровня продукции антител культурами осуществляли с помощью метода непрямого ИФА. Для проведения ИФА использовали 96-луночные планшеты Maxisorp (“Nunc”, Дания). Для сорбции на подложку наносили 100 мкл очищенного рекомбинантного антигена (10 мкг/мл в лунку) и инкубировали в течение ночи при 4°C. Промывали 3 раза по 200 мкл фосфатным буфером (ФБ) с 0.5% Твин-20, а затем добавляли 200 мкл на лунку ФБ с 0.5%-ным БСА для уменьшения неспецифического связывания с подложкой антител в исследуемом образце. Обработку осуществляли в течение 1 ч при 37°C. Затем наносили кондиционированную среду или очищенный препарат антител, титровали, промывали 3 раза ФБ, содержащим 0.5%-ный Твин-20. После этого вносили по 100 мкл в лунку раствора вторичных антител, конъюгированных с пероксидазой хрена, который готовили разведением в соотношении 1 : 20 000 в ФБ содержащим 0.1%-ный БСА. Инкубировали в течение 1 ч при постоянном перемешивании на орбитальном шейкере с частотой 300 об./мин при 37°C. Лунки планшета промывали 3 раза 200 мкл ФБ с 0.5%-ным Твин-20, и вносили по 100 мкл в лунку готового для применения раствора 3,3',5,5'-тетраметилбензидина (ТМБ, “Иммунотех”, Россия) и после развития окраски в течение примерно 15 мин реакцию останавливали внесением 100 мкл 10%-ной серной кислоты. Оценку результатов проводили на планшетном спектрофотометре Model 680 (“Bio-Rad”, США). В качестве контроля использовали очищенный препарат антител с известной концентрацией.
На всех этапах для анализа концентрации мАт в среде культивирования отбирали аликвоты объемом 200 мкл и центрифугировали при 450 g в течение 5 мин и определяли методом ИФА.
Получение и очистка белковых компонентов. Рекомбинантный трансферрин получали по методике, описанной в работе [33]. Для получения модифицированного рекомбинантного трансферрина человека (рТФР) был использован штамм метилотрофных дрожжей Pichia pastoris Yst-TFNG, полученный ранее [33]. Наработку рекомбинантного белка осуществляли в биореакторе в условиях культивирования при высокой плотности биомассы штамма Yst-TFNG в солевой среде BSM (http://www.img.bio.uni-goettingen.de/ms-www/internal/methods/Yeast/PichiaFermentation.pdf) в присутствии глюкозы в качестве источника углерода. Для выделения и очистки рТФР была использована схема с некоторыми модификациями, описанная в работе [34]. После очистки рТФР на анионообменной смоле Q Сефарозе Fast Flow (“GE Healthcare”, США) на второй стадии использовали катионообменный сорбент MonoS 5/50G. Элюцию проводили градиентом концентрации NaCl от 0 до 0.5 М в 50 мМ Na-ацетатном буфере, рН 5.0. На заключительной стадии очистки рТФР использовали гель-фильтрационную хроматографию на колонке Superdex S75 (“GE Healthcare”, США) в фосфатно-солевом буфере (ФСБ), рН 7.2, содержащим 137 мM NaCl, 2.7 мM KCl, 10 мM Na2HPO4 и 1.8 мM KH2PO4. Чистота полученного препарата рТФР составляла более 95%, которую оценивали денситометрически после электрофоретического разделения в 12%-ном ПААГ в невосстанавливающих условиях по стандартной методике Леммли [34].
Для получения рекомбинантного инсулина человека использовали штамм-продуцент Е. coli Bl 21 (DE 3), трансформированный плазмидой pPINS 07. Получение телец включения, ренатурацию и очистку рекомбинантного белка с использованием анионообменной хроматографии на ДЭАЭ-сефарозе FF проводили, как описано ранее [35]. Полученный препарат подвергали ферментативному гидролизу трипсином и карбоксипептидазой В, а также для предотвращения образования дезтреонин (В30)-инсулина и модификации ε-аминогрупп остатков лизина, с помощью цитраконового ангидрида. Дальнейшая очистка рекомбинантного инсулина включала концентрирование, осаждение 0.1 М ацетатом цинка и хроматографическое фракционирование с использованием сорбента YMC-Basic С8-15-200 (“YMCEurope”, Германия) в соответствии с методикой, описанной в работе [36]. Далее инсулин осаждали ацетатом цинка, а полученный после центрифугирования осадок растворяли в 0.5 М уксусной кислоте и хроматографировали на Сефадексе G-50. Из основной фракции инсулин выделяли осаждением ацетатом цинка с последующим центрифугированием. Кристаллизацию инсулина осуществляли с помощью хлористого цинка при рН 6.7 в водном растворе лимонной кислоты, этанола и хлорида цинка. Нейтрализацию этого раствора проводили ступенчато: вначале раствором аммиака до рН 8.2 ± 0.2 и затем раствором соляной кислоты до рН 6.2. Выпавшие кристаллы отфильтровывали и лиофилизовали. Хроматографическая чистота полученного рекомбинантного инсулина человека составляла не менее 98.5%.
Рекомбинантный сывороточный альбумин человека (рЧСА) получали по методике, описанной в работе [37]. Для его получения на основе дрожжей P. pastoris был создан штамм-продуцент “P-ichiaPink Strain4” (“Thermo Fisher Scientific”, Англия) содержащий клетки, нокаутные по генам двух протеаз – pep4 и prb1, вносящих значительный вклад в протеолитическую деградацию получаемого рекомбинантного белка. Для этого нуклеотидная последовательность проЧСА была амплифицирована с плазмидой pPIC9/ЧСА, полученной ранее [37], с использованием специфических олигонуклеотидов, содержащих сайты эндонуклеаз рестрикции EcoRI и KpnI, и клонирована в вектор pPink-HC. Экспрессионная конструкция pPinkHSA была линеаризована с помощью эндонуклеазы рестрикции PmeI и трансформирована в клетки P. pastoris “PichiaPink Strain4” методом электропорации [38]. Наработку рЧСА, как и в случае рТФР, проводили в биореакторе с использованием солевой среды BSM с метанолом в качестве источника углерода (http://www.img.bio.uni-goettingen. de/ms-www/internal/methods/Yeast/PichiaFermentation.pdf). Выделение и очистку рЧСА выполняли в соответствии с ранее описанной методикой [37]. Чистота полученного препарата рЧСА подтверждалась электрофоретическим анализом с последующей денситометрией и составляла не менее 95%.
Небелковые компоненты разрабатываемой среды. Селенит натрия (“Sigma-Aldrich”, Германия) растворяли в воде качества mQ в концентрации 1 мг/мл и стерилизовали через фильтр 0.22 мкм (“Millipore”, США).
Приготовление растворов – гидролизатов растительных белков и контроль реакции. Приготовление растворов (10–25 мг/мл) белков-субстратов (белковых порошков растений) проводили в 0.001 М ЭДТА ⋅ Na2-буфере, рН 6.2, после экстракции в течение ночи при комнатной температуре. Белок, экстрагированный из порошков растений, отделяли центрифугированием при 9000 g на центрифуге 5810R (“Eppendorf”, Германия) в течение 40 мин. Содержание экстрагированного из порошка белка оценивали по его разнице до и после центрифугирования. В надосадочной жидкости белок, содержание которого определяли по методу Брэдфорд с использованием реактива Quick Start Bradford 1x Dye Reagent #5000205(“Bio-Rad”, США), гидролизовали папаином. При этом в 1/20 часть не вносили папаин, а оставляли для контроля, который использовали на всех стадиях гидролиза. Гидролиз растительных белков осуществляли в 0.001 М ЭДТА ⋅ Na2-буфере, рН 6.2, содержащем 0.005 М Cys, на качалке (150 об./мин) в течение 20 ч при 39°С. Соотношение папаин–растительный белок составляло 1 : 20 (по количеству белка). Протеолитическую реакцию останавливали кипячением в течение 10 мин, реакционную смесь охлаждали до 7°С. Содержание экстрагированных и прогидролизованных папаином растительных белков контролировали методом электрофореза в 12%-ном ПААГ (восстанавливающие условия) по методу Лэммли [34], отбирая аликвоты раствора, содержащие 30–50 мкг белка. Затем рН реакционной смеси доводили до 7.2, выпавший осадок снова удаляли центрифугированием (9000 g, 40 мин), а надосадочную жидкость пропускали через ячейку с мембраной Amicon РМ-5 (“Millipore”, США), полученный раствор использовали. Количество полученных пептидов (с молекулярными массами менее 5 кДа, гидролизат) определяли по количеству прогидролизованного белка.
В качестве положительного контроля использовали 10%-ный гидролизат дрожжевой культуры, который растворяли в 100 мл воды качества mQ и автоклавировали для стерилизации в течение 40 мин при 121°C.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для определения концентрации белковых компонентов неживотного происхождения, необходимых для роста культуры продуцента и продукции целевого белка использовали стоковые растворы рекомбинантных белков. Рекомбинантные белки-добавки (рЧСА и рТФР) были получены и очищены с использованием гель-фильтрации как описано в работах [33, 37] и растворены в ФСБ для получения стандартных растворов, концентрация которых приведена в табл. 1.
Таблица 1.
Концентрации стоковых растворов белков и низкомолекулярных компонентов, входящих в состав бессывороточной среды культивирования
| Компонент | Молекулярная масса, Да | Концентрация, мг/мл |
|---|---|---|
| Инсулин | 5808 | 10 |
| Трансферрин | 80 000 | 2.8 |
| Селенит натрия | 173 | 0.1 |
| ЧСА | 66 500 | 140 |
Каждый из белковых компонентов и низкомолекулярных добавок вносили в среду культивирования с помощью фильтров в виде шприц-насадок с диаметром поры 0.22 мкм, что обеспечивало стерильность. Перед добавлением их хранили при 4°C.
В качестве контроля продуктивности клеточной культуры при выращивалии на бессывороточной среде использовали комплексную добавку инсулин-трансферрин-селенит натрия (ITS, “Gibco”, США) в конечной концентрации, равной 1% (1 : 1 : 1) и 3% (3 : 3 : 3).
Для приготовления сред стоковые растворы добавляли в базовую среду культивирования IMDM в количествах, представленных в табл. 2. Для каждой из культур клеток в среду роста также вносили 8 мМ L-глутамин и 0.1% Pluronic F-68 (“Thermo Fisher Scientific”, Англия). После внесения белковых и низкомолекулярных компонентов среды хранили не более 14 сут при 4°C. Конечная концентрация белковых и небелковых компонентов в разрабатываемых средах представлена в табл. 3.
Таблица 2.
Соотношение компонентов в тестируемой бессывороточной среде (объем в мл для приготовления 1 л среды роста)*
| Компонент | Соотношение компонентов в среде, относительно концентрации в ITS | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 : 1 : 1 | 1 : 3 : 1 | 1 : 1 : 3 | 1/3 : 1 : 1 | 1 : 1/3 : 1 | 1 : 1 : 1/3 | 1 : 1 : 1 | 3 : 3 : 3 | 1/3 : 1/3 : 1/3 | ITS 3 : 3 : 3 |
ITS 1 : 1 : 1 |
|
| Инсулин | 3.000 | 1.000 | 1.000 | 0.333 | 1.000 | 1.000 | 1.000 | 3.000 | 0.333 | – | – |
| Трансферрин | 1.964 | 5.893 | 1.964 | 1.964 | 0.655 | 1.964 | 1.964 | 5.893 | 0.655 | – | – |
| Селенит натрия | 0.067 | 0.067 | 0.201 | 0.067 | 0.067 | 0.022 | 0.067 | 0.201 | 0.022 | – | – |
| ЧСА | 7.14 | 7.14 | 7.14 | 7.14 | 7.143 | 7.140 | 7.14 | 7.14 | 7.140 | – | – |
| Добавка ITS | – | – | – | – | – | – | – | – | – | 30 | 10 |
Таблица 3.
Соотношение компонентов в тестируемой бессывороточной среде (мг компонента/количество концентрата, необходимого для приготовления 1 л среды роста)
| Компонент | Соотношение в среде относительно концентрации ITS | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 : 1 : 1 | 1 : 3 : 1 | 1 : 1 : 3 | 1/3 : 1 : 1 | 1 : 1/3 : 1 | 1 : 1 : 1/3 | 1 : 1 : 1 | 3 : 3 : 3 | 1/3 : 1/3 : 1/3 | ITS 3 : 3 : 3 |
ITS 1 : 1 : 1 |
|
| Инсулин | 30 | 10 | 10 | 3.33 | 10 | 10 | 10 | 30 | 3.33 | – | – |
| Трансферрин | 5.5 | 16.5 | 5.5 | 5.5 | 1.8 | 5.5 | 5.5 | 16.5 | 1.8 | – | – |
| Селенит натрия | 0.0067 | 0.0067 | 0.0201 | 0.0067 | 0.0067 | 0.0022 | 0.0067 | 0.0201 | 0.0022 | – | – |
| ЧСА | 1000 | 1000 | 1000 | 1000 | 1000 | 1000 | 1000 | 1000 | 1000 | – | – |
| Добавка ITS* | – | – | – | – | – | – | – | – | – | 30 мл | 10 мл |
Для выявления наивысшей удельной продуктивности клеточной линии-продуцента при культивировании в условиях разрабатываемой бессывороточной среды были проведены 3 серии независимых культивирований. Усредненные данные представлены на рис. 1.
Рис. 1.
Сравнительная абсолютная (I, мкг/мл) и удельная (II, пг мАт/кл./сут) продуктивность клеток линии-продуцента мАт на 44 ч выращивания на среде IMDM с различным сочетание компонентов: 1 – IMDM 3 : 1 : 1, 2 – IMDM 1 : 3 : 1, 3 – IMDM 1 : 1 : 3, 4 – IMDM 1/3 : 1 : 1, 5 – IMDM 1 : 1/3 : 1, 6 – IMDM 1 : 1 : 1/3, 7 – IMDM 1 : 1 : 1, 8 – IMDM 3 : 3 : 3, 9 – IMDM 1/3 : 1/3 : 1/3, 10 – IMDM + ITS (3 : 3 : 3), 11 – IMDM + ITS (1 : 1 : 1), 12 – OptiCHO.
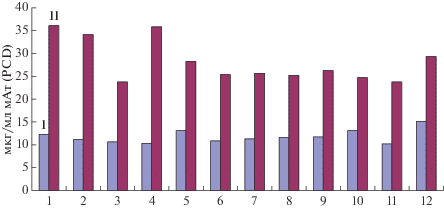
Из рис. 1 следует, что накопление продукта в начале культивирования происходило равномерно для каждой из тестируемых сред культивирования. Однако, относительно контроля удельная продуктивность линий, культивируемых с избытком инсулина или трансферрина, оказалась выше, чем для контрольного образца. Это могло свидетельствовать о компенсации изменения скорости роста культуры удельной продуктивностью.
Для получения максимальной концентрации мАт культивирование продолжали в течение 14 сут, когда происходило истощение питательных веществ в среде (рис. 2).
Рис. 2.
Концентрация мАт в среде после 14 сут культивирования на средах (1–11) с различным соотношением компонентов среды IMDM (даны средние результаты 4 независимых культивирований). 1–11 как и на рис. 1
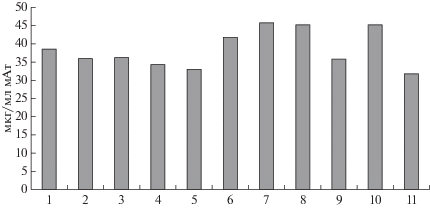
Наиболее высокие концентрации мАт при культивировании были получены в среде IMDM, содержащей однократную и трехкратную концентрацию рекомбинантных белков неживотного происхождения. Для дальнейших исследований применяли среду, с содержанием белковых компонентов как в комплексной добавке ITS. Вместе со средой IMDM применяли белки неживотного происхождения и низкомолекулярные компоненты инсулина, странсферрина, ЧСА и селенит натрия, описанные выше.
Получение и применение гидролизатов. Для получения гидролизата растительные белки экстрагировали из порошков пшеницы, подсолнечника, гороха, риса, рисовой муки и сои. После экстракции белков проводили их количественную (табл. 4) и качественную характеристику (рис. 3). Необходимо отметить, что при экстракции буфером подбирали такое количество порошка, чтобы концентрация экстрагируемого белка в растворе составляла 1 мг/мл. После гидролиза папаином растительных белков рН реакционной смеси доводили до 7.2 и центрифугировали, а в дальнейшем использовали надосадочную жидкость. Затем надосадочную жидкость пропускали через ячейку с мембраной для отделения молекул с молекулярной массой выше 5 кДа, что позволяло в дальнейшем исключить попадание в среды белков, не прогидролизованных папаином, и других высокомолекулярных соединений.
Таблица 4.
Содержание растительного белка после гидролиза папаином
| Источник растительного белка | Экстрагированный белок, мг/% | Масса осадка, мг | Белок после гидролиза, мг |
Количество образующихся пептитидов, мг/% | Концентрация пептидов, мг/мл* |
|---|---|---|---|---|---|
| Рис (1) | 14.0/1.4 | 1.0 | 4.3 | 8.7/62 | 0.22 |
| Рисовая мука (2) | 2.9/0.36 | 0.8 | 1.6 | 0.54/18.6 | 0.014 |
| Горох (3) | 75.4/18.6 | 42.0 | 9.1 | 24.3/32 | 0.6 |
| Соя (4) | 35.9/3.6 | 18.0 | 8.1 | 9.8/27 | 0.24 |
| Пшеница (5) | 23.8/2.9 | 9.7 | 6.5 | 7.6/32 | 0.19 |
| Подсолнечник (6) | 55.3/6.8 | 16.6 | 10.1 | 28.6/52 | 0.7 |
Рис. 3.
Электрофореграммы водных экстрактов растительных белков риса (а, 1–4) и гороха (а, 5 и 6) до (1, 3 и 5) и после (2, 4 и 6) гидролиза папаином, а также соевых белков (б, 1 и 2), глютена (б, 3 и 4) и подсолнуха (б, 5 и 6). М – белки-маркеры молекулярной массы: β-галактозидаза – 16.0, бычий сывороточный альбумин – 66.2, овальбумин – 45.0, лактатдегидрогеназа – 35.0, РЕаза Bsp98I – 25.0, β-лактоглобулин – 18.4, лизоцим – 14.4.
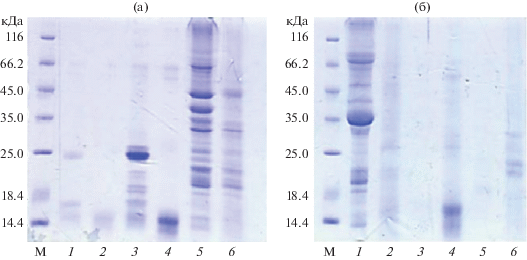
После проведения гидролиза растительных белков был получен набор пептидов (гидролизат). На рис. 3 представлена их электрофореграмма до и после гидролиза папаином. По результатам качественного контроля (рис. 3) было установлено, что белки из порошка риса и рисовой муки с молекулярной массой 25 кДа полностью гидролизовались до фрагментов с молекулярной массой 14.4 кДа. Белки гороха гидролизовались равномерно, при этом полностью исчезали только белки с молекулярными массами 66, 40 и 35 кДа. Белки, экстрагированные из порошков сои, глютена и подсолнечника расщеплялись полностью. Для точного расчета прогидролизованного белка (пептиды) осадок, полученный после гидролиза, подсушивали при 65○С, взвешивали и вычитали из количества первоначально экстрагированного белка. Белок, полученный при концентрировании на мембране, исключающей пептиды с молекулярными массами ниже 5 кДа (белок после гидролиза, табл. 1), также вычитали из количества первоначально экстрагированного белка. Белок, который составил разницу в результате вычитания осадка и пептидов с молекулярной массой более 5 кДа, был отнесен к низкомолекулярным пептидам и аминокислотам (гидролизат), которые использовали в качестве добавок при изучении их влияния на пролиферативную активность клеток-продуцентов.
Результаты проведения гидролиза белков папаином представлены в табл. 4. Конечная концентрация пептидов гидролизата не нормировалась по массе и концентрации, однако для гидролиза были взяты одинаковые количества исходных белков. Получение более высоких конечных концентраций гидролизатов требует доработки методики гидролиза и проведения дополнительных изысканий в этой области.
Для исследования факторов, влияющих на продуктивность линии-продуцента (выход целевого продукта в среду культивирования), были использованы гидролизаты белков риса, рисовой муки, гороха, сои, пшеницы, подсолнечника и дрожжевого экстракта. Каждый из этих гидролизатов добавляли до 10% в среду культивирования, содержащую 3 × 105 кл./мл, а также дважды в ходе культивироваиня. В качестве отрицательного контроля вместо гидролизата добавляли буфер для получения растворов гидролизатов. Усредненные результаты трех независимых экспериментов представлены на рис. 4.
Рис. 4.
Продуктивность линии клеток при внесении гидролизатов неживотного происхождения (1, мАт мкг/мл), увеличение продуктивности культуры при внесении гидролизатов в среды культивирования по отношению к содержанию в них пептидов (2, мкг/мл). К – контроль без внесения растворов гидролизатов, YE – внесение дрожжевого экстракта в объеме равном 10% объема культуральной среды; 1–6 – добавки, как в табл. 4.
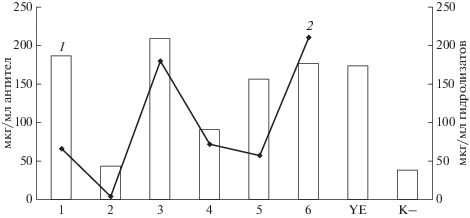
Применение гидролизатов рисового белка и белков гороха и подсолнечника оказалось наиболее эффективным. Такую эффективность трех гидролизатов, содержащих набор пептидов с молекулярной массой не более 5 кДа, можно было объяснить, с одной стороны, присутствием входящих в их состав аминокислот, витаминов и жирных кислот, а с другой – использованными концентрациями. Однако исходя из полученных результатов, не было очевидно, что увеличение конечной концентрации мАт после культивирования клеток линии-продуцента связано с количеством внесенных гидролизатов. Так, наивысший уровень экспрессии рекомбинантных антител в среде IMDM с добавлением белковых и небелковых компонентов в количестве, указанном в табл. 2, наблюдался также при добавлении в среду гидролизата белков гороха, содержащих 180 мкг пептидов, который стимулировал продуцирование 208.4 мкг/мл мАт (конечная концентрация). Это соответствовало потреблению ~0.86 мкг пептидов/мкг целевого белка в 1 мл.
Вторая наиболее продуктивная комбинация культура-продуцент-гидролизат была отмечена при использовании гидролизата рисового белка, содержащего 66 мкг пептидов, при которой продукция мАт в конечной концентрации составила 185 мкг/мл среды, что указывало на конверсию 0.36 мкг пептидов/мкг белка в 1 мл среды культивирования. Третья продуктивная культура содержала гидролизат белков подсолнечника. В этом случае при внесении 210 мкг пептидов продуктивность составила 176 мкг/мл, а конверсия составляла 1.193 мкг пептидов/мкг белка в 1 мл среды. Приведенные результаты не позволили сделать однозначный вывод о том, что увеличение количества гидролизата влияло на уровень продукции мАт, экспрессируемых в среде. Однако можно предположить, что большое значение имели природа и источник гидролизатов. Применение дрожжевого экстракта в качестве контроля позволило сравнить эффективность внесения в среду культивирования гидролизатов, полученных из растительных источников, ранее широко используемых в качестве источников питательных веществ и аминокислот. Следует отметить, что применение дрожжевого экстракта при культивировании клеток для получения специфической продукции линии невозможно без дополнительных исследований безопасности, поскольку он в отличие от гидролизатов растительных белков может содержать и вредные неидентифицированные компоненты различной природы, изучение которых не входило в цели данной работы.
Таким образом, были разработаны эффективные комбинации рекомбинантных белков-добавок и технология получения и применения гидролизатов неживотного происхождения для создания на основе среды IMDM бессывороточной среды культивирования. Совместное применение разработанных добавок или компонентов позволило получить среду для выращивания и эффективной экспрессии целевого белка в виде иммуноглобулинов IgG1, а также других рекомбинантных белков.
Комбинация белков-добавок, входящая в состав разработанной среды, позволила повысить продуктивность стабильной культуры-продуцента рекомбинантных гуманизированных антител на основе клеток линии CHO на 44% по сравнению с используемой комплексной коммерческой добавкой ITS (Insulin-transferrin-selenium). Внесение в измененную среду IMDM гидролизатов белков гороха и риса, содержащих пептиды с молекулярной массой ниже 5 кДа, способствовало увеличению продуктивности линии в 3.9 и 4.5 раза соответственно.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской федерации (Соглашение № 075-15-2019-1391 от 19.06.2019, уникальный идентификатор проекта RFMEFI60717X0177).
Список литературы
Jayapal K.P., Wlaschin K.F., Hu W., Yap M.G. // Chem. Eng. Prog. 2007. V. 103. № 10. P. 40–47.
Wurm F.M. // Nat. Biotechnol. 2004. V. 22. № 11. P. 1393–1398.
Ryu J.H., Kim M.S., Lee G.M., Choi C.Y., Kim B.S. // Biomaterials. 2005. V. 26. № 14. P. 2173–2181.
Yoon S.K., Hong J.K., Choo S.H., Song J.Y., Park H.W., Lee G.M. // J. Biotechnol. 2006. V. 122. № 4. P. 463–472.
Fox S.R., Patel U.A., Yap M.G., Wang D.I. // Biotechnol. Bioeng. 2004. V. 85. № 2. P. 177–184.
Kim D.Y., Lee J.C., Chang H.N., Oh D.J. // Cytotechnology. 2005. V. 47. № 1–3. P. 37–49.
Nienow A.W. // Cytotechnology. 2006. V. 50. № 1–3. P. 9–33.
Arden N., Betenbaugh M.J. // Cytotechnology. 2006. V. 50. № 1–3. P. 77–92.
Liu C.H., Chen L.H. // Cytotechnology. 2007. V. 54. № 2. P. 89–96.
Borys M.C., Linzer D.I., Papoutsakis E.T. // Biotechnology (N.Y.). 1993. V. 11. № 6. P. 720–724.
Ozturk S.S., Palsson B.O. // Biotechnol. Prog. 1991. V. 7. № 6. P. 481–494.
Lin A.A., Kimura R., Miller W.M. // Biotechnol. Bioeng. 1993. V. 42. № 3. P. 339–350.
Furukawa K., Ohsuye K. // Cytotechnology. 1998. V. 26. № 2. P. 153–164.
Barnes D., Sato G. // Cell. 1980. V. 22. № 3. P. 649–655.
Darfler F.J. // In Vitro Cell. Dev. Biol. 1990. V. 26. № 8. P. 769–778.
Kan M., Yamane I. // J. Cell Physiol. 1982. V. 111. № 2. P. 155–162.
Guilbert L.J., Iscove N.N. // Nature. 1976. V. 263. № 5578. P. 594–595.
Lambert K., Birch J. // Animal Cell Biotechnology. 1985. V. 1. P. 85–122.
Kawamoto T., Sato J.D., Le A., McClure D.B., Sato G.H. // Anal. Biochem. 1983. V. 130. № 2. P. 445–453.
Kovár J. // Folia Biol. 1987. V. 33. № 6. P. 377–384.
Bretscher M.S. // Sci. Am. 1985. V. 253. № 4. P. 100–108.
Trowbridge I.S., Omary M.B. // Proc. Natl. Acad. Sci. USA. 1981. V. 78. № 5. P. 3039–3043.
Iscove N.N., Melchers F. // J. Exp. Med. 1978. V. 147. № 3. P. 923–933.
Baré G., Charlier H., De Nijs L., Verhoeye F., Schneider Y.-J., Agathos S., Thonart P. // 17th ESACT Meeting Tylösand. Eds. E. Lindner-Olsson, N. Chatzissavidou, E. Lüllau. Netherlands, Dordrecht: Springer-Science + Business Media, B.V., 2001. P. 217–219.
Mols J., Peeters-Joris C., Agathos S.N., Schneider Y.J. // Biotechnol. Lett. 2004. V. 26. № 13. P. 1043–1046.
Mosser M., Chevalot I., Olmos E., Blanchard F., Kapel R., Oriol E., Marc I., Marc A. // Cytotechnology. 2013. V. 65. № 4. P. 629–641.
Richardson J., Shah B., Bondarenko P.V., Bhebe P., Zhang Z., Nicklaus M., Kombe M.C. // Biotechnol. Prog. 2015. V. 31. № 2. P. 522–531.
Gupta A.J., Gruppen H., Maes D., Boots J.W., Wierenga P.A. // J. Agric. Food Chem. 2013. V. 61. № 45. P. 10 613–10 625.
Donaldson M.S., Shuler M.L. // Biotechnol. Prog. 1998. V. 14. № 4. P. 573–579.
Franěk F., Hohenwarter O., Katinger H. // Biotechnol. Prog. 2000. V. 16. № 5. P. 688–692.
Heidemann R., Zhang C., Qi H., Larrick Rule J., Rozales C., Park S., Chuppa S., Ray M., Michaels J., Konstantinov K., Naveh D. // Cytotechnology. 2000. V. 32. № 2. P. 157–167.
Sung Y.H., Lim S.W., Chung J.Y., Lee G.M. // App. Microbiol. Biotechnol. 2004. V. 63. № 5. P. 527–536.
Bobik T.V., Popov R.Y., Aliev T.K., Mokrushina Y.A., Shamborant O.G., Khurs E.N., Knorre V.D., Smirnov I.V., Gabibov A.G. // Bull. Exp. Biol. Med. 2019. V. 167. № 3. P. 335–338.
Mizutani K., Hashimoto K., Takahashi N., Hirose M., Aibara S., Mikami B. // Biosci. Biotechnol. Biochem. 2010. V. 74. № 2. P. 309–315.
Laemmli U.K. // Nature. 1970. V. 227. № 5259. P. 680–685.
Gusarova V., Vorobjeva T., Gusarov D., Lasman V., Bayramashvili D. // J. Chromatogr. A. 2007. V. 1176. № 1–2. P. 157–162.
Gusarov D., Nekipelova V., Gusarova V., Lasman V., Bairamashvili D. // J. Chromatogr. B. 2009. V. 877. № 11–12. P. 1216–1220.
Бобик Т.В., Воробьев И.И., Пономаренко Н.А., Габибов А.Г., Мирошников А.И. // Биоорг. химия. 2008. Т. 34. № 1. С. 56–62
Wu S., Letchworth G.J. // Biotechniques. 2004. V. 36. № 1. P. 152–154.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


